|
| Temas de FC |
M.S. Camacho Lovillo, M.J. Lirola Cruz*
Hospital Virgen del Rocío de Sevilla. *Instituto Hispalense de Pediatría
| Resumen
Las vasculitis son un grupo de enfermedades heterogéneas caracterizadas por inflamación de los vasos sanguíneos. Su incidencia es baja en la infancia a excepción de la púrpura de Schönlein-Henoch (PSH) y la enfermedad de Kawasaki (EK). Existen ciertos hallazgos clínicos que deben hacer considerar la posibilidad diagnóstica de un cuadro de vasculitis: fiebre prolongada de origen desconocido, lesiones cutáneas sugestivas, neuropatía periférica y/o afectación multisistémica (especialmente renal, pulmonar o cardiovascular), de causa no determinada. El diagnóstico se establece tras la realización de las pruebas de imagen y la biopsia de los tejidos afectos. |
| Abstract
The vasculitis syndromes are a group of heterogeneous diseases characterized by inflammation of the blood vessels. Its incidence is low in childhood with the exception of Henoch Schönlein purpura (HSP) and Kawasaki disease (KD). In the presence of certain clinical features the possibility of an underlying vasculitic disease must be considered: prolonged fever of unknown origin, suggestive cutaneous lesions, peripheral neuropathy and/or multisystemic involvement (especially renal, pulmonary or cardiovascular) of unexplained etiology. To establish a correct diagnosis appropriate imaging and biopsy of the affected tissue may be necessary. HSP is the commonest vasculitis in children and self-limiting in the majority of the cases. However long-term follow-up is important in patients with accompanied nephritis, as they are at increased risk of renal damage. In developed countries KD is the commonest cause of acquired cardiac disease in childhood. The clinical presentation is sometimes incomplete or atypical; more frequently in children aged less than a year, and have a greater risk developing coronary aneurisms. The treatment with intravenous gammaglobulin within the first 10 days of the disease reduces significantly the risk of this complication. |
Palabras clave: Vasculitis; Enfermedad de Kawasaki; Púrpura de Schönlein-Henoch.
Key words: Vasculitis; Kawasaki disease; Henoch-Schönlein purpura.
Pediatr Integral 2013; XVII(1): 34-46
Púrpura de Schönlein-Henoch, enfermedad de Kawasaki y otras vasculitis
Introducción
Las vasculitis son un grupo heterogéneo de enfermedades que producen afectación multisistémica.
El término vasculitis se refiere a la inflamación y necrosis de los vasos sanguíneos. Se suelen afectar varios órganos o sistemas, con unas manifestaciones clínicas dependientes de la localización y tamaño de los vasos implicados. Pueden ser primarias o secundarias a infecciones, tumores, drogas u otras enfermedades reumáticas. Su frecuencia es muy baja en niños, a excepción de la Púrpura de Schönlein-Henoch y la enfermedad de Kawasaki. Debido a la afectación multisistémica y la baja incidencia, el diagnóstico es con frecuencia difícil y, consecuentemente, tardío, lo cual suele asociarse a una importante morbi-mortalidad(1,2). En el año 2005, la Liga Europea contra el Reumatismo (EULAR) y la Sociedad Europea de Reumatología Pediátrica (PRES) desarrollaron la primera clasificación pediátrica de vasculitis (Tabla I)(3). Los hallazgos clínicos y de laboratorio que deben hacer sospechar la existencia de una vasculitis se reflejan en la tabla II. Las pruebas de imagen son útiles, sobre todo en las vasculitis de mediano y grandes vasos, siendo en la mayoría de casos necesaria la biopsia de tejidos afectos. El tratamiento generalmente se realiza con corticoides e inmunosupresores y se requiere un abordaje multidisciplinar. El limitado número de estudios específicos en niños condiciona que muchos aspectos sobre su manejo se extrapolen a partir de la experiencia publicada en adultos(1,2).
Púrpura de Schönlein-Henoch
Introducción
La púrpura de Shönlein-Henoch (PSH) es la vasculitis sistémica más frecuente en los niños. El primer caso fue descrito por Willian Heberden en 1801 en un niño de 5 años con erupción purpúrica, hematuria macroscópica, dolor abdominal, deposiciones sanguinolentas, vómitos, artralgias y edema. En 1837, Johann Schönlein añadió el componente articular y denominó a esta entidad “peliosis reumática” o “púrpura rubra” y, algo más tarde, Eduard Heinrish Henoch, alumno de Schönlein, completó su descripción. La naturaleza vasculítica de la PSH, o púrpura anafilactoide, fue descrita por Gairdner en 1948. Sus manifestaciones clínicas más frecuentes son bien conocidas: púrpura palpable, artritis, dolor abdominal, sangrado intestinal y nefritis, aunque cualquier órgano puede verse afectado. Son consecuencia de una vasculitis leucocitoclástica de pequeños vasos debida al depósito de IgA1 en la pared de los vasos y del mesangio renal. Se ha asociado a una gran variedad de microorganismos, drogas y otros agentes ambientales. En general, su curso es autolimitado aunque el grado de afectación renal condicionará su pronóstico a largo plazo(1,4-6).
Epidemiología
La PSH es más frecuente durante la infancia (3-15 años) y su incidencia oscila entre los 10 y 20 casos por cada 100.000 niños.
La PSH puede aparecer en todos los grupos de edad, siendo más frecuente durante la infancia (entre los 3 y 15 años), ocurriendo el 50% de los casos en menores de 5 años y el 75-90%, en menores de 10 años. Los hallazgos clínicos son, con frecuencia, atípicos en las edades extremas y de mayor gravedad en el adulto; sin embargo, en los menores de 2 años son menos probables las complicaciones renales y gastrointestinales. La incidencia oscila entre los 10 y 20(4). casos por cada 100.000 niños, pudiendo alcanzar los 70,3 casos/100.000 en el grupo de edad entre los 4 y 7 años(4). La distribución según el sexo es similar, aunque con predominio en varones en algunas series (1,5-2:1). No existe un claro predominio racial, los afroamericanos rara vez se afectan. La enfermedad es más frecuente en invierno, otoño y primavera, lo que hace probable la implicación de determinados procesos infecciosos en su patogénesis.
Etiopatogenia
La PSH es una vasculitis mediada inmunológicamente, probablemente resultado de la formación de complejos inmunes en respuesta a determinados estímulos antigénicos en personas genéticamente susceptibles.
Las investigaciones tempranas sobre susceptibilidad genética de la PSH se focalizaron en las asociaciones HLA. Estudios procedentes de España, Italia y Turquía, informaron sobre la asociación de los alelos HLA-DRB1*01, HLA DRB1*11 y HLA- DRB1*14 con esta enfermedad. Un estudio reciente de Turquía mostraba que el alelo HLA-B35 se asociaba con un riesgo elevado de PSH. Un estudio anterior español informaba sobre la asociación del HLA-B35 con el aumento de riesgo de nefritis, pero no sobre el riesgo total de PSH(5).
La PSH aparece hasta en el 7% de los pacientes con fiebre mediterránea familiar (FMF), enfermedad autoinflamatoria determinada genéticamente. Estudios procedentes de Israel y Turquía muestran un aumento significativo de la prevalencia de mutaciones que afectan al gen MEFV, causa de la FMF, en los niños con PSH en comparación con la población general. Es improbable que estos hallazgos sean extensibles a otros países en los que la FMF es mucho menos común(5).
Se han estudiado polimorfismos en genes que codifican citocinas proinflamatorias, moléculas de adhesión celular y moléculas asociadas con la activación de células endoteliales, focalizándose la mayoría de los trabajos en el TNF-alfa, IL-1beta, IL-8, TGB-beta y VEGF. No se ha llegado hasta la fecha a conclusiones firmes respecto a su asociación genética con la PSH(5).
La patogénesis de la PSH continúa siendo desconocida; sin embargo, en general, se piensa que es una enfermedad mediada por el depósito de inmunocomplejos, caracterizados por la presencia de IgA1 polimérica, predominantemente a nivel de los capilares dérmicos, gastrointestinales y glomerulares. Los depósitos granulares patognomónicos de IgA y C3 en el mesangio son indistinguibles de los que se observan en la nefropatía por IgA. Existen 2 subclases de IgA, la IgA1 y la IgA2. La IgA1 contiene una región bisagra con múltiples lugares de glicosilación. La glicosilación aberrante de esta región de la IgA1 podría explicar su participación exclusiva en la patogénesis de la PSH. El aumento de la producción de IgA polimérica por parte del sistema inmune de las mucosas en respuesta a la presentación de antígenos, tales como bacterias, virus u hongos, se contempla como posible mecanismo desencadenante de la PSH. Se ha documentado la existencia de niveles séricos elevados de IgA1, complejos inmunes que contienen IgA1 (de pequeño peso molecular), IgA- ANCA, IgA- FR en los pacientes con PSH. En aquellos que, además, presentan nefritis (PSHN), se detectan complejos inmunes circulantes IgA1-IgG de gran masa molecular. Así mismo, los niveles séricos de de IgA1 con defecto de galactosa (Gd-IgA1) son significativamente más elevados en los pacientes con PSHN que en los controles sanos y en los pacientes con PSH sin nefritis.
Recientemente, se ha demostrado que los niveles en sangre y en orina de leucotrieno B4 (LTB4), potente activador de los neutrófilos e inductor de su quimiotaxis, son más altos en los pacientes con PSH y nefritis. Mientras que, los niveles de lipoxina A4 (LXA4), inhibidora de la activación y reclutamiento de los neutrófilos e inhibidora de la producción de citoquinas proinflamatorias, son más bajos. Estos hallazgos pueden ayudar a explicar el papel prominente de los neutrófilos en la patogénesis de la PSH(5).
Manifestaciones clínicas
En la PSH existirá, principalmente y por este orden, afectación cutánea, digestiva, articular y renal.
Manifestaciones cutáneas
La lesión cutánea característica es la púrpura palpable, presentando el paciente desde petequias a grandes equimosis, pudiendo estar precedidas de un exantema maculopapular eritematoso o urticarial. Aparecen de forma simétrica en las zonas declive (miembros inferiores y nalgas) (Figs. 1 y 2), aunque también pueden encontrarse en los brazos, cara, orejas y espalda. Al inicio del cuadro, puede acompañarse de edema de cuero cabelludo, cara, manos, pies y escroto, sobre todo en niños pequeños. Las lesiones ampollosas o hemorrágicas y necróticas son raras en los niños (2%), ocurriendo hasta en el 60% del paciente adulto.

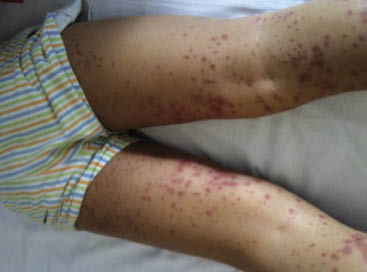
Figuras 1 y 2. Exantema característico de púrpura de Schönlein-Henoch: púrpura palpable en miembros inferiores
Manifestaciones digestivas
Se describen en el 50-75% de los pacientes, siendo el primer síntoma de la enfermedad en el 14-36% de los casos. Se producen como consecuencia del edema y la hemorragia secundaria a la vasculitis de la pared intestinal. El síntoma más frecuente es el dolor abdominal de tipo cólico. Otras manifestaciones pueden ser: hemorragia digestiva (masiva en el 2%), invaginación intestinal, úlceras, perforaciones, pancreatitis aguda, hydrops de la vesícula biliar y enteropatía pierde proteínas.
Manifestaciones articulares
La artritis o artralgia puede ser el primer síntoma de la enfermedad en el 15-25% de los pacientes, encontrándose algún grado de afectación articular en el 82% de los casos. Característicamente, la inflamación es periarticular, dolorosa, sin eritema ni calor pero con limitación, afectando con mayor frecuencia a las grandes articulaciones de miembros inferiores. Son transitorias y se resuelven en pocos días sin dejar deformidad.
Manifestaciones renales
Se producen en el 20-50% de los pacientes y es el factor pronóstico más importante de la enfermedad. La afectación renal se manifestará con: hematuria microscópica/macroscópica, proteinuria, síndrome nefrótico/nefrítico, fracaso renal e hipertensión, siendo la afectación severa en el 5-7% de los casos. Se desarrollará durante el 1º mes de la enfermedad en el 75-80% de los pacientes, y en el 97-100% de los casos a los 3 meses de inicio de la enfermedad. Se han descrito pocos casos en los que la afectación renal se desarrolló varios años después de la presentación de la enfermedad.
Manifestaciones neurológicas
Son raras, aunque la cefalea seguida de una ligera encefalopatía con mínimos cambios en el estado mental, tales como: labilidad emocional, apatía e hiperactividad, podría ser más frecuente de lo que se pensaba. Podemos encontrar alteraciones electroencefalográficas y convulsiones. Se han descrito casos de hematoma subdural, hemorragia subaracnoidea, hemorragia cerebelosa, sangrado intraparenquimatoso e infarto.
Manifestaciones pulmonares
La afectación pulmonar es rara. Aunque ocurre con mayor frecuencia en el adulto, se han descrito casos aislados en los niños de hemorragia difusa alveolar, neumonía intersticial y fibrosis intersticial.
Manifestaciones urológicas
La orquitis es un hallazgo relativamente común en el niño con PSH, encontrándose hasta en el 24% de los casos. Puede llegar a ser necesaria la exploración quirúrgica para descartar la existencia de torsión testicular(1,4-6).
Diagnóstico
El diagnóstico de la enfermedad es fundamentalmente clínico. Las diferentes pruebas complementarias irán encaminadas a descartar otras patologías y a conocer el alcance de la enfermedad.
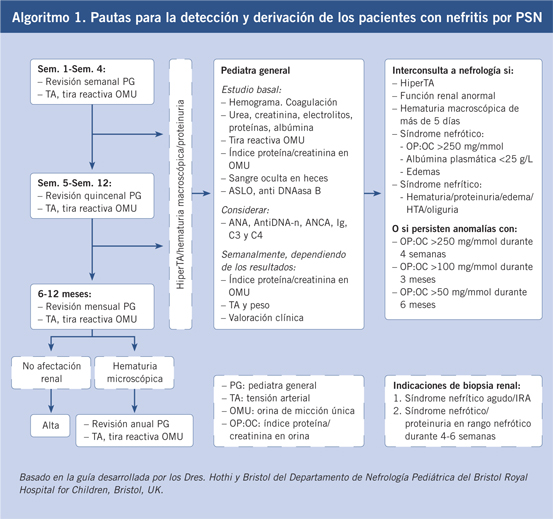
No existen pruebas de laboratorio específicas para el diagnóstico de la enfermedad; por lo que, nos basaremos, fundamentalmente, en los hallazgos clínicos, precisándose en ocasiones hallazgos anatomopatológicos(5,7) (Tabla III). La investigación irá encaminada a descartar otros posibles diagnósticos y a conocer la extensión de la afectación orgánica. En el estudio inicial se incluirán: hemograma, coagulación, creatinina, urea e iones, perfil hepático y óseo, uroanálisis para detectar hematuria y proteinuria y, si fuese necesario, determinación de sangre oculta en heces. Si se identifica proteinuria en la tira reactiva, se determinará en orina de la mañana el índice proteína: creatinina. Si el diagnóstico fuese dudoso, añadiríamos un perfil autoinmune completo, incluyendo: ANA, antiDNAds, ANCA, inmunoglobulinas, C3 y C4. Podremos encontrar anemia, leucocitosis, un discreto aumento de la VSG y, en algunos casos, una función renal y/o hepática alteradas; en pacientes con proteinuria importante, podemos encontrar hipoalbuminemia. La trombocitosis se ha asociado con enfermedad más severa. Los estudios estándares de coagulación son habitualmente normales, aunque la actividad del factor XIII se encuentra disminuida en relación con enfermedad más severa; no se aconseja su determinación rutinaria. La IgA se encuentra elevada en la mitad de los pacientes y no se correlaciona con la severidad de la enfermedad; pueden encontrarse inmunocomplejos circulantes de IgA. El significado de la presencia de IgA ANCA en la PSH está aún en discusión. En general, el estudio básico inmunológico suele ser normal, encontrándose en alguna ocasión niveles descendidos de C3 y C4. En caso de existir sospecha de proceso infeccioso, en función de los síntomas encontrados, realizaríamos: hemocultivo, cultivo faringe, urocultivo y Rx de tórax. Si existe evidencia de infección estreptocócica reciente, determinaríamos los títulos de ASLO y antiDNA asa B. La investigación viral podría revelarnos la causa precipitante de la enfermedad. Si existe afectación renal, se recomienda realizar los controles y pruebas indicados en el Algoritmo 1. La biopsia cutánea, si se realizase (normalmente ante una presentación atípica y dudas diagnósticas), mostraría una vasculitis leucocitoclástica de pequeños vasos con depósitos de IgA e infiltración de neutrófilos y células mononucleares perivasculares. En la biopsia renal, podemos encontrar desde glomerulonefritis con lesiones focales y/o segmentarías hasta la formación de semilunas. También, encontraremos depósitos de IgA en la inmunofluorescencia. La ecografía abdominal puede mostrar un engrosamiento de las paredes del intestino delgado y grueso, ayudará a descartar la existencia de una invaginación intestinal. Realizaremos ecografía escrotal en los casos de escroto agudo para descartar la existencia de una torsión testicular(1,4-7).
Tratamiento
Dada la tendencia a la resolución espontánea de la enfermedad, el tratamiento en la mayor parte de los casos será de sostén, con reposo y analgesia.
Afectación cutánea
El reposo disminuye la aparición de nuevas lesiones cutáneas, no precisando, en general, tratamiento específico añadido. En caso de lesiones bullosas, existen notificaciones del éxito del tratamiento con corticoides. Se han utilizado también agentes ahorradores de corticoides, como la dapsona y la colchicina.
Afectación articular
Normalmente responden a tratamiento con antiinflamatorios no esteroideos, aunque existen datos sobre la rápida respuesta y el acortamiento de la duración de los síntomas con el uso de corticoides.
Enfermedad gastrointestinal
El uso de prednisolona a 1-2 mg/kg (máximo, 60 mg) se podría considerar en niños con PSH y dolor abdominal moderado-severo, una vez descartada patología abdominal significativa, como la invaginación. En caso de vasculitis gastrointestinal muy severa (enteropatía pierde-proteínas y la hemorragia gastrointestinal severa, entre otras), se ha descrito el éxito del tratamiento con infusión de gammaglobulinas, pulsos de metilprednisolona y plasmaféresis. El dolor abdominal persistente o crónico es poco común, pero parece responder a metotrexate o micofenolato mofetilo, aunque deben ser valorados sus efectos secundarios gastrointestinales.
Enfermedad renal
El tratamiento de la PSHN sigue siendo controvertido, no existiendo evidencia suficiente sobre la mejor guía de tratamiento para la PSHN establecida. Se proponen tratamientos con: prednisolona, metilprednisolona, ciclofosfamida, azatioprina, ciclosporina A, micofenolato mofetilo, dipiridamol, warfarina, plasmaféresis y rituximab. Los efectos antihipertensivos y renoprotectores de los inhibidores de la enzima convertidora de la angiotensina (IECA) o de los antagonistas del receptor de la angiotensina II (ARA II) están bien documentados en el adulto con hipertensión y/o insuficiencia renal crónica. En un estudio retrospectivo más reciente, aportan su experiencia positiva con el tratamiento de la PSH con nefropatía severa y la nefropatía IgA con la combinación de esteroides, ciclofosfamida, IECA y ARA II, consiguiendo una respuesta adecuada en el 54% de los niños con cambios histológicos severos (> estadio III) en la biopsia inicial(8-11).
Pronóstico
Las manifestaciones digestivas condicionan el pronóstico a corto plazo, en el momento de la púrpura; mientras que, la afectación renal condicionará el pronóstico a largo plazo.
La PSH es generalmente una enfermedad autolimitada (en 2-4 semanas), aunque hasta el 33% de los pacientes pueden presentar síntomas recurrentes (entre 1 y 6 episodios). Estas recurrencias suelen acontecer durante los 2-3 primeros meses, aunque se describen recaídas que sobrepasan los 18 meses del inicio de la enfermedad. Normalmente, los síntomas son similares a los del debut y parece ser que aquellos pacientes con afectación renal pueden recaer con mayor facilidad. El pronóstico a largo plazo de los niños con PSH se relaciona predominantemente con la existencia de enfermedad renal. Aunque ningún hallazgo es absolutamente predictivo, muchos estudios coinciden en que la presencia de síndrome nefrítico/nefrótico, la disminución de la actividad del factor XIII, la hipertensión, el desarrollo del fallo renal al inicio de la enfermedad y la presencia de esclerosis glomerular/semilunas/afectación tubulointersticial (lesiones histopatológicas clase IV y V), se definen como factores de mal pronóstico; de tal manera que, aunque puedan presentar una recuperación inicial, en el seguimiento a largo plazo (más de 20 años en algunos casos), casi la mitad de estos pacientes pueden presentar hipertensión o insuficiencia renal. Aquellas mujeres a las que se les diagnosticó una PSH durante la infancia, presentarán con mayor frecuencia hipertensión arterial y proteinuria durante el embarazo. El tratamiento inicial de la PSH con corticoides no previene el desarrollo de nefritis(6). Por todo lo referido anteriormente, dado el potencial riesgo de deterioro renal de los pacientes con historia de PSHN, se aconseja su seguimiento de por vida. En aquellos pacientes sin alteraciones del sedimento urinario y con tensiones arteriales normales, el seguimiento se podría abandonar a los 6-12 meses del inicio de la enfermedad o de la última recaída.
Enfermedad de Kawasaki
Introducción
La enfermedad de Kawasaki (EK) es una vasculitis aguda y autolimitada. Constituye la causa más frecuente de enfermedad cardiaca adquirida en la infancia.
Fue descrita por primera vez por Tomisaku Kawasaki en Japón en 1967. Desde entonces su incidencia ha ido en aumento, describiéndose en todos los grupos raciales y étnicos. Su etiología es aún desconocida. Su importancia se debe a que el 15-25% de los niños no tratados desarrollan anomalías coronarias (AC) que puede conducir a infarto de miocardio, muerte súbita o enfermedad isquémica cardiaca. El tratamiento va dirigido a reducir la inflamación y prevenir el desarrollo de AC(12,13).
Epidemiología
Afecta a toda la edad pediátrica aunque, con mayor frecuencia, a menores de 5 años. La incidencia es más elevada en países asiáticos.
La EK afecta principalmente a niños entre 6 meses y 5 años, existiendo una mayor proporción de varones (1,5:1). La incidencia más alta se ha registrado en Japón(13). En nuestro país se estima que la incidencia anual acumulada es similar a la encontrada en Estados Unidos (20,8/100.000 niños menores de 5 años en 2006)(12). Durante el periodo 1998-2009, la incidencia en Noruega, Suecia y Finlandia fue de 5,4, 7,4 y 11,4, respectivamente; mientras que, en ese periodo en Japón, la incidencia aumentó de 111,7 a 218,6/100.000 niños menores de 5 años. Se desconocen las causas de este incremento, si bien ha contribuido un mejor reconocimiento y diagnóstico de la enfermedad(14). Las recurrencias son poco frecuentes (Japón 3% y Estados Unidos 1-2%). Los casos familiares son raros (0,7-2,1%) y el 50% aparecen en los 10 días siguientes al primer caso. En Japón existe un predominio de la enfermedad en los meses de invierno y primavera; si bien, el predominio estacional varía de unos países a otros(15).
Etiopatogenia
La EK se debe a una respuesta inmunológica inapropiada a uno o más agentes infecciosos que actuarían como desencadenantes en individuos genéticamente susceptibles (Tabla IV)(16,17).
La hipótesis que relaciona la EK con determinadas toxinas bacterianas estreptocócicas o estafilocócicas que actuarían como superantígenos es, hoy día, controvertida. El aumento de IgA en el tracto respiratorio que se detecta en pacientes con EK sugiere una puerta de entrada respiratoria del agente etiológico. El coronavirus New Haven ha sido identificado en secreciones respiratorias de niños con EK, así como el coronavirus y bocavirus(12,16).
Actualmente, existen múltiples estudios encaminados a identificar marcadores genéticos de susceptibilidad de la enfermedad, de severidad y de resistencia al tratamiento [CTL-4, caspasa 3, IL-10, IL-1B, CD40L, PD-1, ORAI1 e inositol 1,4,5 trifosfato3kinasaC(ITPKC)](12).
El paso que conduce a la arteritis coronaria aún no está aclarado, si bien la activación de células endoteliales, monocitos/macrófagos CD68, linfocitos CD8 y células plasmáticas IgA monoclonales parece estar implicada. Un trigger infeccioso aumentaría la producción de citocinas, como: TNF-a, IL 1 e IL 6, que inducirían nuevos antígenos endoteliales y se generarían anticuerpos contra ellos. Se produce un infiltrado de macrófagos y linfocitos en la pared arterial que secretan mediadores inflamatorios y enzimas que contribuirían al daño vascular. La inflamación acaba produciendo una destrucción de la media y la formación de aneurismas. En los estadios precoces, se produce una infiltración de neutrófilos que producirían óxido nítrico. Las células T reguladoras (Tregs) están disminuidas en sangre periférica en EK aguda y aumentados los Th17(16,17).
Se suelen afectar las arterias de tamaño medio extraparenquimatosas (celíacas, mesentéricas, femoral, ilíaca, renal, axilar y braquial) y, en especial, las arterias coronarias. Los aneurismas son más frecuentes en las zonas proximales y en las bifurcaciones, ya que son las zonas de mayor estrés de la pared arterial. El enlentecimiento del flujo en la zona dilatada favorece la formación de trombos. Las coronarias que se afectan con mayor frecuencia son la arteria coronaria izquierda, la descendente anterior y la coronaria derecha(13,16).
Clínica
En ausencia de una prueba diagnóstica específica o características clínicas patognomónicas, se han establecido unos criterios clínicos para ayudar al diagnóstico de EK (Tabla V)(13).
Es característico que todas las manifestaciones clínicas no se presenten a la vez en el tiempo, por lo que a veces es necesario esperar varios días antes de hacer el diagnóstico.
El término de Kawasaki incompleto se refiere a pacientes que, aunque no cumplen suficientes criterios, pueden ser diagnosticados de EK. Es más frecuente en menores de 1 año y mayores de 9. En 2004, la Asociación Americana de Cardiología ha desarrollado un algoritmo de actuación para la EK incompleta basada en opiniones de expertos que ayuda a usar los datos clínicos, analíticos y ecocardiográficos para mejorar el diagnóstico y tratamiento (Algoritmo 2). Debe considerarse el diagnóstico de EK en todos los niños con fiebre inexplicable de 5 o más días de duración con 2 ó 3 criterios clínicos principales y en cualquier niño menor de 6 meses con fiebre de más de 7 días de duración con hallazgos de laboratorio compatibles con inflamación y sin causa explicable de la fiebre(13).
Manifestaciones clínicas principales
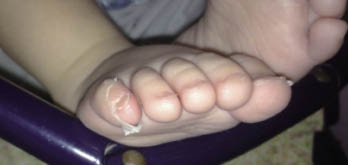
Figura 3. Descamación periungueal en pies en fase subaguda.
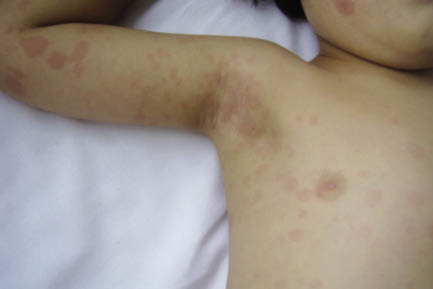
Figura 4. Exantema inespecífico maculopapular.
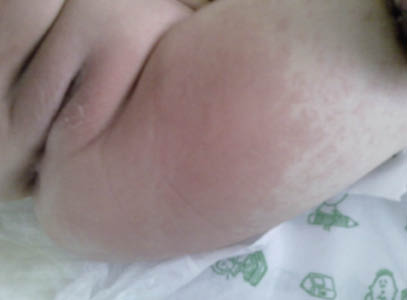
Figura 5. Exantema perineal con descamación precoz.

Figura 6. Lactante irritable con labios rojos.
La fiebre suele ser elevada y sin tratamiento persiste una media de 11 días. Los cambios en las extremidades son característicos. En la fase aguda, suele aparecer eritema de palmas y plantas. Pueden estar, además, edematosas y el niño evita coger objetos y la deambulación. La descamación se inicia en la región periungueal a las 2 ó 3 semanas del comienzo de la fiebre y puede extenderse a palmas y plantas (Fig. 3). A los 5 días del inicio de la fiebre, suele aparecer un rash eritematoso. Puede presentarse de muchas formas, aunque la más frecuente es una erupción maculopapular difusa inespecífica (Fig. 4). A veces, se manifiesta como: urticaria, rash escarlatiniforme, eritrodermia, similar al eritema multiforme o, menos frecuente, erupción micropustular. No se han descrito las formas bullosas, vesiculares y petequias. Suele localizarse en tronco y extremidades, acentuándose en la región perineal, donde puede aparecer una descamación temprana (Fig. 5). La inyección conjuntival bilateral suele aparecer poco después del inicio de la fiebre. Afecta de forma característica a la conjuntiva bulbar y no se asocia a exudado, edema conjuntival o ulceración corneal. Normalmente no es dolorosa. Los cambios en los labios y la cavidad oral incluyen: eritema (Fig. 6), sequedad, fisuras, descamación, grietas y sangrado de labios, lengua aframbuesada indistinguible de la escarlatina y eritema difuso de la mucosa orofaríngea. No suelen verse ni úlceras orales ni exudado faríngeo. La linfadenopatía cervical es la menos frecuente de todas las características clínicas principales. Suele ser unilateral y localizada en el triangulo cervical anterior. Para que sea criterio de la EK, debe haber una o más linfadenopatías mayores de 1,5 cm de diámetro. Suele ser firmes, no fluctuantes y sin eritema en la piel. Pueden aparecer otras manifestaciones descritas en la tabla VI(12,13).
Manifestaciones clínicas cardiovasculares asociadas
En los primeros 10 días, no suelen detectarse aneurismas coronarios, pero puede apreciarse mediante ecocardiografía un aumento de la brillantez que rodea la luz arterial o ectasias. Esta lesión precoz puede resolverse o evolucionar hacia aneurismas. También, se puede observar disminución de la función ventricular, regurgitación valvular o derrame pericárdico. Los aneurismas se suelen detectar en la fase subaguda (4-6 semanas de enfermedad)(12,13).
Hallazgos de laboratorio
Las pruebas de laboratorio no son específicas, pero pueden contribuir al diagnóstico (Tabla VI). Suelen normalizarse de 6 a 10 semanas después del inicio de la enfermedad. El biomarcador N-terminal tipo pro-B péptido natriurético (NT-pro BNP) se correlaciona con marcadores de inflamación, estrés oxidativo y disfunción diastólica cardiaca. Algunos estudios sugieren que se eleva en pacientes con EK en comparación con controles febriles y que podría servir como dato analítico suplementario para el diagnóstico de EK incompleto, incluso podría ser marcador de riesgo de desarrollo de AC(12,13).
Diagnóstico diferencial
El polimorfismo de los signos y síntomas obliga a considerar un amplio diagnóstico diferencial que incluye procesos infecciosos, alérgicos o tóxicos y reumatológicos. El diagnóstico precoz, fundamentalmente de los casos atípicos, puede ser difícil.
Infecciones
• Estreptocócicas y estafilocócicas mediadas por toxinas: en el caso de la escarlatina, existe exudado amigdalar, cultivo faríngeo positivo y respuesta al tratamiento con penicilina. En el shock tóxico, existe afectación renal, hipotensión y elevación de la creatinkinasa.
• Sarampión: es típica la presencia de conjuntivitis supurativa, las lesiones de Koplik y la aparición del rash predominantemente en la cara.
• Adenovirus: la conjuntivitis suele ser supurativa, y se puede utilizar para su diagnóstico los cultivos virales y la reacción en cadena de la polimerasa.
• Otras: virus de Epstein-Barr, parvovirus B19, rickettsias, leptospiras.
Otros
Reacciones medicamentosas, artritis idiopática juvenil de comienzo sistémico, poliarteritis nodosa, lupus eritematoso sistémico, fiebre reumática, enfermedad del suero, Stevens-Johnson y síndromes autoinflamatorios (fiebre periódica asociada al receptor de TNF, síndrome hiper IgD, síndromes periódicos asociados a criopirinas)(12,13).
Tratamiento
El tratamiento con IGIV dentro de los 10 primeros días del comienzo de la enfermedad disminuye la incidencia de AC desde un 20-25% a menos de un 5%.
Ya que no se ha podido establecer un score de riesgo que nos permita distinguir a pacientes con mayor probabilidad de desarrollar aneurismas, todos los pacientes diagnosticados de EK deben ser tratados con IGIV.
La aspirina se emplea por sus efectos antiinflamatorios (a dosis alta) y antitrombóticos (dosis bajas). Aunque no está demostrado que reduzca la incidencia de dilatación coronaria, sí parece disminuir la incidencia de infartos miocárdicos fatales. La dosis a emplear es controvertida, ya que no existen estudios de calidad. En la mayoría de los centros se suele emplear a dosis altas de 80-100 mg/kg/día en 4 dosis durante la fase aguda del proceso; mientras que, en Japón se emplea a dosis moderada (30-50 mg/kg/día). Cuando el paciente lleva 48-72 horas afebril, la dosis de aspirina se reduce a dosis antitrombóticas (3-5 mg/kg/día). El uso de ibuprofeno concomitante antagoniza el efecto antitrombótico de la aspirina. Los pacientes que reciben salicilatos de forma crónica deben vacunarse anualmente de la gripe y estar vacunados de la varicela(12,13).
La IGIV se utiliza a dosis elevadas (2 g/kg) en una sola infusión. Su mecanismo de acción no es del todo conocido, parece tener un efecto antiinflamatorio, disminuyendo la producción de citocinas proinflamatorias y aumentando la producción de antagonista del receptor de IL1(17). Es un producto seguro, con efectos secundarios poco frecuentes: reacción infusional, anafilaxia, urticaria, meningitis aséptica, anemia hemolítica autoinmune, tromboembolismo y fallo renal agudo. Aunque sólo se han demostrado los beneficios para pacientes tratados en los primeros 10 días de la enfermedad, algunos autores recomiendan su empleo en niños con evidencia de inflamación persistente, con o sin alteraciones coronarias, que son diagnosticados después de esta fecha. Una vez administrada, deben esperarse 11 meses para la vacunación de virus vivos.
La utilización de corticoides es controvertida. En un metaanálisis reciente, concluyen que la combinación de corticoides con el régimen convencional de IGIV como tratamiento inicial reduciría el riego de desarrollo de aneurismas coronarios sin aumentar los efectos secundarios(18,19).
Tratamiento de la enfermedad de Kawasaki refractaria
Entre 11,6 y 38,3% de pacientes tratados inicialmente con IGIV y aspirina a dosis alta, tienen fiebre persistente 24-48 horas tras la primera dosis de IGIV o bien recurre a las 36 horas o más después de completar la infusión de IGIV. Estos pacientes tienen mayor riesgo de desarrollo de AC. La mayoría de los expertos recomiendan retratamiento con IGIV a 2 g/kg, previa reevaluación clínica por si el diagnóstico inicial cambia. En algunos estudios, se ha señalado que los pacientes retratados que reciben la 2ª dosis de IGIV precozmente (antes de los 10 días del inicio de la enfermedad) tienen menor prevalencia de aneurismas coronarios. Recientemente, se ha publicado que el tratamiento con infliximab (anticuerpo monoclonal anti TNF-a) puede ser tan seguro y efectivo como la IGIV en EK refractaria en cuanto a duración de síntomas; si bien, en estudios retrospectivos no se han encontrado diferencias en cuanto a la aparición de aneurismas entre el grupo de infliximab y el de IGIV(20). En caso de fracaso de la 2ª dosis de IGIV, se pueden considerar pulsos de metilprednisolona (30 mg/kg durante 3 días), ciclofosfamida asociada a prednisona, ciclosporina o plasmaféresis.
Existen en la actualidad nuevos tratamientos de utilidad aún incierta por la falta de estudios, como la ulinastatina (inhibidor de la tripsina humana) que se ha probado en EK refractario a IGIV, el abciximab (anticuerpo monoclonal trombolítico), que se ha empleado en pacientes con aneurismas gigantes en la fase subaguda, y atorvastin, estatina estudiada en ratones, que podría detener la inflamación en EK(13).
Pronóstico
Muchos casos de infartos en personas jóvenes (3ª-4ª década) son atribuidos a una infradiagnosticada EK en la infancia.
La mortalidad (0,17% en Estados Unidos) se relaciona siempre con secuelas cardiacas. La causa más frecuente de muerte es el infarto de miocardio por trombosis de aneurismas, que suele suceder durante el primer año de enfermedad(13).
La severidad de la anemia, trombocitopenia, hipoalbuminemia y elevación de alanino aminotransferasa (ALT) por encima de 200 U/L y PCR y VSG muy elevadas o persistentemente aumentadas se correlacionan con el riesgo de desarrollar AC. También, son factores de riesgo de aparición de AC las edades extremas y la larga duración de la fiebre antes del tratamiento (menores de 6 meses y mayores de 8 años suelen tener una presentación atípica, una mayor demora diagnóstica y probablemente a una mayor vulnerabilidad genética)(12).
En Japón se han desarrollado varios score de riesgo para predecir la resistencia a IGIV y poder tratar a estos pacientes de forma más agresiva (podrían beneficiarse de un tratamiento inicial con corticoides). Estos score no son aplicables a niños de Estados Unidos(12).
Un 7% de EK se presenta como shock, y se suele asociar con disfunción ventricular y refractariedad al tratamiento. El 1,9% de pacientes con EK desarrollaron un síndrome de activación macrofágica, manifestándose como fiebre resistente a IGIV y aumento de transaminasas.
El mejor pronóstico se asocia a los aneurismas fusiformes de menos de 8 mm de diámetro y el peor con los aneurismas gigantes (>8 mm de diámetro). En la mitad de los pacientes con aneurismas coronarios, estos regresan a largo plazo y en un 20% de los casos progresan hacia una estenosis coronaria.
El seguimiento evolutivo de pacientes con EK se basa en la estratificación de riesgo relativo de isquemia miocárdica. Se suele recomendar estudio ecocardiográfico al diagnóstico, a las 2 y a las 6-8 semanas del comienzo de la enfermedad, y en función de los hallazgos, se establecen los niveles de riesgo:
• Nivel de riesgo I: pacientes sin AC en ninguno de los estadios. Pueden suspender tratamiento con aspirina a las 6-8 semanas de inicio de la enfermedad.
• Nivel de riesgo II: pacientes con ectasia transitoria de la arteria coronaria en la ecocardiografía (desaparece durante la enfermedad aguda) que pueden recibir recomendaciones similares a las del nivel I y continuar reevaluación cardiológica cada 3-5 años.
• Nivel de riesgo III, IV y V: pacientes con aneurismas que precisan mantener tratamiento con: aspirina, con anticoagulación si son aneurismas gigantes, restricción de actividad física y controles cardiológicos periódicos. La resonancia magnética angiográfica coronaria y la tomografía computada multicorte son herramientas no invasivas que en el futuro pueden reemplazar a la angiografía en el seguimiento de pacientes con aneurismas coronarios(13).
El riesgo cardiovascular a largo plazo en pacientes con EK sin AC es desconocido; si bien, parece que puede ser un factor de riesgo para el desarrollo de arteriosclerosis precoz en la edad adulta debido a una disfunción endotelial, por lo que se deben generalizar a todos ellos las recomendaciones sobre factores de riesgo cardiovascular: dieta saludable, ejercicio moderado, peso adecuado, control de tensión arterial y evitar consumo y exposición al tabaco.
Panarteritis nodosa infantil (PAN)
Es una enfermedad rara en niños de etiología desconocida, aunque se han implicado el virus de la hepatitis B, la infección estreptocócica y los depósitos de inmunocomplejos. Se ha asociado con la fiebre mediterránea familiar. Se puede diagnosticar a un niño de PAN si en la biopsia presenta vasculitis necrotizante de arterias de pequeño y mediano calibre o angiografía patológica y al menos 1 de los siguientes: afectación de piel (lívedo reticularis, nódulos, infartos…), mialgias o debilidad muscular, hipertensión arterial en relación con su edad, mononeuropatía o polineuropatía o afectación renal (hematuria, proteinuria o afectación de la función renal)(1,2,7).
Poliarteritis cutánea
Es más frecuente en niños y se caracteriza por la presencia de nódulos subcutáneos dolorosos, lesiones no purpúricas, con o sin lívedo reticularis, sin afectación sistémica (excepto mialgia, atralgia y artritis no erosiva). Se asocia a menudo con antecedente de infección estreptocócica(1,2,7).
Vasculitis asociada a ANCA
Son vasculitis de mediano y pequeño vaso con elevada morbi-mortalidad y frecuentes recaídas. La granulomatosis de Wegener afecta al tracto respiratorio superior e inferior y riñones. 90% son ANCA positivos. Para diagnosticarla deben estar presentes al menos 3 de las 6 características: afectación renal (hematuria, proteinuria, glomerulonefritis pauciinmune necrotizante), granulomas necrotizantes en las biopsias, afectación de vía aérea superior, afectación laringotraqueobronquial, radiografía o TAC pulmonares patológicos y ANCA positivos. La poliangeítis microscópica es una enfermedad no granulomatosa necrotizante que afecta a vasos pequeños. Es característica la capilaritis pulmonar y glomerulonefritis necrotizante. Casi el 100% tienen afectación renal y se asocia con títulos elevados de ANCA. El Churg- Strauss es una vasculitis granulomatosa de vaso mediano y pequeño que afecta a pacientes con asma severa o alergia(1,2,7).
Arteritis de Takayasu
Vasculitis granulomatosa que afecta de forma primaria a los grandes vasos como la aorta y sus ramas. Se presenta en mujeres entre 10 y 30 años, con una incidencia mayor en asiáticos. Para su diagnóstico es necesaria anormalidad en arteriografía (convencional, angioRNM o angio TAC) de la aorta y sus ramas principales, más al menos una de las siguientes características: disminución del pulso arterial periférico y/o claudicación de extremidades, diferencia de presión mayor de 10 mmHg en cualquier miembro, soplo en la aorta o sus ramas principales, hipertensión en relación con su edad, aumento de reactantes de fase aguda(1,2,7).
Vasculitis primaria del sistema nervioso central
La incidencia en niños es desconocida, debido a lo poco frecuentes que son y a la carencia de un consenso para los criterios diagnósticos. Los criterios para adultos son: déficit neurológico con hallazgos típicos de vasculitis en la angiografía o histología. Lo más frecuente es que se manifieste como cefaleas y déficits neurológicos focales, aunque también aparecen con frecuencia disfunciones cognitivas y cambios de comportamiento. El papel de las diversas técnicas de neuroimagen en el diagnóstico y seguimiento de esta patología no está plenamente establecido. La biopsia craneal es la prueba oro, pero tiene una sensibilidad limitada debido a la naturaleza desigual de la enfermedad(1,2,7).
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** Anton J, Bou R. Vasculitis. An Pediatr Contin. 2007; 5(3): 131-8.
2. Weiss PF. Pediatric Vasculitis. Pediatr Clin N Am. 2012; 59: 407-23.
3.** Ozen S, Ruperto N, Dillon MJ, Bagga A, Barron K, Davin JC, et al. EULAR/PReS endorsed consensus criteria for the classification of childhood vasculitides. Ann Rheum Dis. 2006; 65: 936-41.
4.*** Tizard EJ, Hamilton-Ayres MJ. Henoch-Schönlein purpura. Arch Dis Child Ed Pract. 2008; 93(1): 1-8.
5.*** Saulsbury FT. Henoch-Schönlein purpura. Curr Opin Rheumatol. 2010; 22(5): 598-602.
6.** McCarthy HJ, Tizard EJ. Clinical practice: Diagnostic and management of Henoch- Schönlein purpura. Eur J Pediatr. 2010; 169: 643-50.
7.*** OzenS, Pistorio A, Lusan SM, Bakkaloglu A, et al. EULAR/PRINTO/PRES criteria for Henoch-Schönlein purpura, childhood polyarteritis nodosa, childhood Wegener granulomatosis and childhood Takayasu arteritis: Ankara 2008. Part II: Final classification criteria. Ann Rheum Dis. 2010; 69(5): 798-806.
8.** Jauhola O, Ronkainen J, Koskimies O, et al. Outcome of Henoch-Schönlein purpura 8 years after treatment with a placebo or prednisone at disease onset. Pediatr Nephrol. 2012; 27(6): 933-9.
9.*** Kawasaki Y. The pathogenesis and treatment of pediatric Henoch- Schönlein purpura nephritis. Clin Exp Nephrol. 2011; 15(5): 648-57.
10.*** Vila Cots J. Púrpura de Schönlein-Henoch: participación renal. An Pediatr Contin. 2012; 10(3): 121-6.
11.*** Ninchoji T, Kaito H, Nozu K, et al. Treatment strategies for Henoch-Schönlein purpura nephritis by histological and clinical severity. Pediatr Nephrol. 2011; 26: 563-9.
12. Scuccimarri R. Kawasaki Disease. Pediatr Clin N Am. 2012; 59: 425-45.
13.*** Newburger J, Takahashi M, Gerber M, Gewitz M, Tani L, Burns J, Shulman S, et al. Diagnosis, Treatment, and Long-Term Management of Kawasaki Disease: Statement for Health Professionals From the Committee on Rheumatic Fever, A Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association. Pediatrics. 2004; 114: 1708-33.
14. Salo E, Griffiths EP, Farstad T, Schiller B, Nakamura Y, Yashiro M, et al. Incidence Of Kawasaki Disease In Northern European Countries. Pediatr Int. 2012 Jun 21. doi: 10.1111/j.1442-200X.2012.03692.x.
15. Uehara R, Belay ED. Epidemiology of Kawasaki Disease in Asia, Europe,and the United States. J Epidemiol. 2012; 22(2): 79-85.
16.* Wang CL, Wu YT, Liu CA, Kuo HC, Yang KD. Kawasaki Disease Infection, Immunity and Genetics. Pediatr Infect Dis J. 2005; 24: 998-1004.
17. Caroline Galeotti. Kawasaki disease: Aetiopathogenesis and therapeutic utility of intravenous immunoglobulin. Autoimmun Rev. 2010; 9: 441-8.
18.** Chen S, Dong Y, Yin Y, Krucoff MW. Intravenous immunoglobulin plus corticosteroid to prevent coronary artery abnormalities in Kawasaki disease: a meta-analysis. Heart (2012). doi:10.1136/heartjnl-2012-302126Tohru Kobayashi, Tsutomu Saji, Tetsuya Otani, Kazuo Takeuchi, Tetsuya Nakamura, Hirokazu Arakawa, Taichi Kato, Toshiro Hara,
19.** Kobayashi T, Saji T, Otan T, Takeuchi K, Nakamura T, Arakawa H,et al. Efficacy of immunoglobulin plus prednisolone for prevention of coronary artery abnormalities in severe Kawasaki disease (RAISE study): a randomised, open-label,blinded-endpoints trial. Lancet. 2012; 379: 1613-20.
20. Son MB, Gauvreau K, Burns JC, Corinaldesi E, Tremoulet AH, Watson VE et al. Infliximab for Intravenous Immunoglobulin Resistance in Kawasaki Disease: A Retrospective Study. J Pediatr. 2011; 158: 644-9.
Bibliografía recomendada
– Tizard EJ, Hamilton-Ayres MJ. Henoch-Schönlein purpura. Arch Dis Child Ed Pract. 2008; 93(1): 1-8.
Completo artículo de revisión sobre la púrpura de Schönlein-Henoch.
– Saulsbury FT. Henoch-Schönlein purpura. Curr Opin Rheumatol. 2010; 22(5): 598-602.
Interesante artículo de revisión en el que se intenta ahondar sobre las cuestiones aún no resueltas sobre la PSH. Existe suficiente evidencia de la eficacia del tratamiento con corticoides del dolor abdominal y articular, así como de la ineficacia del tratamiento con corticoides en la prevención de la nefritis.
– Vila Cots J. Púrpura de Schönlein-Henoch: participación renal. An Pediatr Contin. 2012; 10(3): 121-6.
Artículo muy reciente en el que se hace una amplia y magnífica revisión del estado actual del tratamiento de la PSH con nefritis.
– Newburger J, Takahashi M, Gerber M, Gewitz M, Tani L, Burns J, Shulman S, et al. Diagnosis, Treatment, and Long-Term Management of Kawasaki Disease: Statement for Health Professionals From the Committee on Rheumatic Fever, A Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association. Pediatrics. 2004; 114: 1708-33.
Completa y estupenda revisión de EK con algoritmo de manejo de EK incompleto muy útil para la práctica diaria.
– Kobayashi T, Saji T, Otan T, Takeuchi K, Nakamura T, Arakawa H, et al. Efficacy of immunoglobulin plus prednisolone for prevention of coronary artery abnormalities in severe Kawasaki disease (RAISE study): a randomized, open-label, blinded-endpoints trial. Lancet. 2012; 379: 1613-20.
Realizado en 74 hospitales japoneses, en los que el grupo que añade prednisolona a 2 mg/kg/día i.v. en la fase aguda de EK grave resulta superior que el grupo de IGIV en cuanto a prevención de AC, reducción de la necesidad de retratamiento y rápida resolución de fiebre y parámetros inflamatorios.
| Caso clínico |

Figura 7. Ecografía abdominal.
Niña de 2 años y 11 meses que ingresa por cuadro de 5 días de evolución consistente en: náuseas continuas, vómitos esporádicos, prácticamente diarios, anorexia, decaimiento, astenia y apatía. Los padres refieren que duerme mucho más de lo habitual. Hace 8 días presentó vómitos (unos 5-6 episodios) que se autolimitan en menos de 24 horas. Dos días más tarde, la madre tuvo un cuadro similar, con cefalea, vómitos y otalgia, que cede en 12 horas. Antecedentes personales Bronquitis recurrentes hasta los 2 años, resto sin interés. Antecedentes familiares Madre con asma extrínseca, metrorragias con anemia secundaria y migrañas. Tío paterno, con 5 años presentó una púrpura de Schönlein-Henoch con manifestaciones cutáneas tras faringoamigdalitis, posteriormente fallece a los 27 años por carcinoma renal. Abuela materna acidosis tubular renal. A la exploración por aparatos, sólo destacar cierto decaimiento, se duerme con facilidad pero despierta durante la exploración con rapidez y colabora, abdomen ligeramente distendido con aumento de la peristalsis, sin otros hallazgos. Pruebas complementarias al ingreso Hemograma: leucocitos: 20.000/ul con 70% de PMN, Hb: 13,5 g/dl, plaquetas: 449.000/ul. Coagulación: normal. Bioquímica básica, renal y hepática, amilasa: normales, proteínas totales 5,9 g/dl. PCR: 79,5 mg/L. EAB: normal. Orina: normal. Evolución Se instaura tratamiento con sueroterapia y omeprazol i.v. Durante las primeras 72 horas de ingreso, mantiene una situación clínica similar, quejándose muy ocasionalmente de dolor abdominal que cede en pocos minutos, náuseas y algún vómito. Transcurrido ese tiempo, se intensifica el dolor cólico, en hipogastrio y periumbilical, asociado a llanto, sin datos a la exploración de irritación peritoneal. Se realiza ECO abdominal (Fig. 7): cambios inflamatorios en asas intestinales, más acusados en segmento corto yeyunal con pared de 6 mm, con líquido y focos lineales ecogénicos en su interior. Se aprecia aumento de la vascularización en el asa edematosa, lo que no sugiere un proceso isquémico. Analítica de control sin cambios, salvo prot. T 4,9 g/dl. A las 30 horas, se evidencian lesiones de 2-3 mm ligeramente sobreelevadas, petequiales en miembros inferiores y nalgas. Ante la persistencia del dolor abdominal moderado-severo y la afectación del estado general de la niña, se instaura tratamiento con metilprednisolona i.v. a 2 mg/kg/día fraccionado en 3 dosis, con lo que la paciente mejora sustancialmente. Cede el dolor, se aclaran las lesiones y mejora la ingesta a los 3 días de iniciado el tratamiento con corticoides. Orinas y tensiones arteriales reiteradamente normales. |