| Temas de FC |
P. Armero Pedreira1, I. Pulido Valdeolivas2, D. Gómez Andrés2,3
1Pediatra. Hospital Centro de Cuidados Laguna. Fundación Vianorte-Laguna. 2Trastornos del Desarrollo y Maduración Neurológica. Departamento de Anatomía, Histología y Neurociencia. IdiPaz-UAM. 3Servicio de Pediatría. Hospital Universitario Infanta Sofía. San Sebastián de los Reyes. Madrid
| Resumen
La parálisis cerebral infantil es un síndrome heterogéneo caracterizado por una alteración del desarrollo motor y de la postura con un grado variable de comorbilidad. A pesar de su frecuencia e importancia en la población pediátrica, persisten una serie de ideas confusas sobre su etiología y su tratamiento. En este artículo, queremos aclarar esos mitos e incidir en la amplia batería de opciones terapéuticas que existen para cada uno de los problemas, neurológicos o no neurológicos, que pueden presentar estos pacientes con una enfermedad incurable, pero tratable y en la que la atención sanitaria de calidad puede cambiar la calidad de vida y el curso de la enfermedad |
| Abstract
The cerebral palsy is a heterogeneous syndrome characterized by an alteration of motor development and posture with a varying degree of comorbidity. Despite its frequency and importance at the level of the pediatric population, remain a series of confused ideas about the etiology and treatment. In this article we want to clarify the myths and influence of the extensive battery of therapeutic options for each of the neurological or non-neurological problems that can present these patients with incurable disease but treatable and in where health care quality can change the quality of life and the course of the disease |
Palabras clave: Parálisis Cerebral; Evaluación de la Discapacidad; Complicaciones
Key words: Cerebral palsy; Disability Evaluation; Complications
Pediatr Integral 2015; XIX (8): 548-555
Seguimiento en Atención Primaria del niño con parálisis cerebral
La parálisis cerebral infantil más allá de los mitos
La PCI es un síndrome heterogéneo en manifestaciones, causas y grado de discapacidad, que es la primera fuente de discapacidad grave en la infancia.
La parálisis cerebral infantil (PCI) es un síndrome heterogéneo en causa y en manifestaciones, cuyo pronóstico es variable en función de cada paciente, y su tratamiento necesita ser adaptado a las necesidades y a las complicaciones. La PCI tiene una definición(1): “La parálisis cerebral infantil se corresponde con un grupo de trastornos del desarrollo del movimiento y de la postura, que producen limitaciones en la actividad y que son atribuibles a lesiones no progresivas que ocurrieron en el sistema nervioso en desarrollo del feto o del lactante. Los problemas motores se acompañan a menudo de problemas: en la sensibilidad, en la cognición, en la comunicación, en la percepción y/o en el comportamiento o por crisis epilépticas”. Aunque es una definición aceptada internacionalmente, su aplicación clínica puede ser complicada en algunos casos, ante la variabilidad de manifestaciones clínicas. Normalmente, la aplicación de esta definición se traduce clínicamente en un síndrome cuyo diagnóstico definitivo de PCI se sustenta en la demostración clínica de un trastorno motor que produce limitaciones en la actividad del sujeto y en la demostración de una lesión cerebral estable mediante historia clínica y/o pruebas de imagen (aunque esto solo está presente en un 80-90% de los pacientes con resonancia magnética nuclear). Por ello, no todo trastorno motor es una PCI. El diagnóstico de PCI se realiza habitualmente a partir de los 2 años (aunque la mayoría de los registros no incluyen el diagnóstico definitivo hasta los 4 años).
A pesar de ser la causa más común de discapacidad motora en la infancia (entre 1 y 2,5 casos por 1.000 nacimientos en Europa)(2), sobre la PCI siguen existiendo una serie de mitos que, unidos a áreas de incertidumbre, hacen que sea una enfermedad mal conocida por la población y por los profesionales sanitarios.
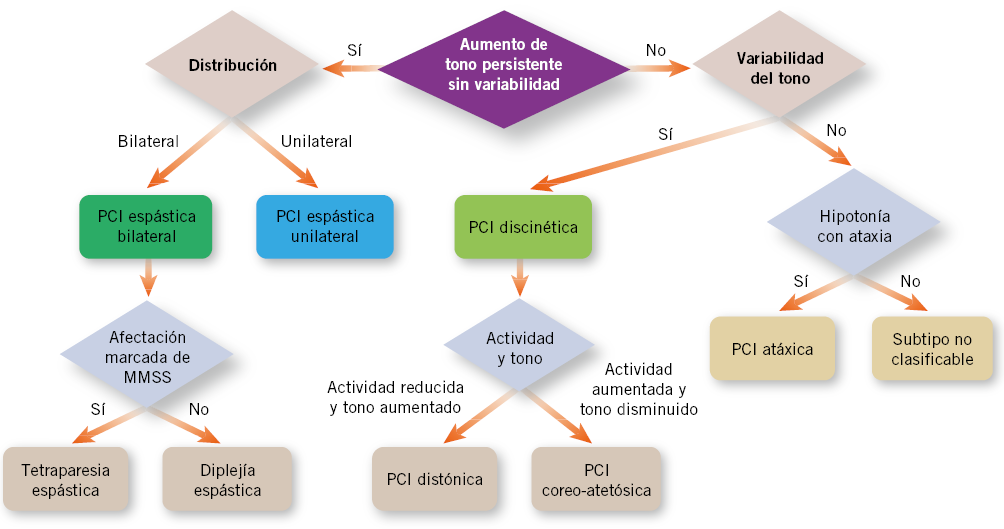
El primer mito es considerar a la PCI como una enfermedad homogénea. No lo es y por ello, se han intentado producir clasificaciones para ordenar su gran heterogeneidad. Se han ido utilizando distintos criterios como: localización anatómica de la lesión (corteza, tracto piramidal, sistema extrapiramidal o cerebelo), grado de tono muscular (hipotónica, con tono normal o hipertónica), sintomatología clínica principal, distribución topográfica de la afectación o el momento supuesto para la lesión que provoca el problema motor (prenatal, intraparto o postnatal)(3). Dos grandes cambios han ocurrido en cuanto a la clasificación en los últimos años. Primero, un grupo de centros europeos, el SCPE (Surveillance of Cerebral Palsy in Europe) diseñó una clasificación que combinaba la semiología clínica principal del trastorno del movimiento con la distribución topográfica de la lesión y, poco a poco, esta clasificación se ha ido consolidando en los últimos años(4). En la figura 1, se muestra la clasificación propuesta por el SCPE con una pequeña modificación que incorpora un subgrupo clínicamente relevante que tradicionalmente se ha denominado “diplejía espástica”(5).
Figura 1. Clasificación SCPE (Surveillance of Cerebral Palsy in Europe) de la distribución y tipos de afectación motora en la PCI (parálisis cerebral infantil). MMSS: miembros superiores.
El segundo gran cambio ha sido la introducción de clasificaciones funcionales que informan sobre el grado de dependencia(6-8) y que, además, sirven para predecir el tipo de complicaciones que presentará cada tipo de paciente (Tabla I).
Estos dos cambios son tan importantes que han cambiado nuestra forma de describir la enfermedad. Hoy, ya no es tolerable diagnosticar a un paciente simplemente de PCI, sino que conviene incorporar sus datos clasificatorios, ya que son estos los que van a determinar su curso clínico y la presencia de complicaciones. Así, por ejemplo, un diagnóstico de “Tetraparesia espástica” es hoy incompleto y se sustituye por “PCI bilateral espástica (tetraparesia espástica). GMFCS (Gross Motor Function Classification System) IV. MACS (Manual Ability Classification System) III. CFCS (Communication Function Classification System) I”.
Sobre las causas de la PCI, también existen bastantes concepciones erróneas. Existen múltiples causas que, con mayor o menor frecuencia, provocan lesiones en el cerebro en desarrollo que son capaces de producir alteraciones en el desarrollo motor del paciente. Podemos clasificar a esa pléyade de causas en función del momento y del tipo de paciente en el que ocurre la lesión (Tabla II).
Entre los mecanismos lesionales, hay que destacar a la encefalopatía hipóxico-isquémica (EHI) y a la leucomalacia periventricular (LMPV). La EHI produce PCI tipo diplejía espástica en prematuros extremos y tetraparesias espásticas o espástico-distónica asociadas a retraso mental en pacientes con más de 34 semanas de gestación(9). Para atribuirla como causa definitiva de una PCI, se utilizan unos criterios causales relativamente estrictos (pH en arteria umbilical < 7, encefalopatía neonatal moderada o grave, PCI espástica o discinética y ausencia de otras causas)(10). Por consideraciones médico-legales y por los efectos psicológicos para la familia, conviene ser claro y estricto en la aplicación de estos criterios. Considerar a la EHI como una causa frecuente es otro mito a desterrar; ya que, en nuestro medio, supone menos del 15% de los casos según los estudios epidemiológicos(3). En contraste, la LPMV (quística o no quística) es la causa más frecuente de PCI en los pacientes nacidos prematuramente. El cerebro del recién nacido pretérmino tiene una especial vulnerabilidad, que se manifiesta en las alteraciones de la mielinización y lesiones axonales focales que aparecen en la LMPV. En muchos pacientes, sobre los mecanismos que provocan la LMPV se añade (es decir, no es la causa principal) la hemorragia de matriz germinal, que suma un daño añadido a las proyecciones corticoespinales cercanas(9).
Tradicionalmente, hemos visto a la PCI como un síndrome unido a gran discapacidad y sin duda, la PCI es una fuente de discapacidad muy importante en la edad pediátrica afectando a los cinco dominios del modelo de la “International Classification of Functioning, Disabibity and Health” (ICF): estructura corporal y función, limitación de actividad, participación, factores personales y ambiente(11). Sin embargo, al contrario de la imagen clásica que los médicos tenemos de la PCI, la discapacidad es muy variable en función de cada sujeto. Aunque todo paciente con PCI sea un paciente crónico, tenemos que ser conscientes de las importantes variabilidades en complejidad que tienen los pacientes. En torno a un 60% de los pacientes con PCI andan sin ayuda y solo un 25-30% de los pacientes no tienen capacidad de marcha(12). El pronóstico está muy relacionado con el tipo SCPE: solo un 3% de los PCI espásticas unilaterales no andan frente a un 60% de las formas discinéticas. Tradicionalmente, hemos prestado mucha atención a la discapacidad y nos hemos olvidado de otros áreas que son también muy importantes para comprender el impacto de la enfermedad en los pacientes y en sus familias. Por ejemplo, el dolor es muy frecuente y sigue infra-diagnosticado en los pacientes con PCI. También, sería importante integrar en el manejo habitual las importantes repercusiones psicosociales que produce la PCI como enfermedad. Desde el punto de vista del paciente, un cuarto de ellos presenta síntomas psicológicos relacionados con la enfermedad. Los cuidadores, generalmente los padres, presentan mayores niveles de estrés y problemas emocionales para enfrentarse a la enfermedad de su hijo, unidos a las dificultades derivadas de los problemas provocados por la red asistencial y de atención social. A nivel educativo, la inclusión de estos pacientes sigue siendo complicada y alterada por los problemas motores y los problemas cognitivos asociados. Socialmente, la PCI produce un considerable aumento del gasto sanitario y una pérdida de productividad extensible al enfermo y a su medio familiar(13). Otro punto sorprendente, es lo poco estudiados e integrados en la práctica clínica que están conceptos, como: la calidad de vida y sus determinantes (por ejemplo, a la larga, en el caso de los pacientes adultos, la capacidad motora donde se invierten enormes esfuerzos familiares y sanitarios, es menos importante para determinar calidad de vida que las habilidades intelectuales, donde los esfuerzos son menos intensos); por ejemplo, aunque tenemos claro que la calidad de vida relacionada con la salud es menor que la de la población general, la percepción de calidad de vida global es similar en muchos estudios, demostrando elementos de resiliencia y adaptación a la enfermedad crónica que quedan por estudiar(14).
A pesar del desconocimiento y del enorme impacto en la salud, en la vida de las familias y en la sociedad de esta enfermedad, la PCI no es una enfermedad intratable. Contrariamente a la percepción generalizada, la PCI tiene tratamientos eficaces que, aunque no son curativos, son eficaces a la hora de evitar complicaciones y mejorar los síntomas de estos pacientes. Transmitir una idea contraria desanima a las familias y puede que esté detrás de la emergencia de terapias “milagro”, cuya eficacia y seguridad son dudosas al carecer del respaldo de pruebas científicas(15). En una enfermedad crónica como la PCI, donde existen problemas a nivel motor, cognitivo, nutricional, etc., es muy importante integrar los tratamientos en un plan terapéutico adaptado a las necesidades, donde es vital la evaluación y el tratamiento multidisciplinar del paciente. Pensamos que el pediatra de Atención Primaria de estos niños juega un papel importante en el equipo como supervisor general de la salud del niño y, muchas veces, como consejero de las familias.
La atención neurológica y neurorrehabilitadora del paciente con PCI
Las complicaciones neurológicas (epilepsia, alteraciones conductuales y cognitivas y problemas de sueño), la espasticidad y las complicaciones musculoesqueléticas requieren de un equipo multidisciplinar.
El tratamiento adecuado de los pacientes con PCI depende de equipos multidisciplinares que atiendan los problemas neurológicos, los problemas generales (v. siguiente punto) y las consecuencias musculoesqueléticas que aparecen en esta enfermedad.
El tratamiento fisioterapéutico de la PCI es un territorio lleno de mitos y concepciones dogmáticas. En este sentido, recientemente se están realizando estudios que están contribuyendo a clarificar qué medidas son eficaces y en qué grupos de pacientes. También está cambiando nuestra concepción a la hora de abordar el problema y el tratamiento se personaliza en función de aquellos objetivos que se quieren alcanzar. En general, el objetivo de las terapias físicas es mejorar las habilidades motoras y el autocuidado, aunque varían en los métodos y en los aspectos concretos que buscan mejorar. Una revisión reciente aporta una visión basada en pruebas sobre las distintas terapias y señala que las terapias que tienen un nivel de evidencia suficiente para recomendarse activamente son: los programas domiciliarios, el entrenamiento bimanual, la terapia de inducción del movimiento por constricción y las terapias ocupacionales basadas en el contexto y/o en los objetivos. También, el entrenamiento físico ha demostrado mejorar la capacidad aeróbica y puede tener su aplicación en pacientes con fatigabilidad. Existen otras terapias, algunas con amplia imposición, cuya eficacia es bastante dudosa en función de los resultados de los estudios clínicos(16).
El manejo de la espasticidad se basa en medidas farmacológicas. Cuando el objetivo terapéutico es mejorar la espasticidad de grupos musculares concretos, el tratamiento eficaz es la toxina botulínica. En el caso de que la espasticidad sea generalizada, se utilizan fármacos orales (el diazepam es el que mayor eficacia ha demostrado según estudios, aunque se pueden utilizar otros como el baclofeno o la tizanidina) y, en casos seleccionados, la infusión intratecal continua de baclofeno. Una opción cuyo nivel de evidencia es bueno, pero cuyo uso es aún infrecuente en nuestro medio, es la rizotomía dorsal selectiva(17).
El trastorno del movimiento en la PCI induce unas complicaciones secundarias en el aparato locomotor: el músculo sufre contracturas, los huesos, deformidades (corregibles solo con cirugías), las articulaciones, subluxaciones (especialmente importante es la cadera) y la columna, escoliosis. Todas estas complicaciones tienen un grado de manejo más o menos complejo. En el manejo de contracturas, se opta habitualmente por utilizar ortesis, pero la medida más eficaz, aunque asociada a efectos adversos y a reticencias del paciente, es la inmovilización con yesos(3). La subluxación de cadera es un problema cuyo control es particularmente importante en la PCI, ya que es prevenible con un control clínico-radiológico ajustado para cada paciente, el tratamiento posicional (mantener el máximo tiempo las caderas en separación) y el manejo de la espasticidad local con toxina botulínica. En casos extremos, hay que recurrir a cirugías invasivas(18). Otra complicación frecuente y grave en los pacientes con GMFCS IV-V es el desarrollo de escoliosis. La escoliosis tiene graves consecuencias en la interacción con el medio y la alimentación y facilita la aspiración y la aparición de dolor. Existen medidas para prevenir la progresión de la escoliosis: los corsés y la correcta sedestación, en ocasiones con ayudas técnicas. En aquellas ocasiones donde la escoliosis produce síntomas y las medidas no quirúrgicas no evitan la progresión, hay que recurrir a complejas cirugías de columna(19).
Al relacionarse la PCI con una lesión en el sistema nervioso central, es habitual que muchos pacientes con PCI presenten crisis epilépticas. El diagnóstico y tratamiento es similar al resto de los pacientes con estas patologías(3).
Muchos de los niños con PCI, pero no todos, asocian alteraciones cognitivas, cuya intensidad y forma es variable en función de la lesión. Muchos cumplen criterios diagnósticos de TDAH y algunos, de autismo. El diagnóstico y el tratamiento es similar al resto de pacientes con estas patologías(3).
Los pacientes con PCI tienen también, con más frecuencia que la población general, problemas de sueño. Los problemas de sueño se relacionan con la gravedad y existencia de epilepsia y con la distribución y el tipo de afectación motora. El problema más frecuente es el síndrome de apneas-hipopneas obstructivas del sueño (en torno a un 15%); pero, además, existe una mayor frecuencia de insomnio y de trastornos del arousal. Clínicamente, suelen estar asintomáticos o reflejarse en una hipersomnia diurna. El tratamiento de los problemas de sueño en la PCI es habitualmente complejo y se basa en el abordaje general del problema concreto, en descartar un papel de actividad epiléptica o de problemas motores en el trastorno (p. ej.: dolor por espasticidad) y en normas conductuales(20).
La atención general del paciente con PCI
Los pacientes con PCI pueden presentar complicaciones en muchos sistemas y se relacionan con el GMFCS.
Las comorbilidades no neurológicas del paciente con PCI son frecuentes e importantes. Tanto su frecuencia como su gravedad suele relacionarse con el grado de discapacidad motora (fácilmente medible con el GMFCS). El grado de interés sobre estos problemas ha sido tradicionalmente bajo. Los pacientes con PCI de GMFCS I-III deberían ser atendidos coordinadamente entre el neuropediatra, el rehabilitador y el pediatra de Atención Primaria. En cambio, la asistencia de los pacientes más complejos debe integrar a estos especialistas y otros, probablemente en un marco más formal que el actual, dirigidos por una figura de coordinador asistencial que asegure la evaluación completa y multidisciplinar del paciente. En todo paciente con PCI, el papel del pediatra general del niño como supervisor del proceso y como consultor más accesible obliga a este a conocer y buscar activamente estos problemas y a orientarlos diligentemente.
El principal área no neurológico de atención en el paciente con PCI es el crecimiento y la nutrición, áreas que son indudablemente esenciales en cualquier niño con o sin PCI. Debemos considerar a todo paciente con PCI como un paciente de alto riesgo de desnutrición, fallo de medro y de obesidad. Por lo tanto, es muy importante realizar controles de peso y talla frecuentes, aunque en niños con gran discapacidad motora y/o contracturas puede ser particularmente complicado. En esos casos, pesar al niño con un padre o pesos especiales que permitan el peso con la silla de ruedas, pueden ser la solución para el peso y en el caso de la talla, se puede realizar una estimación relativamente válida de la talla a través de la longitud tibial (que es válida en niños de 2-12 años, se mide en la cara medial desde la línea interarticular de la rodilla al maléolo medial y cuya relación con la talla sigue la siguiente fórmula: Talla = 30,8 + 3,26 x LT, siendo LT la longitud tibial en cm) y de la altura de la rodilla (válida a todas las edades, pero medible con calibres especiales). La interpretación de los valores antropométricos difiere en los pacientes con PCI: se necesitan referencias especiales para cada nivel de GMFCS y los puntos de corte para considerar riesgo nutricional son distintos (así, hablamos de riesgo nutricional para un percentil menor a 20 de peso para la edad) y precisan aún una intensa investigación para obtener su máximo rendimiento. La información antropométrica puede complementarse con la medición del pliegue tricipital (se utiliza como estimador de los depósitos grasos y hablamos de un riesgo nutricional para un valor menor al p10 de la población general y consideramos un valor deseable a un p10-p25, porque su medición tiende a infraestimar los depósitos grasos en PCI) y la circunferencia del brazo (se utiliza como estimador conjunto de los depósitos musculares y grasos y es interesante por su alta reproducibilidad).
La desnutrición es común en los niños con PCI, pero es una situación evitable y corregible. La principal causa de desnutrición es el consumo inadecuado para su edad. No es un problema de mayores necesidades energéticas: los requerimientos proteicos y de micronutrientes son parecidos a la población general y los requerimientos energéticos parecen similares en el caso de pacientes ambulantes y menores en el caso de pacientes no ambulantes. El consumo inadecuado responde: a problemas de control motor que dificultan la masticación y la deglución, a déficit sensoriales sobre el sabor y textura de los alimentos, a fatigabilidad con la ingesta, a dependencia de otra persona para alimentarse, a presencia de reflujo gastroesofágico y estreñimiento, a alteraciones en el hambre y en la saciedad por la lesión neurológica y a problemas del niño para comunicar sus necesidades alimentarias. La desnutrición en el paciente con PCI lo hace vulnerable a infecciones respiratorias y hace más difícil y menos probable su curación, complica los procedimientos quirúrgicos, afecta al neurodesarrollo como lesión sobreañadida, empeora la calidad de vida relacionada con la salud y aumenta la mortalidad. En todo paciente con PCI, debería realizarse una breve encuesta sobre el tipo de ingesta (qué come, quién le da de comer, cuándo come, cuánto duran las comidas, dónde come y cómo come, es decir, si utiliza algún tipo de asistencia). Aunque las familias tienden a sobre-estimar la cantidad ingerida, esta mínima encuesta nos sirve para detectar aquellos casos en los que la ingesta es claramente inadecuada y aquellos pacientes con imposibilidad de ingesta adecuada (no mastican, tragan mal, etc.) que se benefician de una rehabilitación nutricional para mejorar la ingesta o que son candidatos a gastrostomía. También detecta problemas en el posicionamiento del paciente para comer.
También muy relacionados con la nutrición y el crecimiento, están los problemas de metabolismo óseo. Los pacientes con PCI con formas graves tienen menor densidad ósea, en especial en los casos de mayor inmovilidad (medible por el GMFCS), en aquellos con datos de desnutrición, en los que tienen una ingesta baja de calcio, en los que presentan niveles de vitamina D bajos y en los que necesitan tratamiento antiepiléptico. Esta pérdida de densidad ósea se traduce en fracturas ante mínimos traumatismos(21). El manejo de este problema tiene áreas de incertidumbre, pero actualmente, se recomienda una actitud preventiva consistente en asegurar la ingesta de calcio y vitamina D recomendadas para su edad en una dieta normal (si es imposible, considerar suplementos), considerar en los casos de riesgo un suplemento de vitamina D y estudiar el metabolismo fosfocálcico mediante la determinación de 25-hidroxi-vitamina D (objetivo: 70-100 nM) y el ratio de calcio/osmolaridad en orina de primera micción (objetivo: < 0,25) en los pacientes de riesgo. El papel de la terapia física en la prevención de la pérdida de densidad ósea está pendiente de mejores estudios. En aquellos con una fractura, debe considerar consultar a un experto para valorar un estudio más amplio, suplementos de calcio y vitamina D y tratamiento con bifosfonatos(22).
A nivel digestivo, los pacientes con PCI muestran con mayor frecuencia que la población general problemas relacionados con dismotilidad. Así, hasta en un 75% de los casos, presentan reflujo gastroesofágico y un porcentaje considerable desarrolla una enfermedad por reflujo gastroesofágico (con vómitos o esofagitis como síntomas) y asocian complicaciones importantes relacionadas con este reflujo (rechazo de ingesta, disfagia, aspiración y erosiones dentales). El tratamiento inicial son las medidas conservadoras, como espesamiento de las comidas y corrección de las posiciones después de las comidas. Los tratamientos farmacológicos, como ranitidina o inhibidores de la bomba de protones, se reservan para los casos resistentes o con complicaciones asociadas y se deberían utilizar idealmente de forma transitoria. El tratamiento quirúrgico se reserva en aquellos casos muy resistentes y que suelen necesitar gastrostomía para facilitar la alimentación(23). También, es frecuente la presencia de estreñimiento, especialmente en los pacientes con GMFCS IV-V. Este es un problema muy importante y se relaciona con complicaciones como: el dolor, los efectos secundarios de los tratamientos, la espasticidad, problemas de alimentación o la irritabilidad. El manejo de estos síntomas requiere generalmente un tratamiento con laxantes y vigilar los síntomas hasta alcanzar una dosis eficaz sin incontinencia(24).
Otro problema frecuente, sobre todo en los casos más graves, es la sialorrea, fruto del mal manejo de secreciones. Las consecuencias de la sialorrea son graves: rechazo social, dificultades de cuidado al tener que cambiar continuamente la ropa, infecciones y lesiones orales y periorales, dificultades para la expresión oral y neumonías aspirativas. El manejo de la sialorrea, aunque sigue sin estar claro, se basa actualmente en la inyección de toxina botulínica en las glándulas salivares y en el uso de glicopirrolato(25).
Los pacientes con PCI tienen una alta frecuencia de complicaciones respiratorias y son la primera causa de mortalidad(26). En la figura 2, se incluye un esquema de los mecanismos detrás de las complicaciones respiratorias más frecuentes en la PCI que se hacen más frecuentes con la edad.
Figura 2. Mecanismos involucrados en las complicaciones respiratorias de la parálisis cerebral infantil.
Existen estrategias preventivas muy importantes en aquellos pacientes con GMFCS > III: vacunación completa para neumococo y anual para gripe (es importante considerar a los pacientes con PCI como grupo de alto riesgo de vacunación inadecuada(27)), azitromicina profiláctica en los casos que asocian bronquiectasias o displasia broncopulmonar(28), fisioterapia respiratoria y el control de las complicaciones relacionadas causalmente. Las complicaciones respiratorias producen lesiones residuales que a su vez favorecen la aparición de nuevas complicaciones. Por ello, el tratamiento precoz y la prevención de las complicaciones respiratorias es esencial.
La piel del paciente con PCI es otro órgano al que hay que prestar atención. Muchos de estos pacientes pueden tener úlceras de presión (que pueden desencadenar complicaciones muy graves) o fricción por sus ortesis, que son prevenibles con una educación adecuada al paciente y/o sus padres, explicándoles que una ortesis debe ser ajustada si tras retirarla permanecen áreas enrojecidas durante más de 15-20 minutos. También pueden aparecer áreas de hiperqueratosis por actividades repetidas en rehabilitación o dermatitis del pañal en los pacientes incontinentes(29).
Las alteraciones visuales y auditivas son una comorbilidad muy frecuente en los pacientes con PCI. En el caso de los problemas visuales, hasta un 40% de los pacientes pueden tener un problema visual y todos estos pacientes deben tener una evaluación oftalmológica inicial y revisiones frecuentes. Las alteraciones auditivas también son frecuentes (30-40%), en especial en el caso de las PCI discinéticas. En caso de cualquier duda sobre la capacidad auditiva de un paciente con PCI, debe realizarse una evaluación auditiva reglada.
A nivel urológico, un tercio de los pacientes muestran síntomas de vaciado vesical (incontinencia, urgencia, poliaquiuria, dificultad para iniciar la micción, retención urinaria o infecciones del tracto urinario) por problemas motores del detrusor y de los esfínteres vesicales. La evaluación se basa en el interrogatorio sobre los síntomas, y el tratamiento depende de medidas conductales (establecimiento de rutinas y tiempo para realizar la micción), de adaptaciones en el baño o de sondajes intermitentes. En muchos casos, conseguir la continencia urinaria es complicado(23,29).
A nivel ginecológico y de salud reproductiva, algunos pacientes tienen problemas relacionados con los cambios derivados de la pubertad, que ocurre en la misma edad cronológica que el resto de los niños. A pesar de las reticencias de los padres, existe una necesidad de discutir con estos pacientes temas relacionados con la sexualidad de forma adaptada a su edad mental, para evitar el abuso sexual (más frecuente que en la población general) y los embarazos no deseados (en niñas, también se pueden valorar tratamientos anticonceptivos)(23,29).
En último lugar pero no por ello menos importante, está el dolor, que es frecuente y de origen multifactorial. Es un síntoma difícil de valorar por los profesionales y los familiares. Aunque el manejo pueda ser complicado, la principal dificultad aparece en la adecuada valoración de este síntoma que evita el acceso del paciente a cualquier tratamiento analgésico. Esto obliga a buscar sistemáticamente la existencia y los desencandenantes del dolor(3). Además, en ocasiones, el dolor aparece como consecuencia de actuaciones terapéuticas que se siguen realizando en estos pacientes a pesar de existir claras pruebas de su ineficacia.
A nivel psicosocial, los pacientes y sus familiares pueden suponer un reto para los profesionales en Atención Primaria. Los niños con PCI presentan síntomas relacionados con la depresión y la ansiedad ya en etapas preescolares, sobre los que hay que intervenir, en ocasiones, para evitar que su intensidad aumente en la adolescencia y en la época adulta. En paralelo, los cuidadores y los hermanos sufren también importantes consecuencias emocionales y a nivel laboral y económico.
Conclusión
La atención al paciente con PCI se basa en la comprensión, de que nos enfrentamos a una enfermedad con manifestaciones diversas, por lo que nuestros pacientes requieren planes individualizados en el tratamiento. También, es importante comprender que es una enfermedad compleja y, por lo tanto, una atención adecuada debe ser interdisciplinar y coordinada. Nos enfrentamos a una enfermedad incurable, pero tratable, y esa incurabilidad no debe ser obstáculo ni desánimo para esforzarnos en conseguir una atención médica, psicológica y social de excelencia, que permita mejorar las vidas de estos pacientes y sus familias.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. Bax M, Goldstein M, Rosenbaum P, Leviton A, Paneth N, Dan B, et al. Proposed definition and classification of cerebral palsy, April 2005. Developmental medicine and child neurology. 2005; 47: 571-6.
2. Himmelmann K. Epidemiology of cerebral palsy. Handbook of clinical neurology. 2013; 111: 163-7.
3.*** Colver A, Fairhurst C, Pharoah PO. Cerebral palsy. Lancet. 2014; 383:1240-9.
4. Surveillance of Cerebral Palsy in E. Surveillance of cerebral palsy in Europe: a collaboration of cerebral palsy surveys and registers. Surveillance of Cerebral Palsy in Europe (SCPE). Developmental medicine and child neurology. 2000; 42: 816-24.
5. Ferrari A, Alboresi S, Muzzini S, Pascale R, Perazza S, Cioni G. The term diplegia should be enhanced. Part I: a new rehabilitation oriented classification of cerebral palsy. European journal of physical and rehabilitation medicine. 2008; 44: 195-201.
6. Reid SM, Carlin JB, Reddihough DS. Using the Gross Motor Function Classification System to describe patterns of motor severity in cerebral palsy. Developmental medicine and child neurology. 2011; 53: 1007-12.
7. Eliasson AC, Krumlinde-Sundholm L, Rosblad B, Beckung E, Arner M, Ohrvall AM, et al. The Manual Ability Classification System (MACS) for children with cerebral palsy: scale development and evidence of validity and reliability. Developmental medicine and child neurology. 2006; 48: 549-54.
8. Hidecker MJ, Paneth N, Rosenbaum PL, Kent RD, Lillie J, Eulenberg JB, et al. Developing and validating the Communication Function Classification System for individuals with cerebral palsy. Developmental medicine and child neurology. 2011; 53: 704-10.
9. Marret S, Vanhulle C, Laquerriere A. Pathophysiology of cerebral palsy. Handbook of clinical neurology. 2013; 111: 169-76.
10. Strijbis EM, Oudman I, van Essen P, MacLennan AH. Cerebral palsy and the application of the international criteria for acute intrapartum hypoxia. Obstetrics and gynecology. 2006; 107: 1357-65.
11. Michelsen SI, Flachs EM, Uldall P, Eriksen EL, McManus V, Parkes J, et al. Frequency of participation of 8-12-year-old children with cerebral palsy: a multi-centre cross-sectional European study. European journal of paediatric neurology: EJPN: official journal of the European Paediatric Neurology Society. 2009; 13: 165-77.
12. Himmelmann K, Beckung E, Hagberg G, Uvebrant P. Gross and fine motor function and accompanying impairments in cerebral palsy. Developmental medicine and child neurology. 2006; 48: 417-23.
13. Uldall P. Everyday life and social consequences of cerebral palsy. Handbook of clinical neurology. 2013; 111: 203-7.
14. Vargus-Adams J. Health-related quality of life in childhood cerebral palsy. Archives of physical medicine and rehabilitation. 2005; 86: 940-5.
15. Gómez-Andrés D, Pulido-Valdeolivas I, Martín-Gonzalo JA, López-López J, Martínez-Caballero I, Gómez-Barrena E, et al. [External evaluation of gait and functional changes after a single-session multiple myofibrotenotomy in school-aged children with spastic diplegia]. Revista de neurologia. 2014; 58: 247-54.
16.*** Novak I, McIntyre S, Morgan C, Campbell L, Dark L, Morton N, et al. A systematic review of interventions for children with cerebral palsy: state of the evidence. Developmental medicine and child neurology. 2013; 55: 885-910.
17. Quality Standards Subcommittee of the American Academy of N, the Practice Committee of the Child Neurology S, Delgado MR, Hirtz D, Aisen M, Ashwal S, et al. Practice parameter: pharmacologic treatment of spasticity in children and adolescents with cerebral palsy (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society. Neurology. 2010; 74: 336-43.
18. Robb JE, Hagglund G. Hip surveillance and management of the displaced hip in cerebral palsy. Journal of children’s orthopaedics. 2013; 7: 407-13.
19. Koop SE. Scoliosis in cerebral palsy. Developmental medicine and child neurology. 2009; 51 (Suppl 4): 92-8.
20. Simard-Tremblay E, Constantin E, Gruber R, Brouillette RT, Shevell M. Sleep in children with cerebral palsy: a review. Journal of child neurology. 2011; 26: 1303-10.
21. Mergler S, Evenhuis HM, Boot AM, De Man SA, Bindels-De Heus KG, Huijbers WA, et al. Epidemiology of low bone mineral density and fractures in children with severe cerebral palsy: a systematic review. Developmental medicine and child neurology. 2009; 51: 773-8.
22. Fehlings D, Switzer L, Agarwal P, Wong C, Sochett E, Stevenson R, et al. Informing evidence-based clinical practice guidelines for children with cerebral palsy at risk of osteoporosis: a systematic review. Developmental medicine and child neurology. 2012; 54: 106-16.
23.*** Pruitt DW, Tsai T. Common medical comorbidities associated with cerebral palsy. Physical medicine and rehabilitation clinics of North America. 2009; 20: 453-67.
24. Veugelers R, Benninga MA, Calis EA, Willemsen SP, Evenhuis H, Tibboel D, et al. Prevalence and clinical presentation of constipation in children with severe generalized cerebral palsy. Developmental medicine and child neurology. 2010; 52: e216-21.
25. Walshe M, Smith M, Pennington L. Interventions for drooling in children with cerebral palsy. The Cochrane database of systematic reviews. 2012; 11: CD008624.
26. Reid SM, Carlin JB, Reddihough DS. Survival of individuals with cerebral palsy born in Victoria, Australia, between 1970 and 2004. Developmental medicine and child neurology. 2012; 54: 353-60.
27. Greenwood VJ, Crawford NW, Walstab JE, Reddihough DS. Immunisation coverage in children with cerebral palsy compared with the general population. Journal of paediatrics and child health. 2013; 49: E137-41.
28. Kirk CB. Is the frequency of recurrent chest infections, in children with chronic neurological problems, reduced by prophylactic azithromycin? Archives of disease in childhood. 2008; 93: 442-4.
29.*** Jones MW, Morgan E, Shelton JE. Primary care of the child with cerebral palsy: a review of systems (part II). Journal of pediatric health care: official publication of National Association of Pediatric Nurse Associates & Practitioners. 2007; 21: 226-37.
Bibliografía recomendada
– Colver A, Fairhurst C, Pharoah PO. Cerebral palsy. Lancet. 2014; 383(9924): 1240-9.
Revisión general sobre PCI que se centra en los problemas neurológicos de estos pacientes.
– Novak I, McIntyre S, Morgan C, Campbell L, Dark L, Morton N, et al. A systematic review of interventions for children with cerebral palsy: state of the evidence. Developmental medicine and child neurology. 2013; 55: 885-910.
Revisión sistemática que analiza los estudios disponibles para fundamentar las diversas terapias empleables en el tratamiento de los problemas motores y neurológicos de los pacientes con PCI.
– Pruitt DW, Tsai T. Common medical comorbidities associated with cerebral palsy. Physical medicine and rehabilitation clinics of North America. 2009; 20: 453-67.
Buena revisión sobre las complicaciones médicas no neurológicas de los pacientes con PCI.
– Jones MW, Morgan E, Shelton JE. Primary care of the child with cerebral palsy: a review of systems (part II). Journal of pediatric health care: official publication of National Association of Pediatric Nurse Associates & Practitioners. 2007; 21: 226-37.
Otro excelente resumen sobre las complicaciones médicas no neurológicas de los pacientes con PCI.
| Caso clínico |
|
Enfermedad actual: varón de 6 años de edad que acude a su Centro de Salud por primera vez, procedente de otra comunidad autónoma, con el diagnóstico de diparesia espástica por encefalopatía hipóxico-isquémica. Acuden a consulta porque no come. La madre refiere que tiene “rachas” así y que normalmente se le pasan solas. Antecedentes personales: embarazo de curso normal y controlado adecuadamente. Cesárea urgente por desprendimiento de placenta normalmente inserta. Edad gestacional: 38 semanas. Peso al nacimiento: 2.530 g. pH de arteria umbilical 6,8. Apgar: 3/5/7. Ingresa en Neonatología con los diagnósticos al alta de recién nacido a término de peso adecuado para edad gestacional y encefalopatía hipóxico-isquémica moderada con mínima alteración de ganglios de la base en RMN craneal tratada con hipotermia craneal. Seguimientos previos únicamente por Neurología Pediátrica (EEG normal, retraso del lenguaje y ligera torpeza para la marcha y la manipulación). No recibe tratamiento farmacológico habitual. Escolarizado, previamente, en un colegio de integración motora con adaptación curricular y fisioterapia. Antecedentes familiares: tercer hijo de padres no consanguíneos. Madre sana de 45 años. G-A-V: 3-0-3. Abogada, pero no trabaja actualmente, porque no puede por sus hijos. Padre sano de 46 años. Abogado que trabaja en una internacional y que ha sido trasladado actualmente. Hermana de 14 años y hermano de 12 años sanos. Exploración general: peso 17 kg (p9-1,4 DS). Talla: 120 cm (p71, 0,58 DS). Sin alteraciones relevantes. Exploración neurológica: vital. Reactivo. Interacción adecuada. Lenguaje oral de contenido normal y fácilmente compresible. Impresiona de inteligencia normal o normal-baja. No signos meníngeos. A nivel motor: presenta una espasticidad de tríceps sural y problemas para la manipulación fina, con limitación para la supinación del antebrazo. Funcionalmente, anda solo pero le cuesta correr. Es capaz de dibujar, pero tiene problemas para realizar trazos finos. Aparentemente, no hay déficits sensitivos y los pares craneales son normales.
|