|
| Temas de FC |
A. Fierro Urturi
Centro de Salud Pisuerga. Valladolid
| Resumen
La púrpura se produce como consecuencia de la extravasación de células sanguíneas a la piel y/o mucosas dando lugar a lesiones de color rojo-violáceo que no desaparecen a la vitropresión. Desde el punto de vista etiopatogénico, pueden producirse por alteración de alguno de los tres componentes de la hemostasia: plaquetas, factores de la coagulación o lesiones de la pared vascular (vasculitis). A nivel clínico, se caracterizan por presentar hemorragias cutáneo-mucosas, pero pueden afectar en casos graves a cualquier órgano o sistema, condicionando sintomatología muy diversa. La trombocitopenia inmune primaria (PTI) es una enfermedad autoinmune adquirida producida por una destrucción acelerada y una producción inadecuada de plaquetas mediada por autoanticuerpos. Se caracteriza por una disminución aislada de la cifra de plaquetas por debajo de 100.000/µl, en ausencia de una enfermedad o causa subyacente de la trombocitopenia. El manejo diagnóstico, pronóstico y terapéutico de la trombocitopenia inmune primaria es controvertido. El grupo de trabajo de la Sociedad Española de Hematología y Oncología Pediátricas ha actualizado sus recomendaciones para el diagnóstico y tratamiento de la PTI basadas en los nuevos conceptos fisiopatológicos y en los nuevos recursos terapéuticos. |
| Abstract
Purpura results from the extravasation of blood cells into the skin and/or mucous membranes giving rise to small purple coloured areas that do not disappear under pressure. The etiopathogenic mechanisms may result from abnormalities in any of the three components of hemostasis: platelets, plasma coagulation factors, and blood vessels (vasculitis). Clinic is characterized by mucocutaneous bleeding, but severe cases can affect any organ or system, conditioning diverse symptoms. Primary immune thrombocytopenia (ITP) is an autoimmune disorder characterized by antibody mediated destruction of platelets and suppression of platelet development. It’s defined as a peripheral blood platelet count under 100.000/ μl , and the absence of any obvious initiating and/or underlying cause of the thrombocytopenia. Management, diagnosis, prognosis and treatment of immune thrombocytopenia are controversial. The ITP working group of the Spanish Society of Paediatric Haematology and Oncology has updated its guidelines for diagnosis and treatment of ITP in children based on current pathophysiological concepts and new therapeutic resources. |
Palabras clave: Púrpura; PTI; Infancia.
Key words: Purpura; ITP; Childhood.
Pediatr Integral 2012; XVI(5): 399-412
Púrpuras. Trombocitopenia inmune primaria
Púrpuras
Introducción
La púrpura es producida por la extravasación de células sanguíneas a la piel y/o mucosas, dando origen a lesiones de coloración purpúrea que no desaparecen a la vitropresión. A nivel clínico, se manifiesta con hemorragias cutáneo-mucosas, pudiendo afectar en casos graves a cualquier otro órgano o sistema, condicionando sintomatología muy diversa.
Se clasifican de acuerdo con su localización y tamaño en:
• Púrpuras superficiales: se denominan petequias las lesiones menores de 2 mm y equimosis las de mayor de 1 cm. Las de tamaño intermedio constituyen la púrpura propiamente dicha.
• Púrpuras profundas o hematomas: cuando invade los distintos estratos cutáneos.
El color es inicialmente rojo o rojo-violáceo. Al evolucionar, adquieren tonalidades verdosas y amarillentas hasta desaparecer totalmente o dejar un tono marrón por depósito de hemosiderina. Si a la extravasación de hematíes acompaña una lesión vascular significativa (vasculitis), la lesión purpúrica puede estar elevada y ser palpable.
Etiopatogenia
Puede producirse por alteración de alguno de los tres componentes de la hemostasia: plaquetas, factores de la coagulación o lesiones de la pared vascular (vasculitis).
En la tabla I, se expone la clasificación etiológica de la púrpura según el componente de la hemostasia alterado(1-5).

Diátesis hemorrágicas de origen plaquetario o púrpuras plaquetarias
Pueden estar producidas por una alteración en el número de plaquetas (púrpuras trombopénicas o plaquetopenias ) o por una alteración de la función de las mismas (púrpuras trombopáticas o plaquetopatías).
1. En las púrpuras trombopénicas o plaquetopenias se produce una disminución aislada del recuento plaquetario a valores <100-150.000/µl (según autores). Las causas de trombocitopenia son:
a. Producidas por descenso de la producción plaquetaria, que puede ser de origen congénito o adquirido. En este grupo, están incluidas enfermedades que afectan a la formación de megacariocitos en la médula ósea, o trastornos que provoquen una incapacidad de los megacariocitos para liberar plaquetas funcionantes (trombopoyesis ineficaz).
b. Por un aumento de la destrucción de plaquetas de causa inmunitaria o no inmunitaria.
c. Por alteración de la distribución plaquetar con secuestro de plaquetas en un bazo aumentado de tamaño o en otros órganos.
La causa más frecuente de una trombocitopenia aguda en la infancia en un niño sano es la trombocitopenia inmune primaria (PTI).
2. Las púrpuras trombopáticas o plaquetopatías son cuadros más infrecuentes, debidos a alteraciones de la función plaquetaria. En laboratorio, encontraremos un tiempo de hemorragia/tiempo de obturación (TO) alargado, con un número de plaquetas normal o discretamente disminuido. El tiempo de tromboplastina parcial (TTPa) y el tiempo de protrombina (TP) están en límites normales.
Diátesis hemorrágicas de origen vascular o angiopáticas
Incluyen aquellos trastornos hemorrágicos debidos a alteraciones estructurales y/o funcionales de la pared vascular y sus tejidos de sostén. Las pruebas de coagulación y el número de plaquetas son normales. Se presentan como petequias y equimosis en la piel, siendo menos frecuente la presentación de hemorragias mucosas. Estas pueden ser hereditarias o adquiridas. La mayoría de las vasculitis en la infancia son “reactivas” y secundarias a procesos infecciosos/inflamatorios.
La púrpura de Schönlein-Henoch (PSH) es la vasculitis adquirida más frecuente en la infancia.
Diátesis hemorrágicas de origen plasmático
Se manifiestan clínicamente con auténticos hematomas, pudiendo presentar también hemorragias mucosas. La enfermedad de von Willebrand es la diátesis hemorrágica hereditaria más frecuente y las deficiencias de los factores VIII o factor IX (hemofilia A o B) las enfermedades hemorrágicas hereditarias graves más frecuentes. En laboratorio, encontramos un número de plaquetas dentro de los límites normales y estarán alterados aquellos estudios que evalúen la vía en las que participe el factor alterado (excepto en el déficit del factor XIII).
• Tiempo de protrombina (TP): se alarga por alteraciones en factores vitamina K dependientes (II, VII, IX, X), factor V y fibrinógeno.
• Tiempo de tromboplastina parcial (TTPa): se alarga en las alteraciones de los factores VIII, IX, XI, XII, precalicreína y quininógeno de alto peso molecular.
• Tiempo de trombina: se alarga cuando existen alteraciones del fibrinógeno, hiperfibrinólisis o heparina.
Anamnesis y exploración
Ante un niño con lesiones purpúricas, se debe hacer una historia clínica detallada, preguntando por: antecedente de traumatismo, llanto previo, accesos de tos, vómitos de repetición, antecedentes de sangrado, de infección o de enfermedad sistémica conocida, exposición reciente a fármacos/tóxicos y antecedentes personales o familiares de alteraciones de la coagulación.
En la exploración, se debe valorar el estado general, la afectación de mucosas, número de lesiones y su distribución. Las lesiones localizadas: en tercio superior del tronco, cara y cuello, normalmente están relacionadas con maniobras de Valsalva, en zonas de apoyo tras decúbitos prolongados, en zonas de presión “en cinturón”, brazos o axilas… Descartar signos de infección, asociación de linfadenopatias y/o hepatoesplenomegalia, alteraciones óseas, hiperlaxitud articular y otras alteraciones cutáneas.
Pruebas de laboratorio
Salvo cuando la púrpura sea claramente secundaria al mecanismo de Valsalva, se debe solicitar hemograma completo con fórmula manual para descartar agregación plaquetaria, células inmaduras en sangre periférica y signos de hemólisis propios de las microangiopatías (PTT y SHU) y de la CID. También, se solicitará bioquímica sanguínea, iones con creatinina en sangre y orina, coagulación y tira reactiva en orina.
En situación de trombopenia, es importante la determinación del Volumen Plaquetario Medio (VPM), pues orienta a si la trombopenia es por “consumo periférico” (médula ósea regenerativa, produce plaquetas de mayor tamaño, VPM aumentado) o por “disminución de la producción” (afectación de la médula ósea que es hiporregenerativa, produce plaquetas pequeñas, VPM normal o bajo)(1,6).
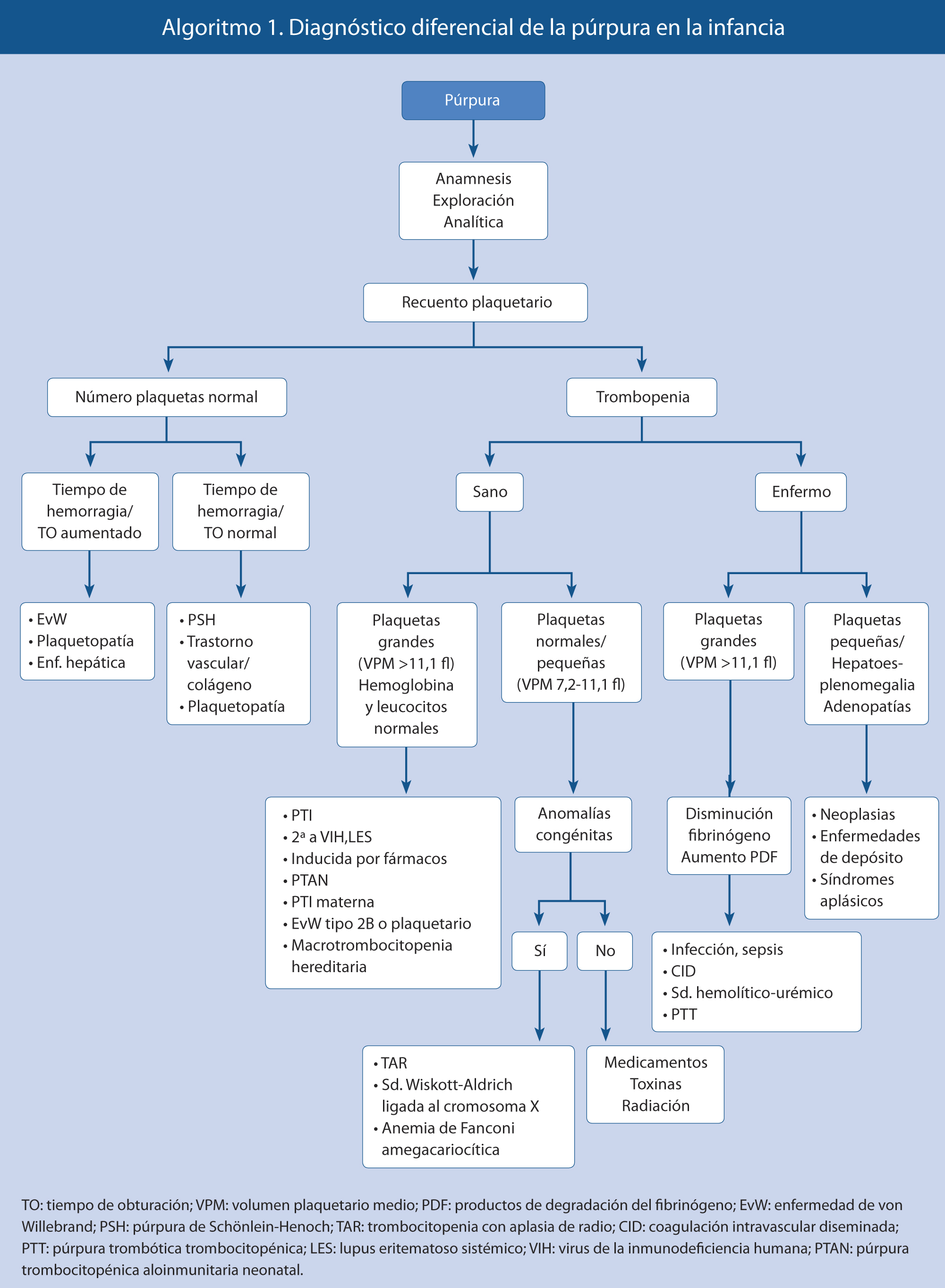
Diagnóstico diferencial
En el algoritmo 1, se describe el diagnóstico diferencial de púrpura en la infancia(1,6).
Trombocitopenia inmune primaria (PTI)
La PTI es una enfermedad autoinmune adquirida, de curso clínico variable, producida por una destrucción acelerada y una producción inadecuada de plaquetas mediada por autoanticuerpos.
Introducción
La trombocitopenia inmune primaria (PTI) es una enfermedad autoinmune adquirida con presentación, características y curso clínico muy variables. Es la causa más frecuente de trombocitopenia de presentación aguda en un niño sano. La incidencia en la edad pediátrica es de 5 casos por 100.000 habitantes/año.
La trombocitopenia inmune primaria (PTI) es, actualmente, motivo de discusión en lo concerniente a evolución, diagnóstico, pronóstico y tratamiento.
En marzo de 2009, un grupo internacional de trabajo, formado por expertos europeos y americanos, publicaron las recomendaciones consensuadas de la terminología, definiciones y criterios de respuesta en la PTI para adultos y niños(7).
En enero de 2010 se publicó el Consenso Internacional para el Diagnóstico y Tratamiento de la PTI basado en los nuevos conceptos fisiopatológicos y en los nuevos recursos terapéuticos(8).
Definiciones básicas
y terminología
Actualmente se recomienda la denominación de trombocitopenia inmune primaria.
Se caracteriza por un recuento de plaquetas <100.000/µl, en ausencia de infecciones o patología de base que la justifique.
Se ha optado por cambiar la nomenclatura clásica (púrpura trombocitopénica idiopática) con el fin de aclarar el mecanismo patogénico de la enfermedad. Los términos “púrpura” e “idiopática” se consideran inadecuados para definir la enfermedad, ya que el sangrado cutáneo o mucoso está ausente o es mínimo en algunos pacientes.
Hoy en día, la patogenia de la enfermedad se considera que es autoinmune, producida por una destrucción acelerada y una producción inadecuada de plaquetas mediada por autoanticuerpos y linfocitos T. Por ello, actualmente, se recomienda la denominación de trombocitopenia inmune primaria. Se mantiene el acrónimo Immune ThrombocytoPenia (ITP) y PTI en castellano, por su significado histórico y su uso consolidado en el lenguaje médico cotidiano.
Para el diagnóstico de PTI primaria deberán estar presentes los requisitos siguientes:
• Trombocitopenia. Se establece una cifra de plaquetas por debajo de 100.000/µl, por los recuentos frecuentes entre 100 y 150.000/µl en personas sanas y embarazadas. El recuento del resto de líneas celulares es normal y el número de megacariocitos en médula ósea normal o aumentado.
• Ausencia de enfermedad infecciosa de base (mononucleosis infecciosa, hepatitis…).
• Ausencia de patología sistémica de base (lupus eritematoso sistémico, síndrome de inmunodeficiencia adquirida, linfoma…).
Se denomina PTI secundaria cuando está asociada a alguna patología infecciosa o sistémica de base, como sucede en las enfermedades autoinmunes, ciertas neoplasias o cuando es inducida por medicamentos o tóxicos.
Clasificación
La PTI se clasifica según el tiempo de evolución en: PTI de reciente diagnóstico (<3 meses), PTI persistente (3-12 meses) y PTI crónica (>12 meses).
• PTI de reciente diagnóstico: menos de 3 meses de evolución.
• PTI persistente: de duración entre los 3 y 12 meses desde el diagnóstico, incluye a:
– Pacientes que no alcanzan la remisión completa de forma espontánea.
– Pacientes que no mantienen la remisión completa después de suspender el tratamiento instaurado.
• PTI crónica: más de 12 meses de evolución.
Fisiopatología
La PTI es un trastorno autoinmune en el que la aparición de anticuerpos antiplaquetarios sigue siendo el mecanismo patogénico central. Se generan autoanticuerpos, generalmente de la clase IgG, contra ciertos antígenos plaquetarios, especialmente glicoproteínas IIb/IIIa y Ib/IX. El defecto subyacente que lleva a la producción de autoanticuerpos se desconoce, y es probable que tanto factores genéticos como ambientales estén involucrados. Un elemento clave en la fisiopatología de la PTI es la pérdida de la autotolerancia, que da lugar a la producción de anticuerpos contra antígenos plaquetarios. La causa de la pérdida de la tolerancia inmunitaria en la PTI sigue siendo desconocida. En el 50-60% de los casos de PTI infantil, existe el antecedente de enfermedad viral reciente, desarrollando entre 1 y 4 semanas después autoanticuerpos dirigidos contra la superficie plaquetaria. Se desconoce la razón por la que algunos niños responden a una infección común desarrollando una enfermedad autoinmunitaria.
Los autoanticuerpos también se unen a los megacariocitos de la médula ósea, afectando de esta manera a la maduración de los megacariocitos y a la producción de plaquetas. Basado en este concepto, se ha utilizado recientemente con éxito tratamiento con estimulantes de la producción plaquetaria con agonistas del receptor de trombopoyetina.
En la figura 1, se representa de forma simplificada la fisiopatología de la PTI(10).
Manifestaciones clínicas
Los síntomas y signos clínicos son muy variables. El riesgo de hemorragia es el principal problema. Los signos clínicos son la púrpura generalizada, espontánea o ante traumatismos mínimos, asociada, en ocasiones, a otras manifestaciones hemorrágicas: epistaxis, hemorragia gastrointestinal, hematuria o menorragia. No siempre hay correlación entre la cifra de plaquetas y las manifestaciones hemorrágicas, aunque éstas son más frecuentes por debajo de 10.000/µl. La mayor incidencia de PTI en el niño se registra entre los 2 y los 8 años de edad. En aproximadamente un 60% de los casos, hay una historia previa de una infección viral ocurrida 1 a 4 semanas antes del comienzo de la trombocitopenia. Hay también un incremento de riesgo de trombocitopenia asociada a la vacunación sarampión-rubéola-parotiditis(11).
La presentación clásica suele ser la aparición brusca de petequias generalizadas y púrpura en un niño de 1 a 4 años previamente sano. Solo el 3% de los niños tienen hemorragias significativas y graves (concentración de hemoglobina <10 g/L, disminución de la hemoglobina en 2 g/L o hemorragia que requiere transfusión). La hemorragia intracraneal es infrecuente afectando aproximadamente 0,1-0,5% de los casos. Factores de riesgo de hemorragia intracraneal en niños con severa trombocitopenia incluyen trauma craneal y uso concominante de medicación que afecte a la función plaquetaria.
Especial cuidado requiere la asociación de niños con PTI y coexistencia de vasculitis o coagulopatías, así como casos PTI asociados a varicela(8).
Cuando la clínica comienza de forma insidiosa, sobre todo en un adolescente, existe con más frecuencia la posibilidad de que evolucione a una PTI crónica o de que la trombocitopenia sea una manifestación de una enfermedad sistémica, como el lupus eritematoso diseminado (LED).
Diagnóstico
El diagnóstico es realizado por exclusión de otras causas de trombocitopenia. No hay ningún parámetro clínico ni analítico que permita realizar el diagnóstico.
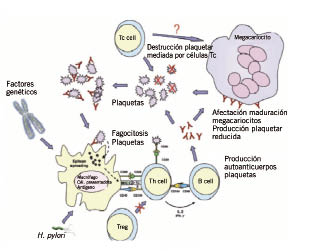
Figura 1. Representación simplificada de la fisiopatología de la PTI. La sensibilización plaquetaria comienza con la fijación de autoanticuerpos a glicoproteínas de las plaquetas. El complejo antígeno-anticuerpo es captado y fagocitado por macrófagos u otra célula presentadora de antígeno (APC) fundamentalmente en el bazo. Las glicoproteínas son degradadas a péptidos, expresándose de novo en la superficie de la célula APC a través de moléculas HLA de clase II. Estas glicoproteínas son presentadas de novo a células Th colaboradoras mediante la presencia de moléculas coestimulatorias para la activación de linfocito T, como son el antígeno 154 y su ligando CD 40. Las células Th activadas producen citoquinas (interleukina-2 e interferón) que promueven la diferenciación de células B y producción de autoanticuerpos. Las células T reguladoras (Tregs) normalmente inhiben la actividad de Th y la proliferación celular, pero su función en la PTI está afectada. Los autoanticuerpos también se unen a los megacariocitos de la médula ósea, afectando de esta manera la maduración de los megacariocitos y la producción de plaquetas. Una vía alternativa de la destrucción de las plaquetas es por células T citotóxicas autoreactivas. Las células Tc en la médula ósea también podrían inhibir la megacariopoyesis y trombopoyesis, aunque esto no ha sido aún demostrado. El papel de las infecciones, tales como H. pylori, no ha sido completamente aclarada, pero se ha demostrado reactividad cruzada entre los antígenos bacterianos y las glicoproteínas de las plaquetas.
Se basa en la amnanesis, la exploración física, el hemograma y la extensión de sangre periférica.
En todos los pacientes con trombocitopenia debe realizarse una historia clínica detallada, tanto familiar como del paciente, y una exploración física completa que permitan descartar otras enfermedades hematológicas o situaciones que, de forma secundaria, puedan producir trombocitopenia.
Historia clínica
Se debe preguntar por:
• Antecedentes recientes (<6 semanas) de infección vírica o contacto con varicela.
• Antecedentes de infecciones graves o recurrentes.
• Síntomas de enfermedad sistémica de base o enfermedad autoinmune.
• Vacunación con virus vivos semanas previas.
• Exposición reciente a fármacos/tóxicos que puedan producir trombocitopenia (heparina, quinina/quinidina, sulfonamidas) o ingesta de aspirina que incremente las manifestaciones hemorrágicas.
• Antecedentes personales o familiares de alteraciones de la coagulación.
• Factores de riesgo de VIH.
En un 20-30% de los pacientes con trombocitopenia inmune, la causa puede ser secundaria a una infección (VIH, CMV, VHC o VEB),drogas, otra enfermedad autoinmune (lupus eritematoso diseminado) o en asociación con una enfermedad maligna (linfoma, leucemia)(11).
Exploración física
La exploración física suele ser normal, salvo las petequias y la púrpura. Si la hemorragia afecta otros órganos, la exploración mostrará la alteración especifica de los órganos o sistemas afectados.
Se deben evaluar las características de la hemorragia, si es cutánea, si afecta a mucosas, su gravedad, extensión y tiempo de evolución. Deben identificarse condiciones concominantes que aumenten el riesgo hemorrágico.
Generalmente, no asocia hepatoesplenomegalia ni adenopatías. La presencia de estos hallazgos sugiere otros diagnósticos, como leucemia o cáncer linfático.
Se debe descartar la existencia de signos dismórficos que sugieran trombocitopenias congénitas incluyendo anomalías óseas e hipoacusias.
Exploraciones complementarias
Se describen en la tabla II las exploraciones complementarias al diagnóstico(8,9).

Es frecuente una trombocitopenia intensa (recuento plaquetario <20.000/µl) con plaquetas de tamaño normal o aumentado debido al incremento del recambio de plaquetas. En la PTI aguda, la concentración de hemoglobina y el recuento y fórmula leucocitaria deben ser normales. En caso de hemorragias intensas, la concentración de hemoglobina puede disminuir.
En los adolescentes con PTI de nueva aparición, se debe descartar un LED mediante anticuerpos antinucleares. En las poblaciones de riesgo, debe analizarse el VIH, sobre todo en adolescentes sexualmente activos.
El análisis de anticuerpos antiplaquetarios (plaquetas asociados a inmunoglobulina G) rara vez resulta útil en la PTI. Un resultado negativo no descarta la enfermedad. También, tienen poca utilidad la determinación de trombopoyetina (TPO), normal o levemente aumentada, el estudio del número de plaquetas reticuladas y el estudio de la supervivencia plaquetar.
Si existe una anemia inexplicada, debe realizarse una prueba de Coombs para descartar un síndrome de Evans (anemia hemolítica y trombocitopenia autoinmunitarias) o antes de iniciar el tratamiento con inmunoglobulina anti-D i.v.
Hay determinadas infecciones víricas (VIH, VHC), así como la del Helicobacter pylori, que pueden relacionarse con trombocitopenia inmune. Se aconseja la determinación del VHC e VIH en todos los pacientes, y la del H. pylori solo en áreas de alta prevalencia o sospecha clínica(12).
El estudio de la médula ósea revela unas series eritrocitaria y granulocítica normales con un número de megacariocitos normal o aumentado. Algunos de estos pueden ser inmaduros debido al aumento de recambio de plaquetas.
Diagnóstico diferencial
El diagnóstico diferencial de los síndromes trombocitopénicos en la infancia se describe en la tabla I.
El algoritmo 1 orienta el diagnóstico de púrpura trombopénica.
• En niños con aspecto sano y trombocitopenia moderada o intensa, otros parámetros sanguíneos normales y una exploración física normal, habría que hacer el diagnóstico diferencial con exposición a medicamentos que inducen la formación de anticuerpos, el secuestro esplénico debido a una hipertensión portal inadvertida o un proceso aplásico inicial del tipo anemia de Fanconi. Los síndromes congénitos: la trombocitopenia amegacariocitica y el síndrome de trombocitopenia con ausencia de radio (TAR) solo interfieren la producción de plaquetas sin inducir anomalías de la síntesis de eritrocitos y leucocitos.
• Niños enfermos que asocian un aumento de destrucción no inmunitaria de plaquetas suelen ser enfermedades sistémicas graves, como síndrome hemolítico urémico (SHU), coagulación intravascular diseminada (CID).
Si la trombocitopenia se acompaña de anemia o leucopenia, deberán descartarse otras patologías causantes, como leucemia aguda o aplasia medular.
La esplenomegalia aislada debe hacer pensar en la posibilidad de un hiperesplenismo debido a una hepatopatía o una trombosis de la vena porta.
La trombocitopenia autoinmunitaria puede ser una manifestación de un LED, de una infección VIH o, más rara vez, de un linfoma.
En varones jóvenes con un recuento de plaquetas bajos, debe sospecharse un síndrome de Wiskott-Aldrich (SWA), especialmente en los que tienen antecedente de eccema e infecciones de repetición.
En neonatos y lactantes pequeños, es necesario descartar trombocitopenia aloinmune y PTI en la madre.
Tratamiento
El objetivo del tratamiento es revertir y evitar hemorragias con relevancia clínica. Se propone una evaluación clínica de la gravedad en función de las manifestaciones hemorrágicas y de unos indicadores o factores de riesgo que, junto al recuento de plaquetas, determinen la recomendación terapéutica específica.
El objetivo del tratamiento es revertir y prevenir hemorragias con riesgo clínico para el paciente, más que corregir las cifras de plaquetas hasta valores normales. Actualmente, se trata de evitar tratamientos innecesarios, potencialmente tóxicos, en pacientes asintomáticos o con descensos moderados de las plaquetas, con el fin de mejorar la calidad de vida con la menor toxicidad asociada al tratamiento.
Criterios para la valoración clínica de la gravedad
Las decisiones terapéuticas se deben tomar considerando múltiples factores(8,9,13). Las recomendaciones basadas exclusivamente en las cifras de plaquetas son muy controvertidas. Se propone una evaluación clínica de la gravedad en función de las manifestaciones hemorrágicas y de unos indicadores o factores de riesgo cuya presencia aumenta el riesgo de hemorragia grave, fundamentalmente, la intracraneal(9).
• Clínica cutánea: equimosis, petequias en la piel y muy escasas en la mucosa oral.
• Clínica cutáneo-mucosa.
• Hemorragia activa: epistaxis que precisa taponamiento, hematuria, hemorragia digestiva macroscópica, menorragia, gingivorragia importante, cualquier hemorragia con riesgo de precisar trasfusión de hematíes.
• Factores de riesgo hemorrágico: hematuria, traumatismo craneoencefálico (TCE), politraumatismo previo, tratamiento con antiagregantes hasta 7-10 días antes, diátesis hemorrágica (coagulopatía, vasculitis).
Recomendaciones generales
Evitar tratamientos innecesarios, potencialmente tóxicos, en pacientes asintomáticos o con descensos moderados de las plaquetas y conseguir una adecuada calidad de vida con la mínima toxicidad asociada a la terapia.
• En el momento del diagnóstico, debe considerarse el ingreso hospitalario en:
– Pacientes con hemorragia activa.
– Factores de riesgo hemorrágico.
– Recuentos de plaquetas igual o inferior a 20.000/µl.
– Se debe considerar el ingreso en niños con familias con problemática psicosocial o domicilios lejanos de un centro sanitario.
• Contraindicado: el uso de ácido acetilsalicílico y derivados. Se debe tener precaución y administar, solo en caso necesario, fármacos que puedan alterar la agregación plaquetaria (antihistamínicos, antiinflamatorios no esteroideos).
• Evitar inyectables intramusculares y punciones vasculares en vasos de difícil compresión.
• Deportes: se indicará restricción de la actividad deportiva en función de la clínica y riesgo traumático.
En la tabla III, se establece la nomenclatura para definir los criterios de respuesta al tratamiento en la PTI.

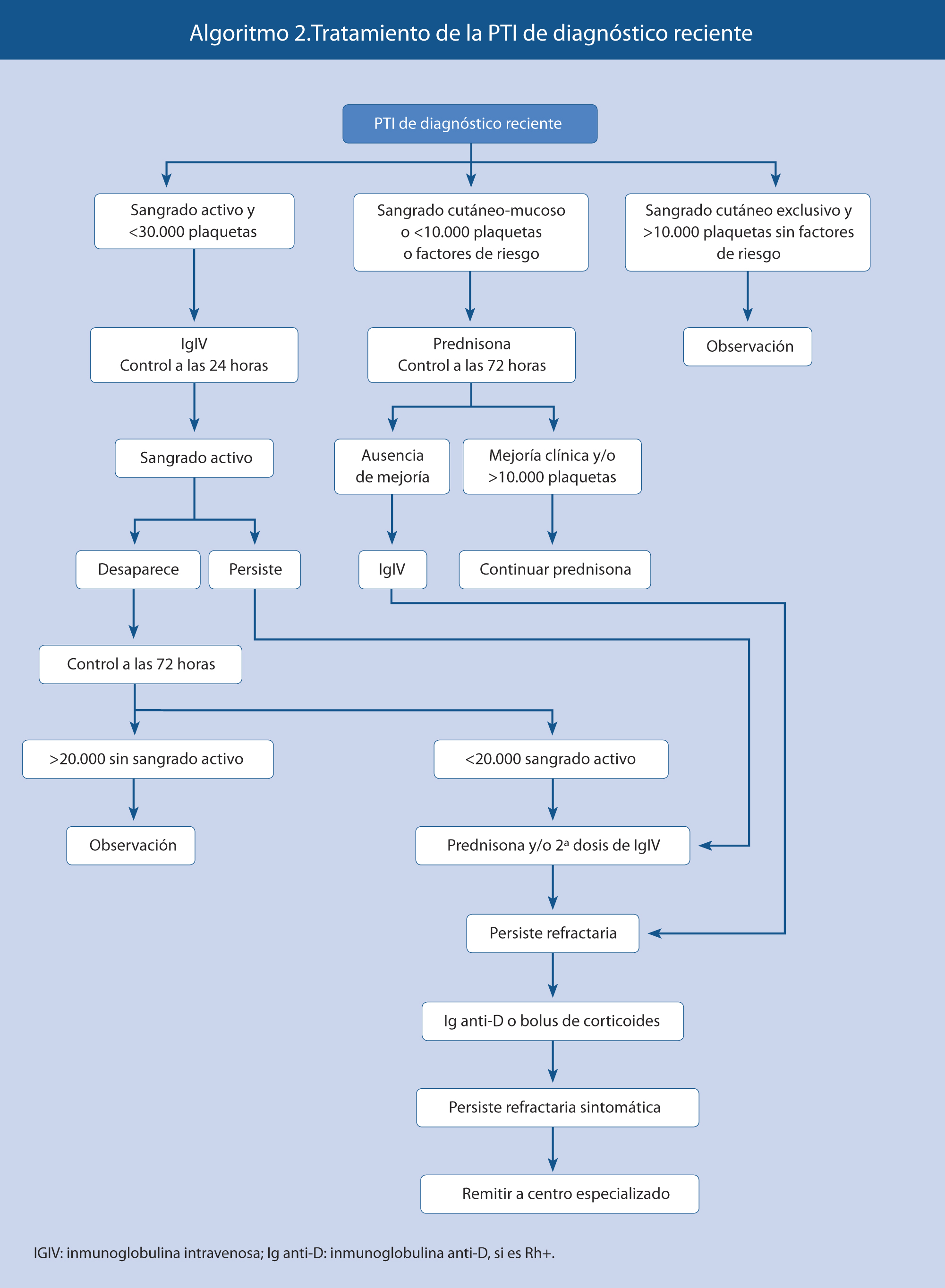
Tratamiento de la PTI de reciente diagnóstico
Para un adecuado enfoque terapéutico, se debe valorar el conjunto de datos clínicos y biológicos. En el algoritmo 2 se muestra la opción de tratamiento más adecuada en función de las manifestaciones clínicas, recuento de plaquetas y factores de riesgo hemorrágico.
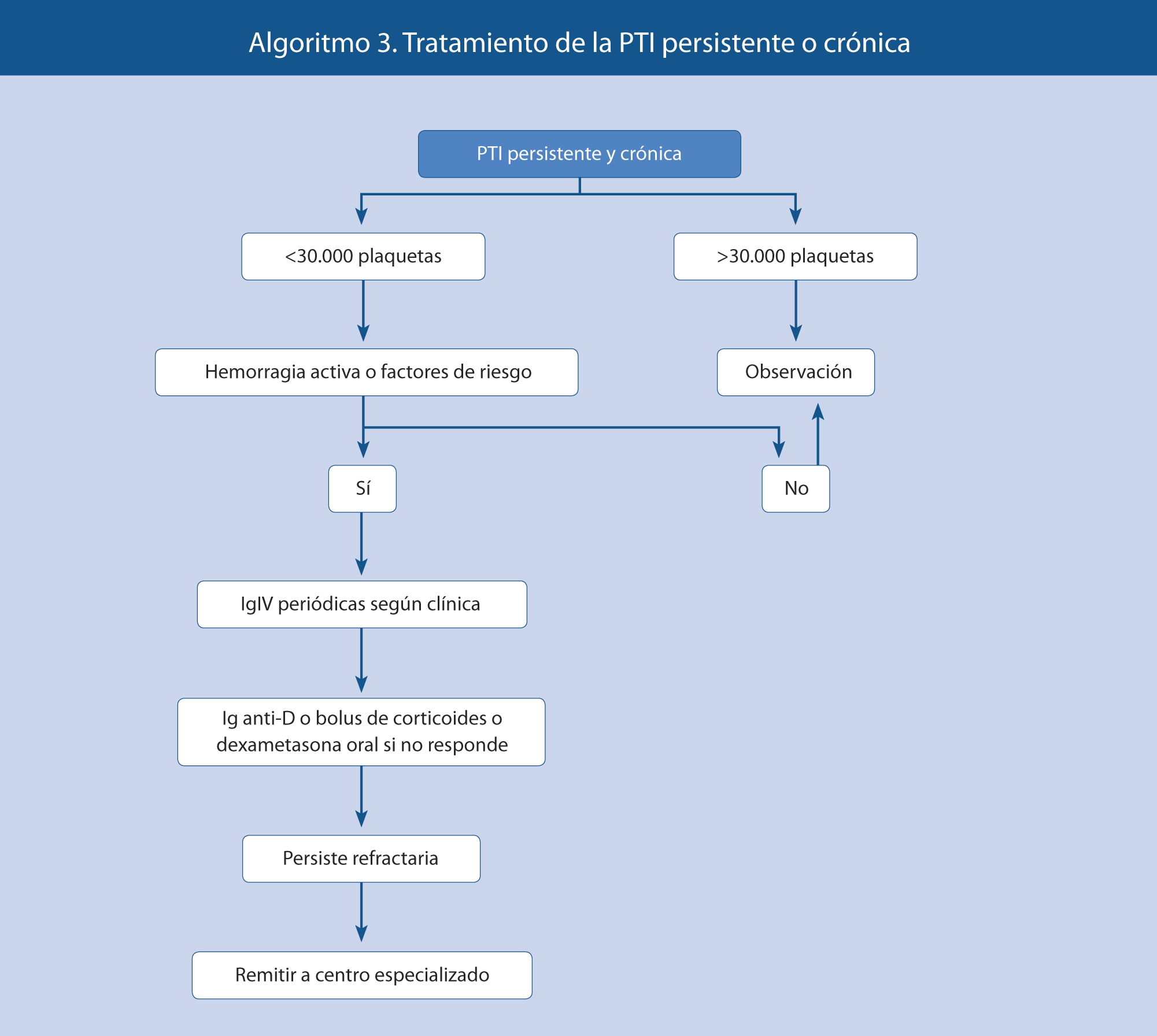
Tratamiento de la PTI persistente y crónica
En el paciente con PTI persistente y crónica hay que valorar también el conjunto de datos clínicos y biológicos, procurando que lleve una vida lo más normal posible y con los mínimos efectos adversos derivados del tratamiento. El mantenimiento de recuentos plaquetarios por encima de 30.000/µl se ha elegido como factor determinante en el análisis de la decisión inicial, considerando esta cifra segura para desarrollar una vida lo más cercana a la normalidad. Hay que tener en cuenta que casi el 60% de los pacientes diagnosticados de PTI crónica, independientemente de sus características personales (edad, sexo, recuento plaquetario…), alcanzan la remisión de la enfermedad incluso sin tratamiento.
En el algoritmo 3, se expone el tratamiento propuesto de la PTI persistente y crónica.
Tratamiento de las urgencias con riesgo vital y de las situaciones con riesgo especial
• En situaciones de riesgo vital con hemorragias del Sistema Nervioso Central (SNC) u otras hemorragias que comprometan la vida del paciente, se recomienda administrar sucesivamente:
1. Metilprednisolona i.v., 10 mg/kg en bolus.
2. Gammaglobulina i.v., 400 mg/kg.
3. Plaquetas, 1 unidad/5-10 kg/6-8 h.
4. Gammaglobulina i.v., 400 mg/kg.
5. Se valorará, según la respuesta, si es necesaria la esplenectomía urgente.
• En TCE,politraumatizados y en cirugía urgente: se recomienda administrar IgIV 0,8-1 g/kg si el recuento es inferior a 50.000/µl, y plaquetas si el recuento es <10.000/µl.
• En casos de cirugía programada, se debe valorar el riesgo hemorrágico según la intervención: se aconseja administrar IgIV 0,8-1 g/kg si las plaquetas son <50.000/µl.
• En la esplecnectomía programada: IgIV 0.8-1 g/kg si el recuento es <20.000/µl y efectuar pinzamiento precoz de la arteria esplénica.
En la tabla IV, se describen las opciones y líneas de tratamiento de la PTI.

Evolución y seguimiento
El seguimiento de los pacientes con PTI debe individualizarse en función de la estabilidad del recuento de plaquetas y de la modalidad terapéutica. Es fundamental la educación del paciente acerca de las manifestaciones clínicas y de los riesgos de la enfermedad.
La evolución de la PTI es variable e impredecible. En la infancia, la PTI es, generalmente, un proceso autolimitado, con una tendencia a la remisión espontánea, incluso a los 2 años de la evolución.
La evolución habitual de la PTI aguda es la remisión espontánea en el 70-80% de los casos en los 6 meses siguientes. No parece que el tratamiento modifique la historia natural de la enfermedad. Evoluciona a una PTI crónica aproximadamente el 20% de los niños que presentan PTI aguda(14). No hay criterios unánimes para pronosticar qué niños evolucionarán con más probabilidad a PTI crónica. Por ello, es necesario observar y controlar a los niños con nuevo diagnóstico de PTI, incluso en casos típicos, realizando recuentos de sangre y frotis hemáticos de forma periódica, y así también poder excluir la posible evolución a enfermedades de la medula ósea o de otros trastornos hematológicos.
Según algunos autores, la edad >10 años y recuentos plaquetarios =20.000/µl en el momento del diagnóstico se ha asociado a mayor riesgo de cronicidad(15). Sin embargo, estos datos no han sido confirmados en otros estudios(14).
No existen en la actualidad indicadores clínicos o de laboratorio que al momento del diagnóstico permitan predecir con certeza cuál será la evolución.
Seguimiento de pacientes con recuento de plaquetas estables que no requieren tratamiento (solo observación):
• Por regla general se realizarán controles del hemograma cada 2 semanas el primer mes y cada mes hasta los 6 meses. Posteriormente, hemograma cada 3-6 meses.
• Educación del paciente y de sus padres para que consulte en caso de:
– Signos de hemorragia.
– Previsión de cirugía o un procedimiento invasor (incluyendo exodoncias).
– Gestación.
• Mantener en observación ante la posibilidad de aparición de otras enfermedades autoinmunitarias.
El seguimiento de pacientes que requieren tratamiento activo:
• Hemograma a demanda.
• Según la modalidad terapéutica se realizarán controles de la potencial toxicidad, tanto inmediata como tardía.
Calidad de vida
La calidad de vida de un paciente debe ser un aspecto importante a tener en cuenta. Se aconseja la aplicación de herramientas específicas para valorar la calidad de vida de los pacientes con PTI.
Los pacientes con PTI están sometidos a restricciones de estilo de vida por el riesgo de hemorragia y las preocupaciones sobre los efectos secundarios del tratamiento. Hay dos herramientas pediátricas de investigación cualitativa que valoran la calidad de vida: The Kids ITP Tools (KIT) y el ITP-quality of life. El KIT se ha desarrollado en Norteamérica y consta de tres cuestionarios: uno para el niño (child self-report), otro para que completen los padres en representación del niño (parent proxy report) y otro para que los padres completen sobre sí mismos (parent impact report)(16). Ayudan a determinar si las investigaciones y el tratamiento invasivo son peores para el paciente que la enfermedad misma. En nuestro medio, se debería incorporar esta metodología, pues es un buen parámetro de eficacia y de la adecuada elección del tratamiento.
Función del pediatra de Atención Primaria
La función del pediatra en Atención Primaria es fundamental para determinar ante un niño con púrpura qué casos constituyen una causa grave que requiera atención hospitalaria inmediata.
Para hacer esta valoración, es importante conocer los mecanismos y las enfermedades frecuentes que producen dichos hallazgos.
El pediatra de Atención Primaria debe hacer una adecuada anamnesis y exploración física completa. Debe evaluar las características de la hemorragia, si es cutánea o mucosa,su gravedad ,extensión y tiempo de evolución. Se deben identificar condiciones concomitantes que aumenten el riesgo hemorrágico.
Salvo cuando la púrpura sea claramente secundaria a mecanismo de Valsalva, se debe derivar al Hospital para realizar los estudios complementarios necesarios para el diagnóstico y tratamiento específico, si fuera necesario.
El seguimiento y control en Atención Primaria del niño diagnosticado de PTI debe basarse en el riesgo de hemorragia mientras exista plaquetopenia.Se informará a los padres y al niño si es mayor para que consulten en caso de signos de hemorragia. Se aconsejará escolarización normal si el recuento plaquetario es estable >20.000/µl. Restringir actividad física y deportes con riesgo traumático (de contacto). Está contraindicado el uso de aspirina. Evitar inyecciones intramusculares. Se debe tener precaución y administar, solo en caso necesario, fármacos que puedan alterar la agregación plaquetaria (antihistamínicos, antiinflamatorios no esteroideos).
Los controles analíticos del recuento plaquetario se realizarán en función de si mantiene recuentos estables y de si recibe o no algún tratamiento, realizando el seguimiento en coordinación con el Servicio de Pediatría Hospitalaria y el Servicio de Hematología.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Scott Nelson JP, Montgomery RR. Enfermedades de las plaquetas y de los vasos sanguíneos. En: Kliegman RM, Behrman RE, Jenson HB, Stanton BF, eds. Tratado de Pediatría Nelson. 18ª ed. Cap. 484. p. 2081-9.
2.*** Amigo Bello MC. Fisiopatología y trastornos de la coagulación. Pediatr Integral. 2008; XII(5): 469-80.
3.*** Toll MT. Trombocitopenia. Trombocitopatías. Trombocitosis. En: Cruz M, eds. Tratado de Pediatría. 9ª edición.Madrid: Ergon; 2006. p. 1528-33.
4.** Espinazo O, Bravo J, García Consuegra, Sastre A. Púrpuras. En: Manual de diagnóstico y terapéutica en Pediatría. 4ª edición. Madrid: Publimed; 2003.
5.* Miller Michael L, Pachman Lauren M. Sindromes vasculíticos. En: Kliegman RM, Behrman RE, Jenson HB, Stanton BF, eds. Tratado de Pediatría Nelson. 18ª ed. Cap. 166. p. 1042-9.
6.*** Menéndez Suso JJ, Lodoso Torrecilla B, Plaza López de Sabando D. Púrpura en urgencias. Decisiones en urgencias pediátricas. Ergon; 2010. p. 606-13.
7.*** Rodeghiero F, Stasi R, Gernsheimer T, Michel M, Provan D, Arnold DM, et al. Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura. Of adults and children: Report from an international working group. Blood. 2009; 113: 2386-93.
8.*** Provan D, Stasi R, Newland AC, Blanchette VS, Bolton-Maggs P, Bussel JB, et al. International consensus report on the investigation and management of primary immune thrombocytopenia. Blood. 2010; 115: 168-86.
9.*** Monteagudo,E, Fernández-Delgado R, Sastre A, Toll T, Llort A, Molina J, Astigarraga I, Dasí MA, Cervera A, en representación del Grupo de Trabajo de la PTI de la Sociedad Española de Hematología y Oncología Pediátricas. Protocolo de estudio y tratamiento de la trombocitopenia inmune primaria (PTI-2010). An Pediatr (Barc). 2011; 74(6): 414.e1-414.e8.
10.*** Stasi R. Immune pathophysiology of primary immune thrombocytopenia Hematology Education: the education program for the Annual Congress of the European Hematology Association. 2011; 5: 173-8.
11.*** Newland A. The diagnosis and management of chronic immune thrombocytopenia in adults. Hematology Education: the education program for the annual congress of the European Hematology Association 2011; 5: 184-90.
12.* Stasi R, Sarpatwari A, Segal JB, Osborn J, Evangelista ML, Cooper N, et al. Effects of eradication of Helicobacter pylori infection in patients with immune thrombocytopenic purpura: a systematic review. Blood. 2009; 113: 1231-40.
13.*** Mitchell WB, Miller AA, Bussel JB. Thrombopoietic agents in immune thrombocytopenia. Hematology Education: the education program for the annual congress of the European Hematology Association. 2011; 5: 179-83.
14.** Calleja Gero ML, Sevilla J, Madero L. ¿Cuál es el pronóstico de trombopenia inmunitaria crónica? An Pediatr (Barc). 2011; 74(5): 317-23.
15.* Watts RG. Idiopathic thrombocytopenic purpura: a 10-year natural history study at the Childrens Hospital of Alabama. Clin Pediatr. 2004; 43: 691-702.
16.* Klaassen RJ, Blanchette VS, Barnard D, Wakefield CD, Curtis C, Bradley CS, et al. Validity, reliability, and responsiveness of a new measure of health-related quality of life in children with immune thrombocytopenic purpura: the Kids’ ITP Tools. J Pediatr. 2007; 150(5): 510-5, 515.e1.
Bibliografía recomendada
– Scott Nelson JP, Montgomery RR. Enfermedades de las plaquetas y de los vasos sanguíneos. En: Kliegman RM, Behrman RE, Jenson HB, Stanton BF, eds. Tratado de Pediatría Nelson. 18ª ed. Cap. 484. p. 2081-9.
En este Tratado de Pediatría, se dedica un capítulo a los trastornos de las plaquetas y de los vasos sanguíneos. Diagnóstico diferencial práctico de los síndromes trombocitopénicos en la infancia.
– Amigo Bello MC. Fisiopatología y trastornos de la coagulación. Pediatr Integral. 2008; XII(5): 469-80.
Revisión detallada y práctica de la fisiopatología y trastornos de la hemostasia.
– Toll MT. Trombocitopenia. Trombocitopatías. Trombocitosis. En: Cruz M, eds. Tratado de Pediatría. 9ª edición.Madrid: Ergon; 2006. p. 1528-33.
Descripción de las alteraciones plaquetarias en la edad pediátrica, su diagnóstico y tratamiento.
– Menéndez Suso JJ, Lodoso Torrecilla B, Plaza López de Sabando D. Púrpura en urgencias. Decisiones en urgencias pediátricas. Ergon; 2010. p. 606-13.
Libro práctico y funcional centrado en patologías urgentes que ayuda a realizar el diagnóstico fisiopatológico y/o etiológico, aplicar la terapéutica más recomendable y las actitudes recomendadas a seguir con los pacientes. Se describe de forma detallada y práctica “Púrpura en urgencias”.
– Rodeghiero F, Stasi R, Gernsheimer T, Michel M, Provan D, Arnold DM, et al. Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura. Of adults and children: Report from an international working group. Blood. 2009; 113: 2386-93.
Publicación donde se establece el Consenso Internacional de estandarización de la terminología, definiciones y criterios de respuesta de la PTI para adultos y niños.
– Provan D, Stasi R, Newland AC, Blanchette VS, Bolton-Maggs P, Bussel JB, et al. International consensus report on the investigation and management of primary immune thrombocytopenia. Blood. 2010; 115: 168-86.
Publicación donde se establecen las directrices del Consenso Internacional en el diagnóstico y manejo de la Trombopenia Inmune Primaria teniendo en cuenta los nuevos conocimientos sobre su fisiopatología y los nuevos avances terapéuticos.
– Monteagudo,E, Fernández-Delgado R, Sastre A, Toll T, Llort A, Molina J, Astigarraga I, Dasí MA, Cervera A, en representación del Grupo de Trabajo de la PTI de la Sociedad Española de Hematología y Oncología Pediátricas. Protocolo de estudio y tratamiento de la trombocitopenia inmune primaria (PTI-2010). An Pediatr (Barc). 2011; 74(6): 414.e1-414.e8.
Documento de referencia del Grupo de Trabajo de la PTI de la Sociedad Española de Hematología y Oncología Pediátricas sobre las recomendaciones protocolizadas actuales para el diagnóstico y tratamiento de la enfermedad. Se explica el protocolo de tratamiento de forma clara y detallada.
– Stasi R. Immune pathophysiology of primary immune thrombocytopenia Hematology Education: the education program for the Annual Congress of the European Hematology Association. 2011; 5: 173-8.
Trabajo de revisión muy completo sobre los conocimientos actuales de la fisiopatología de la PTI.
– Newland A. The diagnosis and management of chronic immune thrombocytopenia in adults. Hematology Education: the education program for the annual congress of the European Hematology Association 2011; 5: 184-90.
Documento actualizado sobre el diagnóstico y manejo de la trombocitopenia inmune crónica publicado en el Congreso Anual de la Asociación Europea de Hematología.
– Mitchell WB, Miller AA, Bussel JB. Thrombopoietic agents in immune thrombocytopenia. Hematology Education: the education program for the annual congress of the European Hematology Association. 2011; 5: 179-83.
Revisión actualizada de los nuevos agentes trombopoyéticos, su biología, perfil clínico, toxicidad y potencial uso en el futuro.
| Caso clínico |
|
Niño de 5 años de edad que es llevado a la consulta por sus padres porque, desde hace 24 h, presenta exantema petequial que ha ido aumentando en número y tamaño. No ha presentado fiebre, vómitos, diarrea, pérdida de peso ni dolores articulares. Hace una semana, ha presentado un proceso febril diagnosticado de viriasis que no precisó tratamiento. Antecedentes personales y familiares Segundo hijo de un matrimonio sano que no tiene antecedentes de consanguinidad. Embarazo, parto y periodo neonatal normales. Crecimiento y desarrollo normal. Calendario vacunal completo. No hay antecedentes personales patológicos ni familiares de interés. Exploración física Presenta aceptable estado general, coloración normal de piel y mucosas, exantema petequial de distribución generalizada y alguna petequia en mucosa bucal. No signos de hemorragia en otra localización. No se palpan adenias cervicales, axilares ni inguinales. Auscultación cardiopulmonar normal. Abdomen normal, no se palpan masas ni visceromegalias. Genitales normales. Faringe normal. Otoscopia normal. Exploración articular y neurológica normal. Peso y talla en percentil 50-75. Temperatura 37,1°C axilar. Tensión arterial 10/6. Se deriva al Hospital para estudio. Exámenes complementarios Analítica realizada en Hospital: hematíes 4,1×1012/L, hemoglobina: 13,2 g/dl, hematocrito: 38,1%, VCM: 98 fl, leucocitos: 5,2×109/L. Fórmula leucocitaria: linfocitos 52%, neutrófilos: 38%, monocitos: 8%, eosinófilos: 2%. Plaquetas: 10.000/µl. Frotis de sangre periférica: plaquetas escasas, alguna de tamaño grande. En el estudio, no se aprecian fórmulas inmaduras. Test de Coombs directo negativo. Pruebas de coagulación normal, tiempo de hemorragia normal. Bioquímica: glucosa, urea y creatinina normales; SGOT: 28 UI/L, SGPT: 46 UI/L, GGT: 50 UI/L, LDH: 254 UI/L. Inmunoglobulinas: normales. Estudio inmunológico de la población linfocitaria: normal. Analítica de orina: normal. Serología vírica: negativa (hepatitis A, B, C, Epstein-Barr, citomegalovirus, parvovirus B19). Anticuerpos antitransglutaminasa tisular IgA: negativos. Hormonas tiroideas: normales. Anticuerpos antitiroglobulina y anti TPO (anti-tiroperoxidasa): negativos. En el aspirado medular, presenta una médula hipercelular con hiperplasia de la serie megacariocítica y con normalidad de las otras series. Evolución Con los resultados analíticos obtenidos y la exploración clínica realizada, se hace el diagnóstico de púrpura trombocitopénica inmune con sangrado cutáneo mucoso. Se decide tratamiento con prednisona i.v. durante 7 días a dosis de 4 mg/kg/día durante 4 días y 2 mg/kg/día durante 3 días. A las 72 horas, no hay nuevas lesiones cutáneo mucosas y el recuento plaquetario es de 50.000/µl. A los 15 días, el número de plaquetas es de 160.000/µl. A los 4 meses del diagnóstico, persiste el recuento plaquetario normal. |