Enseñanza no reglada y sin carácter oficial. Los créditos de formación continuada, no son aplicables
a los profesionales que estén formándose como especialistas en Ciencias de la Salud.

 |
Durante el XXIX Congreso de la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP), celebrado en Zaragoza del 21 al 24 de octubre de 2015, se entregaron tres premios de “El Rincón del Residente” de la Revista Pediatría Integral, seleccionados por el Comité Editorial a los dos mejores Casos clínicos, así como a la mejor Imagen clínica publicados durante todo el curso, desde octubre de 2014 hasta septiembre de 2015. Pueden verse todos los casos e imágenes en www.pediatriaintegral.es.
1er Caso clínico: Niña con dolor musculoesquelético, sin antecedente traumático
Autores: S. Fernández Luis, N. Álvarez, J. Bote Mohedano, M.C. Mendoza Sánchez.
Complejo Asistencial Universitario de Salamanca.
2º Caso clínico: Niño de 6 años con conducta alimentaria anómala
Autores: A. Méndez Sánchez*, A. Pascual Pérez*, V. Martínez Suárez** / *Hospital Universitario Central de Asturias (HUCA). ** Centro de Salud El Llano, Gijón.
Imagen clínica: Infecciones respiratorias de repetición y masa mediastínica
Autores: E. Urbaneja Rodríguez, H. González García, F.J. Álvarez. Hospital Clínico de Valladolid.
“El Rincón del Residente” está coordinado por los nuevos residentes que han comenzado en 2015: Estefania Ballesteros Moya, Ferrán Campillo i López, Ester Pérez Costa y Diego Rodriguez Álvarez (residentes del Hospital Universitario Infantil La Paz de Madrid), a los cuales deseo expresar mi agradecimiento por su trabajo e interés, y está supervisado por el Comité editorial de Pediatría Integral. Estos premios se han establecido para incentivar la participación de los residentes en la revista. Desde aquí, quiero animar a los residentes de las diferentes áreas geográficas de nuestro país, para que participen enviando sus casos e imágenes, lo cual contribuirá a compartir la experiencia, aumentar los conocimientos y mejorar el curriculum.
Mª Inés Hidalgo Vicario
Directora Ejecutiva de Pediatría Integral
La Junta Directiva de la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria realizó la entrega de los premios el Sábado, 24 de Octubre durante el Cóctel de Clausura.
Los premios fueron:
PREMIO DR. GONZÁLEZ-MENESES A LA MEJOR COMUNICACIÓN AL XXIX CONGRESO DE LA SEPEAP
“Premio Dr. González-Meneses” a la mejor comunicación presentada por un Médico Interno Residente de pediatría.
Dotado con 1000€ .
PREMIOS NESTLÉ A LAS 10 MEJORES COMUNICACIONES ORALES
Patrocinados por: NESTLÉ ESPAÑA, S.A. a las mejores comunicaciones orales presentadas durante el Congreso.
Primer Premio de 1500€ y nueve premios de 750€.
PREMIO COLEGIO DE MÉDICOS DE ZARAGOZA A LA MEJOR COMUNICACIÓN AL XXIX CONGRESO DE LA SEPEAP
El Premio Colegio de Médicos de Zaragoza a la mejor comunicación dotado con 2500€.
PREMIO MEJOR PÓSTER
Patrocinados por: ORDESA. Los asistentes al Congreso otorgaron mediante sus votos un primer premio de 500€ y dos accésits de 250€.
PREMIOS FORMACIÓN CONTINUADA PEDIATRÍA INTEGRAL
Para celebrar el 20 aniversario de la revista PEDIATRÍA INTEGRAL, y con el objetivo de estimular y reconocer la importancia de la formación continuada entre los pediatras de Atención Primaria, se convocaron cuatro premios de 500€ cada uno, patrocinados por SOLAN DE CABRAS.
BECAS M.I.R. PARA ASISTENCIA AL XXIX CONGRESO DE LA SEPEAP: La SEPEAP ha otorgado 100 becas a pediatras en formación para su asistencia al Congreso.
 |
| Representación del niño
en la pintura española |
J. Fleta Zaragozano
Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria
Facultad de Ciencias de la Salud. Universidad de Zaragoza
Pediatr Integral 2015; XIX (8): 574.e1-574.e3
Este pintor asturiano fue uno de los retratistas más afamados en la Corte de Felipe V y punto de origen de una saga familiar dedicada a la pintura, donde también destacaron su hermano menor Francisco Antonio como miniaturista y su sobrino Luís como pintor de bodegones. En los últimos años de su vida, Meléndez se especializó en retratos de nobles españoles (fundamentalmente los dos espléndidos retratos del marqués de Vadillo) y en diferentes ejemplos de pintura religiosa encargados por diversas congregaciones.
Vida y obra
Miguel Jacinto Meléndez Díaz nació en Oviedo en 1697, siendo hijo del “muestrense” Vicente Meléndez de Ribera y de Francisca Díaz de Luxío. Siendo niño, su familia emigró a Madrid donde Miguel Jacinto aprendió el arte de la pintura, posiblemente de la mano del pintor José García Hidalgo y en la Academia del Conde de Buena Vista del modo tradicional: copiando estampas y dibujos, luego al natural y, finalmente, copiando cuadros de grandes maestros del siglo XVII.
Durante este período de aprendizaje en la Corte, su hermano, el también conocido pintor Francisco Antonio Meléndez marchará a Italia a aprender, permaneciendo allí hasta su regreso en 1717, momento en el que conseguirá la plaza de Pintor Real de Miniaturas en 1725. La descendencia de éste, con el reputado bodegonista Luis Meléndez a la cabeza, constituirán una dinastía de pintores que se adentrará hasta finales del siglo XVIII.
En 1704 se casa con María del Río; Meléndez termina su etapa de formación y se gana la vida como pintor en la Corte, fundamentalmente realizando retratos de Felipe V y María Luisa de Saboya (hay localizados más de 22 retratos) en un período en el que la Guerra de Sucesión paraliza cualquier actividad artística cortesana. En este contexto, se le nombrará Pintor Honorario del Rey sin sueldo el 31 de junio de 1712. Meléndez solo conseguirá los 720 maravedíes anuales de gajes que conllevaba el cargo en febrero de 1727.
Al finalizar la Guerra de Sucesión, la vida de Miguel Jacinto Meléndez sufre importantes modificaciones. Así, en octubre de 1715, su mujer, María del Río, muere de postparto cinco días después de dar a luz a Julián Joaquín. Un año más tarde, en 1716, se vuelve a casar con Alejandra García de Ocampo de la que tuvo dos hijas, Josefa María y María Vicenta, esta última muerta siendo niña.
Su labor pictórica continuará centrada en el retrato de personas de la realeza. En este campo, la llegada al poder de Luis I implicará un repunte en la actividad de Meléndez, ya que se deberán realizar toda una serie de retratos oficiales al nuevo soberano para colocar en las principales instituciones del reino y afianzar su majestuosa imagen, como se había realizado anteriormente con Felipe V. En esta labor propagandística, Miguel Jacinto Meléndez retratará a lo largo de 1724, en numerosas ocasiones, al nuevo monarca. La abdicación de Felipe V en favor de Luis I provocó la necesidad imperiosa de que se divulgase su figura. Así, encontramos hasta cuatro retratos del nuevo rey, prácticamente idénticos, realizados por Meléndez para diversas instituciones que nos indicarán, de nuevo, su papel fundamental como propagandista político.
Como se ha referido anteriormente, en febrero de 1727 se le reconocerán los gajes como pintor del rey y será en este momento cuando realice la serie de retratos de la familia de Felipe V para la Real Librería y que son, sin duda, el conjunto de cuadros más importantes de Meléndez. Por otra parte, esta será la única serie de retratos que realizará por un encargo directo del rey y con destino al disfrute del propio monarca.
La carrera de Meléndez declinó al no acompañar a la Corte en su traslado a Sevilla, donde estuvo desde 1729 a 1733 y al ser monopolizados los encargos de retratos regios por Jean Ranc y su taller. Con una clientela importante, aunque con el favor real “secuestrado” por Ranc, Miguel Jacinto Meléndez morirá en Madrid en 1734, dejando a su viuda e hijos una desahogada posición económica y, sobre todo, lo que no era tan habitual en la época, ninguna deuda.
La infancia en sus retratos
El maestro pintaba los cuadros, generalmente retratos de corte, por encargo, indispensables para la actividad diplomática de los reinos europeos de aquel entonces. Lo habitual era encargar un retrato oficial al pintor de cámara y, si era aprobado, se realizaban copias en pequeño formato con destino a los principales palacios reales del continente, instituciones oficiales y casas nobiliarias amigas. También era una forma de dar a conocer a los hijos e hijas de los reyes, a la par que se oficializaba su disposición para su matrimonio y la posibilidad de su concierto.
Luis I, Príncipe de España. Se trata del retrato de cuerpo entero de Luis I, representado a la edad de cinco años, con el cetro, el collar de la orden del Toisón y la corona, atributos reales, que lo identifican como Príncipe de Asturias y por tanto heredero al trono. Viste un traje de brocado azul, rojo y oro con bocamangas de encaje y lleva un tocado de terciopelo rojo, con tul y plumas. Data de 1712 y es un óleo sobre lienzo de 103 por 83 cm que pertenece al Museo Cerralbo de Madrid (Fig. 1).

Figura 1. Luís I, Príncipe de España.
El Retrato de Mariana Victoria de España representa a esta infanta de cuerpo entero y sentada sobre un cojín. Mira hacia el artista, lleva vestido blanco con suaves encajes y un escote ciertamente acentuado. Lleva la banda de color azul propia de la realeza. Su mano derecha, apoyada en el regazo, está en contacto con un ramo de flores y su mano izquierda, levantada, lleva una rosa. Un gorro de tela rodea la cabeza de la niña. El fondo es oscuro. Se trata de un óleo sobre lienzo que data de 1720 (Fig. 2).

Figura 2. Retrato de Mariana Victoria de España.
Otro retrato pertenece a Felipe, Duque de Parma. Es un retrato de cabeza y busto de un niño de cuatro años de edad. Está mirando al espectador y muestra una muy leve sonrisa. Ataviado con traje noble y banda regia de color azul oscuro. Al cuello lleva un lazo del mismo color. El niño sostiene con sus manos un libro abierto. Las características fisionómicas de la cara están bien definidas y tiene pelo abundante. Hay un fondo de tonalidades oscuras. Data de 1727 y es un óleo sobre lienzo circular de 53 cm. Pertenece a Biblioteca Nacional en Madrid (Fig. 3).

Figura 3. Felipe, Duque de Parma.
El Príncipe Fernando, futuro Fernando VI. El retrato representa a Fernando (1713-1759), hijo de Felipe V y de su primera esposa María Luisa Gabriela de Saboya, como Príncipe de Asturias, con la corona real y vistiendo media coraza como su padre; luce al pecho el collar del Toisón de Oro. Meléndez utilizó un prototipo anterior a 1727, pues la cara aniñada del Príncipe no corresponde a los catorce años que tendría entonces. Data también de 1727 y es un óleo sobre lienzo circular de 53 cm y pertenece a la Biblioteca Nacional en Madrid (Fig. 4).

Figura 4. El Príncipe Fernando, futuro Fernando VI.
En esta misma época pinta el retrato de Carlos III niño. Se trata de otra obra de parecidas características y factura. Otra vez representa a otro niño de la realeza. Llama la atención su casaca de color rojo oscuro con ricos bordados y una gran insignia. Lleva un pañuelo al cuello de color blanco y una larga melena. Mira al espectador. Se trata de un óleo sobre lienzo circular de 53 cm de diámetro (Fig. 5).

Figura 5. Carlos III niño.
Poco después el artista pinta el cuadro Princesa María Ana Victoria de Borbón, en la línea estilística de los cuadros anteriores. Se trata de la Hija de Felipe V e Isabel de Farnesio. La niña está sentada en un trono y lleva en su regazo, como es muy habitual en los cuadros de Meléndez, unas flores. En su mano derecha, levantada, lleva una flor. También se observa otra flor en el escote del vestido y otra en la cabeza. Lleva un collar ajustado a su cuello. La niña mira al artista. Es importante destacar la presencia de una corona real en la parte inferior derecha del cuadro. Se trata de un óleo sobre lienzo de 76 por 62 cm y pertenece a la colección de los duques de Fernán Núñez (Fig. 6).
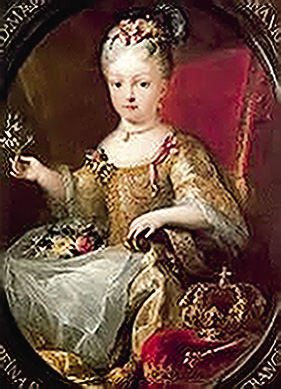
Figura 6. Princesa María Ana Victoria de Borbón.
Bibliografía
- Santiago EM. El pintor Miguel Jacinto Meléndez. A propósito de unos retratos de la Biblioteca Nacional. Revista de Archivos, Bibliotecas y Museos. Madrid, 1966.
- VV.AA. Miguel Jacinto Meléndez. Pintor de Felipe V. Museo de Bellas Artes de Asturias. Oviedo, 1989.
- Santiago EM. Miguel Jacinto Meléndez (1679-1734). Museo Municipal de Madrid. Madrid, 1990.
- Camón J. La pintura española del siglo XVII. Summa Artis. Historia General del Arte. Vol. XXV. Espasa-Calpe. Madrid, 1977.
- Bottineau Y. El arte cortesano en la España de Felipe V (1700-1746). Fundación Universitaria Española. Madrid, 1986.
- Morán JM. El arte en la corte de Felipe V. El Viso. Madrid, 2002.
 |
A. Molina García, C. García Mauriño
Residentes hospital infantil universitario La Paz
4. Role play: Rounding the floor. Resident presenting patient with anaphylaxis to the attending physician
Resident: Wyatt is a three-year-old boy who was admitted to the floor yesterday. He presented to the emergency room (ER) with puffy eyes and increased work of breathing. His mother said he is not allergic to anything that she knows of. Apparently, they were having lunch when she noticed the swelling of the eyes and she brought him directly to the hospital. At the ER they noticed Wyatt had increased work of breathing, and was tachypneic and starting to present some hives. He was monitored and was found to be tachycardic, although he maintained blood pressure within normal ranges, as well as his oxygen saturation. They placed an iv peripheral line and administered a 20 ml/kg bolus of normal saline. He then received a 2 mg/kg dose of iv steroids and a single dose of im adrenaline. The symptoms subsided slowly and he was asymptomatic after a couple of hours. He was then admitted to the floor.
Since admission, he has been stable, with constants within normal limits. He has been asymptomatic and the physical examination today was unremarkable. Labwise, today we asked for CBC´s and LFT, both of which were within normal values.
Wyatt has all his vaccines up to date. He has no known allergies, although his mother remembers that one time when taking amoxicillin for an episode of acute otitis media, he presented some hives. He has taken Amoxicillin after that and he has had no symptoms since then. When he was two, he was admitted for fever and was finally diagnosed of pneumonia. He was treated with antibiotics and the process was resolved without any complications. No other hospital admissions. No surgeries.
Regarding family history, both parents are healthy. He has one sibling who is two years older than him and is also healthy, never been admitted. They live altogether and they have a dog.
Attending: Ok, very good. What about the treatment, what is he currently on?
Resident: He is on steroids, 1 mg/kg Q12.
Attending: And what about the line? Is he still on IV fluids? What about his oral intake?
Resident: apparently, he is refusing to eat, but I spoke to his mother this morning and encouraged her to insist and it seems the kid is doing better.
Attending: And what do you think triggered these symptoms?
Resident: well I asked if Wyatt had anything new during lunch, but apparently, he was eating pasta, and he had eaten pasta many times before, so I’m not really sure.
Attending: What about your assessment and plan?
Resident: Well, Wyatt is a three year old who had an anaphylactic reaction, although we are not sure to what. My plan is to discharge him once his oral intake is adequate and the line can be removed. I think we should send him home on oral steroids and give him an appointment for the allergy outpatient consult, where they can look into what caused the allergic reaction and run the necessary tests.
Attending: Very well, I agree. Touch base with the allergy service to make the appointment. I would also like to follow her up, so please give him an appointment with us in a couple of days.
KEY WORDS:
Rounding the floor: pasar planta de hospitalización.
Attending physician: médico adjunto.
Admitted to the floor: ingresado en la planta.
Emergency room: sala de urgencias.
Puffy eyes: ojos hinchados.
Increased work of breathing: aumento del trabajo respiratorio.
Hives: urticaria.
IV peripheral line: vía venosa periférica.
bolus of normal saline: expansión con suero salino fisiológico.
Subsided (to subside): disminuir.
Unremarkable: sin hallazgos significativos.
Labwise: en relación con los resultados de laboratorio.
CBC´s (complete cell blood count): hemograma.
LFT (liver function tests): estudio bioquímico de función hepática.
Acute otitis media: otitis media aguda.
Hospital admissions: ingresos hospitalarios.
Family history: antecedentes familiares.
Q12: cada 12 horas.
IV fluids: fluidoterapia intravenosa.
Oral intake: ingesta oral.
Triggered (to trigger): desencadenar.
Discharge: dar de alta.
Outpatient consult: consultas externas.
Touch base: ponerse en contacto.
| 10 Cosas que deberías saber sobre…el colecho |
F. Campillo i López, E. Pérez Costa, D. Rodríguez Álvarez, E. Ballesteros Moya
 El colecho no es una práctica moderna. Ha sido y es, en muchas sociedades, el método tradicional para el descanso de madre y bebé.
El colecho no es una práctica moderna. Ha sido y es, en muchas sociedades, el método tradicional para el descanso de madre y bebé.
 El colecho favorece la práctica y continuidad de la lactancia materna, que al mismo tiempo ha demostrado disminuir el riesgo de síndrome de la muerte súbita del lactante (SMSL).
El colecho favorece la práctica y continuidad de la lactancia materna, que al mismo tiempo ha demostrado disminuir el riesgo de síndrome de la muerte súbita del lactante (SMSL).
 Durante la noche los lactantes no solo duermen, también se alimentan y se consuelan. Esto beneficia su desarrollo neurológico y ayuda al mantenimiento de niveles óptimos de prolactina nocturna materna para la segunda etapa de la lactogénesis.
Durante la noche los lactantes no solo duermen, también se alimentan y se consuelan. Esto beneficia su desarrollo neurológico y ayuda al mantenimiento de niveles óptimos de prolactina nocturna materna para la segunda etapa de la lactogénesis.
 El bebé que duerme junto a su madre aprende los ritmos maternos y, en consecuencia, su forma de dormir se asemeja más a la de un adulto, facilitando la autorregulación mutua.
El bebé que duerme junto a su madre aprende los ritmos maternos y, en consecuencia, su forma de dormir se asemeja más a la de un adulto, facilitando la autorregulación mutua.
 Las cunas tipo sidecar no asocian una mejor adherencia a la lactancia materna con respecto a la cuna al lado de la cama de los padres.
Las cunas tipo sidecar no asocian una mejor adherencia a la lactancia materna con respecto a la cuna al lado de la cama de los padres.
 El colecho ha demostrado aumentar por sí mismo el riesgo de muerte súbita del lactante (SMSL), si bien, el 40% de las muertes por SMSL ocurren en la cuna.
El colecho ha demostrado aumentar por sí mismo el riesgo de muerte súbita del lactante (SMSL), si bien, el 40% de las muertes por SMSL ocurren en la cuna.
 El riesgo de SMSL aumenta si, además de colecho, los padres son consumidores de alcohol, tabaco u otras drogas, y los bebés reciben lactancia artificial.
El riesgo de SMSL aumenta si, además de colecho, los padres son consumidores de alcohol, tabaco u otras drogas, y los bebés reciben lactancia artificial.
 También aumenta el riesgo de muerte por asfixia, especialmente,en superficies blandas o estrechas, como sofás, o cuando son varios los que duermen en la cama familiar.
También aumenta el riesgo de muerte por asfixia, especialmente,en superficies blandas o estrechas, como sofás, o cuando son varios los que duermen en la cama familiar.
 El documento de consenso del Comité de Lactancia Materna y el Grupo de Trabajo para el Estudio de la Muerte Súbita Infantil de la AEP recomienda que la forma más segura de dormir para los lactantes menores de seis meses es en su cuna, boca arriba y cerca de la cama de sus padres. Esta práctica disminuye el riesgo de SMSL en más del 50%.
El documento de consenso del Comité de Lactancia Materna y el Grupo de Trabajo para el Estudio de la Muerte Súbita Infantil de la AEP recomienda que la forma más segura de dormir para los lactantes menores de seis meses es en su cuna, boca arriba y cerca de la cama de sus padres. Esta práctica disminuye el riesgo de SMSL en más del 50%.
 No se recomienda el colecho en las siguientes condiciones: lactantes menores de tres meses de edad; prematuridad y bajo peso al nacimiento; padres que consuman tabaco, alcohol, drogas o fármacos sedantes; situaciones de cansancio, especialmente de cansancio extremo, como el postparto inmediato; colecho sobre superficies blandas, colchones de agua, sofá o sillones; y en el caso de compartir la cama con otros familiares, con otros niños o con múltiples personas.
No se recomienda el colecho en las siguientes condiciones: lactantes menores de tres meses de edad; prematuridad y bajo peso al nacimiento; padres que consuman tabaco, alcohol, drogas o fármacos sedantes; situaciones de cansancio, especialmente de cansancio extremo, como el postparto inmediato; colecho sobre superficies blandas, colchones de agua, sofá o sillones; y en el caso de compartir la cama con otros familiares, con otros niños o con múltiples personas.
Para saber aún más…
1. Comité de Lactancia Materna de la AEP y Grupo de Trabajo para el Estudio de la Muerte Súbita Infantil de la AEP. Colecho, síndrome de muerte súbita del lactante y Lactancia Materna. Recomendaciones actuales de consenso. 2014.
2. Landa Rivera L., Díaz-Gómez M., Gómez Papi A., Paricio Talayero J. M., Pallás Alonso C., Hernández Aguilar M. T. et al. El colecho favorece la práctica de la lactancia materna y no aumenta el riesgo de muerte súbita del lactante: dormir con los padres. Rev Pediatr Aten Primaria. 2012; 14(53): 53-60.
3. Ortega Páez E, Molina Arias M. ¿Aumenta el colecho el riesgo de muerte súbita del lactante? Evid Pediatr. 2013; 9: 64.
4. Blair PS, Heron J, Fleming PJ. Relationship between Bed Sharing and Breastfeeding: Longitudinal Population-Based Analysis. Pediatrics. 2010; 126: e1119-26.
5. Ball HL, Ward-Platt MP, Howel D, Russell C. Randomised trial of sidecar crib use on breastfeeding duration (NECOT). Arch Dis Child. 2011; 96: 630-4.
| Regreso a las bases |
L. Fiz Pérez1,2, I. Pulido Valdeolivas3, D. Gómez-Andrés3,4
1Servicio de Urgencias. Médico Asistencial en Neuropediatría. Hospital Universitario La Paz. 2Servicio de Pediatría. Hospital General de Villalba. Collado Villalba. 3Trastornos del Desarrollo y Maduración Neurológica. Departamento de Anatomía, Histología y Neurociencia. IdiPaz-UAM. 4Servicio de Pediatría. Hospital Universitario Infanta Sofía. San Sebastián de los Reyes. Madrid
Pediatr Integral 2015; XIX (8): 572.e1-572.e7
Introducción
En este “Regreso a las Bases”, vamos a repasar la exploración neurológica del niño, reservando para el siguiente número la evaluación del neurodesarrollo. La exploración neurológica, aunque sea somera, es un elemento esencial de cualquier exploración pediátrica, ya que proporciona información sobre el funcionamiento de otros órganos y sistemas. A la vez, la exploración neurológica requiere una exploración general adecuada, ya que en muchos casos, aspectos esenciales para el diagnóstico neurológico están escondidos en otros órganos. Especialmente importantes son: la evaluación antropométrica (incluyendo una correcta medición del perímetro cefálico o circunferencia occipitofrontal, que se mide con una cinta flexible no expansible alrededor del perímetro que pasa por el occipucio y los arcos supraciliares y cuya medición debe repetirse, al menos, 2 veces antes de considerarse patológica), observación de lesiones cutáneas (Tabla I), la evaluación dismorfológica (Tabla II) y la detección de organomegalias (muy importante en enfermedades de depósito).
La exploración neurológica depende de la sistematización de la misma. Es importante seguir siempre el mismo esquema y mantenerlo con adaptaciones para poder ser rápido, preciso y sacar conclusiones sobre la evaluación. En este artículo, proponemos una sistematización que incluye a nuestro parecer, las maniobras más importantes para realizar una exploración neurológica en el ámbito de la Pediatría General.
Evaluación de la cognición
El primer paso de la evaluación neurológica implica evaluar el nivel de conciencia y el grado de la orientación del paciente (si es posible, en tiempo, espacio y persona). Después, es importante determinar el grado de atención y de concentración del paciente, que generalmente se determina con grado de colaboración. Estas funciones cognitivas deben registrarse siempre, porque influyen en la realización de cualquier test neurológico y su alteración condiciona el resto de la exploración. También es fácil incluir una evaluación general de la memoria retrógrada y de las capacidades comunicativas a la vez que se realiza el resto de la exploración. La memoria retrógrada se evalúa preguntando al paciente por su edad, la fecha de su cumpleaños y el nombre de sus familiares, amigos o profesores. Para evaluar la comunicación, nos debemos fijar en la expresión verbal del paciente (si el lenguaje es espontáneo y fluido –fluencia–, si es capaz de repetir sonidos o frases –repetición– o si es capaz de nombrar objetos –nominación–), en la compresión verbal (entiende secuencias de órdenes; por ejemplo, para optimizar el tiempo y explorar a la vez la habilidad motriz y praxias motoras, se puede pedir al paciente que se desvista por sí solo de forma incompleta o en un orden concreto) y la expresión no verbal (uso de gestos para sustituir o acompañar al lenguaje). Por último, es esencial intentar estimar el nivel de inteligencia del paciente y reflejarlo de forma sutil, pero clara en el registro de la exploración.
Si se dispone de tiempo o mientras se realiza la historia clínica, como parte de la exploración cognitiva y de las habilidades manuales del paciente, es recomendable pedirle que dibuje. Si es un niño menor de 5 años, normalmente en la práctica clínica habitual, se utiliza el dibujo libre. En el caso de niños mayores de 5 años, se pueden utilizar varias pruebas, pero quizá la más interesante por ser muy sencilla de aplicar y rápida puntuar, es el test grafomotor de Pascual(4,5).
Si se precisa o si se está evaluando a un paciente por un problema cognitivo, la evaluación de las funciones cognitivas debe ampliarse y, ya en una consulta especializada, exploramos habitualmente:
• Habilidad lectora: se puede recoger una impresión evaluando la lectura en voz alta y la comprensión de un texto sencillo. Se debe evaluar siempre en un fracaso escolar y puede encaminar evaluaciones neuropsicológicas más complejas.
• Habilidad en el cálculo: su evaluación depende de la edad; así a los 2-3 años, un niño debe entender la diferencia entre 1 y 2; a los 3-4 años, emerge el concepto de cantidad (distingue grupos donde hay más o menos número de una cosa); a los 5-6 años, debe saber contar hasta 20-30; a los 6-7 años, debe sumar de memoria; y a los 7-8 años, conocer bien las tablas de multiplicar.
• Alteraciones en la memoria anterógrada: capacidad de recordar tres palabras tras 3-5 minutos.
• Alteraciones en el lóbulo frontal: muy importantes en adolescentes y cuyo examen requiere de cierto tiempo y es relativamente complejo, en especial en su interpretación, porque depende del nivel intelectual y de la motivación del paciente. Una manera sencilla es interrogar al paciente sobre los motivos por los que le gusta algo o que explique qué significa algún dicho.
• Existencia de dispraxias: su evaluación también es relativamente compleja, depende del nivel cognitivo del paciente y escapa a una exploración básica. Si existen dudas, se puede evaluar una apraxia constructiva mediante el dibujo libre de un reloj o la apraxia ideomotora mediante la imitación de la secuencia motora del lavado de dientes.
Evaluación del sistema motor
La evaluación del sistema motor incluye la evaluación de la fuerza, tono y apariencia muscular (“trofismo”), la evaluación de los reflejos osteotendinosos y cutáneos, la valoración de la marcha, la postura y la manipulación, la presencia de movimientos anormales y el examen del control selectivo y los test cerebelosos motores.
La evaluación de la fuerza varía en función de la edad del paciente. En niños no colaboradores, la medición de la fuerza debe realizarse oponiendo resistencia a movimientos propositivos que pueden obtenerse jugando con el niño. En niños colaboradores menores de unos 4 años, debe colocarse al paciente en la posición deseada y jugar con él, indicándole que debe evitar que le muevas realizando una fuerza contraria a la función del grupo muscular que se quiere medir. En niños mayores de unos 4 años, se puede realizar una evaluación más selectiva por grupos musculares, explicando el movimiento a realizar e imponiendo una resistencia. La fuerza muscular habitualmente se mide con la escala MRC, Medical Research Council (Tabla III).
En los casos de debilidad muscular mínima, pueden ser más sensibles una serie de pruebas específicas para detectar debilidad como:
• La maniobra de Barré: se pide al paciente que mantenga los miembros superiores extendidos y en supinación durante más de 20 segundos; en las paresias leves, se observa una tendencia progresiva a la pronación.
• La maniobra de Gowers: se pide al paciente que se levante del suelo sin ayudarse de sus manos; es conveniente recordar que la necesidad de pasar de supino a prono para levantarse es en realidad, la parte más sensible de la prueba para detectar debilidad proximal en miembros inferiores.
• Las evaluaciones de marcha y manipulación.
En algunos casos seleccionados, es recomendable explorar la fatigabilidad. La fatigabilidad se explora selectivamente en varios grupos musculares: en miembros superiores, se explora la asimetría en la fuerza para la abducción del hombro, tras elevar repetidamente un objeto pesado por encima de su cabeza en único lado; en miembros inferiores, se explora repitiendo la maniobra de Gowers; y en la musculatura ocular, manteniendo una mirada forzada hacia arriba.
El tono es la contracción pasiva y continua que está presente en los músculos a pesar del reposo. El tono disminuido axial se valora principalmente a través de la postura (cifosis reducible), y el distal a través de la valoración de la resistencia a la movilización pasiva de la extremidad. Desde el punto de vista clínico, la hipertonía se clasifica clásicamente en: espástica (aumento de la resistencia a la movilización que aumenta con la velocidad del movimiento articular) o distónica (aumento de la resistencia a la movilización que aparece o cambia con determinadas posturas o movimientos). Es importante diferenciar a la hipertonía de la rigidez (resistencia constante que aparece en la flexión y extensión de una articulación) y la hipotonía de la hiperlaxitud (ausencia de resistencia de los tejidos blandos fuera del rango de movimiento habitual). Ambas parejas pueden ocurrir a la vez en la misma articulación del mismo paciente y orientar a un problema neurológico o muscular, pero tanto la rigidez como la hiperlaxitud pueden aparecer independientemente de un problema neurológico o muscular.
Respecto al trofismo muscular, se evalúa la presencia de aplasias/atrofias e hipertrofias selectivas musculares, la existencia de dismetrías entre extremidades y la consistencia del vientre muscular.
Los reflejos osteotendinosos se pueden obtener en cualquier músculo mediante un golpe sobre un tendón que produce un estiramiento muscular. Existen dos claves para conseguir obtenerlos; por un lado, hay que distraer al niño, en especial a los más pequeños, creando un ambiente agradable, utilizando distractores para que presten atención a otra parte de su cuerpo y en miembros superiores, transmitiendo el golpe a través del dedo del examinador; por otro lado, hay que prestar atención a la posición muscular, ya que los reflejos osteotendinosos aparecen característicamente cuando el tendón muscular está moderadamente extendido y por ello, en ocasiones, es conveniente pedir al paciente que realice una mínima contracción muscular. Los reflejos osteotendinosos más importantes y la técnica adecuada para su realización se recogen en la tabla IV.
La interpretación clínica de un reflejo debe integrarse con el resto de la exploración. Así, un reflejo más exaltado de lo habitual, bilateralmente, puede considerarse como variante normal si no encontramos ningún otro dato de piramidalismo. Más cautela debe existir en el caso de un aumento del área reflexógena bilateral, pero aun así, esta alteración debe interpretarse en el contexto clínico. También, una disminución de los reflejos debe interpretarse con el resto de datos clínicos, ya que esta alteración suele acompañarse de debilidad e hipotonía. En caso contrario, lo más recomendable es plantearse si la técnica ha sido correcta. La relación de hiporreflexia con hipotonía es importante también, porque orienta hacia el proceso causal; así, las enfermedades del nervio periférico tienden a tener una hiporreflexia muy marcada para el grado de hipotonía, mientras que las enfermedades del músculo tienen menor grado hiporreflexia que de hipotonía. Una asimetría entre reflejos suele indicar una patología.
Los reflejos cutáneos más frecuentemente utilizados son: la respuesta cutánea plantar y los reflejos abdominales. La respuesta cutánea plantar se realiza con un objeto romo que se desliza sobre la cara lateral de la planta del pie y sobre la piel suprayacente a la cabeza de los metatarsianos. El tipo de respuesta se clasifica en flexora (es la respuesta normal a lo largo de toda la vida postnatal y consiste en la flexión del dedo gordo), indiferente (no hay movimiento del dedo gordo) y extensora (hay un movimiento de extensión del dedo gordo y/o una flexión/apertura en abanico del resto de los dedos). Los reflejos abdominales se obtienen cosquilleando con la uña o un clip a lo largo de un dermatoma hacia la línea media. Es importante saber que su ausencia puede ocurrir en un 15% de la población sana y que pueden ser asimétricos. Su importancia radica en la localización de una lesión espinal (menos fiable que la exploración sensitiva) y sobre todo, ante la sospecha de siringomielia en niños con escoliosis de causa desconocida.
El diagnóstico diferencial de las patologías motoras por déficit se basa en la interpretación integrada de todos los signos descritos hasta ahora (Tabla V).
Durante el examen, pueden aparecer movimientos anormales cuya caracterización depende de la historia clínica y de datos extraídos de la exploración física (Tabla VI).
La evaluación de la postura debe adaptarse al estado de madurez motora gruesa de cada paciente. En aquellos que no han alcanzado la capacidad de sedestación, debe evaluarse la postura en decúbito supino y prono. Si es capaz de sentarse, pero no se mantiene de pie, debe evaluarse sentado. Si ha alcanzado la bipedestación, debe valorarse de pie y utilizar el test de Romberg si el paciente es lo suficientemente colaborador. En la valoración de la postura, evaluamos: la estabilidad, la presencia de contracturas (desvían al paciente de la posición anatómica) y la presencia de movimientos anormales.
La valoración de la marcha es una de las partes más informativas de la exploración neurológica. Es conveniente ser sistemático y apoyarse en una grabación con el móvil. Hay que distraer siempre al paciente para que realice su marcha natural y en la interpretación, es vital correlacionar los hallazgos con aquello que habíamos descrito en la valoración estática de fuerza y tono. Si la marcha nos parece patológica, conviene encuadrar el problema en una serie de patrones clásicos (Tabla VII).
La valoración de la manipulación es más complicada, porque las secuencias de movimientos son más complejas al integrar combinaciones de múltiples fases (alcance, agarre, transferencia mano a mano, transporte y liberación) y porque debe interpretarse en el contexto cognitivo del paciente. De forma práctica, en clínica, se explora mediante el patrón de agarre del lápiz en niños menores de 4 años y en mayores de 4 años, mediante la presencia de errores, alteraciones de la velocidad o sincinesias en la secuencia de tocar cada dedo con el pulgar.
El examen del control selectivo es particularmente importante para manifestar una lesión de la vía piramidal muy leve. En pacientes con pobre control selectivo, al realizar un movimiento muy inferior a la fuerza máxima que pueden realizar, reclutan a músculos no implicados en ese movimiento, provocando movimientos en otra articulación o en el miembro contralateral. En la práctica clínica, se explora a la vez que la fuerza por grupos musculares y mediante la realización repetida de la pinza manual en los miembros superiores observando si existe una flexión muy marcada del resto de los dedos (cierto grado de flexión es normal) o en la muñeca.
Para estudiar el funcionamiento del cerebelo y del sistema del equilibrio, se han de realizar una serie de maniobras que requieren la colaboración del paciente, lo que hace que su correcta evaluación sea complicada en nuestros pacientes más jóvenes:
• Marcha en tándem: se pide al paciente que ande pisando una línea apoyando el pie de tal manera que el talón del pie de avance contacte con los dedos del pie más retrasado. En los pacientes con alteraciones leves del equilibrio, aparece la inestabilidad. Una afectación grave del cerebelo muestra inestabilidad en la marcha normal o en la bipedestación.
• Test de Romberg: compara el grado de inestabilidad del paciente en bipedestación con los pies juntos entre una situación con los ojos abiertos y una situación con los ojos cerrados. Los pacientes con afectación cerebelosa tienen inestabilidad en ambas situaciones, mientras que los pacientes con afectación vestibular o sensitiva empeoran su inestabilidad con los ojos cerrados.
• Prueba dedo-nariz: es un método para medir dismetría y, sobre todo, temblor intencional. Es importante insistir al niño en que no es una prueba de velocidad sino de precisión. En pacientes que no colaboren en la prueba o si se quiere registrar fácilmente en la historia el grado de alteración, se les puede pedir que copien una espiral.
• Prueba dedo-dedo: consiste en que el paciente siga el dedo del explorador que cambia de posición cuando el paciente lo alcanza. Es un método para medir la dismetría.
• Movimientos rápidos alternantes de las manos: se pide al paciente que realice alternativamente movimientos de pronación y supinación sobre su muslo tan rápido y preciso como pueda. Es un método para evaluar la disdiacokinesia. Se puede afectar también por distonía, espasticidad o en pacientes con dispraxias.
• Prueba de talón-rodilla: en decúbito supino, se pide al paciente que toque con el talón la rodilla contralateral y que baje tocando la espinilla. Evalúa la dismetría y el temblor en miembros inferiores.
Evaluación de la sensibilidad
Es el elemento más subjetivo de la exploración neurológica y por ello, la sensibilidad puede ser complicada de explorar, incluso si el paciente es colaborador.
Existen distintos tipos de sensibilidad, que llegan al cerebro por distintas vías. Dependiendo del objetivo de la exploración realizaremos distintos abordajes. En una exploración neurológica general, en Pediatría, se evalúa únicamente la sensibilidad táctil. En una exploración neurológica en la que nos interese la sensibilidad, se han de medir: la sensibilidad termo-algésica, la táctil y la vibratoria.
Para la exploración de la sensibilidad algésica es recomendable usar algún instrumento con punta que no sea capaz de atravesar la piel y que sea desechable, por ejemplo: un clip abierto. Para su correcta realización, se han de realizar distintos pinchazos en cara (siguiendo las tres ramas trigeminales), brazos y piernas. En el caso de la existencia de alguna alteración, se ha de hacer una exploración más pormenorizada siguiendo los territorios de inervación de los principales nervios y los dermatomas. La exploración de la sensibilidad térmica puede realizarse con un tubo (p. ej.: los usados para recoger orina) relleno de agua caliente y con un tubo de agua fría. Sigue el mismo abordaje que en el caso de la algésica. La sensibilidad táctil se explora tocando al paciente con el dedo suavemente o con un algodón. En el estudio de la sensibilidad vibratoria, es necesaria la utilización de un diapasón. Para su realización, se ha de dar un golpe a los cabezales del diapasón y situarlos en las prominencias óseas de las cuatro extremidades (en general: tróclea, maléolos y cabezas de metacarpianos) y comprobar que el paciente nota la vibración de manera similar.
Valoración de los nervios craneales
Nervio olfatorio (I): no se explora habitualmente.
Nervio óptico (II): debe explorarse la función y la anatomía visible del nervio y las reacciones pupilares.
• Función: la función de la mácula (visión central) se explora mediante la agudeza visual y la de retina periférica mediante campimetría por confrontación (requiere la colaboración parcial del paciente) o por el “reflejo” de refijacción (el paciente realiza un movimiento sacádico para explorar un objeto que se acerca desde el campo visual periférico al central). La evaluación de la agudeza visual depende de la edad. En niños que saben leer, prácticamente se evalúa con la capacidad lectora, y en niños pequeños, se explora con la capacidad de manipular (y detectar) pequeños objetos. En caso de duda o de necesidad de buscar alteraciones de la función del nervio óptico, hay que recurrir a métodos más formales (nistagmo oculocinético, test de Isihara…).
• Anatomía: se explora mediante la fundoscopia directa. Esta exploración depende de una correcta realización técnica y de la práctica acumulada en su realización. El primer paso es ajustar el oftalmoscopio: hay que retirarse las gafas, ajustar las dioptrías para ser capaz de leer la cubierta de un libro a la distancia de un brazo y reducir el brillo. Después, hay que preparar al paciente reduciendo la luz de la habitación (evitar la oscuridad), colocarlo en una posición en la que esté tranquilo y pedirle que fije su mirada en un objeto lejano (generalmente, la cara de su progenitor). El oftalmoscopio se agarra con la mano derecha y se utiliza con el ojo derecho para el ojo derecho del paciente. La secuencia comienza buscando el reflejo rojo colocándose 15º lateralmente al paciente a distancia de un brazo. Luego hay que ir acercándose en línea recta al paciente y aumentando el brillo al 80-90% del máximo. Hay que buscar el disco pivotando el oftalmoscopio evitando moverse o mover hacia los lados el oftalmoscopio. Debe explorarse el tamaño y el color de la papila (grisáceo en el recién nacido, amarillento en el preescolar y asalmonado en el niño mayor), los bordes (habitualmente nítidos) y la presencia de pulso venoso (su presencia tiene un alto valor predictivo negativo para hipertensión intracraneal y se explora estabilizando la mano sobre la ceja del paciente y buscando un reflejo de luz móvil sobre las venas retinianas).
• Reacciones pupilares: se buscan asimetrías entre las pupilas (anisocoria) y un defecto pupilar aferente (anomalías en la reactividad pupilar).
Nervios oculomotores (oculomotor, troclear y abducens): respecto a la motilidad ocular, debe explorarse la presencia de parálisis en la función de alguno de estos nervios (Tabla VIII), la existencia de diplopía en las distintas posiciones de la mirada y la presencia de anormalidades en los movimientos oculares.
Nervio trigémino (V): su exploración depende de la evaluación de la sensibilidad de sus tres ramas, de la realización del reflejo corneal (necesaria en pacientes no colaboradores) y del examen de su función motora a través del examen de los movimientos mandibulares.
Nervio facial (VII): su afectación central se caracteriza por la pérdida de movilidad voluntaria de la parte inferior de la hemicara ipsilateral y el borramiento del surco nasolabial ipsilateral. Su afectación periférica se caracteriza por la pérdida de movilidad voluntaria de toda la hemicara con incapacidad para el cierre palpebral y la disminución de las arrugas de la frente al elevar las cejas.
Nervio estatoacústico (VIII): la exploración del componente auditivo, que se basa en la reacción del paciente a estímulos auditivos, depende en gran parte de métodos instrumentales para ser lo suficientemente sensible. El componente vestibular puede explorarse a través del reflejo vestíbulo-ocular, utilizando la maniobra de impulso cefálico que gira la cabeza rápidamente unos 15º.
Nervio glosofaríngeo (IX): se explora con el reflejo de náusea.
Nervio vago (X): su paresia es detectable clínicamente como una debilidad en la elevación del paladar blando al explorar la orofaringe.
Nervio espinal accesorio (XI): se examina a través de la evaluación de la fuerza contra resistencia de un giro de la cabeza.
Nervio hipogloso (XII): su paresia bilateral se manifiesta como incapacidad para protruir la lengua y su paresia unilateral como un arqueamiento de la lengua al protruir la lengua.
Bibliografía
Varios manuales de Neurología Infantil disponen de capítulos excepcionalmente buenos sobre exploración que se han utilizado para construir este artículo:
1. Sims K. Handbook of pediatric neurology. Philadelphia, PA: Lippincott Williams & Wilkins; 2014.
2. Forsyth R, Newton RW. Paediatric neurology. Second edition. ed. Oxford, United Kingdom: Oxford University Press; 2012.
3. Haslam RH. Clinical neurological examination of infants and children. Handbook of clinical neurology. 2013; 111: 17-25.
4. Pascual Pascual SI. [Evaluation of maturity in drawing in childhood. I. Evaluation and validation of a graphomotor test in a population of normal children]. Revista de neurologia. 2001; 33(9): 812-25.
5. Pascual Pascual SI. [Evaluation of maturity in drawing in childhood. II. Development and validation of a graphomotor test in a child with neuropsychiatric disability]. Revista de neurologia. 2001; 33(10): 938-47.
 |
| Temas de FC |
M.A. Fernández Fernández*, M.D. Morillo Rojas**
*Especialista en Pediatría. Neuropediatra. Director del Instituto Andaluz de Neurología Pediátrica. **Especialista en Oftalmología. Instituto Andaluz de Neurología Pediátrica
| Resumen
Los síndromes neuro-cutáneos son un grupo de trastornos caracterizados por la afectación conjunta de las diferentes estructuras generadas en el desarrollo embriológico del neuroectodermo (Sistema Nervioso Central, Sistema Nervioso Periférico y piel con sus anejos). A pesar de su conocimiento y estudio, no hay aún un consenso general al respecto y quedan muchos conceptos por aclarar. La clasificación más habitual se realiza en función del tipo de herencia de cada grupo. La neurofibromatosis (NF) es la más frecuente de todas y se divide en diferentes tipos, en función de la alteración genética y la presentación clínica de cada una, principalmente, manchas café con leche (MCCL) y tumores del sistema nervioso (SN). El complejo esclerosis tuberosa (CET) consiste en una alteración de la migración, proliferación y diferenciación celular en el SNC, caracterizada principalmente por manchas acrómicas y fibromas en múltiples localizaciones. La enfermedad de Von Hippel Lindau (VHL) es una hemangioblastomatosis múltiple de herencia autosómica dominante (AD) y con muy escasa sintomatología dermatológica. |
| Abstract
Neuro-cutaneous syndromes are a group of disorders characterized by the joint involvement of the different structures generated in the embryological development of the neuroectoderm (central nervous system, the peripheral nervous system and the skin with its appendages). Despite their knowledge and study, there is still no consensus on the matter and there are many concepts to be clarified. The most common classification is based on the type of inheritance of each group. The NF is the most common of all and is divided into different types depending on the genetic alteration and clinical presentation of each, mainly CALS and CNS tumors. The CET is a change in the migration, proliferation and differentiation of cells in the CNS mainly characterized by depigmented spots and fibroids in multiple locations. VHL disease is multiple hemangioblastomatosis of AD inheritance and with very little dermatological symptoms. |
Palabras clave: Síndromes neuro-cutáneos; Facomatosis; Neurofibromatosis; Esclerosis tuberosa; Enfermedad de Von Hippel Lindau
Key words: Neuro-cutaneous syndromes; Phakomatoses; Neurofibromatoses; Tuberous sclerosis; Von Hippel-Lindau disease
Pediatr Integral 2015; XIX (8): 565-571
Introducción
Aun en la época que vivimos, hay cosas que todavía están por aclarar. Tanto es así, que el apasionante mundo de la Neurología Pediátrica sigue creciendo. Un claro ejemplo lo tenemos en el área que trata este artículo. Después de muchos años de estudio, conocimiento e investigación, aún no tenemos un acuerdo definitivo, un consenso claro sobre cómo denominar a estos trastornos, cómo clasificarlos y cuáles incluir en el concepto. Dada la situación, y tras revisar la amplia bibliografía existente(1-3), tendré la osadía de realizar una combinación de los aspectos que me han parecido de mayor interés dentro de cada texto. Vaya de antemano mi disculpa por este atrevimiento.
La evolución de las técnicas de diagnóstico dejan de lado la necesidad de los datos clínicos para alcanzar el diagnóstico en la mayor parte de los síndromes neuro-cutáneos. La formación es fundamental para evitar errores en la detección.
Historia
El conocimiento y estudio de estos procesos es ya largo y antiguo. Conforme los avances científicos y los estudios realizados han ido aportando más información, el nombre, el concepto y el desarrollo de estas patologías ha ido cambiando. El concepto de enfermedad neurocutánea(4) es prácticamente clínico. Comenzó a principios del siglo XX bajo la premisa del origen embriológico común de la piel y el SN y la aparición de signos de afectación en ambos. Este concepto teórico ha ido disminuyendo aparentemente en relevancia, conforme han avanzado los medios técnicos, pero permanece como un relevante constructo en la práctica real. De esta manera, hemos ido pasando por el concepto de Facomatosis, que Van der Hoeve (1933) introdujo para referirse a la NF, la Esclerosis Tuberosa (ET) y la enfermedad de VHPL; Facomatosis deriva de facoma (del griego fakoos = lente, lentejuela) y se refiere a las lesiones congénitas, múltiples y bien circunscritas, que se encuentran como islas en medio de un órgano por lo demás normal. Posteriormente, se introdujo el concepto de Hamartomatosis tras la inclusión del síndrome de Sturge-Weber (SSW) dentro de estos procesos. La hamartia es un trastorno de la diferenciación y organización celular definido y localizado dentro del tejido de un órgano.
En general, podemos definir estos cuadros como: un conjunto de síndromes caracterizados por la afectación conjunta de las diferentes estructuras generadas en el desarrollo embriológico del neuroectodermo (Sistema Nervioso Central, Sistema Nervioso Periférico y piel con sus anejos), es decir, síndromes neuro-cutáneos. Aunque en la literatura se definen algunas alternativas a la hora de clasificarlos, la mayoría se decanta por realizar una clasificación en función del origen genético del trastorno. Esto hace que el concepto general de síndrome neuro-cutáneo pueda extenderse tan ampliamente como uno esté dispuesto a abarcar. Tenemos un listado en la tabla I.
La NF1 es la más común de las enfermedades raras y aglutina un conjunto de alteraciones clínicas muy variables que dependen fundamentalmente de la evolución temporal para alcanzar el diagnóstico definitivo.
Neurofibromatosis
Con anterioridad a los estudios de genética molecular, se pensaba que la NF era una sola entidad hereditaria heterogénea o con muchas variantes. Posteriormente, se pudo acabar definiendo bien la existencia de dos variedades clínicas, patológicas y genéticas. La NF1 y la NF2. A pesar de ello, está aún pendiente acabar de categorizar diferentes grupos de pacientes con síntomas atípicos y se han llegado a proponer más de 9 variedades diferentes. La clasificación extendida aparece en la tabla II.
La NF1 o enfermedad de Von Recklinghausen es un tipo de NF debida a la mutación y pérdida de DNA del gen NF1 situado en el brazo largo del cromosoma 17 (17q11.2). En cuanto a la epidemiología, se puede decir que en conjunto, la NF1 es la más frecuente de todos los síndromes neuro-cutáneos con una incidencia de 1/2.500-1/3.000. En relación a la genética(5), la NF1 es una enfermedad con herencia AD con una alta penetrancia, de expresión clínica muy variable y con una alta tasa de mutaciones de novo (50%). Hay una alteración en la región 17q11.2 con 350 kb de ADN que codifican entre 11 y 13 Kb de ARNm. El gen se encuentra en todos los tejidos, tiene unos 60 exones y produce una proteína citoplasmática de 2.818 aminoácidos llamada neurofibromina, que actúa como gen supresor tumoral. La neurofibromina es una proteína que se expresa de forma ubicua en las células y tiene una función de supresión tumoral por medio de regular negativamente el proto-oncogen Ras%(5-7). En condiciones normales, la proteína neurofibromina tiene una región con actividad GTPasa que se une a la proteína Ras y modula la conversión de la forma activa Ras-GTP a la forma inactiva Ras-GDP. Los pacientes con NF1 presentan mutaciones o deleciones del gen que codifica la neurofibromina. Estas mutaciones ocasionan una disminución de su presencia y de la actividad GTPasa con la consiguiente proliferación de células mediadas por Ras-GTP. Se han descrito más de 500 mutaciones diferentes en el gen NF1, siendo la mayoría únicas en cada familia. Pueden ser de muchos tipos, pero más del 80% ocasionan una proteína truncada, la NF1 se expresa clínicamente por las lesiones referidas en la tabla III.
En función de la afectación por sistemas, podemos diferenciar: Signos dermatológicos y de partes blandas(6): la piel es donde suele aparecer el primer signo o síntoma, las MCCL. Las MCCL son áreas cutáneas hiperpigmentadas de color café con leche. Casi siempre están presentes desde el nacimiento y van aumentado en número y tamaño con la edad. Deben ser signos de sospecha al aparecer en recién nacidos y lactantes pequeños. Las efélides periaxilares y/o periinguinales son múltiples y pequeñas MCCL que aparecen, además, en zonas de flexión, cuello…, de forma evolutiva y aumentan principalmente a partir de los 6 años. En algunos textos las catalogan como patognomónicas de NF1. Los neurofibromas cutáneos o subcutáneos son lesiones que se palpan más que se ven, localizadas en trayectos de troncos nerviosos (superficies extensoras de los miembros). Son evolutivos y se hacen más frecuentes en escolares y adolescentes, pudiendo tener un crecimiento progresivo y ser dolorosos. Los nódulos de Lisch del iris son pequeños neurofibromas en dicha localización. Los neurofibromas plexiformes difusos pueden aparecer en cualquier localización, pero suelen predominar en el párpado superior. Al aparecer en los primeros años, habitualmente, son infrecuentes las detecciones más allá de los 4. La hipertrofia corporal ocurre en el 6% de los casos, por afectación tisular de las 3 capas embrionarias o grandes neurofibromas plexiformes. Se asocia a tumores cerebrales y espinales. El prurito generalizado con mayor intensidad en la superficie de los neurofibromas. Entre las manifestaciones neurológicas, encontramos tumores del SNC. El glioma óptico (14-15%) es el tumor intracraneal más frecuente de la NF1. Es un tumor de bajo grado de malignidad, que aparece principalmente en los cuatro primeros años de vida, afectando a nervios ópticos, quiasma y/o cintillas ópticas, de forma uni o bilateral. Inicialmente, tienden al crecimiento progresivo, pero con posterior estabilización a partir de los 6 años. Debe sospecharse NF1 en cualquier paciente con este tumor. Es generalmente asintomático, principalmente en lactantes y suele suponer un hallazgo de neuroimagen (RM de elección). Puede producir: estrabismo, déficit visual, exoftalmos o atrofia óptica y la consecuencia principal es la pérdida de agudeza visual (que suele ser reversible). Los síntomas principales de alarma iniciales son la discromía y el estrabismo. El seguimiento puede hacerse con fondo de ojo, agudeza visual y potenciales evocados. La gran mayoría son benignos y no necesitan tratamiento. También aparecen otros tumores (4-5%). Los astrocitomas pueden ser hemisféricos o de tronco y se dan principalmente en menores de 6 años, con una histología benigna de crecimiento lento. Salvo que se detecten en RM, pueden debutar con crisis parciales. Los tumores hipotalámicos se asocian a alteraciones del crecimiento y del desarrollo puberal. Algunos son agresivos y requieren cirugía, por lo que ante la sospecha hay que realizar RM específica. Los tumores pineales (1%) son pinealomas que pueden cursar con pubertad precoz. Tumores de médula y raíces espinales también son raros (1,5%). Los tumores del SNP (8%) son neuromas plexiformes que afectan a plexos y nervios periféricos principalmente sensitivos. Suelen ser benignos, pero con tendencia a la malignización. La hidrocefalia puede tener origen tumoral o ser secundaria a displasia del acueducto del Silvio (6%). Esta última aumenta con la edad y se asocia a tumores de vías ópticas (25-30%). En general, tiene un curso lento y progresivo, no necesitando siempre tratamiento urgente. Las crisis epilépticas (3-5%) son habitualmente generalizadas. Las alteraciones del aprendizaje y comportamiento son frecuentes. En la NF1, el coeficiente intelectual suele ser límite (80-85), pero no es habitual el retraso mental. Un 40-50% de los afectos presenta problemas de aprendizaje, asociando trastorno por déficit de atención y/o hiperactividad (TDAH) y trastorno del desarrollo de la coordinación motora (TDCM). Hay malformaciones del SNC que aparecen raramente, como Chiari 0,5% o siringomielia 0,5%… En ocasiones, aparecen áreas de hiperseñal, en secuencias T2 en RMN craneal. Dentro de la afectación ocular vemos los nódulos de Lisch, son pequeños neurofibromas localizados en el iris. Tienen un desarrollo evolutivo y son más frecuentes en la edad prepuberal. Son asintomáticos y se valoran en lámpara de hendidura. Como afectación esquelética, la displasia ósea es característica, especialmente la de esfenoides (con exoftalmos pulsátil). También puede aparecer adelgazamiento de la cortical de huesos largos con cambios quísticos. La escoliosis ocurre en el 7-15% y puede deberse a anomalía de la estática vertical o a deformidad vertebral. Predomina en la edad prepuberal y suelen responder a tratamiento conservador. En algunas ocasiones, se asocian a siringomielia. La pseudoartrosis es más frecuente en RN y niños pequeños, suelen aparecer en miembros (antebrazo y tibia), creando deformidad progresiva y déficit funcional. Tienen difícil tratamiento reconstructivo. Ronda entorno al 5-6%. Hay afectación de otros órganos y sistemas, de modo que a nivel renal puede aparecer angiodisplasia y quistes (hematuria, hipertensión arterial, insuficiencia renal crónica). A nivel suprarrenal se ha descrito el feocromocitoma.
Los datos clínicos son los que nos llevan a un diagnóstico de confirmación en la NF1. La genética aporta información, pero no es la respuesta actual a todas las necesidades de las familias.
El diagnóstico de la NF1 es principalmente clínico, merced al cumplimiento de, al menos, dos de los criterios diagnósticos descritos en la tabla IV, pero también puede analizarse el defecto genético específico.
Para el tratamiento de la NF1, solo podemos hacer referencia en la actualidad, al apartado quirúrgico de las lesiones existentes. Dentro de las mismas, tenemos intervenciones cosméticas; en la mayoría de las ocasiones, se centra en la extirpación quirúrgica de los neurofibromas presentes. También hay intervenciones funcionales, en las situaciones que asocien dificultades para la fonación, deglución, respiración… Se realizan intervenciones ortopédicas, en los casos de displasias o pseudoartrosis. El resto, las intervenciones de vías ópticas se realizan solo en casos seleccionados, debido a la lentitud e incluso reversibilidad de los procesos. Finalmente, las intervenciones neuroquirúrgicas se llevan a cabo en caso de obstrucciones a la circulación de LCR con hipertensión intracraneal o ante la aparición de otras tumoraciones.
Concepto de NF2. La NF2 o de los tumores acústicos bilaterales (BANF) se caracteriza por schwannomas bilaterales del componente vestibular, los VIII pares craneales. La NF2 es un trastorno de herencia AD. La mutación puntual o pérdida de ADN del gen, la NF2, son la causa. Troffater y col., en 1993, identificaron el gen responsable en el brazo largo del cromosoma 22, 22q11.1-13.1. El producto del gen es una proteína denominada Merlina (Moesin, Ezrin y Radixin like protein). La epidemiología es menos conocida, la NF2 es menos frecuente que la 1, 1/50.000, y tiene poca incidencia en la infancia. En la NF2, los tumores son mucho más frecuentes y de mayor morbilidad que los de la NF1. En general, son schwannomas de nervios craneales y de las raíces medulares, aunque pueden incluirse meningiomas. Los tumores del SN son el dato más común que se encuentra, en más del 90-95% de los pacientes afectos de NF2, como schwannomas, en la pérdida acústica progresiva, bilateral y asimétrica. Alrededor de un 10% de este grupo de pacientes refiere una hipoacusia unilateral brusca. Pueden aparecer otras neoplasias menos frecuentes como los meningiomas. La existencia de crisis epilépticas puede ser orientativa. Las lesiones dermatológicas son las segundas en frecuencia (60%) y son las MCCL y los neurofibromas. Es importante la afectación ocular, por la aparición de cataratas capsulares posteriores en el 80% de los pacientes, incluyendo niños, lo que puede ser una orientación al diagnóstico precoz. El diagnóstico se realiza por los criterios clínicos, fundamentalmente, según se describe en la tabla V.
La evolución y pronóstico están centrados en la patología existente en cada caso; pero, principalmente, se basa en la patología auditiva. El tratamiento debe centrarse en solucionar las complicaciones que vayan apareciendo, así como el crecimiento de las tumoraciones existentes.
Complejo esclerosis tuberosa
El conocimiento sobre el CET está evolucionando de tal manera en los últimos años, que se alcanza en ella el concepto de patología con posible mejoría. Los avances en los procesos de aparición de la enfermedad traen nuevas posibilidades terapéuticas aún es estudio.
Historia
El CET consiste en una alteración de la migración, proliferación y diferenciación celular en el SNC, de forma genérica, una hamartomatosis.
Epidemiología
El CET es el 2º síndrome neuro-cutáneo más frecuente detrás de la NF1, con 1/10.000-14.000, y afectando por igual a todas las razas, sexos y regiones geográficas. Es un trastorno de herencia AD (Berg 1913) debido a la alteración de, al menos, 2 genes TSC1 (9q34) y TSC2 (16p13) y con una alta tasa de mutaciones de novo (alrededor del 60%). La expresión es altamente variable dentro de los miembros de una misma familia. El gen TSC1 se localiza en el cromosoma 9q34 y codifica la proteína llamada hamartina. Está constituido por 23 exones, y causa la enfermedad en un porcentaje bajo de casos, dando lugar a las formas más benignas de la enfermedad(10). El gen TSC2 está localizado en el cromosoma 16p13. Está constituido por 41 exones y codifica para la proteína llamada tuberina. En general, se puede decir que todo órgano ha sido en alguna ocasión detectado como afectado en el CET a excepción del SNP, el músculo esquelético y la glándula pineal. Las alteraciones patológicas que se encuentran en el CET son de tres tipos: 1) Hamartias, presentes desde el nacimiento. La hamartia mejor conocida es la tuberosidad cortical. 2) Hamartomas, presentes o no desde el nacimiento, pueden progresar y revertir en las diferentes localizaciones. Como ejemplo, están: los rabdomiomas cardícacos o los angiofibromas faciales y el tumor subependimario de células gigantes. Angiomiolipoma renal, linfangioleiomiomatosis pulmonares. 3) Hamartoblastomas, solo se encuentran a partir de la tercera década de la vida, como el carcinoma renal. La afectación cutánea (96%) incluye: las manchas acrómicas ocurren en un 60-90% de los casos, aparecen generalmente desde el nacimiento o primer año y tienen una forma lanceolada característica, pudiendo ser incluso el único signo de CET. Los angiofibromas faciales (también llamado adenoma sebáceo) aparecen generalmente entre los 4-6 años (hasta un 40% antes de los 3 años) llegando a estar en el 45-70% de los adolescentes y adultos. Predominan en mejillas y surco nasogeniano, como nódulos carnosos que imitan el acné. Son lesiones patognomónicas y también pueden aparecer en solitario, como signo único de CET. Los fibromas ungueales (o tumores de Koënen) tienen también aspecto carnoso y son un signo tardío, a veces único, de CET, alcanzando el 20% en los adolescentes y siendo patognomónicos. La piel de chagrín es otro signo cutáneo tardío de CET, no patognomónico, consistente en placas cutáneas sobreelevadas, con aspecto grumoso que aparecen como signo único en el 50% de los pacientes. Los fibromas frontales en placas son patognomónicos. Dentro de la afectación neurológica (90%), tenemos: la epilepsia, ocurre en el 75-90% de los casos y, generalmente, es de difícil control, llegando incluso al síndrome de West. El 84% de las crisis son generalizadas y el debut precoz con un 65% antes del año. El retraso mental ocurre en el 50-70% de los casos, como un proceso precoz y evolutivo relacionado con la situación de la epilepsia. Las alteraciones neuropsiquiátricas(11) pueden ser variadas con: comportamiento psicótico en el 50%, hiperactividad en el 60%, agresividad en el 15% y rasgos autistas en el 55% de los casos con SW. Los tumores intracraneales alcanzan el 10-15%, tendiendo a ser máximos en la pubertad. Los hallazgos principales en neuroimagen son: los nódulos subependimarios, los tuberomas corticales y las heterotopias neuronales. En los ojos, aparecen facomas o hamartomas retinianos en el 50% de los casos. Ya sean planos o nodulares, aparecen con un color blanquecino de granos de tapioca, siendo benignos y de curso no progresivo. Suelen ser asintomáticos, tienden a calcificarse y pueden ser múltiples y/o bilaterales, llegando a ser signo único de la CET. Dentro de la afectación visceral, podemos encontrar rabdomiomas cardiacos 30-45%. Están presentes desde el periodo fetal, pero con tendencia a disminuir tras el nacimiento hasta incluso desaparecer por completo. El riñón es el tercer órgano más afectado (60-80%). Hay quistes renales y los angiomiolipomas alcanzan el 65% de las autopsias. La afectación del pulmón es infrecuente (<1%). El diagnóstico se puede hacer a partir de una serie de criterios o hallazgos descritos en la tabla VI.
El diagnóstico definitivo de esclerosis tuberosa se establece cuando se constatan dos criterios mayores o uno mayor y dos menores; es probable cuando el paciente cumple un criterio mayor y uno menor, y posible cuando cumple un criterio mayor o bien dos o más menores. Desde el punto de vista neuropediátrico, es el cuadro que más complicaciones produce en niños y adolescentes. El tratamiento debe valorarse en función de la sintomatología asociada, epilepsia, tumores…
Síndrome de Von Hippel-Lindau
El síndrome de VHL es una hemangioblastomatosis múltiple de herencia autosómica dominante cuyo diagnóstico es difícil a través de la sintomatología cutánea. La aparición de neoplasias de este tipo en diferentes órganos supone la principal limitación en las expectativas de vida y de calidad de vida en los pacientes.
En 1904, Von Hippel describió el carácter progresivo de las lesiones retinianas que habían sido ya descritas previamente. Por su parte, Lindau en 1926, conjuntaba las lesiones descritas con los conocimientos previos(12). Aunque no se conoce bien la epidemiología real, se ha encontrado una prevalencia de 1/40.000 sujetos en la región alemana de Freiburg. La enfermedad de VHP es un trastorno de herencia AD consistente en una hemangioblastomatosis múltiple que a diferencia de otros síndromes neuro-cutáneos, no presenta unas lesiones dérmicas típicas que permitan un diagnóstico clínico. En 1988, Seizinger y cols., encontraron el gen responsable en el brazo corto del cromosoma 3. (3p25). En 1993, Latif y cols., identificaban el gen anormal que actuaba como gen de supresión tumoral. El mapeo cromosómico sitúa el locus del gen de la VHL cerca del locus del oncogén RAF-1. Las edades extremas de aparición de la enfermedad oscilan entre los 4 y los 68 años, con una media de 26,3. Esto hace que sean raras las descripciones infantiles. Además, durante los primeros 10 años de evolución, solo se observa la complicación más frecuente, la angiomatosis retiniana, que ocurre en el 59% de los afectados. El tumor retiniano va creciendo progresivamente desde un tamaño muy pequeño hasta ser mayor que la papila. Puede ser uni o bilateral y cuenta con una arteria de entrada y una vena de salida, pudiendo sangrar en casos de hipertensión intracraneal. Se describen 4 fases de evolución:
1. Dilatación de vasos (color anaranjado) de hasta 1 cm.
2. Aparición de hemorragias.
3. Exudación masiva y despegamiento de la retina (o con gliosis periférica).
4. Glaucoma y destrucción del ojo.
La distribución de las lesiones existentes es la siguiente: 59% angiomatosis retiniana y hemangioblastoma cerebeloso; 29% carcinoma renal; 13% hemangioblastoma de médula ósea y 7% feocromocitoma. Un 10-20% de todos los pacientes con hemangioblastoma de la retina tienen, además, un tumor intracraneal y por definición VHL. Un 65-83% de los hemangioblastomas del SNC se encuentran en el cerebelo. El 60% de los pacientes con VHL presentan hemangioblastomas cerebelosos en la autopsia. Entre el 5-30% de los pacientes con hemangioblastomas cerebelosos tienen policitemia secundaria a la fabricación de eritropoyetina por el el tumor. Un 10% de los hemangioblastomas del SNC están en el tronco cerebral y el 15% en la médula espinal. El diagnóstico puede realizarse a nivel clínico en base a la aparición de los criterios clínicos(13) (Tabla VII).
La edad media de fallecimiento son los 41 años en un tercio de los pacientes. Hay tendencia familiar a la aparición de las complicaciones más frecuentes. El 10% de los hemangioblastomas cerebelosos extirpados recidivan. Se recomienda revisar desde los 6 años a los sujetos de riesgo. Los hemangioblastomas cerebelosos deben ser tratados quirúrgicamente y los resultados han sido siempre buenos. En cambio, los tumores del tronco cerebral, cuarto ventrículo y medula espinal son más complicados de extirpar y no siempre puede hacerse por completo. El hipernefroma y el feocromocitoma deben ser extirpados al diagnóstico; mientras que, otros tumores, como los de epidídimo, no requieren tratamiento de entrada salvo complicaciones. Las lesiones retinianas requieren tratamiento en un alto porcentaje de casos.
Bibliografía
1. Aicardi J. Disease of the nervous system in chilhood. 2nd ed. London: Mac Keith Press; 1998.
2. Gómez MR. Enfermedades neurocutáneas. En: Gómez MR, Motilla J, Nieto M. Neurología y Neuropsicología Pediátrica. Jaén. Diputación provincial de Jaén 1995.
3. Kerrison JB, Nweman NJ. The phacomatoses. Neurosurg Clin North Am. 1999; 10: 775-87.
4. Pascual I. Trastornos neuroectodérmicos. Barcelona. JR Prous; 1989.
5. Riccardi VM. Neurofibromatosis: Phenotype, Natural History and Pathogenesis 2nd ed. Baltimore: The Johns Hopkins University Press, 1992.
6. Abramowicz A, Gos M. Neurofibromin in neurofibromatosis type 1 – mutations in NF1 gene as a cause of disease. Dev Period Med. 2014; 18: 297-306.
7. Roach ES, Gómez MR, Northrup H. Tuberous sclerosis consensus conference: recommendations for diagnostic evaluation. National tuberous sclerosis asociation. J Child Neurol. 1999; 14: 401-7.
8. Hyman MH, Whittemore VH. National Institutes of Health Consensus Conference: Tuberous sclerosis complex. Arch Neurol. 2000; 57: 662-5.
9. Niemeyer CM. RAS diseases in children. Haematologica. 2014; 99: 1653-62.
10. DiMario FJ Jr, Sahin M, Ebrahimi-Fakhari D. Tuberous sclerosis complex. Pediatr Clin North Am. 2015; 62: 633-48.
11. Leclezio L, de Vries PJ. Advances in the treatment of tuberous sclerosis complex. urr Opin Psychiatry. 2015; 28: 113-20.
12. Metso S. Von Hippel-Lindau disease. Duodecim. 2014; 130: 1867-73.
13. Schmid S et al. Management of von hippel-lindau disease: an interdisciplinary review. Oncol Res Treat. 2014; 37: 761-71.
| Caso clínico |
|
Tuco es un niño de 3 años de edad y 12 kg de peso, cuyos padres lo traen a consulta por presentar un cuadro clínico de inestabilidad y problemas de equilibrio de semanas de evolución, con aumento progresivo y asociación a movimientos anormales en la mano izquierda que le producen torpeza motora y caídas frecuentes. En los antecedentes personales, no refieren problemas gestacionales, perinatales ni en el desarrollo psicomotor durante el primer año de vida. Se aprecian MCCL de pequeño tamaño en abdomen y tórax. Posteriormente, se aprecia postura anómala de miembro superior derecho (MSD) que tras estudiarse, se cataloga de agenesia parcial de cúbito derecho. Ante este signo, se valora a los padres detectándose en la madre MCCL aisladas. Se sospecha NF1 sobre los 18 meses y se practica RMN craneal y cervical que resulta normal. En ese momento descartan la existencia de NF1. En la exploración, se apreciaron los siguientes datos como resumen: buen estado general, pupilas isocóricas normorreactivas, movimientos oculares extrínsecos normales y reflejos musculares profundos normales. En la marcha, se aprecia inestabilidad con aumento de la base de sustentación, inseguridad y tendencia a la caída pendular (ataxia de características centrales). En la exploración del MSD, se aprecia deformidad a la altura de 2/3 distal de antebrazo con incurvación radial. En la piel, se aprecian 7 MCCL de diámetro mayor a 0,5 cm. Ante la aparición de estos síntomas, se decidió completar el estudio y se solicitaron pruebas complementarias de imagen. Los resultados de las pruebas mostraron en la RMN craneal lesiones hiperintensas en globos pálidos y sustancia blanca cerebelosa, sugiriendo lesiones displásicas en el contexto de NF1. Hipertrofia de mucosas de senos paranasales. La RMN de brazo derecho mostró una imagen de pseudoartrosis central cubital. Con estos resultados y la situación clínica, se realizó el juicio clínico de neurofibromatosis tipo 1 con complicaciones asociadas (ataxia central, trastorno del movimiento y trastorno del comportamiento). En la evolución, presenta una evolución desfavorable, con ampliación de los movimientos anormales del MSD y mayor dificultad en la deambulación. Asocia dificultades en la articulación del lenguaje (disartria) y un estrabismo convergente del ojo izquierdo (parálisis del VI, par izquierdo con movilidad). Evolucionan, igualmente, dificultades de comportamiento y aparecen ecolalias frecuentes. Finalmente, se alcanza una imposibilidad casi completa para la marcha, así como para las funciones básicas de la vida diaria (alimentación, higiene…). En relación al tratamiento, a pesar de la valoración por neurocirugía y el resto de especialidades, no se valora posible ninguna intervención que permita mejorar la sintomatología, salvo la actitud ortopédica de miembros inferiores y columna. Se prescriben gafas para intentar mejorar el estrabismo y se plantea la intervención de la pseudoartrosis.
|
 |
| Temas de FC |
I. Bosch, S. Fernández Ramos
Equipo de Orientación Educativa y Psicopedagógica Rivas-Arganda, Madrid
| Resumen
El sistema educativo español cuenta con una red de orientación para garantizar la calidad educativa y la atención a la diversidad de todos los alumnos escolarizados en Educación Infantil, Primaria y Secundaria. Para ello, establece la figura del profesor tutor y los servicios especializados (internos y externos a los centros). Entre las funciones de estos profesionales, se encuentran la coordinación con los servicios de la zona, incluyendo los sanitarios, y la realización de la evaluación psicopedagógica de los alumnos que lo precisen. Dicha evaluación permite fundamentar decisiones sobre el tipo de necesidad educativa, la modalidad de escolarización y el tipo de centro más adecuado, así como asesorar sobre las medidas que conviene poner en marcha para facilitar su desarrollo y aprendizaje |
| Abstract
The Spanish education system has a network of educational psychologists to ensure an excellent standard of education is provided and to address the diversity of all students enrolled in Pre- school, Primary and Secondary. Tutors, along with specialised services which may be internal or external to the school, have been put in place for this endeavour. Duties of these professionals include liaising with health and other services, and conducting psychopedagogical assessments of students as required. This assessment can inform decisions about the type of educational need, the type of schooling and the most appropriate school, as well as advise on the measures to be implemented in order to facilitate their development and learning |
Palabras clave: Equipo de Orientación Educativa y Psicopedagógica; Alumnos con necesidades específicas de apoyo educativo; Evaluación psicopedagógica; Atención educativa
Key words: Educational Psychology and Counseling Team; Students with special educational needs; Psychopedagogical assessments; Educational attention
Pediatr Integral 2015; XIX (8): 556-564
Introducción
El actual sistema educativo cuenta con una red de orientación que garantiza la atención a la diversidad de todos los alumnos escolarizados en el territorio español en Educación Infantil (0-6 años), Primaria (6-12 años) y Secundaria (12-18 años).
Dicha red hace especial hincapié en el establecimiento de medidas educativas que favorezcan la inclusión de los alumnos con necesidades específicas de apoyo educativo (ACNEAE) bajo los principios de inclusión y normalización.
La Ley Orgánica 2/2006, de 3 de mayo, de Educación (LOE), modificada por la Ley Orgánica 8/2013 (LOMCE), para la mejora de la calidad educativa, define a los ACNEAE como aquellos que requieren una atención educativa diferente a la ordinaria por presentar necesidades educativas especiales (ACNEE), dificultades específicas de aprendizaje, Trastorno por Déficit de Atención con Hiperactividad (TDAH), por sus altas capacidades, por haberse incorporado tarde al sistema educativo, o por condiciones personales o de historia escolar(1,2) (Fig. 1).
Figura 1. ACNEE: alumnos con necesidades educativas especiales. TDAH: trastorno por deficit de atención e hiperactividad.
Para garantizar dicha orientación, los centros cuentan con la figura del maestro/profesor tutor y con servicios especializados (Fig. 2).
Figura 2.
El maestro/profesor tutor
El maestro/profesor tutor suele ser aquel que más horas de docencia imparte en un grupo de alumnos y es el docente de referencia para ese grupo.
Tiene entre sus funciones: asesorar a los alumnos sobre sus posibilidades educativas, académicas y profesionales en colaboración con los servicios especializados; y coordinar la acción docente para ese grupo de alumnos, con el fin de garantizar la coherencia educativa de todos los profesores, e informar a los padres sobre el rendimiento académico y la actitud hacia el aprendizaje de sus hijos mediante boletines de notas trimestrales y reuniones(3,4) .
El maestro/profesor tutor, mediante el seguimiento diario de su grupo de alumnos, observa el rendimiento académico y conducta de los alumnos, y pone en marcha medidas ordinarias para atender a su alumnado. Las medidas ordinarias son estrategias organizativas y modificaciones con respecto a agrupamientos, técnicas de enseñanza-aprendizaje y de evaluación, que no modifican los objetivos, contenidos y criterios de evaluación establecidos legalmente por la Administración. Si tras poner en marcha estas medidas, el maestro/profesor tutor observa que no son suficientes, puede solicitar el asesoramiento o evaluación de los servicios especializados mediante la cumplimentación de un protocolo de derivación (Fig. 3).
Figura 3.
Los servicios especializados
Los servicios especializados proporcionan apoyo técnico al profesorado, familias y alumnos en los niveles educativos no universitarios.
Estos servicios se pueden ofrecer mediante servicios internos o externos a los centros educativos. Cada comunidad autónoma ha elegido un modelo diferente, que suele variar en las distintas etapas.
Los servicios especializados externos
Los servicios especializados externos se suelen denominar Equipos de Orientación Educativa y Psicopedagógica (EOEP) en casi todo el territorio español.
Los EOEP intervienen en los Centros de Educación Infantil y Primaria (CEIP) (centros que escolarizan a alumnos de 3-12 años), salvo en Cataluña (denominados Equipo de Asesoramiento y Orientación Psicopedagógica) y País Vasco (Berritzegune Zonal), comunidades autónomas en las que dicha actuación se extiende también a los Institutos de Educación Secundaria (IES) (centros que escolarizan a alumnos de 12 a 18 años). En la Comunidad Valenciana, reciben el nombre de Servicios Psicopedagógicos Escolares.
En casi todas las comunidades, los EOEP pueden ser de Atención Temprana (responsables de la orientación en las Escuelas Infantiles), Generales (responsables en los CEIP) y Específicos (que intervienen de forma complementaria a los de EOEP de Atención Temprana, Generales y Departamentos de Orientación en el tramo no universitario, para atender a los alumnos afectados de discapacidad o con trastornos graves del desarrollo).
Los EOEP ofrecen soporte técnico externo en una zona geográfica determinada y tienen una composición interdisciplinar, normalmente profesores de la especialidad de Orientación educativa (Licenciados en Psicología, Pedagogía y Psicopedagogía) y Profesores Técnicos en Servicios a la Comunidad (Diplomados en Trabajo Social). En los EOEP de Atención Temprana, también suele haber Maestros especialistas en Pedagogía Terapéutica (PT) y/o Maestros especialistas en Audición y Lenguaje (AL), que se encargan de la intervención directa con el ACNEE de las Escuelas Infantiles en la red pública. En los CEIP, Centros de Educación Especial e IES, se puede contar con profesorado especialista que pertenece al Claustro de profesores, según el tipo de necesidades del alumnado escolarizado en ese centro. Los profesionales especialistas que pueden trabajar en un centro son: PT, AL, integradores sociales, técnicos III, fisioterapeutas, enfermeros, intérpretes en lengua de signos y asesores sordos (Tabla I).
Los profesionales de los EOEP suelen asistir una vez a la semana a las Escuelas Infantiles y a los CEIP de, al menos, tres aulas por curso. Los CEIP preferentes de algún tipo de discapacidad cuentan con dos días de asistencia.
Dichos servicios cuentan con funciones similares que se pueden dividir en funciones de sector/zona geográfica y en los centros(5) (Fig. 4):
Figura 4.
Funciones del sector/zona geográfica (Fig. 5):
Figura 5.
1. Coordinación con servicios educativos del sector, como Servicio de Inspección Educativa, otros EOEP, IES, Centros de Educación Especial…
2. Determinación de las NEE del alumnado no escolarizado o escolarizado en centros privados concertados.
3. Coordinación con otros servicios del sector: servicios sanitarios, Centros de Atención Temprana y servicios municipales (especialmente Servicios Sociales, para la prevención e intervención de alumnos en situación de riesgo social, control del absentismo escolar…). Para facilitar la coordinación con los servicios sanitarios, los EOEP suelen tener protocolo de coordinación y un representante del EOEP ante dichos servicios.
Funciones en los centros educativos públicos (Fig. 6):
Figura 6.
1. Contribuir a la mejora de la enseñanza y la calidad de los aprendizajes, ofreciendo apoyo técnico relacionado con:
• Los documentos de centro, en los que se recogen las medidas generales de atención a la diversidad, especialmente:
- Programaciones didácticas, documentos de centro en los que se adapta el currículo establecido por la Comunidad Autónoma (competencias, objetivos, contenidos, metodología y evaluación para un determinado curso) al contexto y características de los alumnos del centro.
- Plan de Atención a la Diversidad: documento en el que se recogen las medidas organizativas, apoyos y refuerzos que un centro planifica y pone en marcha para atender a las necesidades generales y particulares de su alumnado. Las medidas de atención a la diversidad pueden ser generales y ordinarias (para todo el alumnado) o extraordinarias (para un alumno en particular).
- Plan de Convivencia: documento donde se recogen todas las actividades que fomentan el clima de convivencia del centro, así como las normas de conducta. Dentro de este, se pueden planificar jornadas de sensibilización hacia la discapacidad, el periodo de adaptación/acogida de los alumnos nuevos, la coordinación con servicios externos…
- Plan de Acción Tutorial: documento en el que se organizan y planifican las actuaciones de los maestros/profesores tutores.
• La puesta en marcha de medidas ordinarias de atención a la diversidad, como desdobles (división de una clase en dos: una ordinaria y otra de refuerzo), grupos flexibles (profundización, refuerzo), la incorporación de estrategias metodológicas (trabajo por rincones o talleres, trabajo por proyectos, aprendizaje cooperativo, tutoría/ayuda entre iguales…), adaptación de evaluación…
• La realización de evaluaciones psicopedagógicas.
• La planificación de medidas extraordinarias de atención a la diversidad, especialmente la elaboración de adaptaciones curriculares significativas.
2. Contribuir a la mejora del funcionamiento de las estructuras organizativas de los centros (Equipo Directivo, Consejo Escolar, Comisión de Coordinación Pedagógica, Claustro de Profesores, equipos docentes…).
3. Promover la cooperación familia-centro.
Servicios especializados internos
Los servicios especializados internos se suelen denominar Departamentos de Orientación (DO) o Unidades de Orientación. Tienen una composición interdisciplinar y los profesionales que los constituyen forman parte del centro educativo.
Los DO se dan en los IES de todas las comunidades autónomas, salvo en Cataluña y País Vasco y los CEIP de más de 12 clases de la Comunidad Gallega.
Las Unidades de Orientación se dan en Cantabria, Castilla-La Mancha y las ciudades autónomas de Ceuta y Melilla. Dichas unidades ofrecen apoyo técnico en los CEIP.
Los servicios especializados internos realizan funciones similares a las que realizan los servicios externos en los centros educativos. En los IES, además, cuentan con funciones relacionadas con la orientación académica y profesional. Así, sus funciones se suelen dividir en tres aspectos: apoyo al Plan de Acción Tutorial (apoyo técnico a los tutores), apoyo al proceso de enseñanza aprendizaje (planificación de medidas de atención a la diversidad) y apoyo al Plan de Orientación Académico y Profesional (POAP) (Fig. 7).
Figura 7.
El POAP recoge todas las actuaciones llevadas a cabo por el centro, encaminadas a favorecer que los alumnos tomen decisiones con respecto a su itinerario académico y profesional. Destaca, especialmente, la elaboración del Consejo Orientador.
La evaluación psicopedagógica
La Evaluación Psicopedagógica es una de las funciones más específicas de los servicios especializados, en colaboración con el profesorado.
La Orden de 14 de febrero de 1996 entiende: ”la evaluación psicopedagógica como el proceso de recogida, análisis y valoración de la información relevante sobre los distintos elementos que intervienen en el proceso de enseñanza aprendizaje para identificar las necesidades educativas de determinados alumnos que presentan o pueden presentar desajustes en su desarrollo personal y/o académico y para fundamentar y concretar las decisiones respecto a la propuesta curricular y al tipo de ayuda que aquellos puedan precisar para progresar en el desarrollo de las distintas capacidades”(6) .
Ello supone una visión no centrada en el individuo aislado, sino en este como integrante de un sistema, puesto que las necesidades del alumno serán distintas en función de su contexto escolar y sociofamiliar (por ejemplo: ámbito rural/urbano; familia con recursos socio-económicos y culturales/riesgo social; centro abierto a la diversidad del alumnado/centro no abierto a la diversidad del alumnado…).
Desde un enfoque sistémico, el proceso de evaluación debe recoger información del alumno y de su contexto familiar y escolar (Fig. 8).
Figura 8.
Alumno
Desarrollo personal
• Aspectos biológicos: recogida de información sobre incidencias en el embarazo/parto, desarrollo evolutivo temprano, enfermedades (etiología, momento de aparición, posible evolución…). Para justificar discapacidad sensorial, motora, TDAH y Trastorno Generalizado del Desarrollo (TGD), se solicita a la familia diagnóstico médico.
• Aspectos cognitivos: evaluación del desarrollo intelectual mediante pruebas psicométricas. Las más utilizadas son las Escalas McCarthy de Aptitudes y Psicomotricidad (para niños entre 2,5 y 8,5 años) y las Escalas de Inteligencia Wechsler: WPPSI (para niños de 2:6 a 7:7), WISC-IV (para niños 6-16 años). Para niños con dificultades en el lenguaje (discapacidad auditiva, TGD), se puede aplicar la Escala no Verbal de Wechsler (de 5 a 21 años).
• Aspectos comunicativo-lingüísticos: evaluación de la capacidad de comprensión y expresión oral y escrita. El lenguaje escrito, mediante las producciones escolares en situaciones espontáneas de comunicación y pruebas estandarizadas de aspectos fonológicos/fonéticos, sintácticos, semánticos y pragmáticos. Se utilizan pruebas como: Registro Fonológico Inducido, Test Illinois de Aptitudes Psicolingüísticas (3-10 años), Test de Vocabulario en Imágenes Peabody (2-90 años) o Test de Comprensión de Estructuras Gramaticales (4-11 años). El lenguaje escrito mediante las producciones escolares y pruebas como: Batería de evaluación de los Procesos Lectores PROLEC-R (6-12 años) o Batería de Evaluación de los Procesos de Escritura PROESC (8-15 años).
• Aspectos motrices: recogida de información a través de la observación, la aplicación de pruebas estandarizadas y del maestro/profesor de educación física sobre habilidades motrices generales (equilibrio, control postural, tono, marcha, coordinación…) y habilidades motrices específicas (motricidad fina, grafomotricidad…).
• Aspectos sociales: recogida de información mediante observación, recogida de información al equipo docente y aplicación de pruebas estandarizadas sobre habilidades sociales, razonamiento/juicio social y conducta asertiva. Se utilizan pruebas estandarizadas como: Sistema de Evaluación de la Conducta de Niños y Adolescentes BASC (3-18 años) y Test Autoevaluativo Multifactorial de Adaptación Infantil TAMAI (a partir de 8 años).
• Aspectos emocionales: recogida de información mediante la observación, recogida de información al equipo docente y aplicación de pruebas estandarizadas sobre autoconcepto, autoestima, equilibrio/labilidad emocional…
Historia escolar
Recogida de información sobre cuándo se ha escolarizado por primera vez, servicios de apoyo utilizados, áreas en las que presenta un mejor o peor rendimiento académico…
Nivel de competencia curricular
Recogida de información sobre el grado de adquisición de los objetivos propuestos en las distintas materias del curso.
Estilo de aprendizaje
Recogida de información sobre condiciones físico-ambientales más adecuadas, especialmente útil en discapacidad sensorial y motora (iluminación, sonido, elementos arquitectónicos, mobiliario adaptado), nivel de atención/concentración en los distintos momentos de la jornada escolar, agrupamiento en el que trabaja mejor, motivación…
El contexto escolar
Análisis de las características de la intervención educativa en el centro y en el aula.
El contexto familiar
Recogida de datos sobre el entorno (recursos de la vivienda y dependencias comunitarias, grupos sociales de referencia y roles) y datos sobre el alumno en su contexto socio–familiar (características básicas en el ámbito socio-económico-cultural, aficiones y preferencias en su tiempo de ocio, relaciones con los otros miembros de la familia, pautas educativas, grado de autonomía en casa y en el barrio, actitud y hábitos ante el estudio en casa, expectativas con respecto a la escuela y al hijo, relaciones familia-centro educativo).
En el caso de altas capacidades, además, se tienen en cuenta la creatividad y los posibles desequilibrios entre los distintos aspectos del desarrollo, especialmente cuando se prevea flexibilizar (pasar a un curso superior).
Las conclusiones derivadas de la información obtenida durante el proceso de evaluación psicopedagógica se recogen en un informe psicopedagógico. En él, se reflejan las decisiones básicas respecto a la propuesta curricular y los servicios personales y materiales necesarios para llevarlas a cabo.
La evaluación psicopedagógica se realiza de forma prescriptiva a los ACNEE, cuando finalizan cada etapa educativa (Educación Infantil 5 años y 6º de Educación Primaria) y previa a la incorporación a algunos programas específicos de Educación Secundaria.
Escolarización de los alumnos con necesidades educativas especiales (ACNEE)
Si tras la evaluación psicopedagógica se concluye que el alumno presenta NEE, el servicio especializado realiza un Dictamen de Escolarización en el que se informa a la Administración de la categoría de necesidad que presenta el alumno y se propone la modalidad de escolarización, el tipo de centro y los recursos que el alumno necesita.
La LOMCE considera que un alumno presenta NEE si requiere durante su escolarización, determinados apoyos y atenciones educativas específicas derivadas de discapacidad o trastornos graves de conducta (Tabla II).
Las categorías de necesidades educativas que se incluyen en el Dictamen de escolarización son (Tabla III):
• Retraso mental.
• Trastorno generalizado del desarrollo (TGD).
• Trastorno del desarrollo del lenguaje comprensivo y expresivo.
• Trastorno del comportamiento de las emociones de comienzo habitual en la infancia y en la adolescencia por TDAH o trastorno disocial.
• Pérdida o desviación significativa de la vista y funciones relacionadas.
• Pérdida o desviación significativa de las funciones auditivas y vestibulares.
• Pérdida o desviación significativa de las funciones neuromusculoesqueléticas y relacionadas con el movimiento.
• Plurideficiencias.
• Retraso madurativo en la etapa de Educación Infantil.
La modalidad educativa puede ser en (Fig. 9):
Figura 9.
• Centro ordinario con apoyos especializados.
• Centro de educación especial/Unidades de educación especial en zona rural, para alumnos con discapacidad que requerirán a lo largo de su escolarización, adaptaciones curriculares muy significativas en prácticamente todas las áreas del currículo, o la previsión de medios personales y materiales poco comunes en los centros ordinarios, y cuando se prevea además, que en estos centros su adaptación e integración social será reducida.
• Escolarización combinada: jornada escolar compartida entre centro ordinario con apoyo especializado y centro de educación especial.
Los centros pueden ser:
• Centro Ordinario con Atención Educativa de Apoyo, que es un centro educativo con recursos especializados, normalmente maestros de PT y AL.
• Centro Ordinario de Atención Preferente, que es un centro educativo con recursos especializados para cada tipo de discapacidad. Dentro de esta categoría, se incluyen los Centros de Atención Preferente de Discapacidad Auditiva (pueden contar con asesores sordos, intérpretes de signos), de Discapacidad Motora (cuentan con técnicos especialistas III para facilitar la movilidad, higiene y alimentación) y de TGD (cuentan con integrador social). Para escolarizar en centros preferentes, se utilizan criterios complementarios (Fig. 10).
Figura 10.
Los padres o tutores legales participan en el proceso de escolarización y su opinión es recogida antes de adoptar la Resolución de Escolarización. Para ello, el Dictamen de escolarización contempla un anexo con la opinión (favorable o desfavorable) de los mismos. Toda esta documentación es enviada al Servicio de Inspección Educativa para que emita el informe correspondiente.
Medidas específicas para el alumnado con necesidades específicas de apoyo educativo
Los alumnos con necesidades específicas de apoyo educativo se benefician de las medidas generales y ordinarias de atención a la diversidad, planificadas en su centro educativo. Sin embargo, el sistema educativo establece de manera adicional, otras medidas específicas cuando las generales y ordinarias no son suficientes. Estas son (Tabla IV):
• Adaptaciones curriculares, dirigidas a ACNEE, alumnos del programa de educación compensatoria/incorporación tardía al sistema educativo y alumnos con alta capacidad. Las adaptaciones pueden ser de acceso y propiamente curriculares.
- Las adaptaciones curriculares de acceso son: las modificaciones y/o la provisión de recursos personales (profesionales especializados), materiales (ayudas al desplazamiento, posturales, facilitadores del juego y ocio…), de comunicación (sistema aumentativo/alternativo de comunicación) y espaciales (ubicación del aula en lugar de fácil acceso, cuidado de iluminación y sonoridad…).
- Adaptaciones propiamente curriculares. Se pueden modificar todos los elementos del currículo: priorizar competencias, objetivos y contenidos (introducir objetivos y contenidos relacionados con la discapacidad, simplificar o amplificar, cambiar la temporalización, desglosar en objetivos más pequeños…) y evaluación (intercalar distintos tipos de exámenes (oral, escrito, tipo test, desarrollo…), aumentar tiempos, permitir descansos, graduar exigencias y cantidad de contenido…
• Permanencia un año más en la etapa.
- En Educación Infantil, los alumnos no pueden repetir, salvo los ACNEE, que pueden permanecer un año más.
- En Educación Primaria, los alumnos pueden repetir una vez en la etapa, los ACNEE dos.
- En Educación Secundaria Obligatoria (ESO), los alumnos pueden repetir dos veces, los ACNEE tres, si con ello hay posibilidades de obtener el Título de Graduado en ESO.
- En Bachillerato, los alumnos con discapacidad sensorial y motora pueden estar exentos de una parte de algunas materias (p. ej.: aspectos prácticos de Educación Física en una discapacidad motora, aspectos fonéticos de Lengua Extranjera en una discapacidad auditiva) o fraccionarlo con una permanencia máxima de seis años en régimen diurno, previa autorización del Servicio de Inspección.
• Programa de educación compensatoria: dirigido a minorías étnicas, desconocimiento del idioma o alumnos en riesgo social, con más de dos años de desfase curricular.
• Programas para alumnos con dificultades de aprendizaje o ACNEE en Educación Secundaria: Programas de Mejora del Aprendizaje y del Rendimiento Escolar (PMAR) y Formación Profesional Básica (FP Básica).
• Flexibilización, para los alumnos con altas capacidades. La flexibilización supone la incorporación del alumno en un curso superior al que le corresponde por edad. Se puede decidir un máximo de tres veces entre Educación Infantil, Primaria y Secundaria Obligatoria y una vez entre Bachillerato y FP de Grado Medio.
• Aulas hospitalarias: para niños hospitalizados que cursan Educación Primaria y ESO.
• Servicio de apoyo educativo domiciliario, para alumnos en Educación Primaria y ESO, con un periodo de convalecencia de más de 30 días. Para ello, se requiere informe médico.
• Centro Educativo Terapéutico, alumnos con trastorno de Salud Mental escolarizados en Educación Infantil y Primaria. Se accede solo tras ser derivados por Salud Mental.
Bibliografia
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Ley Orgánica 2/2006, de 3 de mayo, de Educación.
2.*** Ley Orgánica 9/2013, de 9 de diciembre, para la mejora de la calidad educativa.
3.*** Real Decreto 82/1996, de 26 de enero, por el que se aprueba el Reglamento Orgánico de las Escuelas de Educación Infantil y de los Colegios de Educación Primaria.
4.*** Real Decreto 83/1996, de 26 de enero, por el que se aprueba el Reglamento Orgánico de los Institutos de Educación Secundaria Obligatoria.
5.** Orden de 9 de diciembre de 1992, por la que se regula la estructura y funciones de los Equipos de Orientación Educativa y Psicopedagógica. Derogada por la Orden 849/2010, de 18 de marzo, pero de aplicación en distintas comunidades autónomas, en tanto no se publique normativa de desarrollo.
6.** Orden de 14 de febrero de 1996, por la que se regula el procedimiento para la realización de la evaluación psicopedagógica y el dictamen de escolarización y se establecen los criterios para la escolarización de los alumnos con necesidades educativas especiales. Derogada por la Orden 849/2010, de 18 de marzo, pero de aplicación en distintas comunidades autónomas, en tanto no se publique normativa de desarrollo.
| Caso clínico |
|
En uno de los centros en que interviene el orientador educativo, se encuentra escolarizada en Educación Infantil, una alumna de 5 años con necesidades educativas especiales asociadas a Retraso Madurativo. Dado que finaliza la etapa, se debe realizar evaluación psicopedagógica. Historia personal Según informa la madre, el embarazo se produjo con normalidad hasta que, a las 36 semanas de gestación, le indujeron el parto por vuelta de cordón. Presentó un desarrollo evolutivo temprano variable en las distintas áreas: adquirió adecuadamente los hitos motrices y las habilidades básicas de autonomía e higiene, pero manifestó dificultades significativas en el área del lenguaje. En concreto, inició la marcha a los 11 meses y emitió sus primeras palabras al año, pero su adquisición se estancó hasta los 3 años, momento en el cual la alumna empezó a desarrollar el lenguaje. No siguió órdenes sencillas hasta los 3 años. A los 30 meses, la madre acudió al médico pediatra por sospecha de Trastorno del Espectro Autista, pero el médico lo descartó. No ha padecido ninguna enfermedad importante. Actualmente el maestro tutor observa una evolución positiva, si bien, sigue presentando dificultades muy significativas en las áreas del lenguaje, socialización y atención. Principalmente, manifiesta dificultades en la comunicación y lenguaje, lo que incide en sus habilidades de interacción con iguales y adultos. Todo ello, hace que la alumna requiera un apoyo individualizado por parte del profesorado para llevar a cabo cualquier tarea dentro del aula y la mediación para establecer interacciones y juego con los iguales. En la actualidad, cuenta con seguimiento médico en el Hospital de la localidad. Desde el Servicio de Psiquiatría, se inició tratamiento farmacológico con Rubifen 5 mg en el desayuno, para posteriormente pasar a 7,5 mg. Sin embargo, al mes y medio dicho tratamiento se suspendió al aparecer conductas de labilidad emocional, lloros frecuentes sin motivos aparentes y cambios de humor. Tras la suspensión de la medicación, no se han vuelto a observar en la alumna dichas conductas. En la actualidad, no toma ningún tipo de medicación. Paralelamente, se le realizó audiometría tonal y verbal, tras la que se concluyó que la alumna presentaba un nivel de audición normal en ambos oídos en todas las frecuencias. Historia familiar Familia de origen rumano, compuesta por los padres y dos hijas, de las cuales, la alumna es la menor. La familia reside en España desde hace 10 años y hablan entre sí rumano, aunque presentan un buen dominio del castellano. Las relaciones entre los distintos miembros de la familia son cordiales y disfrutan de realizar actividades de ocio y tiempo libre juntos. Historia escolar • Alumna escolarizada en el centro desde Educación Infantil 3 años. • Niveles cursados: 1º, 2º y 3º del segundo ciclo de Educación Infantil. • Modalidad educativa: - Educación Infantil 3 años: modalidad educativa ordinaria. - Educación Infantil 4 y 5 años: modalidad educativa ordinaria con apoyos para los ACNEE. • Medidas adoptadas: apoyo especializado por parte de las maestras especialistas en pedagogía terapéutica y audición y lenguaje, así como adaptación curricular significativa. • Otros tratamientos o apoyos de carácter externos: desde septiembre de 2015 la alumna acude al Centro de Atención Temprana de la localidad. Intervenciones realizadas • Entrevistas a los padres. • Recogida de información y coordinación con el profesorado. • Análisis y estudio de informes escolares y médicos. • Análisis de trabajos escolares. • Observaciones sistemáticas de aula, durante la exploración y en momentos de ocio y tiempo libre (especialmente recreo). • Trabajo individual con la alumna. Aplicación de pruebas estandarizadas: Escala de Inteligencia Wechsler para Preescolar y Primaria (WPPSI), Escalas McCarthy de Aptitudes y Psicomotricidad, Test Illinois de Aptitudes Psicolingüísticas, Registro fonológico inducido, Test de Comprensión de Estructuras Gramaticales, Test de Vocabulario en Imágenes Peabody, Prueba Oral de Navarra (PLON-R) y Prueba de Lenguaje Comprensivo y Expresivo (ELCE). • Coordinación con los servicios médicos. • Coordinación con Centro de Atención Temprana. • Devolución de la información a la familia y al centro. • Realización de informe de evaluación psicopedagógica y tramitación del dictamen de escolarización para el cambio de etapa. Desarrollo general del alumno Aspectos cognitivos. En Escalas de Inteligencia Wechsler para Preescolar y Primaria (WPPSI), presenta una capacidad intelectual propia de una niña de su edad (CI 80). Dicho rendimiento es significativamente variable en las distintas escalas, lo que recomienda interpretar con cautela su CI, calcular el IGC (Índice General Cognitivo) y analizar cada una de las escalas por separado. Así, su rendimiento es mejor en la escala manipulativa (CI 112) y velocidad de procesamiento (CI 84). Sin embargo, su rendimiento es significativamente menor en la escala verbal (CI 56). Aspectos comunicativo-lingüísticos. En las pruebas psicopedagógicas aplicadas, se observan dificultades significativas en los distintos elementos en los que se estructura el lenguaje, especialmente en los aspectos sintácticos, semánticos y pragmáticos. En el Test Illinois de Aptitudes Psicolingüísticas, obtiene una edad de desarrollo equivalente a 3 años y 9 meses, siendo su edad cronológica de 6 años. Obtiene edades de desarrollo en torno a los 3 años de edad en comprensión auditiva, asociación auditiva, expresión motora, integración visual y gramatical, estando el canal auditivo vocal muy afectado. En la Prueba ELCE de Lenguaje Comprensivo y Expresivo, obtiene una edad de desarrollo equivalente a 3 años a nivel comprensivo y expresivo. En el Registro Fonológico Inducido, sustituye fonemas. A nivel sintáctico, en el Test de Comprensión de Estructuras Gramaticales se sitúa en un percentil 1. A nivel semántico, en el Test de Vocabulario en Imágenes Peabody, se sitúa en una edad equivalente a 4 años y 2 meses. A nivel pragmático, establece contacto ocular y usa espontáneamente la mirada en situaciones naturales. Sin embargo, el profesorado observa que, aunque presenta intención comunicativa, no utiliza adecuadamente habilidades comunicativas básicas con iguales y adultos. Aspectos motores. En las Escalas McCarthy de Aptitudes y Psicomotricidad, se observa un desarrollo acorde con su edad cronológica. El maestro tutor y el de educación física indican que tiene adquiridas todas las destrezas psicomotoras básicas propias de la edad. Sin embargo, presenta ciertas dificultades en la coordinación de movimientos. Manifiesta elevada inquietud motriz y dificultades significativas de atención. Aspectos socio-emocionales. El maestro tutor informa que la alumna acude contenta al colegio. Conoce y suele respetar las normas de funcionamiento básicas del centro y del aula. En el centro, se muestra inhibida en las actividades de grupo. Sus compañeros la tratan con cierta indiferencia y ella tiende a aislarse. Requiere de la mediación del adulto para iniciar y mantenerse en el juego o actividad. Conclusión de la evaluación psicopedagógica Tras evaluación psicopedagógica, se concluye que la alumna presenta necesidades educativas especiales asociadas a Trastorno en el Desarrollo del Lenguaje Comprensivo y Expresivo. Para atender a sus necesidades educativas, se recomienda que se apliquen medidas de atención a la diversidad ordinaria, que se beneficie del apoyo por parte de las maestras especialistas en pedagogía terapéutica y audición y lenguaje y que se realicen las oportunas adaptaciones curriculares.
|
| Temas de FC |
P. Armero Pedreira1, I. Pulido Valdeolivas2, D. Gómez Andrés2,3
1Pediatra. Hospital Centro de Cuidados Laguna. Fundación Vianorte-Laguna. 2Trastornos del Desarrollo y Maduración Neurológica. Departamento de Anatomía, Histología y Neurociencia. IdiPaz-UAM. 3Servicio de Pediatría. Hospital Universitario Infanta Sofía. San Sebastián de los Reyes. Madrid
| Resumen
La parálisis cerebral infantil es un síndrome heterogéneo caracterizado por una alteración del desarrollo motor y de la postura con un grado variable de comorbilidad. A pesar de su frecuencia e importancia en la población pediátrica, persisten una serie de ideas confusas sobre su etiología y su tratamiento. En este artículo, queremos aclarar esos mitos e incidir en la amplia batería de opciones terapéuticas que existen para cada uno de los problemas, neurológicos o no neurológicos, que pueden presentar estos pacientes con una enfermedad incurable, pero tratable y en la que la atención sanitaria de calidad puede cambiar la calidad de vida y el curso de la enfermedad |
| Abstract
The cerebral palsy is a heterogeneous syndrome characterized by an alteration of motor development and posture with a varying degree of comorbidity. Despite its frequency and importance at the level of the pediatric population, remain a series of confused ideas about the etiology and treatment. In this article we want to clarify the myths and influence of the extensive battery of therapeutic options for each of the neurological or non-neurological problems that can present these patients with incurable disease but treatable and in where health care quality can change the quality of life and the course of the disease |
Palabras clave: Parálisis Cerebral; Evaluación de la Discapacidad; Complicaciones
Key words: Cerebral palsy; Disability Evaluation; Complications
Pediatr Integral 2015; XIX (8): 548-555
La parálisis cerebral infantil más allá de los mitos
La PCI es un síndrome heterogéneo en manifestaciones, causas y grado de discapacidad, que es la primera fuente de discapacidad grave en la infancia.
La parálisis cerebral infantil (PCI) es un síndrome heterogéneo en causa y en manifestaciones, cuyo pronóstico es variable en función de cada paciente, y su tratamiento necesita ser adaptado a las necesidades y a las complicaciones. La PCI tiene una definición(1): “La parálisis cerebral infantil se corresponde con un grupo de trastornos del desarrollo del movimiento y de la postura, que producen limitaciones en la actividad y que son atribuibles a lesiones no progresivas que ocurrieron en el sistema nervioso en desarrollo del feto o del lactante. Los problemas motores se acompañan a menudo de problemas: en la sensibilidad, en la cognición, en la comunicación, en la percepción y/o en el comportamiento o por crisis epilépticas”. Aunque es una definición aceptada internacionalmente, su aplicación clínica puede ser complicada en algunos casos, ante la variabilidad de manifestaciones clínicas. Normalmente, la aplicación de esta definición se traduce clínicamente en un síndrome cuyo diagnóstico definitivo de PCI se sustenta en la demostración clínica de un trastorno motor que produce limitaciones en la actividad del sujeto y en la demostración de una lesión cerebral estable mediante historia clínica y/o pruebas de imagen (aunque esto solo está presente en un 80-90% de los pacientes con resonancia magnética nuclear). Por ello, no todo trastorno motor es una PCI. El diagnóstico de PCI se realiza habitualmente a partir de los 2 años (aunque la mayoría de los registros no incluyen el diagnóstico definitivo hasta los 4 años).
A pesar de ser la causa más común de discapacidad motora en la infancia (entre 1 y 2,5 casos por 1.000 nacimientos en Europa)(2), sobre la PCI siguen existiendo una serie de mitos que, unidos a áreas de incertidumbre, hacen que sea una enfermedad mal conocida por la población y por los profesionales sanitarios.
El primer mito es considerar a la PCI como una enfermedad homogénea. No lo es y por ello, se han intentado producir clasificaciones para ordenar su gran heterogeneidad. Se han ido utilizando distintos criterios como: localización anatómica de la lesión (corteza, tracto piramidal, sistema extrapiramidal o cerebelo), grado de tono muscular (hipotónica, con tono normal o hipertónica), sintomatología clínica principal, distribución topográfica de la afectación o el momento supuesto para la lesión que provoca el problema motor (prenatal, intraparto o postnatal)(3). Dos grandes cambios han ocurrido en cuanto a la clasificación en los últimos años. Primero, un grupo de centros europeos, el SCPE (Surveillance of Cerebral Palsy in Europe) diseñó una clasificación que combinaba la semiología clínica principal del trastorno del movimiento con la distribución topográfica de la lesión y, poco a poco, esta clasificación se ha ido consolidando en los últimos años(4). En la figura 1, se muestra la clasificación propuesta por el SCPE con una pequeña modificación que incorpora un subgrupo clínicamente relevante que tradicionalmente se ha denominado “diplejía espástica”(5).
Figura 1. Clasificación SCPE (Surveillance of Cerebral Palsy in Europe) de la distribución y tipos de afectación motora en la PCI (parálisis cerebral infantil). MMSS: miembros superiores.
El segundo gran cambio ha sido la introducción de clasificaciones funcionales que informan sobre el grado de dependencia(6-8) y que, además, sirven para predecir el tipo de complicaciones que presentará cada tipo de paciente (Tabla I).
Estos dos cambios son tan importantes que han cambiado nuestra forma de describir la enfermedad. Hoy, ya no es tolerable diagnosticar a un paciente simplemente de PCI, sino que conviene incorporar sus datos clasificatorios, ya que son estos los que van a determinar su curso clínico y la presencia de complicaciones. Así, por ejemplo, un diagnóstico de “Tetraparesia espástica” es hoy incompleto y se sustituye por “PCI bilateral espástica (tetraparesia espástica). GMFCS (Gross Motor Function Classification System) IV. MACS (Manual Ability Classification System) III. CFCS (Communication Function Classification System) I”.
Sobre las causas de la PCI, también existen bastantes concepciones erróneas. Existen múltiples causas que, con mayor o menor frecuencia, provocan lesiones en el cerebro en desarrollo que son capaces de producir alteraciones en el desarrollo motor del paciente. Podemos clasificar a esa pléyade de causas en función del momento y del tipo de paciente en el que ocurre la lesión (Tabla II).
Entre los mecanismos lesionales, hay que destacar a la encefalopatía hipóxico-isquémica (EHI) y a la leucomalacia periventricular (LMPV). La EHI produce PCI tipo diplejía espástica en prematuros extremos y tetraparesias espásticas o espástico-distónica asociadas a retraso mental en pacientes con más de 34 semanas de gestación(9). Para atribuirla como causa definitiva de una PCI, se utilizan unos criterios causales relativamente estrictos (pH en arteria umbilical < 7, encefalopatía neonatal moderada o grave, PCI espástica o discinética y ausencia de otras causas)(10). Por consideraciones médico-legales y por los efectos psicológicos para la familia, conviene ser claro y estricto en la aplicación de estos criterios. Considerar a la EHI como una causa frecuente es otro mito a desterrar; ya que, en nuestro medio, supone menos del 15% de los casos según los estudios epidemiológicos(3). En contraste, la LPMV (quística o no quística) es la causa más frecuente de PCI en los pacientes nacidos prematuramente. El cerebro del recién nacido pretérmino tiene una especial vulnerabilidad, que se manifiesta en las alteraciones de la mielinización y lesiones axonales focales que aparecen en la LMPV. En muchos pacientes, sobre los mecanismos que provocan la LMPV se añade (es decir, no es la causa principal) la hemorragia de matriz germinal, que suma un daño añadido a las proyecciones corticoespinales cercanas(9).
Tradicionalmente, hemos visto a la PCI como un síndrome unido a gran discapacidad y sin duda, la PCI es una fuente de discapacidad muy importante en la edad pediátrica afectando a los cinco dominios del modelo de la “International Classification of Functioning, Disabibity and Health” (ICF): estructura corporal y función, limitación de actividad, participación, factores personales y ambiente(11). Sin embargo, al contrario de la imagen clásica que los médicos tenemos de la PCI, la discapacidad es muy variable en función de cada sujeto. Aunque todo paciente con PCI sea un paciente crónico, tenemos que ser conscientes de las importantes variabilidades en complejidad que tienen los pacientes. En torno a un 60% de los pacientes con PCI andan sin ayuda y solo un 25-30% de los pacientes no tienen capacidad de marcha(12). El pronóstico está muy relacionado con el tipo SCPE: solo un 3% de los PCI espásticas unilaterales no andan frente a un 60% de las formas discinéticas. Tradicionalmente, hemos prestado mucha atención a la discapacidad y nos hemos olvidado de otros áreas que son también muy importantes para comprender el impacto de la enfermedad en los pacientes y en sus familias. Por ejemplo, el dolor es muy frecuente y sigue infra-diagnosticado en los pacientes con PCI. También, sería importante integrar en el manejo habitual las importantes repercusiones psicosociales que produce la PCI como enfermedad. Desde el punto de vista del paciente, un cuarto de ellos presenta síntomas psicológicos relacionados con la enfermedad. Los cuidadores, generalmente los padres, presentan mayores niveles de estrés y problemas emocionales para enfrentarse a la enfermedad de su hijo, unidos a las dificultades derivadas de los problemas provocados por la red asistencial y de atención social. A nivel educativo, la inclusión de estos pacientes sigue siendo complicada y alterada por los problemas motores y los problemas cognitivos asociados. Socialmente, la PCI produce un considerable aumento del gasto sanitario y una pérdida de productividad extensible al enfermo y a su medio familiar(13). Otro punto sorprendente, es lo poco estudiados e integrados en la práctica clínica que están conceptos, como: la calidad de vida y sus determinantes (por ejemplo, a la larga, en el caso de los pacientes adultos, la capacidad motora donde se invierten enormes esfuerzos familiares y sanitarios, es menos importante para determinar calidad de vida que las habilidades intelectuales, donde los esfuerzos son menos intensos); por ejemplo, aunque tenemos claro que la calidad de vida relacionada con la salud es menor que la de la población general, la percepción de calidad de vida global es similar en muchos estudios, demostrando elementos de resiliencia y adaptación a la enfermedad crónica que quedan por estudiar(14).
A pesar del desconocimiento y del enorme impacto en la salud, en la vida de las familias y en la sociedad de esta enfermedad, la PCI no es una enfermedad intratable. Contrariamente a la percepción generalizada, la PCI tiene tratamientos eficaces que, aunque no son curativos, son eficaces a la hora de evitar complicaciones y mejorar los síntomas de estos pacientes. Transmitir una idea contraria desanima a las familias y puede que esté detrás de la emergencia de terapias “milagro”, cuya eficacia y seguridad son dudosas al carecer del respaldo de pruebas científicas(15). En una enfermedad crónica como la PCI, donde existen problemas a nivel motor, cognitivo, nutricional, etc., es muy importante integrar los tratamientos en un plan terapéutico adaptado a las necesidades, donde es vital la evaluación y el tratamiento multidisciplinar del paciente. Pensamos que el pediatra de Atención Primaria de estos niños juega un papel importante en el equipo como supervisor general de la salud del niño y, muchas veces, como consejero de las familias.
La atención neurológica y neurorrehabilitadora del paciente con PCI
Las complicaciones neurológicas (epilepsia, alteraciones conductuales y cognitivas y problemas de sueño), la espasticidad y las complicaciones musculoesqueléticas requieren de un equipo multidisciplinar.
El tratamiento adecuado de los pacientes con PCI depende de equipos multidisciplinares que atiendan los problemas neurológicos, los problemas generales (v. siguiente punto) y las consecuencias musculoesqueléticas que aparecen en esta enfermedad.
El tratamiento fisioterapéutico de la PCI es un territorio lleno de mitos y concepciones dogmáticas. En este sentido, recientemente se están realizando estudios que están contribuyendo a clarificar qué medidas son eficaces y en qué grupos de pacientes. También está cambiando nuestra concepción a la hora de abordar el problema y el tratamiento se personaliza en función de aquellos objetivos que se quieren alcanzar. En general, el objetivo de las terapias físicas es mejorar las habilidades motoras y el autocuidado, aunque varían en los métodos y en los aspectos concretos que buscan mejorar. Una revisión reciente aporta una visión basada en pruebas sobre las distintas terapias y señala que las terapias que tienen un nivel de evidencia suficiente para recomendarse activamente son: los programas domiciliarios, el entrenamiento bimanual, la terapia de inducción del movimiento por constricción y las terapias ocupacionales basadas en el contexto y/o en los objetivos. También, el entrenamiento físico ha demostrado mejorar la capacidad aeróbica y puede tener su aplicación en pacientes con fatigabilidad. Existen otras terapias, algunas con amplia imposición, cuya eficacia es bastante dudosa en función de los resultados de los estudios clínicos(16).
El manejo de la espasticidad se basa en medidas farmacológicas. Cuando el objetivo terapéutico es mejorar la espasticidad de grupos musculares concretos, el tratamiento eficaz es la toxina botulínica. En el caso de que la espasticidad sea generalizada, se utilizan fármacos orales (el diazepam es el que mayor eficacia ha demostrado según estudios, aunque se pueden utilizar otros como el baclofeno o la tizanidina) y, en casos seleccionados, la infusión intratecal continua de baclofeno. Una opción cuyo nivel de evidencia es bueno, pero cuyo uso es aún infrecuente en nuestro medio, es la rizotomía dorsal selectiva(17).
El trastorno del movimiento en la PCI induce unas complicaciones secundarias en el aparato locomotor: el músculo sufre contracturas, los huesos, deformidades (corregibles solo con cirugías), las articulaciones, subluxaciones (especialmente importante es la cadera) y la columna, escoliosis. Todas estas complicaciones tienen un grado de manejo más o menos complejo. En el manejo de contracturas, se opta habitualmente por utilizar ortesis, pero la medida más eficaz, aunque asociada a efectos adversos y a reticencias del paciente, es la inmovilización con yesos(3). La subluxación de cadera es un problema cuyo control es particularmente importante en la PCI, ya que es prevenible con un control clínico-radiológico ajustado para cada paciente, el tratamiento posicional (mantener el máximo tiempo las caderas en separación) y el manejo de la espasticidad local con toxina botulínica. En casos extremos, hay que recurrir a cirugías invasivas(18). Otra complicación frecuente y grave en los pacientes con GMFCS IV-V es el desarrollo de escoliosis. La escoliosis tiene graves consecuencias en la interacción con el medio y la alimentación y facilita la aspiración y la aparición de dolor. Existen medidas para prevenir la progresión de la escoliosis: los corsés y la correcta sedestación, en ocasiones con ayudas técnicas. En aquellas ocasiones donde la escoliosis produce síntomas y las medidas no quirúrgicas no evitan la progresión, hay que recurrir a complejas cirugías de columna(19).
Al relacionarse la PCI con una lesión en el sistema nervioso central, es habitual que muchos pacientes con PCI presenten crisis epilépticas. El diagnóstico y tratamiento es similar al resto de los pacientes con estas patologías(3).
Muchos de los niños con PCI, pero no todos, asocian alteraciones cognitivas, cuya intensidad y forma es variable en función de la lesión. Muchos cumplen criterios diagnósticos de TDAH y algunos, de autismo. El diagnóstico y el tratamiento es similar al resto de pacientes con estas patologías(3).
Los pacientes con PCI tienen también, con más frecuencia que la población general, problemas de sueño. Los problemas de sueño se relacionan con la gravedad y existencia de epilepsia y con la distribución y el tipo de afectación motora. El problema más frecuente es el síndrome de apneas-hipopneas obstructivas del sueño (en torno a un 15%); pero, además, existe una mayor frecuencia de insomnio y de trastornos del arousal. Clínicamente, suelen estar asintomáticos o reflejarse en una hipersomnia diurna. El tratamiento de los problemas de sueño en la PCI es habitualmente complejo y se basa en el abordaje general del problema concreto, en descartar un papel de actividad epiléptica o de problemas motores en el trastorno (p. ej.: dolor por espasticidad) y en normas conductuales(20).
La atención general del paciente con PCI
Los pacientes con PCI pueden presentar complicaciones en muchos sistemas y se relacionan con el GMFCS.
Las comorbilidades no neurológicas del paciente con PCI son frecuentes e importantes. Tanto su frecuencia como su gravedad suele relacionarse con el grado de discapacidad motora (fácilmente medible con el GMFCS). El grado de interés sobre estos problemas ha sido tradicionalmente bajo. Los pacientes con PCI de GMFCS I-III deberían ser atendidos coordinadamente entre el neuropediatra, el rehabilitador y el pediatra de Atención Primaria. En cambio, la asistencia de los pacientes más complejos debe integrar a estos especialistas y otros, probablemente en un marco más formal que el actual, dirigidos por una figura de coordinador asistencial que asegure la evaluación completa y multidisciplinar del paciente. En todo paciente con PCI, el papel del pediatra general del niño como supervisor del proceso y como consultor más accesible obliga a este a conocer y buscar activamente estos problemas y a orientarlos diligentemente.
El principal área no neurológico de atención en el paciente con PCI es el crecimiento y la nutrición, áreas que son indudablemente esenciales en cualquier niño con o sin PCI. Debemos considerar a todo paciente con PCI como un paciente de alto riesgo de desnutrición, fallo de medro y de obesidad. Por lo tanto, es muy importante realizar controles de peso y talla frecuentes, aunque en niños con gran discapacidad motora y/o contracturas puede ser particularmente complicado. En esos casos, pesar al niño con un padre o pesos especiales que permitan el peso con la silla de ruedas, pueden ser la solución para el peso y en el caso de la talla, se puede realizar una estimación relativamente válida de la talla a través de la longitud tibial (que es válida en niños de 2-12 años, se mide en la cara medial desde la línea interarticular de la rodilla al maléolo medial y cuya relación con la talla sigue la siguiente fórmula: Talla = 30,8 + 3,26 x LT, siendo LT la longitud tibial en cm) y de la altura de la rodilla (válida a todas las edades, pero medible con calibres especiales). La interpretación de los valores antropométricos difiere en los pacientes con PCI: se necesitan referencias especiales para cada nivel de GMFCS y los puntos de corte para considerar riesgo nutricional son distintos (así, hablamos de riesgo nutricional para un percentil menor a 20 de peso para la edad) y precisan aún una intensa investigación para obtener su máximo rendimiento. La información antropométrica puede complementarse con la medición del pliegue tricipital (se utiliza como estimador de los depósitos grasos y hablamos de un riesgo nutricional para un valor menor al p10 de la población general y consideramos un valor deseable a un p10-p25, porque su medición tiende a infraestimar los depósitos grasos en PCI) y la circunferencia del brazo (se utiliza como estimador conjunto de los depósitos musculares y grasos y es interesante por su alta reproducibilidad).
La desnutrición es común en los niños con PCI, pero es una situación evitable y corregible. La principal causa de desnutrición es el consumo inadecuado para su edad. No es un problema de mayores necesidades energéticas: los requerimientos proteicos y de micronutrientes son parecidos a la población general y los requerimientos energéticos parecen similares en el caso de pacientes ambulantes y menores en el caso de pacientes no ambulantes. El consumo inadecuado responde: a problemas de control motor que dificultan la masticación y la deglución, a déficit sensoriales sobre el sabor y textura de los alimentos, a fatigabilidad con la ingesta, a dependencia de otra persona para alimentarse, a presencia de reflujo gastroesofágico y estreñimiento, a alteraciones en el hambre y en la saciedad por la lesión neurológica y a problemas del niño para comunicar sus necesidades alimentarias. La desnutrición en el paciente con PCI lo hace vulnerable a infecciones respiratorias y hace más difícil y menos probable su curación, complica los procedimientos quirúrgicos, afecta al neurodesarrollo como lesión sobreañadida, empeora la calidad de vida relacionada con la salud y aumenta la mortalidad. En todo paciente con PCI, debería realizarse una breve encuesta sobre el tipo de ingesta (qué come, quién le da de comer, cuándo come, cuánto duran las comidas, dónde come y cómo come, es decir, si utiliza algún tipo de asistencia). Aunque las familias tienden a sobre-estimar la cantidad ingerida, esta mínima encuesta nos sirve para detectar aquellos casos en los que la ingesta es claramente inadecuada y aquellos pacientes con imposibilidad de ingesta adecuada (no mastican, tragan mal, etc.) que se benefician de una rehabilitación nutricional para mejorar la ingesta o que son candidatos a gastrostomía. También detecta problemas en el posicionamiento del paciente para comer.
También muy relacionados con la nutrición y el crecimiento, están los problemas de metabolismo óseo. Los pacientes con PCI con formas graves tienen menor densidad ósea, en especial en los casos de mayor inmovilidad (medible por el GMFCS), en aquellos con datos de desnutrición, en los que tienen una ingesta baja de calcio, en los que presentan niveles de vitamina D bajos y en los que necesitan tratamiento antiepiléptico. Esta pérdida de densidad ósea se traduce en fracturas ante mínimos traumatismos(21). El manejo de este problema tiene áreas de incertidumbre, pero actualmente, se recomienda una actitud preventiva consistente en asegurar la ingesta de calcio y vitamina D recomendadas para su edad en una dieta normal (si es imposible, considerar suplementos), considerar en los casos de riesgo un suplemento de vitamina D y estudiar el metabolismo fosfocálcico mediante la determinación de 25-hidroxi-vitamina D (objetivo: 70-100 nM) y el ratio de calcio/osmolaridad en orina de primera micción (objetivo: < 0,25) en los pacientes de riesgo. El papel de la terapia física en la prevención de la pérdida de densidad ósea está pendiente de mejores estudios. En aquellos con una fractura, debe considerar consultar a un experto para valorar un estudio más amplio, suplementos de calcio y vitamina D y tratamiento con bifosfonatos(22).
A nivel digestivo, los pacientes con PCI muestran con mayor frecuencia que la población general problemas relacionados con dismotilidad. Así, hasta en un 75% de los casos, presentan reflujo gastroesofágico y un porcentaje considerable desarrolla una enfermedad por reflujo gastroesofágico (con vómitos o esofagitis como síntomas) y asocian complicaciones importantes relacionadas con este reflujo (rechazo de ingesta, disfagia, aspiración y erosiones dentales). El tratamiento inicial son las medidas conservadoras, como espesamiento de las comidas y corrección de las posiciones después de las comidas. Los tratamientos farmacológicos, como ranitidina o inhibidores de la bomba de protones, se reservan para los casos resistentes o con complicaciones asociadas y se deberían utilizar idealmente de forma transitoria. El tratamiento quirúrgico se reserva en aquellos casos muy resistentes y que suelen necesitar gastrostomía para facilitar la alimentación(23). También, es frecuente la presencia de estreñimiento, especialmente en los pacientes con GMFCS IV-V. Este es un problema muy importante y se relaciona con complicaciones como: el dolor, los efectos secundarios de los tratamientos, la espasticidad, problemas de alimentación o la irritabilidad. El manejo de estos síntomas requiere generalmente un tratamiento con laxantes y vigilar los síntomas hasta alcanzar una dosis eficaz sin incontinencia(24).
Otro problema frecuente, sobre todo en los casos más graves, es la sialorrea, fruto del mal manejo de secreciones. Las consecuencias de la sialorrea son graves: rechazo social, dificultades de cuidado al tener que cambiar continuamente la ropa, infecciones y lesiones orales y periorales, dificultades para la expresión oral y neumonías aspirativas. El manejo de la sialorrea, aunque sigue sin estar claro, se basa actualmente en la inyección de toxina botulínica en las glándulas salivares y en el uso de glicopirrolato(25).
Los pacientes con PCI tienen una alta frecuencia de complicaciones respiratorias y son la primera causa de mortalidad(26). En la figura 2, se incluye un esquema de los mecanismos detrás de las complicaciones respiratorias más frecuentes en la PCI que se hacen más frecuentes con la edad.
Figura 2. Mecanismos involucrados en las complicaciones respiratorias de la parálisis cerebral infantil.
Existen estrategias preventivas muy importantes en aquellos pacientes con GMFCS > III: vacunación completa para neumococo y anual para gripe (es importante considerar a los pacientes con PCI como grupo de alto riesgo de vacunación inadecuada(27)), azitromicina profiláctica en los casos que asocian bronquiectasias o displasia broncopulmonar(28), fisioterapia respiratoria y el control de las complicaciones relacionadas causalmente. Las complicaciones respiratorias producen lesiones residuales que a su vez favorecen la aparición de nuevas complicaciones. Por ello, el tratamiento precoz y la prevención de las complicaciones respiratorias es esencial.
La piel del paciente con PCI es otro órgano al que hay que prestar atención. Muchos de estos pacientes pueden tener úlceras de presión (que pueden desencadenar complicaciones muy graves) o fricción por sus ortesis, que son prevenibles con una educación adecuada al paciente y/o sus padres, explicándoles que una ortesis debe ser ajustada si tras retirarla permanecen áreas enrojecidas durante más de 15-20 minutos. También pueden aparecer áreas de hiperqueratosis por actividades repetidas en rehabilitación o dermatitis del pañal en los pacientes incontinentes(29).
Las alteraciones visuales y auditivas son una comorbilidad muy frecuente en los pacientes con PCI. En el caso de los problemas visuales, hasta un 40% de los pacientes pueden tener un problema visual y todos estos pacientes deben tener una evaluación oftalmológica inicial y revisiones frecuentes. Las alteraciones auditivas también son frecuentes (30-40%), en especial en el caso de las PCI discinéticas. En caso de cualquier duda sobre la capacidad auditiva de un paciente con PCI, debe realizarse una evaluación auditiva reglada.
A nivel urológico, un tercio de los pacientes muestran síntomas de vaciado vesical (incontinencia, urgencia, poliaquiuria, dificultad para iniciar la micción, retención urinaria o infecciones del tracto urinario) por problemas motores del detrusor y de los esfínteres vesicales. La evaluación se basa en el interrogatorio sobre los síntomas, y el tratamiento depende de medidas conductales (establecimiento de rutinas y tiempo para realizar la micción), de adaptaciones en el baño o de sondajes intermitentes. En muchos casos, conseguir la continencia urinaria es complicado(23,29).
A nivel ginecológico y de salud reproductiva, algunos pacientes tienen problemas relacionados con los cambios derivados de la pubertad, que ocurre en la misma edad cronológica que el resto de los niños. A pesar de las reticencias de los padres, existe una necesidad de discutir con estos pacientes temas relacionados con la sexualidad de forma adaptada a su edad mental, para evitar el abuso sexual (más frecuente que en la población general) y los embarazos no deseados (en niñas, también se pueden valorar tratamientos anticonceptivos)(23,29).
En último lugar pero no por ello menos importante, está el dolor, que es frecuente y de origen multifactorial. Es un síntoma difícil de valorar por los profesionales y los familiares. Aunque el manejo pueda ser complicado, la principal dificultad aparece en la adecuada valoración de este síntoma que evita el acceso del paciente a cualquier tratamiento analgésico. Esto obliga a buscar sistemáticamente la existencia y los desencandenantes del dolor(3). Además, en ocasiones, el dolor aparece como consecuencia de actuaciones terapéuticas que se siguen realizando en estos pacientes a pesar de existir claras pruebas de su ineficacia.
A nivel psicosocial, los pacientes y sus familiares pueden suponer un reto para los profesionales en Atención Primaria. Los niños con PCI presentan síntomas relacionados con la depresión y la ansiedad ya en etapas preescolares, sobre los que hay que intervenir, en ocasiones, para evitar que su intensidad aumente en la adolescencia y en la época adulta. En paralelo, los cuidadores y los hermanos sufren también importantes consecuencias emocionales y a nivel laboral y económico.
Conclusión
La atención al paciente con PCI se basa en la comprensión, de que nos enfrentamos a una enfermedad con manifestaciones diversas, por lo que nuestros pacientes requieren planes individualizados en el tratamiento. También, es importante comprender que es una enfermedad compleja y, por lo tanto, una atención adecuada debe ser interdisciplinar y coordinada. Nos enfrentamos a una enfermedad incurable, pero tratable, y esa incurabilidad no debe ser obstáculo ni desánimo para esforzarnos en conseguir una atención médica, psicológica y social de excelencia, que permita mejorar las vidas de estos pacientes y sus familias.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. Bax M, Goldstein M, Rosenbaum P, Leviton A, Paneth N, Dan B, et al. Proposed definition and classification of cerebral palsy, April 2005. Developmental medicine and child neurology. 2005; 47: 571-6.
2. Himmelmann K. Epidemiology of cerebral palsy. Handbook of clinical neurology. 2013; 111: 163-7.
3.*** Colver A, Fairhurst C, Pharoah PO. Cerebral palsy. Lancet. 2014; 383:1240-9.
4. Surveillance of Cerebral Palsy in E. Surveillance of cerebral palsy in Europe: a collaboration of cerebral palsy surveys and registers. Surveillance of Cerebral Palsy in Europe (SCPE). Developmental medicine and child neurology. 2000; 42: 816-24.
5. Ferrari A, Alboresi S, Muzzini S, Pascale R, Perazza S, Cioni G. The term diplegia should be enhanced. Part I: a new rehabilitation oriented classification of cerebral palsy. European journal of physical and rehabilitation medicine. 2008; 44: 195-201.
6. Reid SM, Carlin JB, Reddihough DS. Using the Gross Motor Function Classification System to describe patterns of motor severity in cerebral palsy. Developmental medicine and child neurology. 2011; 53: 1007-12.
7. Eliasson AC, Krumlinde-Sundholm L, Rosblad B, Beckung E, Arner M, Ohrvall AM, et al. The Manual Ability Classification System (MACS) for children with cerebral palsy: scale development and evidence of validity and reliability. Developmental medicine and child neurology. 2006; 48: 549-54.
8. Hidecker MJ, Paneth N, Rosenbaum PL, Kent RD, Lillie J, Eulenberg JB, et al. Developing and validating the Communication Function Classification System for individuals with cerebral palsy. Developmental medicine and child neurology. 2011; 53: 704-10.
9. Marret S, Vanhulle C, Laquerriere A. Pathophysiology of cerebral palsy. Handbook of clinical neurology. 2013; 111: 169-76.
10. Strijbis EM, Oudman I, van Essen P, MacLennan AH. Cerebral palsy and the application of the international criteria for acute intrapartum hypoxia. Obstetrics and gynecology. 2006; 107: 1357-65.
11. Michelsen SI, Flachs EM, Uldall P, Eriksen EL, McManus V, Parkes J, et al. Frequency of participation of 8-12-year-old children with cerebral palsy: a multi-centre cross-sectional European study. European journal of paediatric neurology: EJPN: official journal of the European Paediatric Neurology Society. 2009; 13: 165-77.
12. Himmelmann K, Beckung E, Hagberg G, Uvebrant P. Gross and fine motor function and accompanying impairments in cerebral palsy. Developmental medicine and child neurology. 2006; 48: 417-23.
13. Uldall P. Everyday life and social consequences of cerebral palsy. Handbook of clinical neurology. 2013; 111: 203-7.
14. Vargus-Adams J. Health-related quality of life in childhood cerebral palsy. Archives of physical medicine and rehabilitation. 2005; 86: 940-5.
15. Gómez-Andrés D, Pulido-Valdeolivas I, Martín-Gonzalo JA, López-López J, Martínez-Caballero I, Gómez-Barrena E, et al. [External evaluation of gait and functional changes after a single-session multiple myofibrotenotomy in school-aged children with spastic diplegia]. Revista de neurologia. 2014; 58: 247-54.
16.*** Novak I, McIntyre S, Morgan C, Campbell L, Dark L, Morton N, et al. A systematic review of interventions for children with cerebral palsy: state of the evidence. Developmental medicine and child neurology. 2013; 55: 885-910.
17. Quality Standards Subcommittee of the American Academy of N, the Practice Committee of the Child Neurology S, Delgado MR, Hirtz D, Aisen M, Ashwal S, et al. Practice parameter: pharmacologic treatment of spasticity in children and adolescents with cerebral palsy (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society. Neurology. 2010; 74: 336-43.
18. Robb JE, Hagglund G. Hip surveillance and management of the displaced hip in cerebral palsy. Journal of children’s orthopaedics. 2013; 7: 407-13.
19. Koop SE. Scoliosis in cerebral palsy. Developmental medicine and child neurology. 2009; 51 (Suppl 4): 92-8.
20. Simard-Tremblay E, Constantin E, Gruber R, Brouillette RT, Shevell M. Sleep in children with cerebral palsy: a review. Journal of child neurology. 2011; 26: 1303-10.
21. Mergler S, Evenhuis HM, Boot AM, De Man SA, Bindels-De Heus KG, Huijbers WA, et al. Epidemiology of low bone mineral density and fractures in children with severe cerebral palsy: a systematic review. Developmental medicine and child neurology. 2009; 51: 773-8.
22. Fehlings D, Switzer L, Agarwal P, Wong C, Sochett E, Stevenson R, et al. Informing evidence-based clinical practice guidelines for children with cerebral palsy at risk of osteoporosis: a systematic review. Developmental medicine and child neurology. 2012; 54: 106-16.
23.*** Pruitt DW, Tsai T. Common medical comorbidities associated with cerebral palsy. Physical medicine and rehabilitation clinics of North America. 2009; 20: 453-67.
24. Veugelers R, Benninga MA, Calis EA, Willemsen SP, Evenhuis H, Tibboel D, et al. Prevalence and clinical presentation of constipation in children with severe generalized cerebral palsy. Developmental medicine and child neurology. 2010; 52: e216-21.
25. Walshe M, Smith M, Pennington L. Interventions for drooling in children with cerebral palsy. The Cochrane database of systematic reviews. 2012; 11: CD008624.
26. Reid SM, Carlin JB, Reddihough DS. Survival of individuals with cerebral palsy born in Victoria, Australia, between 1970 and 2004. Developmental medicine and child neurology. 2012; 54: 353-60.
27. Greenwood VJ, Crawford NW, Walstab JE, Reddihough DS. Immunisation coverage in children with cerebral palsy compared with the general population. Journal of paediatrics and child health. 2013; 49: E137-41.
28. Kirk CB. Is the frequency of recurrent chest infections, in children with chronic neurological problems, reduced by prophylactic azithromycin? Archives of disease in childhood. 2008; 93: 442-4.
29.*** Jones MW, Morgan E, Shelton JE. Primary care of the child with cerebral palsy: a review of systems (part II). Journal of pediatric health care: official publication of National Association of Pediatric Nurse Associates & Practitioners. 2007; 21: 226-37.
Bibliografía recomendada
– Colver A, Fairhurst C, Pharoah PO. Cerebral palsy. Lancet. 2014; 383(9924): 1240-9.
Revisión general sobre PCI que se centra en los problemas neurológicos de estos pacientes.
– Novak I, McIntyre S, Morgan C, Campbell L, Dark L, Morton N, et al. A systematic review of interventions for children with cerebral palsy: state of the evidence. Developmental medicine and child neurology. 2013; 55: 885-910.
Revisión sistemática que analiza los estudios disponibles para fundamentar las diversas terapias empleables en el tratamiento de los problemas motores y neurológicos de los pacientes con PCI.
– Pruitt DW, Tsai T. Common medical comorbidities associated with cerebral palsy. Physical medicine and rehabilitation clinics of North America. 2009; 20: 453-67.
Buena revisión sobre las complicaciones médicas no neurológicas de los pacientes con PCI.
– Jones MW, Morgan E, Shelton JE. Primary care of the child with cerebral palsy: a review of systems (part II). Journal of pediatric health care: official publication of National Association of Pediatric Nurse Associates & Practitioners. 2007; 21: 226-37.
Otro excelente resumen sobre las complicaciones médicas no neurológicas de los pacientes con PCI.
| Caso clínico |
|
Enfermedad actual: varón de 6 años de edad que acude a su Centro de Salud por primera vez, procedente de otra comunidad autónoma, con el diagnóstico de diparesia espástica por encefalopatía hipóxico-isquémica. Acuden a consulta porque no come. La madre refiere que tiene “rachas” así y que normalmente se le pasan solas. Antecedentes personales: embarazo de curso normal y controlado adecuadamente. Cesárea urgente por desprendimiento de placenta normalmente inserta. Edad gestacional: 38 semanas. Peso al nacimiento: 2.530 g. pH de arteria umbilical 6,8. Apgar: 3/5/7. Ingresa en Neonatología con los diagnósticos al alta de recién nacido a término de peso adecuado para edad gestacional y encefalopatía hipóxico-isquémica moderada con mínima alteración de ganglios de la base en RMN craneal tratada con hipotermia craneal. Seguimientos previos únicamente por Neurología Pediátrica (EEG normal, retraso del lenguaje y ligera torpeza para la marcha y la manipulación). No recibe tratamiento farmacológico habitual. Escolarizado, previamente, en un colegio de integración motora con adaptación curricular y fisioterapia. Antecedentes familiares: tercer hijo de padres no consanguíneos. Madre sana de 45 años. G-A-V: 3-0-3. Abogada, pero no trabaja actualmente, porque no puede por sus hijos. Padre sano de 46 años. Abogado que trabaja en una internacional y que ha sido trasladado actualmente. Hermana de 14 años y hermano de 12 años sanos. Exploración general: peso 17 kg (p9-1,4 DS). Talla: 120 cm (p71, 0,58 DS). Sin alteraciones relevantes. Exploración neurológica: vital. Reactivo. Interacción adecuada. Lenguaje oral de contenido normal y fácilmente compresible. Impresiona de inteligencia normal o normal-baja. No signos meníngeos. A nivel motor: presenta una espasticidad de tríceps sural y problemas para la manipulación fina, con limitación para la supinación del antebrazo. Funcionalmente, anda solo pero le cuesta correr. Es capaz de dibujar, pero tiene problemas para realizar trazos finos. Aparentemente, no hay déficits sensitivos y los pares craneales son normales.
|
 |
| Temas de FC |
P.J. Rodríguez Hernández*, I. González González**, A. Manuel Gutiérrez Sola***
*Pediatra Acreditado en Psiquiatría Infantil (A.E.P.) y Psicólogo. Centro de trabajo: Hospital de Día Infantil y Juvenil “Diego Matías Guigou y Costa”. Servicio de Psiquiatría. Hospital Universitario Ntra. Sra. de Candelaria. Tenerife. **Médico Residente en Psiquiatría. Servicio de Psiquiatría. Hospital Universitario de Canarias. Tenerife. ***Médico Residente en Psiquiatría. Servicio de Psiquiatría. Hospital Universitario Ntra. Sra. de Candelaria. Tenerife
| Resumen
El Trastorno por Déficit de Atención/Hiperactividad (TDAH) es un trastorno del neurodesarrollo frecuente en la edad pediátrica. Sus síntomas cardinales involucran a la atención y/o la impulsividad y/o la hiperactividad. El grado en el que están presentes esos tres síntomas conforman los distintos subtipos de TDAH. El desajuste social, personal y/o familiar, así como el escolar, son necesarios para su tipificación y dependerá, entre otros factores, de la severidad sintomática y la detección y abordaje tempranos del trastorno. La detección precoz mejora el pronóstico y reduce la morbilidad. Existen distintas alternativas terapéuticas con efectividad elevada. El presente artículo desarrolla las bases teóricas y prácticas necesarias para un adecuado enfoque del TDAH y analiza las distintas opciones terapéuticas existentes. |
| Abstract
Attention-Deficit/Hyperactivity Disorder (ADHD) is a frequent disorder of neurodevelopment. The main symptoms are attention disorder and/or impulsivity and/or hyperactivity. There are different subtypes of ADHD according to the degree of presence of these three symptoms. The social, personal, family and school disruption observed in these patients are necessary for classification and depends on clinical severity, early and adequate diagnosis and treatment. The early detection improves the prognosis and reduces morbidity. There are different therapeutic approaches with high proved effectiveness. This current article develops the theoretical and practical bases for an appropriate approach of ADHD and an assessment of the different treatment options. |
Palabras clave: Infancia; Salud mental; Trastorno por déficit de atención e hiperactividad; Metilfenidato
Key words: Childhood; Mental health; Attention Deficit Hyperactivity Disorder; Methylphenidate
Pediatr Integral 2015; XIX (8): 540-547
Introducción
El Trastorno por Déficit de Atención e Hiperactividad es un trastorno del neurodesarrollo.
El Trastorno por Déficit de Atención e Hiperactividad (TDAH) es el trastorno neuropsicobiológico más frecuente en la infancia y ocupa un lugar destacado en la psicopatología del adulto. En las clasificaciones de enfermedades, se sitúa en los trastornos del neurodesarrollo. Se señala su importancia no solo porque causa sufrimiento en los niños afectos y en los que los rodean. También, porque interfiere con el desarrollo social y educacional, y pueden conducir a problemas sociales y psicológicos que duran toda la vida. En los últimos tiempos, se ha avanzado en el conocimiento de diversos apartados del TDAH, tales como sus bases neurobiológicas y terapéuticas. Desde el punto de vista psicológico, el TDAH es una alteración de la función ejecutiva, término que engloba muchas capacidades (atención, memoria, etc.) necesarias para realizar tareas fundamentales en el funcionamiento cotidiano como: atender, planificar y organizar los distintos pasos para conseguir un objetivo, reflexionar sobre las posibles consecuencias antes de hacer algo o inhibir la respuesta inadecuada y cambiarla por otra más apropiada(1).
El TDAH fue descrito por primera vez en el año 1902. En el artículo, publicado en la revista Lancet, el autor atribuye el comportamiento hiperactivo a un déficit en el control moral. Realiza una descripción clínica de 43 niños que presentan: desafío, comportamiento agresivo, desinhibición, problemas en la atención sostenida y conductas opuestas a las reglas(2).
En los últimos años, se han multiplicado las iniciativas encaminadas a sistematizar la información basada en la evidencia científica que existe sobre el TDAH y establecer las recomendaciones relativas a la toma de decisiones. En España, dentro del Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad, se ha publicado la Guía de Práctica Clínica sobre el TDAH en niños y adolescentes (GPC). La primera edición data del 2010 y, en la actualidad, se encuentra en proceso de revisión(1).
Prevalencia
El TDAH es muy frecuente, afectando al 5% de los niños.
Aunque existen cifras de prevalencia dispares, situadas entre el 2 y el 15%, la mayoría de los estudios indican que el trastorno afecta al 5% de los niños en edad escolar. Las diferencias que se encuentran en algunos estudios se deben más a dificultades metodológicas o problemas en la selección de los instrumentos de evaluación que a factores culturales o contextuales(1).
Uno de los principales meta-análisis realizado hasta la actualidad, para homogeneizar los resultados encontrados en los estudios, refleja un porcentaje algo superior al 5% en niños y adolescentes (6% para niños y 3% en adolescentes)(3). La disminución del diagnóstico en la adolescencia se debe a que la expresión de las conductas impulsivas e hiperactivas disminuye en esta etapa de la vida, aunque el déficit de atención tiende a mantenerse. En España, los estudios más significativos presentan prevalencias similares, en torno al 5%, como los realizados por Benjumea y Mojarro en Sevilla o Cardo y cols., en Mallorca.
En cuanto a la distribución por sexos, el diagnóstico se realiza en 4 niños por cada niña. Algunos autores refieren la existencia de un infradiagnóstico en niñas, debido a que en ellas los problemas de conducta son menos llamativos(1).
Etiopatogenia
El origen neurobiológico del TDAH ha sido demostrado en múltiples estudios.
El TDAH se considera un trastorno neurobiológico del neurodesarrollo, de etiopatogenia multifactorial. Existe implicación patogénica desde el nivel molecular, con defectos en los alelos de los genes que codifican los receptores de la dopamina y otros neurotransmisores en el sistema nervioso central. Estos defectos cromosómicos presentan notables patrones de heredabilidad(1,4). Debido a la elevada cantidad de estructuras implicadas en el proceso atencional y en el control de las conductas impulsivas, la probabilidad de afectación de alguna de ellas es elevada cuando una noxa o un elemento ambiental o genético de cualquier tipo interfiere en el desarrollo del sistema nervioso. Se ha demostrado la asociación del TDAH con la prematuridad, las infecciones del sistema nervioso y las cromosomopatías, entre otros. Por otra parte, los factores ambientales contribuyen a matizar la expresión sintomatológica del trastorno y la influencia de las circunstancias sociales y familiares contribuye a exacerbar o mitigar la clínica y a condicionar la evolución. Aunque no se conoce la causa exacta y no existe ningún examen complementario que permita establecer el diagnóstico definitivo, se han identificado distintos factores relacionados con su génesis. Los más importantes son:
• Factores genéticos: quizás sea el factor más importante. La numerosa bibliografía existente al respecto indica una heredabilidad superior al 70%. Estos estudios se han realizado mediante técnicas de biología molecular, estudios en gemelos y en familiares de afectados por el trastorno.
Se presupone una herencia poligénica (varios genes de efecto pequeño suman su efecto para desarrollar el trastorno) y heterogénea, en la que se ven implicados diferentes polimorfismos de un solo nucleótido, que pueden predisponer a presentar el trastorno. La mayor parte de estos genes (pero no todos) están involucrados en el metabolismo o el funcionamiento catecolaminérgico(4).
Las variaciones alélicas (polimorfismos) serían el mecanismo subyacente. Algunos de ellos son: receptores 2, 4 y 5 de la dopamina (DRD2, DRD4 y DRD5). Transportadores de dopamina (DAT-1). Enzima que convierte la dopamina en noradrenalina (DBH). Transportador de serotonina (5HTT). Los estudios muestran que posiblemente, uno de los efectos más importantes producidos por la influencia genética es la pérdida de función dopaminérgica y noradrenérgica(5).
Hoy en día, no están indicados los estudios genéticos fuera del ámbito de la investigación.
• Estudios de neuroimagen: las técnicas de neuroimagen han permitido estudiar las diferencias entre el cerebro de los niños con TDAH y grupos de niños control. Se han realizado análisis estructurales (principalmente estudios de volúmenes cerebrales) y de funcionalidad mediante resonancia magnética. Los resultados indican que existen diferencias estructurales y funcionales entre niños con y sin TDAH(5,6).
Hasta el momento, se han realizado varios estudios estructurales cerebrales y todos ellos encuentran menor volumen cerebral, menor grosor cortical y otras alteraciones anatómicas en los niños con TDAH que en los grupos control, aunque los resultados difieren en las zonas cerebrales en las que ocurre el fenómeno.
• Estudios sobre factores ambientales: se ha relacionado el TDAH con la presencia ambiental de metales pesados, como el mercurio o con el déficit de hierro en los niños. El factor de daño cerebral más analizado es el consumo de tabaco en la gestación. Este hábito tóxico incrementa el riesgo de padecer TDAH en 2,5 veces(7). También, se ha relacionado el TDAH con enfermedades que producen daño cerebral durante el embarazo, como la prematuridad o la encefalopatía hipóxico-isquémica, etc.
• Aportación de la neuropsicología: en los últimos años, los estudios neuropsicológicos han ayudado a clarificar las zonas y sistemas neurológicos implicados en el TDAH. La atención es la principal función psicológica que se altera en el TDAH. Su estudio es muy complejo, debido a la variedad y heterogeneidad de las redes y circuitos implicados. A partir de los resultados de los estudios neuropsicológicos, se han formulado distintos modelos psicológicos que intentan explicar la conducta del niño con TDAH(8). Algunos de los más importantes son: el modelo del déficit de las funciones ejecutivas, planteado por Barkley (1997), que propone la existencia de dificultades en la inhibición de las respuestas que debe dar el niño ante cada situación; el modelo del déficit motivacional desarrollado por Sonuga-Barke (1992), indica que los niños con TDAH precisan de gratificación inmediata, aunque sea pequeña, por encima de otra gratificación demorada en el tiempo, aunque sea mayor; por último, el modelo de Brown incide en la idea de la existencia de dificultades en la funcionalidad ejecutiva, pero matizada por los aspectos emocionales y motivacionales(1,8).
Clínica
El TDAH se caracteriza por la existencia de déficit de atención, acompañado, en ocasiones, por hiperactividad e impulsividad.
La presencia o ausencia de los tres síntomas, o el grado en el que estos están presentes, establece tres subtipos clínicos: TDAH subtipo inatento (predomina el déficit de atención), TDAH subtipo hiperactivo e impulsivo (predominan la hipercinesis y la impulsividad) y TDAH subtipo combinado (aparecen los tres síntomas en igualdad de importancia).
El cuadro clínico puede evolucionar en el tiempo, de manera que se pueden identificar en un mismo paciente varios subtipos de TDAH en momentos distintos. Además, la influencia del entorno puede modular la presentación del cuadro clínico, minimizándose la repercusión de los síntomas en caso de recompensas frecuentes por comportamientos apropiados, de una estrecha supervisión, de que el paciente se encuentre en una situación nueva, de la implicación en actividades, especialmente interesantes, de que exista estimulación externa constante (por ejemplo: la obtenida delante de una pantalla con un videojuego) y de la interacción directa con otra persona (por ejemplo: durante la entrevista clínica).
La tríada sintomática del TDAH puede condicionar las siguientes alteraciones:
• Disminución de la flexibilidad cognitiva (que, entre otras habilidades restringidas en los pacientes con TDAH, depende de la atención dividida y la memoria de trabajo).
• Dificultad en el establecimiento de metas (debido a la baja capacidad de planificación y organización estratégica típicas del TDAH).
• Alteraciones en el procesamiento de la información (debido a una menor fluidez y velocidad de procesamiento en pacientes TDAH que en individuos sanos).
La característica principal de este trastorno es la repercusión en el funcionamiento académico, laboral, familiar y social. El perfil sintomatológico de cada paciente condiciona las áreas de funcionamiento en las que se evidencia esta repercusión:
• El déficit de atención interfiere en la adquisición de conocimientos y, por lo tanto, en el rendimiento académico, siendo fuente de retraso escolar.
• La hiperactividad-impulsividad compromete el adecuado cumplimiento de las normas de convivencia, generando conflictos frecuentes, tanto con iguales como con figuras de autoridad. Las alteraciones de conducta en este contexto provocan maniobras de contención y castigos frecuentes por parte de su entorno, que pueden complicar el estado del paciente con la aparición de trastornos ansioso-depresivos.
Más del 70% de los pacientes con diagnóstico de TDAH sufren otros trastornos comórbidos(9). Los trastornos comórbidos más frecuentes son: Trastorno Negativista Desafiante, Trastornos de Ansiedad, Trastornos del Estado de Ánimo, Trastorno Disocial y Trastornos de Aprendizaje.
Clásicamente, el TDAH se enmarca dentro de los cuadros psiquiátricos infantiles; sin embargo, actualmente, se reconoce la persistencia del cuadro en la edad adulta en, al menos, el 30% de los pacientes diagnosticados en la niñez. Los pacientes pertenecientes a familias con varios individuos afectos de TDAH tienen mayor riesgo de continuar presentando sintomatología en la edad adulta. Entre los predictores de continuidad del TDAH en el adulto, se encuentran: el estrés por elevada exigencia, la baja adaptación y el humor negativo. La memoria de trabajo o la capacidad de inhibición no se comportan como factores predictores de continuidad.
A continuación, se exponen los cambios que experimentan los síntomas principales durante la evolución del cuadro clínico:
• El déficit de atención comienza a evidenciarse entre los 5-7 años y, aunque supone un obstáculo manifiesto para el desarrollo del individuo en todas las etapas de la vida, su repercusión es más llamativa durante la etapa escolar. En mayores de 18 años, se caracteriza por la dificultad para estructurar el tiempo, para organizar y planificar proyectos o por la incapacidad para establecer prioridades(10).
• La hiperactividad se identifica a partir de los 3 años y se atenúa durante la evolución con respecto a la presentación en la niñez, manifestándose en el adolescente como una sensación interna de inquietud que provoca el inicio simultáneo de múltiples tareas que se suelen abandonar inacabadas.
• La impulsividad también se manifiesta entre los 3 y los 4 años y suele mejorar con el tiempo. En caso de que el cuadro evolucione de forma tórpida, sobre todo en aquellos que reciben un diagnóstico tardío, puede dar lugar a cuadros compatibles con trastorno disocial de la personalidad, trastorno por consumo de sustancias e incluso problemas de delincuencia.
Diagnóstico
El diagnóstico del TDAH es exclusivamente clínico.
Actualmente, no existen pruebas complementarias que arrojen evidencias diagnósticas definitivas para el TDAH. Por este motivo, las guías de práctica clínica sugieren que el diagnóstico debe estar basado únicamente en la valoración clínica realizada por psiquiatras, pediatras y especialistas entrenados tanto en el TDAH como en sus comorbilidades más frecuentes. Esta valoración debe incluir: una anamnesis extensa del paciente, exploración física completa, exploración psicopatológica completa y estudio del entorno psicosocial del paciente(1).
Las guías de práctica clínica se remiten a los criterios diagnósticos recogidos en el DSM-IV-TR(11). En algunas, también se contempla la posibilidad de que se usen los criterios de la CIE-10(12). Aunque ambas clasificaciones comparten que la clínica debe afectar a varias situaciones y áreas de funcionamiento, que los síntomas deben manifestarse antes de los siete años y la clínica a la que hacen referencia se describe de forma similar, existen diferencias relativas a los criterios que definen el diagnóstico en cada una de ellas. La CIE-10 exige para el diagnóstico definitivo que el paciente presente criterios de los tres síntomas fundamentales (déficit de atención, hiperactividad e impulsividad), mientras que el DSM-IV-TR contempla distintos subtipos en función de la clínica predominante.
En la tabla I, se muestran los criterios diagnósticos para el TDAH de la DSM-IV-TR.
Las pruebas complementarias de laboratorio, de neuroimagen o neurofisiológicas no están indicadas a menos que la valoración clínica lo justifique.
Se debe tener en cuenta que desde el año 2013, se encuentra disponible la quinta versión del Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM-5). Este nuevo manual no ha sido incluido aún en las guías diagnóstico-terapéuticas del TDAH. Por este motivo, se ha priorizado la información aportada en los criterios recogidos en el DSM-IV-TR. Aunque la definición del cuadro clínico y los criterios del mismo no han sufrido alteraciones llamativas, consideramos de interés mencionar las diferencias fundamentales entre ambas versiones:
• El DSM-5 incluye el TDAH en el grupo de los Trastornos del Neurodesarrollo.
• Se reconoce su existencia en la edad adulta, requiriendo un síntoma menos (5 de 9 de inatención y 5 de 9 de hiperactividad) para su diagnóstico.
• Se amplía la edad mínima de aparición de los síntomas a los 12 años (en el DSM-IV-TR era antes de los siete años).
• Es preciso un mínimo de dos informadores.
• Se acepta el diagnóstico comórbido con los Trastornos del Espectro Autista.
Tratamiento
Tanto el tratamiento farmacológico como el no farmacológico han demostrado una efectividad y seguridad elevada, especialmente cuando se utilizan de manera conjunta.
Tratamiento no farmacológico
Se incluyen todas aquellas intervenciones de alta efectividad que permiten una mejoría en el funcionamiento atencional, en el rendimiento escolar y en la regulación de la conducta del paciente. El objetivo es disminuir la incidencia de trastornos comórbidos y atenuar la intensidad de los síntomas, si estos ya han aparecido(13).
Psicoeducación
El tratamiento psicoeducativo se debe realizar con los padres, con los niños (según la edad) y también con el colegio(14). Se trata de explicarles en qué consiste el trastorno, por qué se produce y qué pueden hacer para mejorarlo:
• Informar de algunos aspectos prácticos: transmitir la información al niño de forma fraccionada, en orden, y evitar dar más de una orden cada vez. Establecer rutinas para facilitar la organización y planificación. Por ejemplo, es importante que existan horarios establecidos para levantarse, comer, jugar, hacer los deberes y acostarse, y que estas rutinas se cumplan en la medida de lo posible. En este sentido, también es de gran utilidad que el entorno físico sea estable (por ejemplo, estudiar siempre en la misma mesa y en la misma habitación). Limitar, en la medida de lo posible, los estímulos distractores que pueden interferir con las actividades que implican el mantenimiento de la atención (ruidos, juguetes a la vista…). Es conveniente que en el colegio, el niño se siente cerca del profesor y disponga de referencias constantemente visibles de lo que se le solicita (por ejemplo, permanecer sentado durante la clase), mediante notas escritas o indicaciones verbales frecuentes(15).
• Aclarar conceptos básicos: No es culpa ni de los padres ni de los niños; los síntomas tienen como causa una disfunción de origen cerebral, no se deben a que los niños sean vagos, desobedientes o desafiantes y, como tal, se puede tratar y mejorar.
Entrenamiento para padres en manejo conductual
El tratamiento psicológico de elección en el TDAH se basa en Técnicas de Modificación de Conducta (TMC), siendo el tratamiento no farmacológico más eficaz(15,16). Las más importantes son:
1. Economía de fichas: se trata de un procedimiento dirigido a establecer un control de la conducta. La idea básica consiste en establecer estímulos reforzadores, artificialmente establecido para esta tarea, cuya emisión puede controlarse si se consigue la respuesta positiva del niño (por ejemplo, acudir al cine un fin de semana después de que el niño haya terminado los ejercicios de matemáticas en tres ocasiones esa semana).
2. Extinción: consiste en retirar la atención que prestamos al niño cuando presenta conductas desafiantes. Este procedimiento es más lento que otros métodos de reducción de conductas, incluso suele producir inicialmente un incremento de la respuesta, pero si se mantiene la extinción, progresivamente comenzará a disminuir.
3. Castigos: no suele ser útil utilizar castigos prolongados o frecuentes. En contraposición, resulta más efectivo el reforzamiento positivo. Esto es, transmitir halagos cuando aparece un buen comportamiento.
Apoyo académico
Es conveniente contactar con el colegio del niño de cara a completar la evaluación e iniciar la intervención desde el centro escolar(16).
A los niños diagnosticados de TDAH no es necesario reducirles el nivel de exigencia académica, pero se deben tomar medidas destinadas a mejorar sus resultados.
• Mejorar la atención: sentarlo cerca del profesor, evitar distracciones, supervisarle con frecuencia.
• Regulación de la hiperactividad e impulsividad: permitirle que se levante con relativa frecuencia y de forma programada.
• Mejorar la motivación: elogiarlos por sus buenos resultados y su buena conducta, y evitar criticarlos en público.
• Adaptación curricular en evaluación: exámenes más cortos, permitirles más tiempo, entregarles las preguntas de una en una, exámenes orales…
Tratamiento farmacológico
Con el objetivo de alcanzar la remisión sintomatológica, las guías actuales de manejo del TDAH recomiendan un tratamiento que integre un abordaje psicosocial y una pauta psicofarmacológica individualizada a las necesidades del paciente. La mayoría de los protocolos sugieren los 6 años como edad mínima para el inicio del tratamiento farmacológico. La duración del tratamiento no está preestablecida, debiendo abandonarse únicamente cuando no existe beneficio clínico en su continuación. Las retiradas puntuales y transitorias consensuadas entre paciente, familia y médico (“periodos de descanso”), deben plantearse de forma extraordinaria en circunstancias especiales (aparición de efectos adversos, estudio de la tolerancia a la suspensión o disminución del tratamiento, en función del subtipo de TDAH…)(17). Los fármacos utilizados en el TDAH no provocan dependencia ni predisponen al consumo de sustancias adictivas.
Las características principales de los fármacos para el tratamiento del TDAH son:
Psicoestimulantes
Metilfenidato: se postula que actúa mediante el bloqueo de la recaptación presináptica de dopamina y noradrenalina. La evidencia científica apoya la indicación de tratamiento con metilfenidato en niños mayores de 6 años diagnosticados de TDAH. Utilizando presentaciones mixtas (que incluyan un porcentaje de su composición en formulación de liberación retardada) se alcanza respuesta terapéutica en el 70-80% de los casos y remisión completa de los síntomas en el 50-60%. De forma extraordinaria, se puede plantear el tratamiento con metilfenidato, en pacientes de entre 4 y 6 años que presenten sintomatología limitante (siempre que no respondan a un abordaje psicoterapéutico intenso). En España, se disponen de cuatro presentaciones distintas del metilfenidato: liberación inmediata, con duración de la acción de 4 horas, se presenta en comprimidos de 5, 10 y 20 mg; liberación prolongada 50:50 (50% liberación inmediata, 50% liberación prolongada), la duración de la acción es de 8 horas y se presenta en cápsulas de 5, 10, 20, 30 y 40 mg; liberación prolongada 30:70 (30% liberación inmediata, 70% liberación prolongada), la duración de la acción es de 8 horas y se presenta en cápsulas de 10, 20, 30, 40 y 50 mg; y por último osmótica (22% liberación inmediata, 78% liberación prolongada); la duración de la acción es de 12 horas y se presenta en cápsulas de 18, 27, 36 y 54 mg.
Se recomienda iniciar el tratamiento a dosis bajas, en las tomas iniciales, una pauta que oscile entre los 0,3 y los 0,5 mg/kg/día. Tras evaluar el beneficio terapéutico y el disconfort ocasionado por posibles efectos secundarios, se valora la conveniencia de aumentar progresivamente la dosis diaria de metilfenidato. La dosis de mantenimiento suele oscilar entre los 0,8 y los 1,2 mg/kg/día. Los efectos secundarios suelen ser leves, transitorios y dosis-dependientes, e incluyen en orden decreciente de frecuencia: el insomnio de conciliación, la pérdida de apetito, la cefalea y el dolor abdominal.
Respecto a las distintas formulaciones disponibles, se debe tener en cuenta que todas han demostrado eficacia en el tratamiento del TDAH una vez se optimiza la pauta.
No existe restricción temporal definida en relación a la pauta de tratamiento, este se mantendrá mientras el paciente obtenga un beneficio clínico objetivable, tanto en consultas de revisión como en el entorno en el que se desarrolla(18).
Lisdexanfetamina (se comercializa en cápsulas de 30, 50 y 70 mg): se trata de un profármaco resultado de la combinación, mediante enlace covalente del aminoácido lisina y la dexanfetamina o dextro-anfetamina. Tras su administración vía oral, es absorbido en el intestino y una vez en el torrente sanguíneo, la capacidad hidrolítica de los glóbulos rojos separa los dos componentes mediante la disolución del enlace covalente, permitiendo el aumento de la concentración de dexanfetamina, componente responsable de la actividad farmacológica. Actúa bloqueando la recaptación presináptica de dopamina y noradrenalina. Resulta un compuesto seguro, menos perjudicial que otros psicoestimulantes en caso de sobreingesta y con menor potencial de riesgo de abuso.
Se recomienda una pauta inicial de 30 mg por la mañana; en caso de no respuesta o de respuesta subóptima, se sugiere un incremento de la dosis a razón de 20 mg semanales, siendo la dosis máxima recomendada de 70 mg/día. Los efectos adversos más frecuentes son, igual que en el caso del metilfenidato, el insomnio de conciliación y la disminución del apetito.
Atomoxetina (disponible en dosis de 10, 18, 25, 40, 60 y 80 mg.): actúa inhibiendo selectivamente la recaptación presináptica de noraderenalina. A diferencia de los psicoestimulantes, su efecto no es inmediato. El inicio del alivio sintomático no se objetiva hasta tres o cuatro semanas después del inicio del tratamiento y la respuesta terapéutica plena se retrasa hasta 2 o 3 meses tras alcanzar la dosis óptima.
La dosis inicial recomendada es de 0,5 mg/kg/día. En caso de no respuesta, se recomienda un incremento progresivo de dosis hasta 1-1,2 mg/kg/día. Se debe tener en cuenta que cuanto menor sea la velocidad a la que se aumente la dosis, mejor tolerado será este aumento, dificultando la aparición de efectos adversos. Los efectos adversos más comunes son: la pérdida de apetito, las molestias gastrointestinales y la somnolencia.
Otros coadyuvantes terapéuticos
Existen otras técnicas de intervención sobre el paciente que presentan resultados de efectividad dispar y, en ocasiones, contradictorios. Quizás la que ha aportado más evidencia científica positiva sea el neurofeedback. Se trata de un programa de entrenamiento de pacientes mediante el control individual de las ondas cerebrales utilizando tecnología electroencefalográfica. El objetivo es incrementar la actividad beta y disminuir la actividad theta para mejorar la atención y proporcionar una medida fisiológica de auto-control. Los estudios realizados sobre suplementación nutricional con omega 3 también presentan cada vez mayor evidencia científica sobre su utilidad en la regulación conductual, mejoría de la atención y mejoría del rendimiento académico. Los omega 3 juegan un papel importante en el sistema nervioso central, siendo esenciales para el funcionamiento normal del cerebro, incluyendo la atención y otras habilidades neuropsicológicas. Su indicación podría ser como coadyuvante del tratamiento farmacológico y conductual del TDAH y cuando los padres rechazan el tratamiento farmacológico.
Función del pediatra de Atención Primaria
Las funciones más importantes son las siguientes:
• Aportar la información necesaria sobre el TDAH según criterios científicos y de calidad.
• Debe derivar a la familia a recursos especializados si lo cree conveniente y estar en contacto con las asociaciones de familiares de TDAH.
• Debe estar familiarizado con instrumentos útiles para realizar la evaluación psicopatológica del TDAH.
• Establecer el plan terapéutico farmacológico y no farmacológico.
• Coordinar a todos los profesionales que participan en el tratamiento.
• Informar sobre los tratamientos e intervenciones que no han mostrado evidencia científica.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Grupo de trabajo de la Guía de Práctica Clínica sobre el Trastorno por Déficit de Atención con Hiperactividad (TDAH) en Niños y Adolescentes. Fundació Sant Joan de Déu, coordinador. Guía de Práctica Clínica sobre el Trastorno por Déficit de Atención con Hiperactividad (TDAH) en Niños y Adolescentes. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad, Política Social e Igualdad. Agència d´Informació, Avaluació i Qualitat (AIAQS) de Cataluña; 2010. Guías de Práctica Clínica en el SNS: AATRM Nº 2007/18.
2. Still GF. Some abnormal psychical conditions in children: the Goulstonian lectures. Lancet. 1902; 1: 1008-12.
3. Polanczyk G, Lima MS, Horta BL, Biederman, J. The worldwide prevalence of attention-deficit/hyperactivity disorder: A sistematic review and meta-regression analysis. Am J Psychiatry. 2007; 164: 942-8.
4.*** Biederman J, Faraone SV. Attention-deficit hyperactivity disorder. Lancet. 2005; 366: 237-48.
5. Martín Fernández-Mayoralas D, Fernández-Jaén A. Trastorno por déficit de atención/hiperactividad. Acta Pediatr Esp. 2010; 68: 167-72.
6. Rodríguez Hernández PJ, Martín Fernández-Mayoralas D, Fernández-Jaén A. El Trastorno por Déficit de Atención/Hiperactividad. Pediatr Integral. 2011; 15: 766-75.
7. Braun M, Kahn RS, Froehlich T, Auinger P, Lanphea BP. Exposures to environmental toxicants and Attention Deficit Hiperactivity Disorder in U.S. children. Environ Health Perspect. 2006; 114, 1904-9.
8. Artigas-Pallarés J. Modelos cognitivos en el trastorno por déficit de atención/hiperactividad. Rev neurol. 2009; 49, 587-93.
9. Wilens TE, Spencer TJ. Understanding Attention-Deficit/Hyperactivity Disorder from childhood to adulthood. Postgrad Med. 2010; 122, 97-109.
10.** Ramos-Quiroga JA, Chalita PJ, Vidal R, Bosch R, Palomar G, Prats L, Casas M. Diagnóstico y tratamiento del trastorno por déficit de atención e hiperactividad en adultos. Rev neurol. 2012; 54: 105-15.
11. American Psychiatric Association. Manual diagnóstico y estadístico de los trastornos mentales. DSM-IV. Barcelona: Masson, 1995.
12. Organización Mundial de la Salud. Clasificación Internacional de Enfermedades. 10ª ed. Ginebra: OMS, 1992.
13. The MTA Cooperative Group. A 14 month randomized clinical trial of treatment strategies for attention-deficit/hyperactivity disorder. Multimodal Treatment Study of Children with ADHD. Arch Gen Psychiatry. 1999; 56: 1073-86.
14. Pliszka S. Practice parameter for the assessment and treatment of children and adolescents with attention-deficit/hyperactivity disorder. J Am Acad Child Adolesc Psychiatry. 2007; 46: 894-921.
15.** Orjales Villar I. Déficit de atención con hiperactividad: manual para padres y educadores. 16 ed. Madrid: Ciencias de la Educación Preescolar y Especial; 2010.
16. Hodgson K, Hutchinson AD, Denson L. Nonpharmacological treatments for ADHD: A meta-analytic review. J Attention Disord. 2014; 18: 275-82.
17.*** Díez A, Soutullo C, Figueroa A, San Sebastián J. Tratamiento farmacológico del trastorno por déficit de atención e hiperactividad. En: TDAH en Pediatría. (Rodríguez Hernández PJ, Coord.). Madrid: inScienceCommunications; 2013. p. 83-100.
18. Kaplan G, Newcorn JH. Pharmacotherapy for child and adolescent attention-deficit hyperactivity disorder. Pediatr Clin North Am. 2011; 58: 99-120.
Bibliografía recomendada
- Soutullo C, Díez A. Manual de Diagnóstico y Tratamiento del TDAH. Madrid: Editorial Médica Panamericana; 2007.
Manual de referencia sobre el TDAH, con información práctica. Muy interesante los aspectos relacionados con el tratamiento psicosocial.
- Quintero Gutiérrez del Álamo FJ, Correas Lauffer J, Quintero Lumbreras FJ. Trastorno por Déficit de Atención e Hiperactividad (TDAH) a lo largo de la vida. 3ª Edición. Barcelona: Elsevier España, 2009.
Es un libro extenso y completo que aborda las particularidades de la presentación, diagnóstico y tratamiento en las distintas etapas de la vida y no solo en la infancia.
- Soutullo C y cols. Informe PANDAH. El TDAH en España. Barcelona: ADELPHA Targis S.L.; 2013.
Documento elaborado por un equipo de expertos de distintas áreas sobre la situación actual del TDAH en España. Se incluyen informes desde el punto de vista sanitario, educativo y social y pretende incrementar el conocimiento sobre el trastorno y sensibilizar a la población.
- TDAH en Pediatría. (Rodríguez Hernández PJ, Coord.). Ed.: inScienceCommunications. Madrid, 2013.
Manual breve sobre el TDAH. La importancia radica en que está dirigido especialmente a su consulta por el pediatra.
- Programa Action. Actualización Terapéutica. TDAH en el niño. (Sánchez Santos L, Coord.). Madrid: IMC; 2015.
Incluye información actualizada y detallada sobre todos los aspectos relacionados con el TDAH.
| Caso clínico |
|
Juan es un niño de 9 años de edad que presenta el diagnóstico de Trastorno por Déficit de Atención e Hiperactividad (TDAH) subtipo combinado desde los 6 años. El diagnóstico lo realiza su pediatra en el Centro de Salud después de analizar los problemas de comportamiento y el bajo rendimiento escolar. En el proceso diagnóstico inicial, el pediatra realiza una entrevista clínica a los padres, observación del niño en la consulta y se administra el test de Conners a padres y profesor. Después de descartar patología orgánica, se establece el diagnóstico de TDAH subtipo combinado y se inicia tratamiento con metilfenidato de liberación prolongada. El rendimiento académico en ese momento refleja 3 suspensos en la primera evaluación. Además de sintomatología inatenta e impulsiva, existen problemas conductuales leves, tales como peleas esporádicas con otros niños en los momentos de descanso o no obedecer las normas dentro del aula. Después de establecido el diagnóstico médico, el equipo psicopedagógico del centro realiza un informe en el que detectan: las dificultades de atención, problemas de inhibición y dificultades en el aprendizaje en el área del lenguaje (dislexia). En el citado informe, se establecen recomendaciones para el profesorado, entre las que destacan que el niño tiene que estar sentado junto al profesor, que hay que darle más tiempo en los exámenes de lenguaje y que es importante que el profesor compruebe que el niño apunta las actividades para realizar en casa. El tratamiento inicial produce una disminución en la sintomatología inatenta y una mejoría en la impulsividad. Después de 6 meses de tratamiento, las calificaciones finales indican que se han superado todas las asignaturas con notas superiores al bien, excepto lenguaje que continúa suspendida. La evolución en los siguientes años muestra un patrón similar, con adecuado rendimiento medio en todas las asignaturas excepto en lenguaje (ya existe un retraso de más de 2 años) y escasa sintomatología inatenta e impulsiva (es capaz de esperar una fila o una cola, no responde antes de que se le termine la pregunta…). Se ha intentado suspender el tratamiento en tres ocasiones, pero la sintomatología inatenta e impulsiva se reproduce. Durante los últimos 6 meses, se constata el incremento de la irritabilidad, con conductas oposicionistas de predominio en el ámbito familiar, aunque también escolar y desafío a las figuras de autoridad. Son muy frecuentes las ocasiones en las que la familia se siente desbordada y en el colegio ha aumentado la conflictividad a pesar de las medidas psicoeducativas que han tomado. La familia consulta a su pediatra por este motivo. El pediatra valora la nueva sintomatología y actualiza el diagnóstico. Los diagnósticos que presenta Juan a los 9 años de edad son: TDAH subtipo combinado, Dificultades de Aprendizaje en el área del lenguaje y Trastorno Oposicionista Desafiante. La explicación que aporta el pediatra a la familia de Juan es la siguiente: el diagnóstico y tratamiento de TDAH está bien realizado. Sin embargo, los niños con TDAH pueden presentar otras dificultades o trastornos en situación de comorbilidad. En este caso, se observa que existe Dificultad de Aprendizaje en el área del lenguaje, que se establece cuando hay un retraso en 2 o más años en el aprendizaje de alguna materia. El tratamiento de las dificultades de aprendizaje es psicopedagógico, aunque el metilfenidato puede ayudar al mejorar la atención. La presencia de dificultades de aprendizaje en niños y adolescentes con TDAH se acerca al 70%. También se observa un patrón de conductas desafiantes y oposicionistas de más de 6 meses de duración, con importante significación clínica. El Trastorno Oposicionista Desafiante está presente en el 40% de los niños y adolescentes con TDAH. Aunque el tratamiento con metilfenidato ayuda a controlar la impulsividad generadora de las conductas perturbadoras, es importante aplicar medidas conductuales y valorar añadir risperidona si los síntomas continúan aumentando.
|
 |
| Temas de FC |
D. Martín Fernández-Mayoralas1, A. Fernández-Jaén2, A.L. Fernández Perrone3, B. Calleja-Pérez4, N. Muñoz-Jareño5
1Neuropediatra. Responsable de la Unidad de Neuropediatría del Hospital Quirón San Camilo. Adjunto de la Unidad de Neuropediatría del Hospital Universitario Quirón Madrid. Centro de Atención a la Diversidad Educativa (CADE). Madrid. 2Neuropediatra. Jefe de la Unidad de Neuropediatría del Hospital Universitario Quirón Madrid. Centro de Atención a la Diversidad Educativa (CADE). Madrid. 3Neuropediatra. Adjunto de la Unidad de Neurología Infantil del Hospital Universitario Quirón Madrid. 4Pediatra de Atención Primaria. Centro de Salud “Doctor Cirajas”. Madrid. 5Neuropediatra. Adjunto de la Sección de Neurología Infantil. Hospital Infanta Leonor de Vallecas. Madrid
| Resumen
El retraso psicomotor (RPM) es un motivo habitual de consulta especializada. El origen puede ser múltiple, desde una escasa estimulación ambiental, hasta enfermedades neurológicas severas. El pediatra es el único especialista que podrá indicar precozmente la presencia de dicho RPM. |
| Abstract
Psychomotor retardation (PR) is a frequent cause of specialized consultation. The etiology can be diverse, from a low environmental stimulation to severe neurological diseases. The pediatrician is the only specialist that may early indicate the presence of the PR. In diagnosis, both complete history and physical examination are the most important points. The pediatrician will be able to measure psychomotor development in time. In relation to therapy, treatment of the PR will depend on the etiology. As a symptomatic syndrome, stimulation, and physical therapy will help to improve the patient ́s evolution. |
Palabras clave: Retraso psicomotor; Regresión psicomotriz; Discapacidad intelectual; Retraso mental
Key words: Psychomotor retardation; Psychomotor regression; Intellectual disability; Mental retardation
Pediatr Integral 2015; XIX (8): 532-539
Introducción
Es necesario el conocimiento del desarrollo psicomotor normal y de sus límites, para poder establecer el diagnóstico de un retraso psicomotor.
El retraso psicomotor (RPM) no es una enfermedad o trastorno en sí mismo, sino la manifestación clínica de patologías del SNC (sistema nervioso central) debidas a trastornos genéticos y/o factores ambientales, con especial incidencia en el desarrollo psicomotor (DPM) del niño(1). El término DPM se emplea para definir el progreso del niño en diferentes áreas (lenguaje, motor, manipulativo, social) durante los primeros 24-36 meses; debemos definir, por tanto, el RPM como la adquisición lenta o anormal (cualitativamente alterada) de los primeros hitos del desarrollo(2,3).
Para la tipificación del retraso psicomotor, previamente tenemos que conocer el desarrollo psicomotor normal, la edad media del alcance de los hitos del desarrollo señalados, su variación y márgenes de la normalidad (Tabla I)(2,3). En general: todo niño que al año y medio de edad no dice palabra alguna y/o no camina debe ser remitido al neuropediatra para descartar que exista algún problema serio (lo que no sucede en la mayoría de casos, por lo que no se debe alarmar a la familia).
Clasificación(4,5)
Debe atenderse de forma particularmente urgente a aquellos niños que muestran una pérdida de adquisiciones ya conseguidas.
Estático vs regresivo
El término RPM se emplea básicamente para explicar un DPM más lento, en el cual el niño alcanza más tardíamente los hitos lógicos del desarrollo. El término regresión psicomotriz tipifica un problema preocupante, en el cual el niño ha mostrado previamente un DPM normal, apareciendo posteriormente una pérdida evidente de adquisiciones ya alcanzadas, frecuentemente acompañada de nuevos signos neurológicos, deficitarios o anormales.
La separación entre el desarrollo o la regresión puede ser compleja, bien por la naturaleza del problema neurológico que lo está justificando o bien por la levedad del mismo. La obtención de la información de logros del desarrollo en el interrogatorio familiar está sujeta a la subjetividad familiar, los pacientes con RPM pueden tener procesos intercurrentes que alteran transitoriamente el propio desarrollo o las manifestaciones clínicas del proceso base, pueden cambiar a lo largo de la vida debido al desarrollo del individuo, siendo el problema estático, por ejemplo: en la parálisis cerebral.
Indudablemente, la tipificación de un trastorno regresivo, cuando este es evidente, puede tener una trascendencia marcada en el diagnóstico, tratamiento y pronóstico, por lo que su abordaje debe ser preferente.
Parcial vs global
El RPM global, como su propio nombre indica, se tipifica ante un DPM enlentecido o anormal en todas las áreas del desarrollo. El RPM parcial, apunta de forma particular a un área específica como la afectada. Su distinción puede dirigir el diagnóstico del problema de base.
De nuevo, esta separación no es sencilla. No es infrecuente que un RPM global lo sea, pero una de las áreas evaluadas está claramente más afectada que las restantes (un niño con parálisis cerebral puede mostrar un retraso global del desarrollo, aunque el desarrollo motor será el más afectado y el que tipifica el diagnóstico). Del mismo modo, un RPM parcial con frecuencia tiende a asociarse con cierto retraso de otras áreas del desarrollo (es frecuente que un retraso significativo en el lenguaje, condicione la adaptación social del niño que lo sufre). Desde nuestro punto de vista, cuando un área del desarrollo está intensamente más afectada que el resto, como este último caso, es mejor referirnos a dicha área (p. ej., un retraso específico del lenguaje en un niño de 3 años que no dice una sola palabra a pesar de que exista cierta torpeza motora).
Clasificación etiológica (Tabla II)(4-6)
Un retraso psicomotor no siempre es patológico o anormal, pero puede ser también la antesala de graves problemas del desarrollo físico y cognitivo del niño.
Variante de la normalidad
Los márgenes de la normalidad para numerosos hitos son amplios. En ocasiones, especialmente en RPM parciales, encontramos pacientes completamente sanos, que se “escapan” de los márgenes señalados como “normales” para la población a estudio, los signos más frecuentes aparecen en la tabla III.
Por ejemplo, un tercio de los niños no gatea nunca, por lo que es un signo más “tranquilizador” en su presencia que de “alarma” en su ausencia.
Dos circunstancias especiales en este sentido son: el recién nacido prematuro (RNPT) y el niño ingresado-encamado. El RNPT alcanzará los hitos lógicos del DPM más tarde que los demás; para valorar la normalidad del desarrollo en estos niños, deberá emplearse la edad corregida; es decir, la edad que el niño tendría si hubiera nacido en la fecha prevista del parto (edad corregida= “edad cronológica medida en semanas o meses”-“número de semanas o meses de prematuridad”). Esta corrección es especialmente necesaria en los primeros 24 meses. Por otro lado, la prematuridad es un factor de riesgo para los problemas del desarrollo y el aprendizaje, por lo que el DPM deberá ser vigilado estrechamente. El niño ingresado o encamado durante tiempos largos durante el 1º-2º año de vida, puede igualmente mostrar un leve retraso o estancamiento del desarrollo motor. En estos niños, se puede sumar el RPM a déficit asociados en el desarrollo por la patología que justificó el ingreso hospitalario.
Hipoestimulación
Los niños pobremente estimulados o institucionalizados pueden mostrar un claro RPM en los primeros meses de la vida. Esta circunstancia es generalmente normalizable. Sin embargo, cuando la hipoestimulación es severa y mantenida, como sucede en niños adoptados del este de Europa, puede justificar, junto a otros factores de riesgo, futuros problemas del neurodesarrollo.
Déficit neurosensorial
Los problemas sensoriales, especialmente auditivos o visuales, pueden ser causa de un RPM. Es habitual que la patología auditiva severa se asocie con retrasos del lenguaje, la comunicación e incluso con conductas de aislamiento, que pueden recordar trastornos generalizados del desarrollo. Por ello, deben descartarse en todos los casos, bien por audiometría, bien por potenciales evocados auditivos del tronco encefálico (PEATE) si el niño no colabora o es muy pequeño. Los niños con trastornos auditivos pueden mostrar un desarrollo del lenguaje normal los primeros 6 meses de vida (ruidos, risas, balbuceos…) con interrupción del mismo por ausencia de feedback ambiental. Es excepcional que la hipoacusia leve uni o bilateral justifique un verdadero retraso del lenguaje; del mismo modo, no debe justificarse el retraso del lenguaje a otitis recurrentes.
Los problemas visuales pueden igualmente asociarse a problemas de la coordinación, manipulación… Estos generalmente están relacionados con el componente visual-sensorial, no con el motor; un estrabismo o nistagmus puede ser un signo de un trastorno neurológico de base, pero no la causa de un RPM.
Anticipación de un trastorno específico del desarrollo
Los trastornos del desarrollo de la coordinación y los trastornos de la comunicación, tienden a anticiparse por RPM con afectación predominantemente motora y del lenguaje respectivamente.
Anticipación de un trastorno motor
La parálisis cerebral infantil (PCI) tiende a manifestarse en los primeros 18-24 meses de vida por un RPM global o predominantemente motor. Aunque PCI se define como un trastorno motor, crónico, de comienzo precoz y no progresivo, las manifestaciones clínicas pueden ser cambiantes y más invalidantes durante el desarrollo del niño. Puede, además, acompañarse de problemas sensoriales (visuales hasta en el 50% y auditivos hasta en el 15% de los casos) o epilepsia (25-35%), que puede condicionar el propio desarrollo global o discapacidad intelectual (DI) –retraso mental– (hasta en el 50% de los niños).
En este apartado, debemos incluir las miopatías, tanto las congénitas como las distrofias musculares, que pueden manifestarse con carácter estático o progresivo respectivamente y, a veces, acompañadas de retraso cognitivo. Igualmente, no deben obviarse otras enfermedades, como la atrofia muscular espinal, que se manifestará en los primeros meses de vida, o algunas neuropatías genéticas, que podrán hacerlo en los 3-4 primeros años, en forma de retraso motor, hipotonía o torpeza.
Anticipación de una discapacidad intelectual –DI– (retraso mental)(7)
Generalmente, la mayoría de los pacientes con DI (este término ha ido sustituyendo al de retraso mental) han tenido, al menos, cierto RPM. En ocasiones, las DI leves se anticipan por leves RPM o RPM parciales, que pasan desapercibidos para la familia o el médico.
Es un trastorno plurietiológico, habitualmente de causa genética. Estos últimos años, el diagnóstico etiológico ronda el 50% de los casos leves y el 80% de los graves, gracias a los espectaculares avances en el diagnóstico genético estos últimos 3-4 años.
Es frecuente que los pacientes con DI asocien otros problemas neurológicos que contribuyen de forma desfavorable en el DPM. Algunos estudios refieren la asociación a encefalopatías motoras en el 7% de los pacientes, epilepsia en el 10%, alteraciones neurosensoriales en el 7% o autismo en el 2-3%. Estas asociaciones se muestran más intensas cuanto menor es el CI.
Anticipación de un trastorno del espectro autista (TEA)
Caracterizado eminentemente por una alteración de la socialización, la comunicación y un patrón de intereses restringidos y comportamientos estereotipados, se puede manifestar con un desarrollo lento o atípico. Estos problemas pueden acompañarse de cierta torpeza o hipotonía en los primeros meses de vida (a menudo debido a la causa genética subyacente del trastorno), pero suele expresarse en los primeros meses/años de vida con una alteración cualitativa y/o cuantitativa del lenguaje y ser indeferenciable inicialmente de un trastorno específico del lenguaje (TEL) con afectación de la comprensión del mismo. En estos casos, lo más importante es derivar al neuropediatra e instaurar una intervención precoz adecuada mientras se realizan las pruebas complementarias oportunas. La ausencia de un diagnóstico específico no puede demorar la derivación de un niño con sospecha de TEA/TEL a un centro de atención temprana especialista en trastornos de la comunicación. Separar este grupo de los anteriores se muestra complejo, dada de nuevo su comorbilidad con otros trastornos o enfermedades. Hasta el 90% de los casos de TEA grave, pueden tener DI, y epilepsia hasta en la mitad de los casos (especialmente si tienen DI), alteraciones visuales o auditivas leves que pueden condicionar el DPM, etc.
Evaluación del desarrollo psicomotor (DPM)(8,9)
El pediatra juega un papel trascendental en el diagnóstico precoz del retraso psicomotor.
Los controles periódicos de salud, en los primeros años de vida, van a proporcionar al pediatra un momento extraordinario para valorar el DPM del niño en cada momento, así como la evolución cognitiva, social y motora, entre otras esferas, que presentará en los primeros años de vida.
Los programas de seguimiento del niño sano permiten la evaluación transversal y evolutiva del niño. Para facilitar este seguimiento, el pediatra puede hacer uso de diferentes escalas de desarrollo. Ninguna de las escalas de desarrollo tiene un correlato fiable con el cociente intelectual del niño mayor. Se describen las más frecuentes:
Escalas de Desarrollo Infantil de Bayley (BSID). Evalúan el desarrollo infantil desde el nacimiento hasta los 2,5 años. Aportan un índice de desarrollo mental. Existen otras versiones con mayor cobertura etaria, pero no están baremadas en nuestro país.
Se compone de 3 subescalas:
1. Escala mental: evalúa desarrollo cognitivo y capacidad comunicativa.
2. Escala de psicomotricidad: pondera coordinación motora y motricidad fina en manos y dedos.
3. Escala comportamental: mide conducta del niño e interacción con su entorno.
Test de Screening de Desarrollo de Denver (DDST). Posiblemente la escala más empleada. Se trata más de un registro o cuestionario que de una escala de desarrollo. Valora cuatro áreas: motor-gruesa, motor-fina, personal-social y lenguaje. En sus diferentes versiones, registra el desarrollo en estas áreas hasta los 4 años de edad. No aporta ningún índice; si el niño falla en ítems que son satisfactoriamente cubiertos por el 90% de niños más jóvenes, debe sospecharse un RPM e iniciarse una evaluación más profunda.
Test de Haizea-Llevant. Similar al DDST en su sistema de evaluación y estimación de áreas comprometidas. Elaborada de forma específica en niños españoles hasta los 4 años.
Diagnóstico etiológico
La historia clínica y la exploración física son los apartados más importantes en la evaluación etiológica del RPM.
Anamnesis
La historia clínica debe ser completa. Se debe recoger de forma detallada el desarrollo psicomotor del paciente, no solo el desarrollo motor. En el caso de un estancamiento o involución, deben anotarse, entre otras: la edad de comienzo, las áreas afectadas, los síntomas acompañantes si existieron y las causas atribuidas por los padres u otros profesionales.
Dentro de este apartado, se reflejarán igualmente los antecedentes personales de forma minuciosa, haciendo referencia a ingesta de fármacos u otras sustancias durante la gestación, control del embarazo, infecciones, características del parto, edad gestacional, instrumentación, etc.
La recogida de datos relacionados con el periodo neonatal aporta de nuevo una información trascendental (Apgar, peso al nacimiento, cuidados neonatales…). Se añadirá la calidad de succión y llanto, resultado de screening metabólico, la presencia de hipotonía o crisis en los primeros días de vida, los problemas respiratorios y otros problemas.
En relación a los antecedentes personales posteriores, no se obviarán aquellos trastornos o enfermedades que puedan tener relación con la situación a estudio: convulsiones febriles o afebriles, meningoencefalitis, traumatismos craneoencefálicos severos, cardiopatías, etc.
Finalmente, se añadirán los antecedentes familiares. Debemos intentar obtener un árbol genealógico lo más amplio posible en el que se haga constar los posibles antecedentes de DI, TEA, trastornos psiquiátricos, epilepsia y cualquier otro antecedente llamativo.
Exploración física(3)
Debe iniciarse por un examen general que incluya, entre otros: la exploración de rasgos dismórficos (Tabla IV)(10,11), aunque sean menores, el perímetro craneal (fundamental), el desarrollo ponderoestatural, las características cutáneas, el desarrollo óseo, la presencia de visceromegalias y cualquier otro dato que nos llame la atención.
El pediatra, y especialmente el neurólogo infantil, no deben temer la descripción de rasgos que le resultan inicialmente anormales. Igualmente, no debe obviarse la obtención de imágenes-fotografías del niño o familia, ante la presencia de rasgos dismórficos, para una posterior evaluación a través de bases de datos de malformaciones congénitas (p. ej.: Omim, Possum). En ocasiones, una descripción fenotípica detallada es la que orienta el diagnóstico. En otras ocasiones, el desarrollo ponderoestatural apoya un diagnóstico de sospecha; la anotación de la talla-peso-perímetro craneal desde edades precoces, puede orientar al diagnóstico. La identificación de anomalías menores y mayores resulta trascendental en estos casos. Dentro del examen por sistemas, algunas alteraciones podrán sugerir la etiología de base. La presencia de trastornos pigmentarios cutáneos puede apuntar hacia trastornos neurocutáneos frecuentes, como la neurofibromatosis (Fig. 1), la hipomelanosis de Ito o la esclerosis tuberosa, u otros menos frecuentes, como la enfermedad de von Hippel-Lindau o la incontinentia pigmenti (Fig. 2)(12); la fotosensibilidad podrá orientar hacia la enfermedad de Hartnup, el exantema malar hacia la homocistinuria… Las alteraciones de anejos cutáneos pueden ser también orientativas; las alteraciones del cabello serán objetivables en la enfermedad de Menkes, en el hipotiroidismo… La presencia de hepatoesplenomegalia apuntará hacia mucopolisacaridosis, esfingolipidosis o glucogenosis, entre otras.
Figura 1. Manchas color “café con leche” características de la neurofibromatosis tipo 1.
Figura 2. Lesiones características de la incontinentia pigmenti.
Tras abordar un examen físico completo, se debe proceder a la exploración neurológica igualmente completa, valorando cualquier signo focal presente, asimetrías en el examen (Fig. 3), no obviando el examen craneal, la impresión subjetiva del nivel cognitivo, el examen del fondo de ojo ni la valoración neurosensorial.
Figura 3. Marcha de inicio asimétrica de niño con hemiparesia izquierda.
De igual modo, el fondo de ojo puede revelar trastornos pigmentarios (encefalopatías mitocondriales, síndrome de Cockayne, síndrome de Kearns-Sayre…), cataratas (síndrome de Down, rubéola gestacional, hipotiroidismo, galactosemia…) o manchas rojo cereza (mucolipidosis, gangliosidosis…).
El examen auditivo y visual se realizará en todos los casos; la audiometría convencional, la discriminación visual o auditiva, la campimetría por confrontación son medidas realizables en cualquier consulta pediátrica, si bien, complejas en el niño de corta edad.
La historia clínica y la exploración física completa y minuciosa, serán las que deberán orientar al diagnóstico, y a la consecuente realización de las exploraciones complementarias oportunas(8,10).
Exploraciones complementarias(1,4,7)
• Observación cualitativa: con independencia de la actitud y comportamiento del niño en la consulta (conducta, flexibilidad, lenguaje no verbal…), el pediatra puede solicitar la realización de dibujos, manipulación de juguetes, recabar información a través de los boletines de la escuela infantil… En ocasiones, los informes escolares apuntan información más objetiva de las habilidades motoras, verbales…
• Estudios analíticos: deberá valorarse la realización sistemática de: hemograma, bioquímica sanguínea, ionograma, gasometría, función hepática-renal, láctico, pirúvico, ceruloplasmina, función tiroidea, anticuerpos antitransglutaminasa IGA, amonio y ácido úrico en sangre. Ante la presencia de signos no estrictamente neurológicos (dismorfias, alteración del crecimiento, vómitos frecuentes, alteraciones cutáneas, cardiopatía o hepatoesplenomegalia) u otros neurológicos (sordera, alteración visual, trastorno del comportamiento, letargia o examen anormal) que apunten hacia un posible origen metabólico, el examen analítico será ampliado en consecuencia (Tabla V). Se determinarán: aminoácidos en sangre y ácidos orgánicos en orina, bioquímica y láctico en LCR, bioquímica básica de orina que incluya la presencia de cuerpos cetónicos y reductores, mucopolisacáridos y oligosacáridos en orina(13-15).
• Estudios neurorradiológicos: la utilidad de los estudios mediante resonancia magnética cerebral (RM) dependerá de los hallazgos clínicos y la severidad del retraso. En general, la rentabilidad diagnóstica de la RM cerebral en el RPM es escasa. Debe recomendarse en: RPM moderado-severo, dismorfias, epilepsia, alteraciones craneales asociadas o exploración neurológica anormal. Si es posible, sobre todo en caso de epilepsia con DI, debe de asociarse una espectroscopia a la misma, especialmente útil en la detección del déficit de creatina cerebral.
• Estudios genéticos: se ha producido un cambio espectacular en los últimos años. La inmensa mayoría de los pacientes con una DI padecen un trastorno genético, habitualmente estable, no progresivo. Los estudios genéticos básicos han pasado de ser el cariotipo, que generalmente revela escasa información, a la hibridación genómica comparada (CGH-arrays). Con esta prueba, se detectan casi todas las ganancias y pérdidas de material genético asociadas a síndromes de microdeleción y microduplicación, detectando aproximadamente un 20-30% de los casos de DI importante. Su rendimiento es mucho mayor si existen dismorfias o signos neurológicos asociados. Aunque previamente el síndrome X Frágil era una prueba protocolizada ante un varón con RPM importante de origen desconocido, su rendimiento bajo (0,5%) no justifica su realización rutinaria y, actualmente, se recomienda en un segundo escalón. En este segundo escalón, una nueva prueba, la secuenciación exómica, se está abriendo campo a grandes pasos, su rendimiento es muy alto [50% aproximadamente en los casos de DI importante en trío (paciente-padres) y con algunos kits más económicos del 25%]. A pesar de su alto precio, es de esperar que el coste baje de forma importante en muy pocos años y sea una herramienta perfeccionada y estandarizada que sustituya poco a poco a muchos métodos engorrosos (orinas de 24 horas, líquido cefalorraquídeo, biopsia muscular, etc.). Por supuesto, la detección de un síndrome clínico específico debe hacernos realizar el gen o genes característicos de dicho síndrome (p. ej.: analizar el gen MECP2 en una niña con algunos síntomas del síndrome de Rett). Por lo tanto, está pendiente el desarrollo de nuevos algoritmos diagnósticos consensuados, que con toda seguridad, van a modificar sustancialmente a los anteriores(16-18). Exponemos uno que pudiera ser útil en la figura 4(18).
Figura 4. Posible algoritmo en el diagnóstico genético de la discapacidad intelectual y/o retraso psicomotor.
• Otros exámenes: el EEG es una prueba obligada ante la presencia o sospecha de epilepsia. Otros estudios deberán realizarse dependiendo del caso: serie radiológica completa, ecografía visceral, electromiograma (si hipotonía-hiporreflexia, fenómenos miotónicos…), potenciales auditivos (si retraso específico del lenguaje, antecedente de sordera, infección durante el embarazo…) o visuales y biopsia muscular (enfermedad mitocondrial), entre otros.
Abordaje terapéutico
Es trascendental aportar una información realista de la situación clínica del niño con RPM, ni proteccionista ni catastrofista.
La mejor acción por parte del pediatra o neurólogo infantil debe ser el diagnóstico precoz. Este va a permitir la rehabilitación o reeducación de habilidades del paciente en los primeros años de vida, mejorando así las capacidades adaptativas del mismo. Deberá recibir igualmente el tratamiento específico a la etiología del RPM, si esto fuera posible (metabolopatías, epilepsia…). Debemos conocer los medios que el sistema sanitario y educativo pone a disposición de estos pacientes, para ofrecer al niño con RPM todas aquellas ayudas que puedan beneficiarle en los primeros meses o años de vida.
Desde el punto de vista farmacológico, no existen tratamientos específicos para el RPM. Se han empleado diferentes fármacos, con eficacia clínica muy cuestionable (citicolina, piracetam, vitamina B…), con el objeto de proteger la función cerebral. Sí existen tratamientos para mejorar los síntomas asociados, como el metilfenidato para mejorar la impulsividad e hiperactividad, o la risperidona para la agresividad.
Igualmente, debemos informar con serenidad a la familia de la sospecha del RPM. Es importante evitar informaciones catastrofistas o sobreproteccionistas. Con el seguimiento, deberemos registrar y notificar los avances del paciente.
En el apartado pronóstico, este vendrá relacionado con numerosos factores: la severidad del propio retraso, el origen del mismo, la presencia de otros trastornos (epilepsia, autismo, DI…).
Función del pediatra
El diagnóstico precoz del RPM es esencial. Ya en este primer apartado, el pediatra juega un papel principal. Dada la planificación del control del niño sano, el pediatra podrá valorar periódicamente el DPM del niño. Igualmente, podrá cuantificar o ponderar las características de la familia, su “potencial” estimulador, la presencia en los familiares de primer orden de dificultades de aprendizaje, retrasos…
Del mismo modo, a través de la historia clínica y la exploración física, podrá anticiparse en el diagnóstico. A la primera, tendrá acceso de forma constante, y podrá reevaluar ciertos aspectos que en una primera entrevista (no focalizada al diagnóstico de RPM) hayan podido quedar incompletos. La exploración del niño, tanto física como neurológica, será evolutivamente diferente; la adquisición de los hitos, la modificación de la exploración o la presencia de reflejos primitivos por encima de las edades normales ayudará al pediatra a estimar la presencia del RPM, su origen y severidad.
Aunque, en la mayor parte de los casos, la realización de estudios más complejos (estudios genéticos, neuroimagen…) recaerá en el neuropediatra, el pediatra coordinará las evaluaciones de las consultas, establecerá sospechas diagnósticas, supervisará diagnósticos previos, etc.
A nivel terapéutico, el pediatra deberá igualmente coordinar las medidas que el niño precise para prevenir, solucionar o rebajar los déficits parciales o globales de su DPM. Para ello, es imprescindible que el pediatra esté familiarizado con los apoyos o recursos de zona. A través de los controles periódicos, podrá igualmente estimar la eficacia de los apoyos establecidos.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** Fernández-Jaén A. Retraso psicomotor. En: Fernández-Jaén A, Calleja-Pérez B, eds. Patologías del feto y del lactante Vigo: Obradoiro Gráfico SL; 2000: p. 501-7.
2.** Borbujo JS. Desarrollo psicomotor hasta los 2 años; retraso en el desarrollo psicomotor. En: Aparicio-Meix JM, Artigas J, Campistol J, et al, eds. Neurología pediátrica. Madrid: Ergon; 2000.
3.*** Fernández-Jaén A, Roche MC, Pascual-Castroviejo I. Exploración clínica del niño. En: Grau Veciana JM, Escartín Siquier AE, eds. Manual del residente de neurología. Madrid: Sociedad Española de Neurología; 2000: p. 17-26.
4.*** García A, Narbona J, Martínez MA, Bejarano A. Retraso del desarrollo psicomotor. En: Verdú A, García A, Martínez B. Manual de Neurología Infantil. Madrid: Pubmed; 2008: p. 333-40.
5.*** Narbona J, Schlumberger E. Retraso psicomotor. En: Delgado Rubio A, ed. Protocolos Diagnósticos y Terapéuticos en Pediatría: Genética-Dismorfología, Neurología. 1. Bilbao: Asociación Española de Pediatría; 2000: p. 186-90.
6.*** Fenichel GM. Neurología pediátrica clínica un enfoque por signos y síntomas. (6ª edición) Barcelona: Elsevier España, S.L.; 2010.
7.** Fernández-Jaén A, Calleja-Pérez B. El retraso mental desde la Atención Primaria. Med Integr. 2002; 4: 141-6.
8.** Sherr EH, Shevell MI. Mental retardation and global developmental delay. En: Swaiman KF, Ashwal S, Ferriero DM, eds. Pediatric neurology: principles & practice. 4th ed. Philadelphia PA: Mosby Elsevier; 2006: 799-820.
9.*** Artigas-Pallarés J, Narbona J. Trastornos del neurodesarrollo. Barcelona: Viguera; 2011.
10.*** Jones KL, Smith DW. Smith’s recognizable patterns of human malformation. 6th ed ed. Philadelphia: Saunders; 2006.
11.** Cruz Hernández M, Bosch J. Atlas de síndromes pediátricos. Barcelona: Espaxs; 1998.
12.** Fernández-Jaén A, Martín Fernández-Mayoralas D, Calleja-Pérez B, Muñoz-Jareño N. Enfermedades neurocutáneas. Jano. 2007; 1667: 87-92.
13.** Kahler SG, Fahey MC. Metabolic disorders and mental retardation. Am J Med Genet C Semin Med Genet. 2003; 117C: 31-41.
14.*** Lyon G, Kolodny EH, Pastores GM. Neurology of hereditary metabolic diseases of children. 3rd ed. New York: McGraw-Hill, Medical Pub. Division; 2006.
15.*** Sociedad Española de Neurología, Liga Española Contra la Epilepsia. Epilepsia. Majadahonda (Madrid): Ergon; 2003.
16.** Redin C, Gérard B, Lauer J, et al. Efficient strategy for the molecular diagnosis of intellectual disability using targeted high-throughput sequencing. J Med Genet. 2014; 51: 724-36.
17. Srour M, Shevell M. Genetics and the investigation of developmental delay/intellectual disability. Arch Dis Child. 2014; 99: 386-9.
18. Shashi V, McConkie-Rosell A, Rosell B, et al. The utility of the traditional medical genetics diagnostic evaluation in the context of next-generation sequencing for undiagnosed genetic disorders. Genet Med. 2014; 16: 176-82.
Bibliografía recomendada
- Verdú A, García A, Martínez B. Manual de Neurología Infantil. Madrid: Pubmed; 2008.
Manual, completo y amplio, de presencia necesaria en la librería del pediatra, sobre las patologías neuropediátricas más frecuentes, su abordaje y tratamiento.
- Delgado Rubio A, ed. Protocolos Diagnósticos y Terapéuticos en Pediatría: Genética-Dismorfología, Neurología. 1. Bilbao: Asociación Española de Pediatría; 2000.
Tomo número 1 de la serie de Protocolos de la AEP. El primer tomo aborda los trastornos o síndromes genéticos más frecuentes o relevantes, así como los problemas neurológicos que más frecuentemente afectan a la población infantil. El capítulo de RPM vuelve a ser de relevante interés en el apartado etiológico.
- Fenichel GM. Neurología pediátrica clínica un enfoque por signos y síntomas. (6ª edición). Barcelona: Elsevier España, S.L.; 2010.
Manual esencial en Neurología Infantil. Aborda desde los síntomas y la exploración, los diferentes problemas que pueden estar tras los mismos. Es un manual obligado en la biblioteca del pediatra. Ahora disponible en castellano.
- Artigas-Pallarés J, Narbona J. Trastornos del neurodesarrollo. Barcelona: Viguera; 2011.
Revisión amplia y sencilla de los principales trastornos del neurodesarrollo. Los diferentes capítulos abordan los trastornos de la comunicación, el aprendizaje, la parálisis cerebral, los trastornos generalizados del desarrollo…
| Caso clínico |
|
Varón de 8 meses de edad, remitido por el pediatra, por retraso psicomotor y fenotipo particular. Los padres describen la presencia de sostén cefálico de inicio, sedestación ausente. Se coge los pies, pero no echa las manos a los objetos. Volteo ocasional. Ruidos. No vocales ni bisílabos. Se ríe. Empático. En los 3 meses anteriores a la consulta, recibe estimulación y fisioterapia. El embarazo fue normal. Parto instrumentado a término. Apgar: 9/10. Precisó reanimación superficial. No precisó ingreso al nacimiento. PRN: 3.020 g. TRN: 49 cm. PCef al nacimiento: 33,5 cm. No ha tenido enfermedades de interés. A los 5 meses, es valorado por departamento neuropediátrico, donde se solicita ECO cerebral, que muestra signos compatibles con hemorragia intraventricular leve, examen oftalmológico que evidencia un coloboma retiniano periférico en ojo derecho, cariotipo normal, PEAT que muestran una leve pérdida de audición de 20 dB bilateralmente y RM cerebral que desmuestra la presencia de megacistarna magna con dudosa paquigiria parietal derecha. Es la primera hija de unos padres no consanguíneos, y entre los antecedentes familiares no aparece nada destacable. Ante la insistencia, el padre apunta la presencia de una tía del mismo, fallecida en el primer año de vida por fetopatía rubeólica. La exploración física demuestra unos datos antropométricos normales y un fenotipo particular, con discreto hipertelorismo, nariz fina y levemente incurvada, labios finos, ojos almendrados con pequeñas hendiduras palpebrales, camptodactilia, mamilas separadas, mamila supernumeraria. El examen neurológico revela un bajo tono global, ROT vivos. R. de Moro ausente. Ausencia de respuesta de paracaídas. Pares craneales aparentemente normales. Evaluación simétrica. Escasa fijación de la mirada. Ruidos ocasionales. Ausencia de sedestación o sostén cefálico estable. A la vista de la exploración, y tras el hallazgo de un dudoso antecedente de retraso, solicitamos fotografías de la tía del padre. Aportan las mismas, encontrando un fenotipo similar al paciente. Se solicita un estudio genético más amplio (deleciones subteloméricas) que revelan una monosomia de la región cromosómica 2q37.3->qter de 5’6 Mb y una trisomía parcial de la región cromosómica 10q26.1 3->qter de 9’5 Mb de origen paterno. Posteriormente, se ha podido diagnosticar a una prima del paciente señalado, con retraso psicomotor y misma causa.
|
 |
| Editorial |
M.I. Hidalgo Vicario
Directora Ejecutiva de Pediatría Integral
| «El pediatra de Atención Primaria tiene una importante función en la detección precoz y el seguimiento de estos pacientes y sus familias tras el diagnóstico, evaluando los progresos del niño, procurando los cuidados de promoción y prevención de la salud, descartando problemas médicos coexistentes, así como apoyar y dirigir a las familias hacia programas educativos y conductuales lo más precozmente posible" |
El pasado 23 de septiembre, se publicó en la revista Neuron, un artículo de Stephan J. Sanders et al., sobre la arquitectura genómica y la biología de 71 loci de riesgo para los Trastornos del Espectro Autista (TEA)(1). Constituye el mayor estudio genético realizado sobre este trastorno hasta la fecha. El autismo es, en gran medida, un trastorno genético, por lo que la búsqueda de los genes implicados es un primer paso lógico para entender la neurobiología. Al tener en cuenta cuándo, dónde, y cómo estos genes interactúan, los estudios se pueden centrar en el período de tiempo de desarrollo, región del cerebro, y el tipo de células que se afectan.
Anteriormente, se realizaban estudios de genes candidatos que se creía que estaban relacionados con el autismo, mientras que en la actualidad, teniendo la cadena genética completa del individuo, así como de sus progenitores, los estudios van dirigidos a la búsqueda de duplicaciones o deleciones, que se mapean con una muestra de población control. La finalidad es encontrar las variaciones del número de copias, llamado Copy Number Variant (CNV) y compararlo con muestras de otros pacientes y familiares con autismo, así como con muestras control, y poder entender los mecanismos genéticos involucrados.
Los autores han observado que hay variaciones del número de copias de novo (dnCNV) asociados con el TEA y han replicado los estudios anteriores de la Colección de Simons (con 2.591 familias). También, encuentran mutaciones de novo asociadas en individuos con TEA y alto coeficiente de inteligencia. Las deleciones pequeñas de novo, pero no de las grandes (dnCNV) de algunos genes, tienen un alto riesgo para este trastorno. En definitiva, se han identificado 6 loci (1q21.1, 3q29, 7q11.23, 16p11.2, 15q11.2-13, y 22q11.2), así como 65 genes relacionados con TEA. Estos genes se dividen en 2 categorías funcionales, unos asociados al modelado de la cromatina y otros al desarrollo y trasmisión de las sinapsis. La relación entre esas dos categorías parece que es clave en la investigación. Pueden ser dos caminos separados o estar relacionados entre sí.
El estudio también proporciona pistas a la disparidad de sexo, con diagnósticos tres a cuatro veces más común en niños que en niñas; al parecer, las mujeres están protegidas contra el riesgo de autismo, a menos que su carga de mutación sea importante.
El TEA (DSM-5) o trastorno generalizado del desarrollo (CIE-10), es un trastorno biológico del neurodesarrollo, caracterizado por déficit en la comunicación e interacción social, con un patrón restrictivo y repetitivo de las conductas, los intereses y las actividades(2). El CIE-10 requiere que los síntomas se hayan iniciado antes de los 3 años, mientras que el DSM-5 no incluye corte de edad, indicando que los síntomas pueden no llegar a manifestarse hasta que las demandas sociales excedan los límites de las capacidades.
La prevalencia estimada del TEA es de 1/50 a 1/500 niños(3). Existe una heterogeneidad etiológica, no siempre la misma, en todas las familias y personas afectadas. Pueden influir factores ambientales (tóxicos, fármacos, infecciones en los primeros meses del embarazo, alteraciones obstétricas, inmunológicas, metabólicas…), antecedentes familiares de TEA (hermanos), dando lugar al trastorno con distinta amplitud y gravedad, produciendo alteraciones cerebrales tempranas.
El término “espectro” indica una amplia gama de presentaciones clínicas: unos niños tienen manifestaciones en el primer año de la vida con retraso en las habilidades sociales y de comunicación ya comentadas, mientras que otros desarrollan normalmente las habilidades, aunque luego se estancan, y otros niños manifiestan una franca regresión tras un desarrollo normal. La diversidad de manifestaciones clínicas dificulta la detección precoz y el diagnóstico, que en bastantes ocasiones no se confirma antes de los 3 años, así como su tratamiento. A ello, se añade el desconocimiento del trastorno en los ámbitos médicos y educativos. Es preciso ofrecer la información necesaria para realizar una detección precoz, tanto a los servicios educativos como a los pediatras de atención primaria, ya que son estos profesionales los que van a ser consultados en primer lugar por los padres, cuando detecten que algo no va bien en sus hijos, o los que pueden detectar las alteraciones en las evaluaciones programadas del niño. En nuestro medio, en un 80% de los casos, es la familia la primera en sospechar que hay un problema en el desarrollo de su hijo.
Dentro de las manifestaciones clínicas destacan:
Interacción social alterada: en lactantes hay falta de contacto visual, expresiones y gestos limitados, que se traduce a veces en una especie de sordera selectiva, ya que no suelen reaccionar cuando se les llama por su nombre. En niños pequeños: falta de interés en ser ayudados, falta de habilidad para iniciar o participar en juegos con otros niños o adultos, juegos en solitario y respuesta inapropiada en las relaciones sociales.
Alteración en la comunicación verbal y no-verbal: no usan el lenguaje verbal y/o corporal como comunicación funcional, incluso puede existir mutismo en los casos más graves. Algunos inician el desarrollo del lenguaje en el 1º año de vida, pero pueden sufrir una regresión a partir del 2º año y perderlo. Otros, en cambio, sufren retrasos generalizados en todos los aspectos del lenguaje y de la comunicación. Cuando el lenguaje está presente, existe alteración de la capacidad para iniciar o mantener una conversación, ecolalia, confusión de pronombres personales (se refieren a ellos mismos en segunda o tercera persona), repetición verbal de frases o de un tema particular y anormalidades de la prosodia. Utilizan un lenguaje estereotipado y repetitivo.
Restricción de intereses y comportamientos estereotipados y repetitivos. Preocupaciones absorbentes por uno o más patrones estereotipados y restrictivos que resultan anormales en su intensidad o en su contenido. Es común la insistencia exagerada en una misma actividad, rutinas o rituales específicos. Tienen escasa tolerancia a los cambios de las rutinas. Suelen adquirir manierismos motores estereotipados y repetitivos, tales como sacudir o girar las manos o dedos, o movimientos complejos de todo el cuerpo.
Otras manifestaciones comunes: respuesta inusual a estímulos (auditivos, visuales, táctiles, olores, sabores…). A veces, disfunción grave de la sensación del dolor que puede enmascarar problemas médicos (fracturas). Trastornos del comportamiento (hiperactivos, déficit de atención). Algunos pueden mostrar habilidades especiales en áreas concretas sensoriales, de memoria, cálculo, y otras, que pueden hacer que destaquen en temas, como por ejemplo: música, arte o matemáticas.
En ocasiones, los TEA pueden ir acompañados de otros problemas de salud como: epilepsia, discapacidad cognitiva, problemas del movimiento, alteraciones oculares y auditivas, macrocefalia, insomnio y otros. Además, a partir de la adolescencia, pueden empezar a manifestarse trastornos de salud mental asociados como el trastorno obsesivo compulsivo, ansiedad y depresión.
El pediatra de Atención Primaria (PAP) tiene una importante función en la detección precoz y el seguimiento de estos pacientes y sus familias tras el diagnostico, evaluando los progresos del niño, procurando los cuidados de promoción y prevención de la salud, descartando problemas médicos coexistentes, así como apoyar y dirigir a las familias hacia programas educativos y conductuales lo más precozmente posible. Será de ayuda, dar información sobre escuelas apropiadas, instalaciones de apoyo, grupos de padres y otros sistemas de apoyo comunitarios.
La detección temprana la puede realizar con escalas utilizadas, en nuestro medio, para la vigilancia del desarrollo del niño en los controles periódicos de salud: el Denver Developmental Screening Test (DDST-II) y la escala Haizea-Llevant permiten comprobar el nivel de desarrollo cognitivo, social y motor de niños de 0 a 5 años. Existen unas “señales de alerta tempranas” que indican la necesidad de una evaluación más específica, y otras señales de alerta según la edad del niño. Entre las primeras destacan: preocupación de los padres por déficits de habilidades sociales, en conducta, en lenguaje, comunicación o intolerancia al cambio. No balbucea, no hace gestos (señalar, decir adiós con la mano, conocer su nombre) a los 12 meses. No dice palabras sencillas o juego simbólico para los 18 meses. No dice frases espontáneas de dos palabras (no ecolálicas) a los 24 meses. Y cualquier pérdida de habilidades del lenguaje o a nivel social a cualquier edad.
Varias Guías de Práctica Clínica (SIGN, española) y la Academia Americana de Pediatría consideran el instrumento Modified CHAT o M-CHAT (The Checklist for Autism in Toddlers), como una herramienta útil para la confirmación de la sospecha clínica del TEA en niños de 16-30 meses, existiendo también otros cuestionarios. No obstante, los profesionales deben vigilar la posible presencia de señales de alarma, y los factores de riesgo comentados desde al menos los 6 meses de edad, derivando el paciente a la atención especializada y con experiencia en TEA cuando sea preciso. El diagnóstico es clínico y lo debe realizar un equipo multidisciplinar con experiencia, se basa en los criterios del DSM-5 y del CIE-10, siendo de utilidad determinadas herramientas como el ADI-R (Autism Diagnostic Interview Revised) o el ADOS (Autism Diagnostic Observational Schedule). El tiempo medio entre la evaluación inicial por sospecha y el diagnóstico es de 13 meses(3).
El PAP debe proporcionar información objetiva y sencilla a los padres sobre lo que son los TEA, ya que es fundamental que entiendan a sus hijos (porqué se comportan, cómo lo hacen), y responder ante cualquier duda, así como valorar el estrés del cuidador (generalmente la madre). La comunicación con los niños se realizará en ambiente tranquilo y coordinado con los padres, se pueden utilizar frases sencillas, cortas, órdenes directas, refuerzos con premios, e intervenciones con apoyo visual (pictogramas, viñetas, imitación en muñecos), p. ej.: mostrar instrumental. Para realizar determinadas técnicas y procedimientos, se valorará el riesgo/beneficio.
El TEA es un trastorno crónico que requiere una aproximación amplia y multidisciplinar por un equipo con experiencia (neurólogo, psiquiatra, psicólogo, genetista, pediatra, logopeda…). El tratamiento será individualizado (según la edad, las fortalezas, debilidades y necesidades del chico y su familia). Los objetivos son mejorar su funcionamiento en los diferentes aspectos afectados, dirigir al chico hacia la independencia y mejorar la calidad de vida. Los síntomas pueden disminuir con el tiempo y una minoría puede llegar a no tener disfunción. La mayoría necesitará algún tipo de apoyo especializado durante toda la vida. El tratamiento consiste en intervenciones conductuales y educacionales dirigidas al núcleo de los síntomas del TEA. La intervención conductual intensiva, ABA (Applied Comportamiento Análisis), tiene por objeto reforzar las conductas deseables y disminuir las indeseables. Los objetivos son enseñar nuevas habilidades y generalizar las habilidades aprendidas descomponiéndolas en sus elementos más simples. Se enseñan a través de ensayos basados en recompensas repetidas(3). Los tratamientos farmacológicos pueden usarse, en ocasiones, ante comorbilidades psiquiátricas por especialistas, además del tratamiento médico. Los programas se monitorizarán y modificarán según las necesidades del niño.
Se debe informar a los padres de que actualmente no existe evidencia de la efectividad de las dietas libres de gluten y caseína; suplementos de vitamina B6 + magnesio, ácidos grasos Omega-3, dimetilglicina, oxígeno hiperbárico y musicoterapia, para el tratamiento de los TEA.
Aunque no hay cura para el TEA, un diagnóstico y tratamiento temprano mejora el pronóstico significativamente, ya que favorece: el inicio del tratamiento, el apoyo familiar con reducción del estrés, y la adaptación social del niño facilitando la generalización de las conductas aprendidas y la calidad de vida. Es precisa la formación de los profesionales sanitarios, así como de los maestros, y trabajar conjuntamente con los padres y el equipo terapéutico.
Bibliografía
1. Sanders S, He X, Jeremy Willsey A, Gulhan Ercan-Sencicek A, Samocha K, Ercument Cicek A et al. Insights into Autism Spectrum Disorder Genomic Architecture and Biology from from from 71 from 71 Risk Loci. Neuron. 2015; 87(6): 1215-53.
2. American Psychiatric Association. Autism spectrum disorders. In: Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition. American Psychiatric Association, Arlington, VA. 2013. p50.
3. Bridgemohan C, Augustyn M, Torcha M. Autism spectrum disorders: Surveillance and screening in primary care. Uptodate 2015, Jun 17.
 |
| El Rincón del Residente |
Coordinadores:
F. Campillo i López, E. Pérez Costa, D. Rodríguez Álvarez, E. Ballesteros Moya
Residentes de Pediatría del Hospital Universitario La Paz. Madrid
Autores:
A. Rodríguez Vidal*, M. el Kadaoui Calvo**, R.M. Alcobendas Rueda***
*Médico Residente de Pediatría. Hospital Clínico Universitario de Santiago de Compostela. **Médico Residente de Pediatría. Hospital Universitario La Paz. ***Médico Adjunto de la Unidad de Reumatología Pediátrica. Hospital Universitario La Paz.
| El Rincón del Residente es una apuesta arriesgada de Pediatría Integral. No hemos querido hacer una sección por residentes para residentes. Yendo más allá, hemos querido hacer una sección por residentes para todo aquel que pueda estar interesado. Tiene la intención de ser un espacio para publicaciones hechas por residentes sobre casos clínicos e imágenes entre otras. ¡Envíanos tu caso! Normas de publicación aquí |
Pediatr Integral 2015; XIX(8): 573.e1-573.e6
Cojera de inicio brusco en un lactante
Caso clínico
Varón de 21 meses de edad, sin antecedentes personales ni familiares de interés. Consultó por cojera de inicio brusco en miembro inferior derecho de 72 horas de evolución, sin traumatismo previo conocido. No referían rigidez matutina, fiebre ni otros síntomas acompañantes.
Exploración física
Se observó cojera y un punto doloroso a la presión en tercio distal de tibia derecha. El resto de la exploración física era normal.
Pruebas complementarias
El hemograma y la bioquímica no mostraron alteraciones (proteína C reactiva 5,3 mg/L y VSG 14 mm/h). La radiografía de la pierna no mostraba discontinuidad de la cortical (Fig. 1).

Sin embargo, debido a la persistencia de la clínica a los 10 días, se realizó una gammagrafía ósea con tecnecio 99 (Fig. 2).

 |
| 20 Aniversario |
M.J. Mardomingo Sanz
Doctora en Medicina. Especialista en Pediatría y Psiquiatría. Especialista en Psiquiatría Infantil.

Epigenética y trastornos psiquiátricos
Introducción
El médico del siglo XXI y de modo particular el pediatra, se encuentra ante el gran reto de conocer y comprender los avances del conocimiento científico de nuestro tiempo y sus implicaciones en la prevención y tratamiento de las enfermedades de los niños. Es éste un desafío inmenso y también apasionante.
Uno de los campos más complejos y que ha experimentado una mayor transformación en las últimas dos décadas es el de la genética, con logros trascendentales, como: el proyecto genoma humano (Human Genome Project), que culmina en 2003 con la secuencia de 20.000-25.000 genes y la identificación de 3.500 millones de pares de bases del ADN; la puesta en marcha del proyecto epigenético humano (Human Epigenome Project) en 1999; y la realización del proyecto ENCODE (ENCyplediaOfDnaElements), que identifica los elementos funcionales de la secuencia del genoma humano y culmina en 2012. Queda claro, que no basta con conocer el número de genes y dónde se ubican, sino que es necesario descubrir su función y significado. Es preciso entender, cómo los genes interactúan con el ambiente, cómo interactúan entre sí, cómo el ambiente modifica su expresión y, en último término, cuáles son los mecanismos de la herencia genética y no genética(1).
De este modo, se someten a crítica y revisión los grandes paradigmas históricos sobre la herencia, que nacen con los trabajos de tres figuras esenciales: Jean Baptist Lamarck, Charles Darwin y Gregor Mendel. La herencia genética de Mendel se complementa con conceptos nuevos sobre otros modos de herencia no genéticos, a través fundamentalmente de mecanismos de silenciamiento de genes, a través de mecanismos epigenéticos.
Los estudios genéticos permiten descubrir las bases moleculares de la conducta y de la génesis de las enfermedades, personalizar los tratamientos y analizar su eficacia. Son una de las vías de investigación más destacadas de la etiopatogenia de los trastornos psiquiátricos, el cáncer, las enfermedades inmunes y de las denominadas “enfermedades de la vida moderna”, tales como: la obesidad, la hipertensión, las enfermedades cardiovasculares y el estrés.
El avance de la genética puede significar una revolución de los métodos de diagnóstico y tratamiento y, tal vez, también signifique un auténtico cambio de paradigma de la medicina. Ha llegado el momento de identificar los genes, sus variantes, el epigenoma, los factores de transcripción de la información, las interacciones de unos genes con otros, la función exacta que tienen y la relación de los genes con los factores ambientales. También ha llegado el momento, de conocer la función de esa gran cantidad de ADN, nada menos que el 98,5%, que no está formado por genes, pero que regula su función a distancia y es responsable de numerosas enfermedades.
Se trata de llegar a saber de qué modo la experiencia individual induce cambios en la expresión de los genes y pone en marcha las enfermedades y de qué modo estos cambios moleculares perturban la memoria, la cognición, las emociones y la conducta y dan lugar a trastornos psiquiátricos. La investigación de las últimas décadas pone de manifiesto que, cuanto más se sabe acerca de los genes, mayor importancia adquiere el ambiente. El progresivo descubrimiento de los mecanismos epigenéticos plantea de nuevo uno de los temas trascendentales de la pediatría y la psiquiatría infantil de todos los tiempos, el de la naturaleza y la crianza, la “natura” y la “nurtura”, y lo hace desde una perspectiva nueva y apasionante. Son las preguntas de siempre, pero desde distintas perspectivas y con nuevas respuestas.
Concepto de epigenética
El término “epigenética” deriva del prefijo griego “epi” que significa “sobre” o “en” y fue introducido en la literatura por el biólogo Conrad Hal Waddintong (1905-1975) en el año 1940. El autor se refiere a las interacciones de los genes con el ambiente que dan lugar al fenotipo. Más adelante, Waddington destaca dos características de los mecanismos epigenéticos: la plasticidad y la posibilidad de que la respuesta adaptativa del organismo al ambiente quede fija sin necesidad de que se produzca una mutación y sin que, por tanto, se modifique la estructura del ADN. Esto significa que el cambio pueda tener un carácter estable y, en consecuencia, heredarse. Por lo tanto, según Waddintong, los mecanismos epigenéticos proporcionan al organismo la capacidad de reaccionar a las contingencias ambientales de forma rápida mediante cambios moleculares que alteran la expresión de los genes. Estos cambios tienen lugar en el soporte físico del ADN, que es precisamente la cromatina.
Se trata, por tanto, de mecanismos en los que se altera la función de los genes, que suelen quedar silenciados, lo que se traduce en el fenotipo, sin que por eso se modifique la secuencia de bases del ADN. Dentro de los factores ambientales que dan lugar a cambios epigenéticos, destacan: los factores prenatales y postnatales, como la desnutrición, el que la madre fume o consuma drogas durante el embarazo, el maltrato o el estrés.
Los mecanismos epigenéticos consisten fundamentalmente en: metilación del ADN, modificación de las histonas y remodelado de la cromatina. Dos de sus características más relevantes, tal como se decía más arriba, son: la posibilidad de ser reversibles o por el contrario el tener un carácter duradero y transmitirse, por tanto, de padres a hijos. El hecho de que puedan ser reversibles, abre sin duda grandes perspectivas de cara al tratamiento y la prevención.
Conocer cómo tiene lugar el proceso de regulación y expresión de los genes a lo largo del tiempo, como respuesta a los estímulos intra y extracelulares, es uno de los temas de mayor interés en genética. Interesan no solo los genes, como tales, sino su soporte, la cromatina. Podría decirse que la cromatina es el libro cuyas palabras son los genes. Este libro tiene que ser abierto, para encontrar esas palabras, y así ser leído y comprendido(2). La regulación epigenética de la expresión de los genes se refiere a este proceso. La interacción de los genes con el ambiente a lo largo de la vida da lugar al fenotipo y tiene lugar, entre otros, a través de estos mecanismos epigenéticos que se caracterizan por la plasticidad y la estabilidad, pudiendo ser reversibles o por el contrario heredarse. Esta interacción acontece a lo largo de toda la vida y es fundamental en tres etapas concretas: el embarazo, los primeros años de vida y en aquellos momentos en que tienen lugar cambios hormonales, como sucede durante el periodo de fertilidad(3). Tienen un papel destacado en: el desarrollo normal del sistema nervioso y en la etiología de los trastornos psiquiátricos, los síndromes malformativos, las enfermedades degenerativas y el sistema de respuesta al estrés. Durante el periodo de desarrollo del sistema nervioso, actúan sobre fenómenos tan importantes como la plasticidad sináptica y los procesos cognitivos, de modo particular sobre el aprendizaje y la memoria.
Uno de los mecanismos de regulación epigenética descubierto recientemente y que abre una vía de investigación más interesante, son los micro ARNs (miRNAs), que pertenecen a la familia de ARN no codificante (ncRNAs) cuya función es regular la expresión de los genes, ejerciendo así un papel muy importante en el desarrollo del sistema nervioso. Los ncRNAs se expresan en el cerebro y regulan la génesis de las neuronas y su destino final, las vías de migración, la formación de las dendritas y de sus espinas, la complejidad de los axones, la formación y función de las sinapsis y los procesos de la memoria y la cognición. Son fundamentales para el desarrollo normal de la conducta y, cuando se altera su expresión, dan lugar a trastornos del neurodesarrollo, como: síndrome de William, síndrome de Rett, síndrome X Frágil, alcoholismo fetal, epilepsia, trastorno bipolar o esquizofrenia. En el caso de la esquizofrenia, estas alteraciones pueden tener un carácter causal. Por tanto, fenómenos que tienen lugar durante las primeras etapas del desarrollo, en el embarazo y en los primeros años de vida, tienen consecuencias duraderas en los procesos cognitivos y en el comportamiento del adulto. Es muy probable, que el estudio de los miRNAs contribuya a una mejor comprensión de los mecanismos moleculares subyacentes a los trastornos psiquiátricos y al diseño de nuevos medicamentos(4).
Desde la perspectiva pediátrica, se constata cómo los factores ambientales, de modo particular los intrauterinos y las experiencias de los primeros años de vida, pueden dar lugar a cambios epigenéticos que aumentan la susceptibilidad del sujeto a sufrir trastornos del neurodesarrollo, pero también enfermedades, como: el cáncer, la obesidad, la esquizofrenia, la depresión, los trastornos de conducta, el retraso mental o el consumo de drogas(5,6), indicando el enorme interés de este tema para comprender la etiopatogenia de las enfermedades. Pero no solo son fundamentales para entender los mecanismos de numerosas enfermedades, sino también, el desarrollo normal de la conducta del niño y la personalidad del futuro adulto(7). De este modo, un tema esencial de la Pediatría, como es la crianza de los niños por parte de los padres, surge de nuevo y desde otra perspectiva, como un elemento fundamental del desarrollo humano. Ya no se trata de “natura versus nurtura”, sino de genes y ambiente interactuando entre sí, genes y educación influyéndose y modificándose. Visto desde una perspectiva existencial, puede decirse que no solo cuenta el determinismo de la herencia con la que se nace, sino las decisiones paternas y más tarde las del propio individuo, que contribuyen a configurar el estado de salud, la personalidad y, en último término, la vida.
Los genes se expresan a lo largo de la vida del individuo y lo hacen en función de la programación genética y de las circunstancias personales y sociales en las que esa vida transcurre y con las que los genes interactúan, lo que explica las enormes diferencias entre unos y otros individuos y entre las distintas especies. Todo ello, explica el carácter único de la vida de cada persona.
Los mecanismos epigenéticos regulan la expresión de los genes y, por tanto, el estudio de la genética es inseparable del estudio de la epigenética y viceversa. La epigenética es un campo relativamente nuevo, como lo son las enfermedades de etiología compleja, y ha precisado de los avances tecnológicos de los últimos años. Sus aplicaciones a la comprensión de las enfermedades y a la realidad personal de los pacientes irán llegando poco a poco.
Interacción genes-ambiente
Un tema fundamental para entender trastornos psiquiátricos, como el autismo o la esquizofrenia, es conocer el papel de los genes en el desarrollo del sistema nervioso. Mientras que los genes estructurales producen proteínas funcionales para el organismo, los genes reguladores tienen como misión controlar en qué situaciones se activan otros genes. En este proceso de activación y silenciamiento de genes son esenciales los factores ambientales, lo que pone de nuevo de manifiesto la falacia de la dicotomía entre natura y nurtura.
La interrelación e interdependencia de genes y ambiente se manifiesta en primer lugar a nivel microscópico y celular, de manera que la expresión del código genético depende en gran medida de la presencia de factores de transcripción en el microambiente del núcleo de la célula. Los mecanismos de transcripción y traducción de la información genética, contenidos en el ADN, son imprescindibles para la síntesis de las proteínas y se han desarrollado con toda seguridad durante miles de años, a lo largo de la evolución de la especie. Hasta tal punto, la actividad de los genes está regulada por factores de su medio ambiente, que dicho de una forma sencilla, un gen codifica una enzima si está presente el sustrato en el cual esa enzima ejerce su actividad. Un papel similar a los factores ambientales lo cumplen las citocinas del sistema inmune y las hormonas del sistema endocrino, las cuales regulan la síntesis de enzimas por el ADN en los cromosomas.
Al principio, el ambiente de la célula está constituido por el citoplasma, después se amplía al medio intercelular abarcando las conexiones célula-célula, célula-medio extracelular, neurona-célula de glía y neurona-neurona distante. Más tarde, el sistema nervioso experimentará la influencia de los factores ambientales intrauterinos y perinatales, para incorporar después las experiencias postnatales de los primeros años de vida (experiencia temprana), con especial relevancia del medio familiar y social del niño(8).
Parece bastante claro, que ya no es posible entender por separado la acción de los factores: genéticos, epigenéticos y ambientales, ya que se influencian mutuamente. De hecho, los cambios en el medio exterior o macroambiente, se traducen en cambios en el medio interno o microambiente y viceversa. La secuencia de acontecimientos puede resumirse de la siguiente manera: la experiencia individual da lugar a cambios moleculares que modifican la expresión de los genes, pudiendo alterarse la función de las neuronas y de los circuitos neuronales, lo que a su vez altera los procesos cognitivos, las emociones y el comportamiento, dando lugar a las enfermedades psiquiátricas (Fig. 1). Al mismo tiempo, el individuo tiene la oportunidad de aprender de los acontecimientos, reflexionar sobre sus consecuencias y tomar decisiones acerca de su propia vida.
Figura 1. Experiencia individual, genes y enfermedades psiquiátricas. Tomado de Mardomingo MJ: Genética del desarrollo de la conducta. En: MJ Mardomingo “Tratado de Psiquiatría del niño y del adolescente”, Madrid, Díaz de Santos, 2015, pp 75-104.
Herencia genética y herencia no genética
Hasta hace no muchos años, los conocimientos sobre la transmisión hereditaria de las enfermedades se limitaban al modelo mendeliano de herencia, según el cual, el trastorno se debe a la mutación de un único gen, bien sea de carácter dominante, recesivo o ligado al cromosoma X. Posteriormente, se comprobó que numerosas enfermedades –como es el caso de los trastornos psiquiátricos– responden a un modelo multigenético en el que son varios, cuando no múltiples, los alelos implicados, contribuyendo cada uno de ellos en una pequeña proporción a la etiología del trastorno. Esta característica presente en el autismo, la esquizofrenia, el trastorno bipolar o el TDAH, confiere una particular complejidad al estudio de la etiología, teniendo que señalar, que la mayoría de los trastornos psiquiátricos se caracterizan por una alta carga hereditaria, que oscila desde 0,81 en la esquizofrenia a 0,37 en la depresión y 0,50 en los trastornos de conducta(9) (Tabla I).
Por otra parte, el descubrimiento de la herencia no genética, que consiste en la transmisión a las generaciones posteriores de cambios funcionales del ADN consecutivos a mecanismos epigenéticos, ha abierto nuevas vías de investigación y comprensión de la naturaleza humana.
Conviene resaltar que el hecho de que se sepa que numerosas enfermedades y la mayoría de los trastornos psiquiátricos responden a un modelo multigénico y multifactorial no significa que se conozca exactamente cómo sucede y en qué consiste. Se han elaborado dos hipótesis: la hipótesis de la “variante común-trastorno común” y la hipótesis de la “variación genética rara”.
De acuerdo con la primera hipótesis, el riesgo genético de la mayoría de los trastornos psiquiátricos se debería a variaciones de alelos habituales en la población general. Estas variaciones se definen como polimorfismos genéticos, que están presentes en más de un 1% de los individuos. Es lo que sucede, por ejemplo, en la enfermedad de Alzheimer y en otros trastornos que suelen manifestarse en épocas tardías de la vida.
Puede también suceder que determinados alelos que han tenido una misión de protección del individuo y, por tanto, de sobrevivencia de la especie, dejen de cumplir su función en un momento determinado por cambios en las circunstancias ambientales. Es lo que probablemente sucede con los genes de la obesidad, que fueron un factor de protección en las épocas de hambruna, pero que se han convertido en un riesgo de obesidad en estos tiempos de sobreabundancia de alimentos(10).
La segunda hipótesis plantea la posibilidad de que la mayoría de los trastornos psiquiátricos que comienzan en la infancia se deban a variaciones genéticas raras o poco comunes. Esto puede suceder a través de diversos mecanismos, como la acumulación de numerosas mutaciones raras en uno o en varios genes, lo que se denomina “heterogeneidad alélica”, o bien una mutación rara en algunos de los genes que forman parte de un grupo más numeroso, dando lugar a un fenotipo semejante, es lo que se llama “heterogeneidad de locus”. Una tercera posibilidad es que ambos tipos de heterogeneidad, alélica y de locus, se combinen dando lugar a un síndrome psiquiátrico único, lo que sería especialmente plausible en el caso de los trastornos psiquiátricos que comienzan en la infancia y que tienen carácter grave(11).
Una de las consecuencias más importantes del descubrimiento del genoma humano ha sido comprobar que el genoma normal consta de numerosas variaciones estructurales del tipo de duplicaciones y deleciones que están presentes incluso en regiones de gran trascendencia biológica(12). Esto significa que hay que ser cautos en la interpretación del papel que pueda tener la existencia de estas variantes en un individuo concreto y su relación con la patología. Hasta hace no mucho, la pérdida o ganancia de material genético se consideraba como causa del fenotipo en estudio y esto no tiene por qué ser así, pues puede tratarse simplemente de una variante normal del genoma. También, puede ser que el número de copias de la variación contribuya al riesgo de que aparezca dicho fenotipo.
Otro tema de interés es la constatación de que hay variantes genéticas que están implicadas en varios trastornos psiquiátricos, por ejemplo, hay variantes genéticas comunes a la esquizofrenia y al trastorno bipolar, con una correlación alta. La correlación es moderada entre esquizofrenia y depresión mayor y entre trastorno bipolar y depresión mayor, y baja pero significativa, entre esquizofrenia y síndrome de Asperger(13). Esto tal vez significa que algunas variantes genéticas tienen un papel sobresaliente y de carácter general en la salud mental del individuo.
Experiencias tempranas
Las experiencias tempranas de la vida y de modo particular la interacción madre-hijo es uno de los temas que ha despertado y despierta un mayor interés en pediatría, psicología y psiquiatría. El maltrato, el abandono, la institucionalización, la conflictividad en el medio familiar y la interacción anómala madre-hijo son circunstancias ambientales que dan lugar a retrasos y trastornos del desarrollo del niño, cuyos efectos se prolongan en la vida adulta marcando la biografía del individuo. Los estudios clínicos y en modelos animales indican con pocas dudas cómo estos factores ambientales anómalos, son factores de riesgo de psicopatología a lo largo de la vida.
Los estudios en modelos animales constatan cómo la ausencia de cuidados por parte de la madre da lugar a alteraciones en la reactividad al estrés de la prole, de tal modo que el animal es mucho más vulnerable y sufre altas dosis de ansiedad. Tiene lugar, además, una transmisión generacional de la conducta materna perturbada, que el animal maltratado lleva a cabo con sus propios hijos(14,15).
Estas alteraciones se asocian a cambios en la expresión de los genes que tienen lugar en la infancia y se mantienen de forma duradera. Los efectos a largo plazo se producen a través de modificaciones epigenéticas de los genes promotores de diferentes receptores, como el receptor de glucocorticoides. Estos cambios epigenéticos, consistentes por ejemplo en metilación del ADN, pueden ser críticos para el efecto de los cuidados maternos sobre la expresión de los genes, dando lugar a diferentes fenotipos en la prole, aumentando la vulnerabilidad para sufrir trastornos de ansiedad, depresión, adicción a drogas o trastorno de estrés postraumático, tanto en la infancia como en las futuras generaciones(16,17).
Los modelos animales son una de las fuentes más importantes de investigación en este tema, pues permiten estudiar de qué forma pequeñas modificaciones en el medio ambiente, inducen cambios en la expresión de los genes en el sistema nervioso y en la conducta del animal. El aislamiento de la madre y la falta de contacto con los compañeros son dos de los factores ambientales más relevantes, observándose alteraciones de la reactividad al estrés y de la conducta social y materna de la prole.
Otra línea de investigación de este tema son los estudios etológicos, que destacan la importancia de las primeras fases del desarrollo para la normalidad de la conducta del animal, y el carácter patógeno, en ocasiones irreversible, que pueden tener circunstancias ambientales adversas. Estudios en monos –un animal tan cercano a los humanos del que solo nos diferencia un 1% del genoma– constatan que la deprivación materna y el aislamiento del animal son dos circunstancias ambientales altamente lesivas para el monito, quien sufre trastornos de conducta y adaptación social en la infancia y anomalías en la elección de pareja y en las conductas maternales con la prole cuando es adulto(15).
La experiencia temprana anómala repercute también en la función inmunitaria del animal y en la función neuroendocrina, modificando la susceptibilidad frente a agentes patógenos, como virus, y la capacidad de respuesta del organismo ante acontecimientos vitales estresantes(17,18).
La investigación de los factores de riesgo de tipo ambiental para la normalidad de la conducta humana ha enlazado con el estudio de los factores que tienen un carácter protector. El contacto con la madre y la interacción adecuada madre-hijo, tiene un efecto regulador clave del equilibrio homeostático del organismo, de la protección para sufrir enfermedades y de la normalidad de la conducta del animal y del ser humano. Los cuidados maternos son, por tanto, necesarios para el desarrollo normal de la conducta y para prevenir trastornos psiquiátricos y otras enfermedades en la prole. El contacto con la madre tiene profundos efectos en la estructura del ADN, que modifican a su vez la actividad de genes esenciales para la respuesta al estrés y la conducta materna adulta(17,18). La interacción madre-hijo y los buenos cuidados ocupan un lugar central, modulando las respuestas del niño y marcando un estilo de conducta que se prolongará a lo largo del tiempo. La ausencia de la madre y el maltrato son dos de las circunstancias con un mayor poder lesivo.
Depresión
La depresión es un trastorno que se caracteriza por la complejidad de la etiopatogenia pues intervienen factores: genéticos, neuroquímicos, neuroendocrinos, inmunológicos, ambientales y de resistencia al estrés. El papel de los mecanismos epigenéticos se empezó a sospechar al observarse que el tratamiento con antidepresivos tiene que ser duradero y mantenerse a lo largo del tiempo para que sea eficaz y beneficie a los pacientes. Esta observación hizo pensar que en la depresión tienen lugar cambios moleculares de carácter estable, que afectan a estructuras cerebrales como el hipocampo, el núcleo accumbens y la corteza prefrontal, que pueden deberse a modificaciones epigenéticas sobre las que a su vez actuarían los antidepresivos.
La depresión se caracteriza por tener una carga hereditaria relativamente baja, mucho menor que en otras enfermedades psiquiátricas, lo que subraya la importancia de los factores ambientales y de otras circunstancias en la etiopatogenia. Además de estas diferencias respecto a la herencia entre gemelos monocigóticos, también se han observado diferencias desde el punto vista epigenético.
Las investigaciones en modelos animales aprecian cambios epigenéticos cuando al animal se le somete a una situación de estrés. Así, en ratas, se observa que el animal expuesto a la acción de un agresor, evita la presencia de este cuando aparece de nuevo, una circunstancia que se describe como de “fracaso social por estrés”(2). Esta situación de fracaso social se acompaña de cambios en la cromatina, que se traducen en una regulación a la baja de carácter estable de los receptores del BDNF (factor neurotrófico derivado del cerebro), BDNFIII y BDNFIV en el hipocampo, y en una regulación al alza de las marcas represoras de metilación de las histonas 3, en la región promotora del BDNF y de la orexina(19).
Además de los cambios en el hipocampo, también se observan alteraciones en el núcleo accumbens, tanto en ratas como en humanos, con regulación a la baja de la histona deacetilasa 5 y de la histona deacetilasa 2(20) y alteraciones en la corteza prefrontal en humanos con un aumento de la metilación del ADN(21). Por tanto, la acción del estrés es fundamental para que se generen estas alteraciones moleculares.
El tratamiento de los ratones con imipramina revierte la represión del BDNF, aumentando la acetilación de histonas, lo que abre nuevas vías de comprensión del mecanismo de acción de los fármacos antidepresivos y nuevas perspectivas para los tratamientos. El tratamiento prolongado con fluoxetina refuerza, asimismo, la transcripción de MBD1 (proteína unida a metil-CpG) en la corteza frontal, estriado e hipocampo en la rata, concretamente en las interneuronas gabaérgicas, un dato de gran interés, ya que en los pacientes que tienen depresión mayor y en los que cometen suicidio, hay anomalías en la transmisión sináptica y en la metilación del gen del GABA(2).
Estos hallazgos indican que en la depresión existe una vulnerabilidad individual, por la presencia de diferentes variantes genéticas con las que nace el individuo, a la que se suman las modificaciones epigenéticas consecutivas a factores ambientales que acabarán traduciéndose en el cuadro clínico de la enfermedad.
Parece evidente que la investigación genética de la depresión es uno de los campos más interesantes de la psiquiatría actual y es muy posible que las medidas terapéuticas y preventivas de los próximos años se basen en estos descubrimientos. El estudio progresivo de los mecanismos epigenéticos es esencial para comprender de qué forma la adaptación del individuo al estrés se traduce en la expresión estable de los genes y en cambios adecuados de comportamiento, mientras que la mala adaptación da lugar al silenciamiento de genes y al aumento de la vulnerabilidad para sufrir depresión, un fenómeno que puede persistir a lo largo de la vida y transmitirse a futuras generaciones.
Las nuevas investigaciones sobre los mecanismos epigenéticos de la depresión abren nuevas vías para la prevención y el tratamiento, pues estas alteraciones epigenéticas, que pueden ser reversibles, podrán convertirse en dianas terapéuticas de nuevos tratamientos.
Abuso de sustancias
La adicción a drogas es uno de los fenómenos sociales que produce una mayor preocupación por sus consecuencias individuales, familiares y económicas. El alcohol y el tabaco forman parte de la vida de muchísimos adolescentes que no perciben el riesgo que puedan tener y la edad de consumo ha disminuido considerablemente en los últimos años(22). El consumo de cocaína, estimulantes, drogas de diseño y tranquilizantes también ha aumentado. De acuerdo con el Observatorio Español de Drogas, el 50%-75% (2009) de los adolescentes españoles ha probado alguna droga ilegal y el 20-40% ha tenido contacto con más de una. En cuanto a la población general, un 10% tiene problemas con el alcohol y un 2% sufre dependencia.
Para algunas personas, el contacto con las drogas tiene un carácter transitorio, pasajero, sin consecuencias negativas en la propia vida; pero para otras, ese primer contacto supondrá que las drogas pasen a ocupar un lugar central en su existencia. Poder diferenciar a ambos grupos, y por tanto prevenir la mala evolución, es uno de los retos de la psiquiatría y la pediatría. El consumo de drogas depende de factores genéticos, características temperamentales y de personalidad, y circunstancias ambientales. Se calcula que el riesgo genético es del 50%, pero se desconocen los genes que intervienen. Lo que se constata a diario en la clínica es que el fenotipo adictivo tiende a persistir a lo largo de la vida, repitiéndose los episodios de abstinencia, búsqueda de la droga y dependencia, incluso después de años de haber estado el sujeto libre del problema. Esta tendencia a la persistencia y, por tanto a la cronicidad, plantea la hipótesis de que las drogas den lugar a cambios estables y duraderos de la función cerebral, que son la base de las conductas adictivas, en los cuales los mecanismos epigenéticos desempeñan probablemente un papel clave.
Así como está bien demostrado que los cambios epigenéticos que se traducen en el silenciamiento o la activación de genes son esenciales durante el desarrollo y los primeros años de vida, parece cada vez más probable que estos mismos mecanismos actúen como mediadores de la adaptación del organismo a los estímulos ambientales a lo largo de la vida. Uno de estos estímulos ambientales serían las drogas.
Los estudios en modelos animales ponen de relieve que el consumo de drogas da lugar a una respuesta adaptativa del cerebro que consiste en modificaciones epigenéticas que afectan a la acetilación y fosforilación de histonas, metilación del ADN, cambios en el modelado de la cromatina e inducción de ncRNAs. Estos cambios en la expresión de los genes son el modo de respuesta y adaptación del cerebro al consumo de drogas, unos cambios que contribuyen a explicar el carácter crónico del trastorno(23).
Las modificaciones epigenéticas inducidas por las drogas se producen precisamente en las estructuras y circuitos cerebrales implicados en la adicción a sustancias. Estas estructuras constituyen el circuito de recompensa y refuerzo que es fundamental en los mecanismos de la adicción. Este circuito está compuesto por el área tegmental ventral, la corteza prefrontal medial, el núcleo accumbens y la amígdala que, a su vez, se conectan con el hipotálamo lateral, el locus coeruleus y los núcleos del rafe. Su acción consiste en convertir los estímulos emocionales en motivaciones que se traducen en actos a través de las vías extrapiramidales, lo que explicaría la estrecha relación entre el deseo del adicto de consumir droga y la búsqueda compulsiva de la misma. El núcleo accumbens puede considerarse como el transformador central del sistema de recompensa, capaz de integrar funciones motoras, endocrinas, viscerales, somáticas, emocionales y conductuales(24).
Se han descrito cambios epigenéticos en la ingesta aguda y crónica de alcohol, consistentes en una mayor acetilación de histonas en la amígdala, corteza frontal y estriado(25), mientras que en la adicción a morfina aumenta la fosforilación de histonas en el estriado(26). En la adicción a cocaína, se produce un aumento de la acetilación de histonas 3 y 4, mediado por la proteína unida a CREB, en el estriado y en el núcleo accumbens del ratón(27,28), así como un aumento de la fosfoacetilación(27). También, se da una disminución de la metilación de histonas en el núcleo accumbens(29) y un aumento de la metilación del ADN en estriado, corteza cerebral e hipocampo(30). En la adicción a anfetamina, hay un aumento de la metilación y una disminución de la acetilación de histonas en el núcleo estriado, así como un aumento de la metilación de ADN en el núcleo accumbens.
La adicción a drogas es un fenómeno universal que existe desde tiempos remotos. La epigenética abre nuevas vías de comprensión de los mecanismos implicados y probablemente, nuevos métodos de prevención y tratamiento que contribuyan a aliviar el sufrimiento de los pacientes y de sus familias y el enorme coste social que tienen.
Autismo
La complejidad del cuadro clínico del autismo y de los trastornos del espectro autista, unido a su baja incidencia y a la variedad del cuadro clínico, representan una seria dificultad para estudiar la etiopatogenia. En cualquier caso, la etiología genética de este trastorno se sospechó desde las primeras descripciones, al mismo tiempo que se despertaba el interés por las posibles causas de origen ambiental(31,32).
Actualmente, se sabe que el autismo es un trastorno del neurodesarrollo en el que intervienen mecanismos genéticos y ambientales, siendo la interacción entre genes y ambiente, genes entre sí y mecanismos epigenéticos, la causa última del cuadro clínico. Un cuadro clínico tan complejo que afecta a la cognición, el lenguaje, la comunicación y la adaptación social, y en el que se alteran estructuras cerebrales y mecanismos neuroquímicos, neurofisiológicos e inmunológicos(33).
Así como el componte genético del autismo está bien demostrado, hay que identificar con más claridad los factores ambientales y los mecanismos epigenéticos que regulan la expresión de los genes(34,35).
Los mecanismos epigenéticos constituyen un apartado fundamental del estudio de los trastornos del neurodesarrollo y, de modo particular, del autismo(34,35), un trastorno que tiene lugar durante las primeras etapas del desarrollo embrionario, coincidiendo con procesos fundamentales, como: la proliferación y migración de las neuronas, el establecimiento de las vías neuronales, la formación de sinapsis y redes sinápticas, la poda de dendritas y la muerte neuronal, todo lo cual sucede a los dictados del código genético, pero bajo la influencia del medio ambiente. Descubrir en qué momento y porqué motivos se perturba este proceso es uno de los grandes objetivos de la investigación actual. Las infecciones durante el embarazo, la anoxia perinatal y la malnutrición, aumentan sin duda el riesgo de sufrir estos trastornos.
En los trastornos del neurodesarrollo, se alteran mecanismos epigenéticos de metilación del ADN, metilación y acetilación de histonas, modelado de la cromatina, ARN mensajero, génesis de ribosomas y micro ARNs entre otros. Puesto que estas alteraciones pueden tener un carácter reversible, su investigación abre nuevos caminos de prevención y tratamiento.
Desde el punto de vista genético, se considera que en los trastornos del espectro autista, intervienen tanto variantes comunes como variantes raras. Las variantes comunes contribuirían al 40%-60% de la varianza. Las variantes raras se han descrito, por ejemplo, en el 5% de los pacientes con síndrome de Asperger y en el 10%-15% de los pacientes con autismo. Un gen de especial relevancia es el MECP2 que es la causa del síndrome de Rett en el 70% de las niñas afectadas y es letal en los varones. Asimismo, se trata de un gen cuya expresión está disminuida en la corteza frontal en pacientes con autismo. Una de las características de este gen es su capacidad para activar o desactivar la metilación del ADN, un mecanismo epigenético que probablemente está implicado en la etiopatogenia del autismo(36).
Esquizofrenia
La esquizofrenia es un trastorno del neurodesarrollo en el que tiene lugar una perturbación de los mecanismos epigenéticos que regulan el desarrollo de las neuronas y de los oligodendrocitos(37). Esta perturbación consiste en que se altera una proteína de la matriz extracelular, la reelina, y una glicoproteína que se expresa en las neuronas gabaérgicas durante el desarrollo del sistema nervioso y en la vida adulta(38). Esta glicoproteína tiene una importante función en la migración neuronal(39). Además de las alteraciones del sistema gabaérgico, también se han encontrado en el sistema dopaminérgico y en la cromatina.
En estudios post mortem se observa una disminución de la expresión de reelina en diversas regiones cerebrales de pacientes con esquizofrenia(40), que probablemente se debe a una hipermetilación del gen promotor de reelina. Es muy probable que la hipermetilación de genes sea una de las causas de la disfunción de las neuronas gabaérgicas y de la oligodendroglía en la esquizofrenia. Por el contrario, se detecta una hipometilación del sistema dopaminérgico que tiene un importante papel en funciones ejecutivas, como la memoria de trabajo y la atención. En este sentido, otra observación en pacientes con esquizofrenia es un aumento de la activación de la COMT (catecol-O-metiltransferasa), que se asocia con problemas de memoria y atención y un riesgo alto de esquizofrenia(41).
Los estudios de la cromatina indican también alteraciones de las histonas, que mejoran con ácido valproico. El valproico disminuye la actividad de las histonas y aumenta la expresión de reelina. Por su parte, el haloperidol induce fosfoacetilación de histonas 3 en el núcleo estriado de la rata. Todos estos trabajos, todavía en fase preliminar, pueden contribuir a entender mejor los mecanismos moleculares de la esquizofrenia y la acción de los fármacos, abriendo nuevos caminos de tratamiento de los pacientes.
Conclusión
Puede concluirse que la investigación genética y epigenética de las enfermedades y de los trastornos psiquiátricos se ha convertido en un tema fascinante y de enorme complejidad, que tendrá en el futuro enormes consecuencias para los tratamientos. La dotación genética con que el individuo nace interactúa con el medio ambiente en que transcurre su vida dando lugar al fenotipo, es decir a las características personales y a las enfermedades. El fenotipo condiciona la conducta personal y el modo de relación con el medio. El medio ambiente a su vez da lugar a cambios en los genes, bien a través de mutaciones o de modificaciones epigenéticas. De este modo transcurre el ciclo vital, con sus numerosos cambios del fenotipo que incluyen las posibles enfermedades y la desdicha, pero también el progresivo enriquecimiento personal y la felicidad.
Bibliografía
1. Mardomingo M. Genética del desarrollo de la conducta. In Mardomingo M, editor. Tratado de Psiquiatría del niño y del adolescente. Madrid: Díaz de Santos; 2015. 75-104.
2. Gräff J, Kim D, Dobbin M, Tsai L. Epigenetic regulation of gene expression in physiological and pathological brain processes. Physiol Rev. 2011; 91: 603-4.
3. Guintivano J, Kaminsky Z. Role of epigenetic factors in the development of mental illness throughout life. Neurosci Res. 2014; pii: S0168-0102(14)00179-5. doi: 10.1016/j.neures.2014.08.003..
4. Kocerha J, Dwivedi Y, Brennand K. Noncoding RNAs and neurobehavioral mechanisms in psychiatric disease. Molecular Psychiatry. 2015; 20: 677–84; doi:10.1038/mp.2015.30; published online 31 March 2015.
5. Schaefer A, Tarakhovski A, Greengard P. Epigenetic mechanisms of mental retardation. Progress in Drug Research. 2011; 67: 125-46.
6. Peña C, Bagot R, Labonté B, Nestler E. Epigenetic Signaling in Psychiatric Disorders. J. Mol. Biol. 2014; 426: 3389-412..
7. McGowan P, Szyf M. The epigenetics of social adversity in early life: Implications for mental health outcomes. Neurobiology of Disease. 2010; 39: 66-72.
8. Mardomingo M. Genética del comportamiento y entorno familiar. Factores de riesgo. Revista de Psiquiatría Infanto-Juvenil. 2001; 1: 22-27.
9. Sullivan P, MJ D, O’Donovan M. Genetic architectures of psychiatric disorders: the emerging picture and its implications. Nat Rev Genet. 2012; (13):537-52.
10. Herbert A, Gerry N, McQueen M, al.. A common genetic variant is associated with adult and childhood obesity. Science. 2006; 312: 279-283.
11. Fernández T, State M. Assessing risk: gene discovery. En: Martin A, Volkmar F. Lewis’s Child and Adolescent Psychiatry. A Comprehensive Textbook. Philadelphia: Wolters Kluwer – LW&W; 2007. 189-99.
12. Iafrate A, Feuk I, Rivera M, al.. Detection of large-scale variation in the human genome. Nat Genet. 2004; 36: 949-51.
13. Cross-Disorder Group of the Psychiatric Genomics Consortium. Identification of risk loci with shared effects on five major psychiatric disorders: a genome-wide analysis. Lancet. 2013; 381: 1371-9.
14. Provençal N, Binder E. The effects of early life stress on the epigenome: From the womb to adulthood and even before. Experimental Neurology. 2015; 268: 10–20.
15. Mardomingo M. Experiencias tempranas y desarrollo de la conducta. En: Mardomingo M, ed. Tratado de Psiquiatría del niño y del adolescente. Madrid: Díaz de santos; 2015. 247-80.
16. Champagne F, Curley J. Epigenetic mechanisms mediating the long-term effects of maternal care on development. Neuroscience & Biobehavioral Reviews. 2009; 33: 593-600.
17. Rinaman L, Banishashemi, Koehnle T. Early life experience shapes the functional organization of stress-responsive visceral circuits. Physiol Behav. 2011; 104: 632-40.
18. Godfrey K, Gluckman P, Hanson M. Developmental origins of metabolic disease: live course and intergenerational perspectives. Trends in Endocrinology & Metabolism. 2010; 21: 199-205.
19. Tsankova N, Berton O, Rentha lW, Kumar A, Neve R, Nestler E. Sustained hippocampal chromatin regulation in a mouse model of depression and antidepressant action. Nature Neurosci. 2006; 9: 519–25.
20. Renthal W, Maze I, Krishnan V, Covington H3, Xiao G, Kumar A, et al. Histone deacetylase 5 epigenetically controls behavioral adaptations to chronic emotional stimuli. Neuron. 2007; 56: 517–29.
21. Poulter M, Du L, Weaver I, Palkovits M, Faludi G, Merali Z, et al. GABAA receptor promoter hypermethylation in suicide brain: implications for the involvement of epigenetic processes. Biol Psychiatry. 2008; 64: 645-52.
22. Hidalgo Vicario M, Redondo Romero A. Consumo de drogas en la adolescencia. Pediatr Integral. 2005; IX: 137-53.
23. Robison A, Jian Feng J, Nestler, EJ. Drug addiction and reward. En: Sweatt J, Meaney M, Nestler E, Akbarian S, ed. Epigenetic Regulation in the Nervous System. Basic Mechanisms and Clinical Impact. Amsterdam: Academic Press; 2013. 173-95.
24. Mardomingo M. Trastorno por abuso de sustancias. En: Mardomingo M, ed. Tratado de Psiquiatría del niño y del adolescente. Madrid: Díaz de santos; 2015. 925-53.
25. Pandey S, Ugale R, Zhang H, Tang L, Prakash A. Brain chromatin remodeling: a novel mechanism of alcoholism. J Neurosci. 2008; 28: 3729–37.
26. Sanchís-Segura C, López-Atalaya J, Barco A. Selective boosting of transcriptional and behavioral responses to drugs of abuse by histone deacetylase inhibition. Neuropsychopharmacology. 2009; 34: 2642–54.
27. Kumar A, Choi K, Renthal W, Tsankova N, Theobald D, Truong H, et al. Chromatin remodeling is a key mechanism underlying cocaine-induced plasticity in striatum. Neuron. 2005; 48: 303-14.
28. Wang L, Lv Z, Hu Z, Sheng J, Hui B, Sun J, et al. Chronic cocaine-induced H3 acetylation and transcriptional activation of CaMKIIalpha in the nucleus accumbens is critical for motivation for drug reinforcement. Neuropsychopharmacology. 2010; 35: 913-28.
29. Maze I, Covington H3, Dietz D, LaPlant Q, Renthal W, Russo S, et al. Essential role of the histone methyltransferase G9a in cocaine-induced plasticity. Science. 2010; 327: 213-16.
30. Im H, Hollander J, Bali P, Kenny MeCP2 controls BDNF expression and cocaine intake through homeostatic interactions with microRNA-212. Nat Neurosc. 2010; 13: 1120-7.
31. Mardomingo M, Parra E. Factores pre y perinatales en el autismo infantil precoz. Rev Española Neurología. 1991; 6: 551-4.
32. Mardomingo M. Neurobiología del espectro autista. En: Tomás J, ed. El espectrum autista. Barcelona: Laertes; 2003. 33-44.
33. Mardomingo M. Neurobiología de los trastornos generalizados del desarrollo. Acta Pediátrica Española. 2003; 61: 142-149.
34. Millan M. An epigenetic framework for neurodevelopmental disorders: From pathogenesis to potential therapy. Neuropharmacology. 2013; 68: 2-82.
35. Grafodatskaya D, Chung B, Szatmari P, Weksberg R. Autism Spectrum Disorders and Epigenetics. J Am Acad Child Adolesc Psychiatry. 2010; 49: 794-809.
36. Lee R, Avramopoulos D. Introduction to Epigenetics in Psychiatry. En: Peedicayil J, Grayson D, Avramovoulos D, ed. Epigenetics in Psychiatry. Amsterdam: Academic Press; 2014. 3-25.
37. Svrakic D, Zorumski C, Svrakic N, Zwir I, Cloninger C. Risk architecture of schizophrenia: the role of epigenetics. Curr Opin Psychiatry. 2013; 26: 188-95.
38. Dean B, Boer S, Gibbons A, Money T, Scarr E. Recent advances in postmortem pathology and neurochemistry in schizophrenia. Current Opinion in Psychiatry. 2009; 22: 154-60.
39. Costa E, Chen Y, Dong E, Grayson D, Kundakovic M, Maloku E, et al. GABAergic promoter hypermethylation as a model to study the neurochemistry of schizophrenia vulnerability. Expert Rev Neurother. 2009; 9: 87-98.
40. Guidotti A, Auta J, Davis J, Di-Giorgi-Gerevini V, Dwivedi Y, Grayson D, et al. Decrease in reelin and glutamic acid decarboxylase67 (GAD67) expression in schizophrenia and bipolar disorder: a postmortem brin study. Arch Gen Psychiatry. 2000; 57: 1061-9.
41. Van Vliet J, Oates N, Whitelaw E. Epigenetic mechanisms in the context of complex diseases. Cell Mol Life Sci. 2007; 64: 1531-8.
 |
| El Rincón del Residente |
Coordinadores:
F. Campillo i López, E. Pérez Costa, D. Rodríguez Álvarez, E. Ballesteros Moya
Residentes de Pediatría del Hospital Universitario La Paz. Madrid
Autores:
N. Arza Méndez*, V.S. López García**, A. Solé Ribalta*, A. Polidura Navío**
*Residente de Pediatría y áreas específicas, Hospital Sant Joan de Déu, Esplugues de Llobregat.
**Adjuntos de pediatría ambulatoria, ABS Centre, L’Hospitalet de Llobregat, Barcelona.
| El Rincón del Residente es una apuesta arriesgada de Pediatría Integral. No hemos querido hacer una sección por residentes para residentes. Yendo más allá, hemos querido hacer una sección por residentes para todo aquel que pueda estar interesado. Tiene la intención de ser un espacio para publicaciones hechas por residentes sobre casos clínicos e imágenes entre otras. ¡Envíanos tu caso! Normas de publicación aquí |
Pediatr Integral 2015; XIX(8): 573.e1-573.e6
Diagnóstico diferencial de lesión cutánea lineal asintomática
Caso clínico
Paciente de 3 años que consulta por la aparición hace 3 semanas de una lesión lineal, pálida, en extremidad superior derecha, que ha avanzado en los últimos días en dirección distal. Refieren que al inicio del cuadro clínico, se objetivaban unas pequeñas lesiones papulares que han ido confluyendo formando la lesión actual. No se acompaña de dolor ni prurito. No refieren fiebre ni otra sintomatología acompañante. En la primera visita, se recomienda una conducta expectante y control evolutivo. Al cabo de 7 días, acuden al control, donde se objetiva progresión distal siguiendo una distribución lineal hasta antebrazo, sin aparición de otra sintomatología acompañante (Figs. 1 y 2).
El paciente no presenta antecedentes personales ni familiares de interés, ni episodios similares previos.

