|
| Temas de FC |
J. Ruiz Contreras
Jefe del Servicio de Pediatría del Hospital Universitario 12 de Octubre. Unidad de Inmunodeficiencias. Profesor Titular de Pediatría de la Universidad Complutense de Madrid
| Resumen
Las inmunodeficiencias primarias (IPs) son un grupo de enfermedades poco frecuentes, que afectan a alguna de las ramas del sistema inmune. Se manifiestan como infecciones frecuentes o recurrentes, que responden mal al tratamiento antibiótico o que están producidas por microorganismos oportunistas. Sin embargo, muy frecuentemente, las infecciones se acompañan de manifestaciones no infecciosas, que afectan sobre todo a la piel, y a fenómenos autoinmunes. |
| Abstract
Primary immunodeficiencies (PIs) are a group of uncommon diseases that affect any of the branches of the immune system. Clinical manifestations consist of frequent or recurrent infections that respond poorly to antibiotic treatment or are caused by opportunistic microorganisms. However, infections are very often accompanied by noninfectious manifestations, that mainly affect the skin, and autoimmune phenomena. It is crucial to have a high index of suspicion for these diseases, since a delay in diagnosis can lead to serious sequelae and even death of the child. |
Palabras clave: Inmunodeficiencias; Infecciones recurrentes; Autoinmunidad; Vacunación de pacientes inmunodeprimidos; Citometría de flujo.
Key words: Immunodeficiencies; Recurrent infections; Autoimmunity; Vaccination of immunocompromised patients; Flow cytometry.
Pediatr Integral 2014; XVIII(3): 183-192
Inmunología básica. Aproximación a las inmunodeficiencias primarias
Introducción
El diagnóstico precoz de las IPs, es fundamental para evitar secuelas permanentes o la muerte del niño, o comprometer el éxito del tratamiento definitivo.
Las inmunodeficiencias primarias (IPs) son enfermedades poco frecuentes. Su incidencia oscila (si se exceptúa la deficiencia de IgA) entre 1/10.000-1/20.000 de recién nacidos vivos(1-2). Dado que, la mayoría de ellas son enfermedades congénitas, las manifestaciones clínicas se inician, casi siempre, en los primeros años de vida. La importancia del diagnóstico precoz en las IPs viene determinada porque un retraso en el mismo puede comprometer el tratamiento definitivo, dar lugar a secuelas graves e irreversibles, e incluso desembocar en la muerte del niño.
Manifestaciones clínicas ¿cuándo sospechar una IP?
Se sospecha una IP, cuando un niño tiene infecciones recurrentes, que no responden bien al tratamiento antibiótico o que están producidas por organismos oportunistas. Sin embargo, una infección única, que cursa de forma rara o fulminante, puede ser la única manifestación de una IP. El tipo de infección orienta hacia la rama del sistema inmune que está afectada.
La defensa frente a las infecciones, es una de las funciones primordiales del sistema inmune; por lo tanto, no es de extrañar que las infecciones frecuentes, recurrentes o por organismos oportunistas constituyan la manifestación clínica más frecuente de este grupo de enfermedades(1-3).
El término “infecciones frecuentes” es impreciso. Durante la primera infancia, los niños sanos tienen una media de 6-8 infecciones de vías respiratorias altas al año, pero si el niño asiste a guardería o tiene hermanos que lo hacen, puede llegar hasta 10-12 infecciones anuales. Sin embargo, en estas infecciones de los niños sanos no se aísla ninguna bacteria, curan sin tratamiento antibiótico y en los intervalos entre ellas, el niño está asintomático. Además, el desarrollo estáturo-ponderal es normal, aunque también puede serlo en niños con IPs.
Las infecciones recurrentes (Tabla I), las causadas por organismos oportunistas y la ausencia de respuesta al tratamiento antibiótico son los signos clásicos de inmunodeficiencias(1-3). Sin embargo, una infección única de curso raro, atípico o grave puede ser la primera, e incluso única, manifestación de IP. Por ejemplo, una neumonía o una osteomielitis por Aspergillus nidulans, es casi patognomónica de la enfermedad granulomatosa crónica (ECG)(4,5).
Clásicamente, las IPs se dividen en: defectos de la inmunidad adaptativa, que comprenden los síndromes de deficiencias de anticuerpos y las inmunodeficiencias de células T; y los defectos de la inmunidad innata, que incluyen los trastornos de la fagocitosis, los defectos en la vía de señalización de los TLR (receptores de tipo Toll o Toll-like receptor) y las deficiencias del complemento.
Manifestaciones infecciosas en las inmunodeficiencias de la inmunidad innata
La inmunidad innata, que existe antes del encuentro con el antígeno, se pone en marcha en pocas horas y constituye la primera línea de defensa del sistema inmune frente a las infecciones. Esta rama de la inmunidad corre a cargo de varios tipos de células: las células presentadoras de antígenos (CPA) –fundamentalmente las células dendríticas–, las células fagocíticas (macrófagos neutrófilos) y las células natural killer (NK). También, forman parte de la inmunidad innata, el complemento y las lectinas que unen la manosa, un azúcar presente en la superficie bacteriana(6).
El reconocimiento de los microorganismos en la inmunidad innata se lleva a cabo, sobre todo, mediante los TLR, que se expresan en la membrana citoplásmica o en la membrana de los endosomas de las células dendríticas. Este reconocimiento no es específico, como puede ser el de los anticuerpos, sino que los TLR reconocen estructuras o moléculas (PAMPs o patrones moleculares asociados a patógenos) que forman parte de las bacterias o de los virus, pero no de las células eucariotas. La unión de los TLR a los PAMPs activa una vía, en la que intervienen la quinasa IRAK4 y la proteína MyD88, y cuyo resultado final es la producción de inflamación y la secreción de quemocinas y citoquinas que activan a los fagocitos. Además, se crea un estado antiviral mediante la secreción de interferones.
La deficiencia de IRAK 4 y MyD88, dos trastornos autosómicos recesivos, cursa con infecciones bacterianas recurrentes, sobre todo neumocócicas, a menudo con escasa respuesta inflamatoria (leucocitosis moderada o ausente y elevaciones de PCR y VSG discretas), que comienzan en la primera infancia. Algunas mutaciones en el gen TLR3 y del UNC-93 –una proteína necesaria para la producción de IFN-α, IFN-β e IFNγ, tras la estimulación de los TLR3, TLR7, TLR8 y TLR9–, dan lugar a un incremento del riesgo de encefalitis herpética(1).
Además de la activación fagocitaria inducida por las quemocinas y citoquinas en la inmunidad innata, la opsonización y fagocitosis de los microorganismos son estimuladas por los anticuerpos y la fracción C3b depositados en la superficie bacteriana. Los fagocitos tienen en su superficie receptores Fc para la región constante de las inmunoglobulinas, capaces de captar a las bacterias recubiertas de anticuerpos (opsonización mediada por los anticuerpos), y receptores para el complemento (receptor para el C3b), que se unen a las bacterias que han fijado el complemento (opsonización mediada por el complemento) promoviendo la fagocitosis. La digestión de las bacterias y otros microorganismos se lleva a cabo mediante la generación de radicales libres del oxígeno (O2–, H2O2, OH– y ClO–), que se producen mediante mecanismos de oxidación/reducción a cargo del complejo NADPH oxidasa, compuesto de citocromos de membrana y proteínas citoplasmáticas. La falta de alguno de los componentes del sistema NADPH oxidasa da lugar a la enfermedad granulomatosa crónica, caracterizada por la incapacidad para destruir microorganismos catalasa positivos (Staphylococcus aureus, Serratia marcescens, Salmonella sp, Aspergillus sp, Burkholderia cepacia, Nocardiasp y otros), que persisten dentro del fagocito, dando lugar a inflamación y formación de granulomas4,5).
El complemento se activa de tres formas: 1) la vía clásica; 2) la vía de las lectinas; y 3) la vía alterna.
La activación de la vía clásica se inicia cuando la IgM o la IgG (fundamentalmente IgG1 e IgG3) se unen a su antígeno específico induciendo la activación secuencial del C1q, C1r, C1s, C4 y C2, dando lugar a la convertasa del C3 (C4b2a) que rompe a aquel factor dando lugar a C3b, que proseguirá la activación de los factores tardíos del complemento. Como quiera que la vía clásica necesita de los anticuerpos depositados en la superficie bacteriana, depende, en parte, de la inmunidad adaptativa(7).
En la activación de la vía de las lectinas, estas sustancias, que se encuentran en el plasma, hacen el mismo papel que los anticuerpos en la vía clásica. Las lectinas que unen la manosa (MBL) a través de unas proteasas plasmáticas asociadas (MASP) que se activan, cuando las lectinas se unen a la manosa de la superficie bacteriana, activan al C1q.
En la vía alterna, hay una activación constante de muy bajo grado, que da lugar a una pequeña cantidad de C3b. Sin embargo, cuando se activa por medio de algunos productos bacterianos, como los peptidoglicanos de la pared de las bacterias grampositivas y la endotoxina de las bacterias gramnegativas, se produce un asa de amplificación, mediante la activación del factor D que rompe al factor B, cuyos fragmentos se unen al C3b dando lugar al C3bBb que es la convertasa de C3 de la vía alterna. Las convertasas de C3 (C4a2b y C3bBb), rompen a C3 y, a partir de ahí, se produce la activación de los factores tardíos del complemento, que culminan en la formación del complejo de ataque de membrana que lisa a las bacterias gramnegativas, sobre todo Neisseria sp(7).
El otro mecanismo de defensa del complemento es, como se ha expuesto más arriba, favorecer la opsonización y la fagocitosis de las bacterias recubiertas por anticuerpos y la fracción C3b. Por último, la activación del complemento contribuye a la defensa frente a las infecciones, estimulando la inflamación y la quimiotaxis, a través de los fragmentos C3a y C5a.
Tanto las deficiencias de la vía alterna como de los factores tardíos del complemento predisponen a infecciones por Neisseria meningitidis, aunque las infecciones son de curso muy diferente. Las deficiencias de properdina (funcionales o cuantitativas) suelen cursar con sepsis fulminante; mientras que, las deficiencias de los factores tardíos (de C5 a C9) dan lugar a infecciones recurrentes por Neisseria meningitidis que, casi nunca, son fulminantes(7).
Las deficiencias de los factores de la vía clásica cursan con infecciones recurrentes por bacterias capsuladas, como: neumococo, meningococo y Haemophilus influenzae tipo b (Hib), fundamentalmente, infecciones respiratorias y meningitis. A veces, aparecen fenómenos autoinmunes, como el lupus eritemtoso sistémico.
Manifestaciones infecciosas en las IPs humorales
La defensa frente a las bacterias extracelulares y frente a algunos virus, como los enterovirus, corre a cargo de la inmunidad humoral y es mediada por los anticuerpos específicos, que destruyen a los microbios por neutralización, opsonización y fagocitosis, según los mecanismos descritos más arriba.
Los síndromes de deficiencia de anticuerpos representan el 65-75% de todas las IPs(8). Las deficiencias de anticuerpos, como las agammaglobulinemias congénitas y la inmunodeficiencia variable común, cursan con infecciones recurrentes por bacterias capsuladas como: neumococo, Haemophilus influenzae tipo b (Hib), Staphylococcus aureus y otros, como Pseudomona aeruginosa. Clínicamente, se manifiestan, sobre todo, por infecciones respiratorias de repetición, como: sinusitis, neumonía, otitis, bronquitis y, finalmente, bronquiectasias(8,9). También, puede producirse sepsis por Staphylococcus aureus o Pseudomona aeruginosa (en este último caso, puede acompañarse de ectima gangrenoso), asociada a neutropenia. Menos frecuentes, son: la celulitis y los abscesos perirrectales. Además, hay un incremento de la susceptibilidad a Mycoplasma, Ureaplasma y enterovirus. Las primeras infecciones se manifiestan como artritis; mientras que, los enterovirus pueden producir infecciones diseminadas o meningoencefalitis crónica de muy difícil tratamiento(8,9).
La carencia de anticuerpos en la luz intestinal se traduce en diarreas recurrentes por sobrecrecimiento bacteriano, por Campylobacter sp o por Giardia intestinalis.
Característicamente, en las agammaglobulinemias congénitas, los síntomas suelen iniciarse a partir de los 4-6 meses de vida, cuando los anticuerpos maternos han desaparecido, y en la mayoría de los niños antes de los 5 años. En la inmunodeficiencia variable común (IVC), los síntomas comienzan en la infancia más tardía, incluso en la edad adulta.
Manifestaciones infecciosas de las inmunodeficiencias de células T
El espectro de las IPs de células T es muy amplio (Tabla II). La inmunidad celular es la rama de la inmunidad adaptativa que se encarga de la defensa frente a las infecciones bacterianas intracelulares, frente a los virus y frente a algunos hongos y protozoos. La defensa frente a estos microorganismos está mediada por las respuestas Th1, cuyo paso inicial es la génesis de células del mismo nombre, a partir de las células TDC4+ naive por la influencia de la IL-12 secretada por los macrófagos y células dendríticas, en respuesta a los microbios y por el interferón gamma (INF-γ), producido por las células NK.
El linfocito Th1 produce señales para generar linfocitos CD8+ citotóxicos específicos, capaces de destruir los microbios intracelulares, especialmente los virus, que son presentados en el contexto de los HLA de clase I.
Por todo lo anterior, las inmunodeficiencias de células T cursan con infecciones recurrentes oportunistas, como: hongos (Candida, Aspergillus, Criptococo, Pneumocystis jiroveci), virus del grupo herpes (Herpes simplex, CMV, virus de Epstein-Barr, Varicela-zoster), virus respiratorios (gripe, VRS, parainfluenza, adenovirus), protozoos (Criptosporidium, Toxoplasma) y bacterias (Listeria monocytogenes, Nocardia, Salmonella)(1-4).
En todas las inmunodeficiencias graves de células T, al faltar la función cooperadora de esta célula, se altera también la función de las células B, dando lugar a todo el espectro de las inmunodeficiencias combinadas severas o SCID.
Clínicamente, las inmunodeficiencias combinadas severas se manifiestan con: diarrea crónica o recurrente, retraso del crecimiento, candidiasis oral o cutánea persistente, neumonía por Pneumocystis jiroveciio por Aspergillus, infecciones diseminadas por citomegalovirus y otros virus del grupo herpes, infecciones por adenovirus, infecciones por Aspergillus sp, exantemas generalizados persistentes y verrugas crónicas extensas o recalcitrantes por infecciones persistentes por papilomavirus humano(1-3).
Manifestaciones no infecciosas de las IPs
Además de las infecciones, las IPs tienen con mucha frecuencia, manifestaciones sistémicas y, paradójicamente, fenómenos autoinmunes.
Alteraciones cutáneas, del pelo y uñas
La defensa frente a las infecciones no es la única función del sistema inmunológico. La inmunidad celular también se ocupa de la protección frente a tumores, de la modulación de la inflamación y de los mecanismos reguladores que controlan su propia activación. De hecho, la coexistencia de infecciones recurrentes con inflamación alterada (por exceso o por defecto) o con fenómenos autoinmunes hace necesario excluir una IP. El aumento de tumores, en muchas deficiencias graves de células T, principalmente neoplasias linforreticulares, requiere evaluaciones periódicas en estos niños.
Por otra parte, el sistema inmune se encuentra diseminado por todos los órganos y sistemas, y las alteraciones de su función se traducen, con frecuencia, en manifestaciones multisistémicas(10). De hecho, en un niño con infecciones frecuentes, la posibilidad de que padezca una IP aumenta si existen manifestaciones sistémicas no relacionadas con la infección. Un ejemplo ilustrativo es el síndrome de DiGeorge, en el que existen, además de una inmunodeficiencia celular de grado variable, hipoparatiroidismo con hipocalcemia, cardiopatía (anomalías conotruncales), anomalías faciales y alteraciones autoinmunes.
La piel se afecta con mucha frecuencia en los pacientes con inmunodeficiencias celulares. Los exantemas generalizados en los primeros meses de vida son, a veces, la primera manifestación de una IP celular grave. Aunque morfológicamente pueden ser similares a la dermatitis atópica, aparecen más precozmente que aquélla, que lo suele hacer a partir del segundo o tercer mes de vida. En ocasiones, los exantemas son debidos a reacciones injerto-contra huésped, debido al paso, durante el parto, de linfocitos T desde la madre hasta el niño, que no puede eliminarlos por carecer de inmunidad celular. Algunas de las IPs que se asocian casi siempre a manifestaciones cutáneas son: el síndrome Omenn, los síndromes de Hiper-IgE y el síndrome de Wiskott-Aldrich.
Otras manifestaciones cutáneas de las IPs son: alopecia de cejas y pelo (síndrome de Omenn), lupus discoide crónico (enfermedad granulomatosa crónica [EGC]), telangiectasias oculares y cutáneas (ataxia-telangiectasia), albinismo óculo cutáneo (síndrome de Chediak Higashi y síndrome de Griscelli).
Las uñas aparecen toscas, engrosadas y con signos de inflamación, como consecuencia de la infección crónica por hongos, en la candidiasis mucocutánea crónica; también, aparecen uñas distróficas, de causa no infecciosa, en otras IPs síndrómicas o celulares.
Rasgos dismórficos y anomalías esqueléticas
Los rasgos dismórficos y las anomalías esqueléticas son casi la regla en las llamadas inmunodeficiencias síndrómicas, como: el síndrome de hipoplasia del pelo-cartílago, la displasia inmuno-ósea de Schimke y algunos otros. En el déficit de adenosín deaminasa, hay alteraciones costales y anomalías vertebrales.
Fenómenos autoinmunes e inflamatorios
Las manifestaciones autoinmunes son, aunque parezca paradójico, frecuentes en las IPs, particularmente cuando la función celular está afectada(11,12). Este hecho se debe a la carencia o alteración de los mecanismos inmunorreguladores en un sistema inmune dañado.
Las citopenias inmunes en sangre periférica, afectando a una o más de las tres series, son probablemente el fenómeno autoinmune más común en las IPs(13). En la inmunodeficiencia variable común (IVC)(14), las citopenias pueden ser evidentes varios años antes de que aparezcan otras manifestaciones clínicas de la enfermedad. También, algunas IPs celulares, como: el síndrome de DiGeorge, las deficiencias de ADA (adenosina desaminasa) o nucleótido fosforilasa y el síndrome de Wiskott-Aldrich, cursan, con frecuencia, con fenómenos autoinmunes variados.
Enfermedad inflamatoria intestinal
No es infrecuente que en algunas IPs exista una enfermedad inflamatoria intestinal similar a la enfermedad de Crohn o a la colitis ulcerosa. Característicamente, los síntomas aparecen en los primeros años de vida, más precozmente que en la enfermedad inflamatoria no asociada a IPs, y muchos de estos pacientes desarrollan enfermedad grave ulcerosa y fistulizante(15). La enfermedad intestinal inflamatoria ha sido descrita, sobre todo, en la EGC, la IVC, los defectos de la vía de la señalización de la IL-10 y el síndrome IPEX (immunodysregulation, polyendocrynopathy, enteropathy, X-linked), pero también en otras IPs.
Úlceras en mucosas
Hasta un 11% de pacientes con EGC tienen aftas orales. Algunos pacientes con IPs celulares graves tienen aftas gigantes en mucosa oral o rectal. Esto parece ser más frecuente en las deficiencias por mutaciones en RAG (recombination activating gen) que en otras IPs. A veces, es la primera o más prominente manifestación de inmunodeficiencia celular. La etiología es desconocida, pero es posible que forme parte del espectro de manifestaciones autoinmunes de las IPs.
Alteraciones endocrinas
Las alteraciones endocrinas son, también, frecuentes en las IPs. Un buen ejemplo, es el síndrome IPEX (immunodysregulation, polyendocrynopathy, enteropathy, X-linked) o el síndrome de DiGeorge.
Diagnóstico de las IPs
El diagnóstico de las IPs se basa en la historia clínica, los antecedentes familiares y las pruebas de laboratorio. Una cifra de linfocitos < de 2.500 µL en sangre periférica en un niño menor de 2 años, puede ser la primera manifestación de una inmunodeficiencia combinada grave.
Además de las manifestaciones clínicas, la historia familiar es la otra piedra angular para sospechar una IP. Muchas inmunodeficiencias primarias son hereditarias; por lo que, la historia familiar revela, a veces, a través de varias generaciones, la existencia de antepasados muertos cuando eran niños o que padecieron infecciones de repetición. En las IPs ligadas al X, pueden encontrarse antecedentes de infecciones graves o recurrentes y muertes precoces solo en los niños varones. También, se encuentran antecedentes en las IPs de herencia dominante; mientras que, en las IPs de herencia recesiva, lo valioso es encontrar antecedentes de consanguinidad en padres o abuelos. También es importante, la búsqueda de enfermedades autoinmunes o neoplasias hematológicas en la familia.
Sin embargo, hasta en la mitad de los casos de IPs, no se encuentran antecedentes familiares.
Una vez establecida la sospecha de IPs, son necesarias pruebas complementarias para llegar al diagnóstico definitivo.
La aproximación diagnóstica inicial puede realizarse mediante pruebas de laboratorio sencillas, al alcance de la mayoría de los centros sanitarios.
El hemograma completo, con recuento de las tres series, es la primera prueba a realizar en un niño en el que se sospecha una IP; ya que, se puede considerar que la sangre es: “la ventana del sistema inmune”. Aunque con mucha frecuencia no se repara en el número de linfocitos, en todas las inmunodeficiencias graves de células T hay una linfopenia marcada que es, a veces, el primer signo de la enfermedad. Un recuento de linfocitos < 1.500/µL en niños mayores de 5 años y < 2.500 µL en los menores de esta edad, debe ser comprobada en cualquier circunstancia, ya que puede ser el signo de una inmunodeficiencia celular grave (SCID). A veces, la linfopenia puede “estar oculta” por el paso de linfocitos T maternos durante el parto, que pueden persistir meses, incluso años, en el niño debido a su incapacidad inmune para eliminarlos.
Como se ha expuesto anteriormente, las citopenias en sangre periférica aparecen en muchas IPs. La trombopenia con volumen plaquetario pequeño es típica del síndrome de Wiskott-Aldrich. Otras veces, la mutación del WAS (gen del síndrome de Wiskott Aldrich) se traduce en una trombopenia crónica (trombocitopenia ligada al X), sin ninguna otra manifestación. El frotis sanguíneo también aporta hallazgos relevantes, como los gránulos gigantes de los granulocitos, en el síndrome de Chédiak-Higashi. La eosinofilia aparece en los síndromes de Hiper-IgE, de Omenn, de IPEX y otros.
El análisis de los parámetros bioquímicos más comunes proporciona, a veces, datos orientativos, como el ácido úrico bajo (déficit de nucleótido fosforilasa), la hipocalcemia (anomalía de DiGeorge) o, simplemente, una disminución de las proteínas totales en sangre con albúmina normal, lo que apunta a hipogammaglobulinemia.
La radiografía de tórax revela ausencia de timo en los lactantes con inmunodeficiencias celulares graves. También, puede demostrar alteraciones vertebrales costales (déficit de adenosín deaminasa) o las secuelas de las infecciones pulmonares repetidas, como bronquiectasias. En las inmunodeficiencias síndrómicas, una serie ósea proporciona información sobre las alteraciones musculoesqueléticas.
La cuantificación de inmunoglobulinas es una prueba fácil de realizar. Una cifra menor de 150 mg/dl es diagnóstica de hipogammaglobulinemia; mientras que, por encima de esta cifra, hay que tener en cuenta el rango de cada laboratorio según la edad. La hipogammaglobulinemia en un niño menor de 24 meses que no padece infecciones, orienta hacia una hipogammaglobulinemia transitoria de la infancia; mientras que, por encima de esta edad, obliga a descartar una IVC, independientemente de que haya síntomas o no.
La citometría de flujo (CF) es, en la actualidad, la herramienta más potente en el diagnóstico de las inmunodeficiencias, ya que permite evaluar las poblaciones y subpoblaciones celulares, identificar moléculas de la membrana y del citosol, e incluso valorar la función anormal de una proteína.
La determinación de las principales poblaciones y subpoblaciones linfocitarias (Tabla III) permite hacer una aproximación bastante fidedigna al tipo de inmunodeficiencia, que se completa con otros estudios de CF, pruebas funcionales de los linfocitos, en los que se valorará su capacidad para proliferar cuando se les enfrenta a diferentes mitógenos y antígenos, y estudios genéticos. Una ausencia de células B con hipogammaglobulinemia es sugestiva de una agammaglobulinemia congénita (la más frecuente es la agammaglobulinemia de Bruton por déficit de la kinasa Btk); mientras que, una hipogammaglobulinemia con linfocitos B normales es propia de la hipogammaglobulinemia transitoria de la infancia o de la inmunodeficiencia variable común.
En cualquier caso, el diagnóstico de IP por parte de pediatras y médicos de familia no debería ir más allá de las pruebas de escrutinio de cada tipo de inmunodeficiencia (Tabla II); ya que, su manejo exige la participación de un especialista en estas enfermedades para lograr los mejores resultados diagnósticos y terapéuticos.
Actuación ante la sospecha de IP
Una vez que se sospecha una IP, deben establecerse todas las medidas necesarias para prevenir las infecciones y contactar con un pediatra especialista en inmunodeficiencias, para evitar actuaciones nocivas para el niño y establecer el tratamiento definitivo.
Una vez que se sospecha una IP, deben establecerse los siguientes objetivos: 1) mantener el estado nutricional y general del niño; 2) evitar actuaciones que puedan poner en peligro su vida o comprometer su curación; 3) prevención de las infecciones con medidas, como profilaxis antibiótica y protección ambiental del paciente; y 4) tratamiento definitivo.
Mantenimiento del estado nutricional
La malnutrición es difícil de evitar en los pacientes con inmunodeficiencias graves de células T, que con frecuencia padecen diarrea crónica intratable y un aumento del catabolismo por las infecciones recurrentes. Además, las infecciones producen anorexia y algunas de ellas, como la candidiasis orofaríngea y esofágica y las infecciones herpéticas de la mucosa oral y del esófago, dan lugar a una incapacidad para ingerir el alimento.
Sin embargo, mantener una nutrición adecuada es de una importancia crucial, ya que la malnutrición aumenta la susceptibilidad a infecciones y compromete seriamente el éxito del tratamiento definitivo. Para ello, es necesario el concurso de un especialista en nutrición y uso de medidas nutricionales especiales y técnicas de alimentación enteral o incluso parenteral, valorando el riesgo infeccioso de esta última.
Evitar actuaciones nocivas para el paciente
Las vacunas de microorganismo vivos están contraindicadas en todas las IPs celulares, excepto en las deficiencias del complemento. En los trastornos del sistema fagocítico, las vacunas de virus vivos pueden ser administradas, pero están contraindicadas las vacunas bacterianas vivas, como la BCG y la vacuna oral frente a la fiebre tifoidea. Las vacunas inactivadas son seguras y pueden administrase en todas las IPs, aunque se desconoce su efectividad.
Las transfusiones de hemoderivados tienen que hacerse siguiendo precauciones estrictas. En los pacientes con inmunodeficiencias de células T, la sangre deber ser sangre irradiada, para evitar una reacción injerto contra huésped, que puede ser muy grave o incluso mortal para el niño. Es importante transfundir solo cuando sea absolutamente necesario y no utilizar sangre de familiares que más tarde puedan ser donantes de la médula ósea, para no comprometer el éxito del trasplante. Además, la sangre tiene que ser negativa para CMV, que produce infecciones muy graves en los pacientes con deficiencias de células T.
Prevención de infecciones
La puesta al día de los calendarios vacunales (incluyendo vacunación frente a la varicela en los susceptibles) y la vacunación anual frente a la gripe de todos los familiares de los niños con IP es una de las medidas más efectivas para la prevención de infecciones.
Medidas generales
La instrucción de los pacientes, familiares y personal sanitario, sobre la importancia del lavado de manos con geles de alcohol es primordial. También es vital, educar a los pacientes para que mantengan una buena higiene bucal y realicen controles orodentales periódicos, al menos, dos veces al año o más frecuentemente si es necesario. En los pacientes con deficiencias de células T, se recomienda el aislamiento estricto.
Los pacientes con riesgo de infecciones por Aspergillus sp (inmunodeficiencias celulares, síndrome de Hiper-IgE, EGC) deben evitar la exposición al hongo en ambientes como: establos, lugares de almacenamiento de heno y zonas de construcción y movimiento de tierra.
Los pacientes con deficiencias de células T deben evitar beber en fuentes o lagos. Para prevenir la infección por Criptosporidium, algunos autores recomiendan el uso de agua embotellada en los pacientes de riesgo, ya que este protozoo es resistente a la cloración.
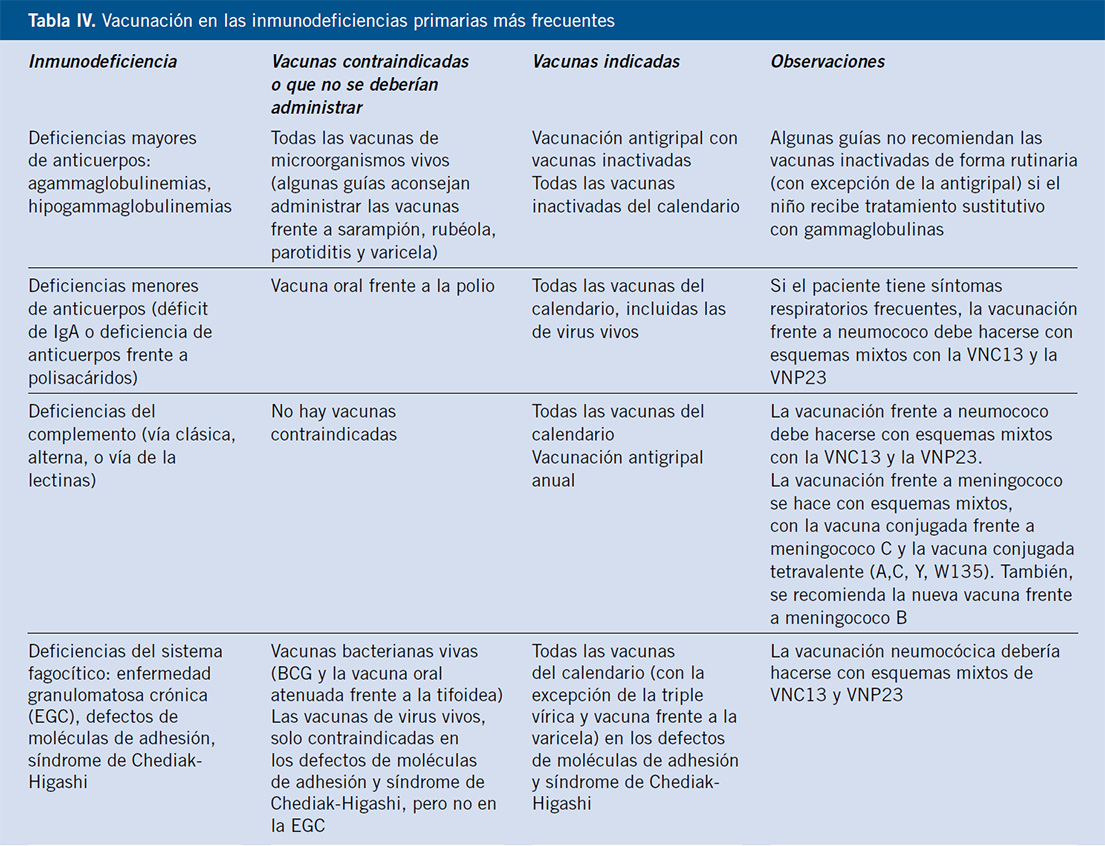
Vacunación (Tabla IV)
Además de administrar las vacunas indicadas a los niños con IPs, es primordial la inmunización y puesta al día de los calendarios vacunales de todos los familiares. Anualmente, deben ser vacunados frente a la gripe y, cuando sean susceptibles, está indicada la vacunación frente a la varicela.
Las vacunas de microorganismos vivos están contraindicadas en todas las inmunodeficiencias de células T. En las inmunodeficiencias en las que está indicada la vacunación frente a neumococo, se recomienda utilizar pautas mixtas con la vacuna neumocócica conjugada 13-valente (VNC13) y la vacuna neumocócica de 23 polisacáridos puros (VN23). En los pacientes con riesgo de infecciones frecuentes o graves por Neisseria meningitidis, como en los déficit de factores de complemento, está indicado vacunar frente a este agente con esquemas mixtos, utilizando las vacunas conjugadas frente a meningoco C, las vacunas conjugadas cuadrivalentes frente meningococo e incluso la nueva vacuna frente a meningococo B(17,18). En la tabla II, se exponen las vacunaciones en los niños con IPs.
Profilaxis post-exposición e inmunización pasiva
Palivizumab. Los niños con inmunodeficiencias graves de células T deben recibir 15 mg/kg de palivizumab, mensualmente, durante la estación del virus respiratorio sincitial (VRS). La utilidad de esta práctica no ha sido, sin embargo, establecida en estas enfermedades.
Profilaxis postexposición frente a varicela. En los niños con IPs que están recibiendo tratamiento sustitutivo con gammaglobulina intravenosa o subcutánea periódicamente, no es necesaria ninguna medida. En cualquier otra circunstancia, está indicada la administración de gammaglobulina hiperinmune varicela/zoster, a dosis de 125 unidades por cada 10 kg de peso (máximo 625 unidades), a ser posible en las primeras 96 horas tras el contacto. Si no se dispone de este preparado, la gammaglobulina endovenosa, a dosis de 400-500 mg/kg, puede proporcionar niveles de anticuerpos similares. Algunos autores prefieren la quimiprofilaxis con aciclovir, a dosis de 20 mg/kg/dosis, cuatro veces al día (sin pasar de 3.200 mg/día) durante 7 días, sobre todo si han transcurrido más de 96 horas del contacto. Otra alternativa es el valaciclovir, a 20 mg/kg/dosis, tres dosis al día, sin pasar de 3.000 mg/día.
Profilaxis frente a Pneumocystis jirovecii. Está indicada en todas las inmunodeficiencias celulares y en el síndrome de hiper-IgM. Se lleva a cabo con trimetoprim-sulfametoxazol a dosis de 150 mg/m2 (o 5 mg/kg) por día de trimetoprin y 750 mg/m2 (o 25 mg/kg) por día de sulfametoxazol, en dos dosis diarias, 3 días consecutivos por semana. También, se puede administrar en dosis única diaria, o hacerlo todos los días de la semana.
Profilaxis frente a Aspergillus. Está indicada en los pacientes con deficiencias graves de células T (inmunodeficiencia combinada grave) y en la EGC. Se recomienda itraconazol a dosis de 5-10 mg/kg/día, dividido en dos dosis.
Profilaxis en los trastornos fagocíticos. Se recomienda la administración de trimetoprim-sulfametoxazol a dosis de 5 mg/kg de trimetoprim y 30 mg/kg/día de sulfametoxazol. Disminuye la incidencia de infecciones bacterianas e intervenciones quirúrgicas en la EGC6. Este antibiótico se concentra en los neutrófilos y es activo frente a Staphylococcus aureus y Burkholderia spp, y preserva la flora anaeróbica del colon al absorberse en los tramos altos del intestino delgado.
Profilaxis en las deficiencias del complemento. Dado que no hay terapia sustitutiva para las deficiencias del complemento, en estas IPs se recomienda la profilaxis continua frente a bacterias capsuladas, aunque no hay estudios que demuestren la eficacia de esta medida. El antibiótico de elección es la amoxicilina.
Tratamiento definitivo
En las inmunodeficiencias celulares graves es esencial realizar el trasplante de progenitores hemopoyéticos lo más precozmente posible para evitar el fracaso del mismo.
Una vez sospechada una IP, el niño debe ser enviado rápidamente a un pediatra especialista en inmunología clínica, para confirmar el diagnóstico y planificar el tratamiento definitivo. En los trastornos graves de células T y en algunas otras IPs, el tratamiento curativo consiste en dotar al niño de un sistema inmunológico mediante el trasplante de progenitores hemopoyéticos. Esto supone una carrera contra el tiempo, ya que el riesgo de muerte por infecciones es muy alto en estas IPs. El primer paso es, determinar la histocompatibilidad entre el niño, hermanos y padres, para llevar a cabo un trasplante alogénico idéntico procedente de un hermano, que cura la enfermedad en un 97% de los casos. Independientemente del tipo de trasplante (idéntico emparentado, idéntico no emparentado o haploidéntico), el porcentaje de supervivencia a los 5 años es del 94%, si el trasplante de lleva a cabo antes de los 3,5 meses de edad. En los niños mayores de esta edad y con infección activa, la tasa de éxito se reduce al 50%(19). Esto ilustra la necesidad de actuar con celeridad y evitar las infecciones.
En los pacientes con deficiencias de células B, el tratamiento consiste en la administración sustitutiva de inmunoglobulina intravenosa o subcutánea, para mantener al paciente libre de infecciones. Este objetivo suele lograrse con dosis de 500-600 mg/kg administradas mensualmente (o la dosis anterior repartida semanalmente por vía subcutánea), aunque al principio del tratamiento pueden ser necesarias dosis más frecuentes. En general, los niveles de IgG 700-800 mg/dl en sangre del paciente “en el valle” (inmediatamente antes de la próxima dosis de inmunoglobulinas), son suficientes para mantener al paciente libre de infecciones.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Notarangelo LD. Primary Immunodeficiencies. J Allergy Clin Immunol. 2010; 125: S182-184.
2. Subbarayan A, Colarusso G, Hughes SM, Gennery AR, Slatter M, Cant AJ, et al. Clinical features that identify children with primary immunodeficiency diseases. Pediatrics. 2011; 127: 810-16.
3. McCusker C, Warrington R. Primary immunodeficiency. Allergy Asthma Clin Immunol. 2011; 7: Suppl 1. S11.
4. Seger RA. Modern Management of chronic granulomatous disease. Br J Haematol. 2008; 140: 255-266.
5. Van den Berg JM, Van Koppen E, Ahlin A, Belohradsky BH, Bernatowska E, Corbeel L, et al. Chronic granulomatous disease: the European experience. PLoS One. 2009; 4: e5234.
6.*** Medzhitov R, Janeway C. Innate Immunity. N Engl J Med. 2000; 343: 338-344.
7. Skattum L, Van Deuren M, Van der Poll T, Truedsson L. Complement deficiency states and associated infections. Mol Immunol. 2011; 48: 1643-1655.
8.** Yong PFK. Hypogammaglobulinemia. Immunol Allergy Clin N Am. 2008; 28: 691-713.
9.*** Winkelstein JA, Marino MC, Lederman H M, Jones SM, Sullivan K, Burks W, et al. X-linked agammaglobulinemia. Report on a United States Registry of 201 patients. Medicine (Baltimore). 2006; 85: 193-202.
10.** E. de Vries in collaboration with European Society for Immunodeficiencies (ESID) members. Patient-centred screening for primary immunodeficiency, a multi-stage diagnostic protocol designed for non-immunologists. Clin Exper Immunol. 2011; 167: 108-119.
11. Siegel RM. Rheumatologic and autoimmune manifestations of primary immunodeficiency disorders. Curr Opin Rheumatol. 2009; 21: 78-84.
12. Cunningham-Rundles C. Autoimmunity in primary immune deficiency: taking lessons from our patients. Clin Exper Immunol. 2011; 164: S6-S1.
13. Notarangelo LD.Primary immunodeficiencies (PIDs) presenting with cytopenias. Hematology. 2009; 139-146.
14. Bader-Meunier B, Guitton C, Lorotte S. Childhood autoimmune cytopenia, common variable immunodeficiency and sarcoidosis. J Pediatr. 2004; 145: 861.
15. Uhlig HH. Monogenic diseases associated with intestinal inflammation: implications for the understanding of inflammatory bowel disease. Gut. 2013; 62: 1795-1805.
16.*** O´Gorman RMC. Role of flow cytometry in the diagnosis and monitoring of primary immunodeficiency disease. Clin Lab Med. 2007; 27: 591-626.
17.*** Manual de vacunas on linede la AEP. Vacunación en niños inmunodeprimidos o con tratamiento inmunosupresor. Inmunodeficiencias primarias. http://vacunasaep.org/documentos/manual/cap-14#4.
18.*** Rubin LG, Levin MJ, Ljugman P, Daviers EG, Avery R, Tomblyn M, et al. 2013 IDSA Clinical Practice Guideline for Vaccination of the immunocompromised host. Clin Infect Dis. 2013; 58: e44-e100. doi: 10.1093/cid/cit684.
19. Pai SY, Logan BR, Griffith LM, Buckley RH, Parrott RE, Dvorak CC, et al. Transplantation outcomes for severe combined immunodeficiency, 2000-2009. N Engl J Med. 2014 Jul 31; 371(5): 434-46. doi: 10.1056/NEJMoa1401177.
Bibliografía recomendada
- Notarangelo LD. Primary Immunodeficiencies. J Allergy Clin Immunol. 2010; 125: S182-184.
Excelente revisión panorámica de las inmunodeficiencias, en la que se incluyen, de forma breve, una clasificación y las manifestaciones clínicas de las mismas. La parte final se centra en la aproximación al diagnóstico de estas enfermedades.
- Medzhitov R, Janeway C. Innate Immunity. N Engl J Med. 2000; 343: 338-344.
Aunque este artículo no es reciente, su lectura merece la pena por su claridad en los conceptos y la visión breve, pero completa de la inmunidad innata. No en vano, sus autores pueden ser considerados como: “dos de los padres de la inmunidad innata”.
- Manual de vacunas on line de la AEP. Vacunación en niños inmunodeprimidos o con tratamiento inmunosupresor. Inmunodeficiencias primarias. http://vacunasaep.org/documentos/manual/cap-14#4.
En este artículo, se contemplan los calendarios para diferentes pacientes inmunodeprimidos. Muy práctico para pediatras y médicos de familia y otros médicos que tratan a este tipo de pacientes.
- Rubin LG, Levin MJ, Ljugman P, Daviers EG, Avery R, Tomblyn M, et al. 2013 IDSA Clinical Practice Guideline for Vaccination of the immunocompromised host. Clin Infect Dis. 2013; 58: e44-e100. doi: 10.1093/cid/cit684.
Este artículo constituye la guía para la vacunación de los pacientes inmunodeprimidos de la Sociedad Americana de Enfermedades Infecciosas (IDSA). Incluye los calendarios para todos los pacientes inmunodeprimidos y una gran cantidad de bibliografía muy actualizada.
- O´Gorman RMC. Role of flow cytometry in the diagnosis and monitoring of primary immunodeficiency disease. Clin Lab Med. 2007; 27: 591-626.
Excelente revisión de las posibilidades de la citometría de flujo para el diagnóstico de las inmunodeficiencias. Muy útil para los pediatras en general y para todos los médicos que simpatizan con el campo de las inmunodeficiencias.
| Caso clínico |
|
Un niño de 4 meses de edad es llevado a su médico por tos de 13 días de duración, a los que se ha añadido dificultad respiratoria en los últimos dos días. No existen otros antecedentes previos. La exploración física muestra un niño que pesa 5.100 g, con buen estado general. Presenta dificultad respiratoria leve, con taquipnea de 60 rpm y discreto tiraje subcostal. A la auscultación, tiene estertores inspiratorios y espiratorios diseminados. En la unión del paladar duro y blando, presenta, a cada lado, dos aftas de aproximadamente 1 cm de diámetro de fondo rojo y bordes blanquecinos. La saturación de oxígeno, respirando aire ambiente es del 90%. En la radiografía de tórax, se aprecian infiltrados peribronquiales bilaterales. En el hemograma, se encuentran los siguientes valores: leucocitos 6.030/mm3 (neutrófilos 80%, monocitos 10%, linfocitos 7%, eosinófilos 3%), Hb 10,8 g/dl, plaquetas 380.000 mm3. |