 |
| Temas de FC |
S. Alperi García*, V. Martínez Suárez**
*Hospital Materno Infantil Virgen de las Nieves. Granada. **Servicio de Salud del Principado de Asturias. Universidad de Oviedo
| Resumen
La infección del tracto urinario (ITU) febril o pielonefritis aguda (PNA) es una de las infecciones bacterianas más frecuentes en Pediatría, sobre todo en lactantes y en pacientes con malformaciones nefrourológicas congénitas asociadas (CAKUT). Escherichia coli continúa siendo la bacteria responsable en la mayoría de los casos, aunque otros patógenos como Klebsiella, Proteus, enterococco, enterobácter y Pseudomonas, están aumentando su frecuencia. La realización de una historia clínica completa es fundamental para el enfoque diagnóstico correcto. El estudio de un paciente con sospecha de ITU se debe iniciar por la orina, con el análisis de una muestra aislada mediante tira reactiva, el estudio del sedimento, la tinción de Gram y el urocultivo. Los pacientes con reflujo vesicoureteral (RVU) y otras CAKUT tienen mayor riesgo de PNA, pudiendo producirse por gérmenes atípicos y más agresivos y evolucionar a una nefropatía cicatricial con un progresivo deterioro de la función renal. Las nuevas guías sugieren ser menos agresivos con las pruebas de imagen tras un primer episodio de ITU, reduciendo así costes y dosis de radiación. Las indicaciones y eficacia del tratamiento antibiótico profiláctico continúan siendo controvertidas. Ofrecemos una aproximación al manejo de la ITU basada en la información más reciente y con mayor nivel de evidencia. |
| Abstract
Febrile urinary tract infection (UTI) or acute pyelonephritis (API) is one of the most common bacterial infections in pediatrics, especially in infants and patients with congenital anomalies of the kidney and urinary tract (CAKUT). Escherichia coli continues to be the responsible bacteria in most cases, however other pathogens such as Klebsiella, Proteus, Enterococcus, Enterobacter and Pseudomonas species are being more frequently isolated. Performing a complete medical history is essential in the correct initial diagnostic approach. The study of a patient with suspected UTI should be initiated in the urine, by analysing an isolated sample using a urine test strip, sediment, Gram stain and urine culture. Patients with vesicoureteral reflux and other CAKUT have a higher risk of acute pyelonephritis, which may be caused by atypical and more aggressive pathogens and may progress to a scarring nephropathy and progressive deterioration of renal function. New guidelines suggest less aggressive imaging strategies after a first typical infection, reducing radiation exposure and costs. Indications and efficacy of prophylactic antibiotic treatment remain controversial. We offer an approach to the management of febrile UTI based on a review of the current literature with a higher level of evidence. |
Palabras clave: Infección urinaria; Reflujo vesicoureteral; Diagnóstico; Tratamiento; Pediatría.
Key words: Urinary tract infection; Vesicoureteral reflux; Diagnosis; Treatment; Pediatrics.
Pediatr Integral 2022; XXVI (8): 460-470
OBJETIVOS
• Dar a conocer la prevalencia de la ITU febril en la población pediátrica y orientar su diagnóstico.
• Llamar la atención sobre las malformaciones nefrourológicas como posibles factores predisponentes a ITU recurrentes o atípicas entre otras condiciones de riesgo.
• Valorar la importancia de una buena interpretación del análisis urinario, basándose siempre en el juicio clínico adecuado.
• Conocer la etiología de la ITU más frecuente en nuestro medio, así como los antimicrobianos más eficaces según su localización y el patrón de resistencias bacterianas existente.
• Enumerar las principales indicaciones actuales de quimioprofilaxis y familiarizarse con las características de las principales pruebas de imagen y su uso prudente y racional.
• Entender la importancia de la elección del tratamiento adecuado y conocer los criterios de derivación a un centro o unidad de referencia.
Infección del tracto urinario y reflujo vesicoureteral
Introducción
El pediatra necesita conocer exhaustivamente los condicionantes de la ITU infantil para la correcta toma de decisiones diagnósticas y terapéuticas.
La ITU continúa siendo una de las infecciones bacterianas más prevalentes en la población pediátrica y es, entre las potencialmente graves, la más frecuente.
Tiene gran relevancia clínica y pronóstica en lactantes menores de tres meses, ya que puede desencadenar un proceso séptico sin apenas sintomatología específica acompañante. De ahí la gran importancia de disponer de un alto índice de sospecha diagnóstica. Además, en un porcentaje no desdeñable de casos en este grupo de pacientes es “el evento centinela” de una uropatía malformativa asociada, que deberemos saber sospechar y diagnosticar para un tratamiento y seguimiento adecuados.
Desde ese planteamiento hablamos de ITU cuando existe crecimiento de microorganismos en una orina recogida de manera correcta en un paciente con sintomatología clínica compatible acompañante. Requiere, por tanto, la confirmación diagnóstica mediante un urocultivo.
Los pacientes con RVU y otros tipos de CAKUT (anomalías del sistema colector renal; “congenital anomalies of the kidney and urinary tract”) tienen un riesgo más elevado de infecciones recurrentes y de posteriores lesiones cicatriciales en el parénquima renal, pudiendo abocar a un progresivo deterioro de la función renal y a una enfermedad renal crónica terminal(1-3,10-12).
La toma de decisiones en el diagnóstico, tratamiento y seguimiento de los pacientes pediátricos con ITU requiere un conocimiento específico para el pediatra de Atención Primaria.
Definiciones
Es fundamental diferenciar la ITU verdadera de la bacteriuria asintomática para evitar el infra o sobrediagnóstico de esta patología.
El recuento bacteriano significativo en orina es variable según la técnica de recolección utilizada. Además, debe tenerse en cuenta una clínica acompañante compatible o posible y una reacción inflamatoria urinaria relevante (estimada por el nivel de leucocituria). Si el paciente no tiene síntomas compatibles con ITU y se aislasen microorganismos en la orina hablamos de una bacteriuria asintomática, que ocurre hasta en el 1-3 % de los preescolares y no precisa seguimiento ni tratamiento por nuestra parte(2,11-12).
Según la localización de la infección en la vía urinaria se habla de pielonefritis aguda (afectación del parénquima renal) o de infección urinaria de vías bajas (cistitis o cistouretritis). En la práctica clínica se utiliza muchas veces de manera indiferente los términos ITU febril y PNA, sin que necesariamente toda ITU febril se acompañe de afectación renal.
Debemos definir además los conceptos de ITU atípica e ITU recurrente(7,9-11):
• Se habla de ITU atípica cuando es causada por un uropatógeno diferente a E. coli, cuando persiste la fiebre a las 48 horas de haber iniciado un tratamiento antibiótico adecuado, si desencadena septicemia, si existe un flujo urinario escaso, si se produce elevación de la creatinina en suero o ante el hallazgo de una masa abdominal o vesical.
• Se considera ITU recurrente cuando se producen dos episodios de ITU alta o PNA, la suma de un episodio de PNA y otro de cistitis o tres o más episodios de cistitis en un año.
Tras cada episodio infeccioso, el tiempo libre de clínica y/o con orina estéril mayoritariamente aceptado para diferenciar una ITU recurrente de una reinfección es de dos semanas.
Epidemiología y factores de riesgo
La ITU continúa siendo una de las infecciones pediátricas bacterianas más frecuentes. A menor edad en el primer episodio, mayor riesgo de uropatía malformativa de base.
La distribución etaria sigue un patrón bimodal, con dos picos de incidencia: lactantes y preescolares de 3-4 años. Los lactantes menores de 90 días con fiebre sin foco son los que presentan mayor riesgo de infección bacteriana potencialmente grave, siendo la ITU la infección más frecuente. En los menores de 2 meses con fiebre sin foco (FSF) el riesgo de ITU febril oscila entre el 2 y el 20 %(4).
Se estima que la probabilidad de que un niño menor de dos años con fiebre y sin focalidad aparente padezca una ITU es de un 7 %, aunque es variable en función de múltiples factores de riesgo. Entre los dos años y la adolescencia, existiendo sintomatología compatible, la prevalencia de ITU sería de alrededor del 7,8 %(8).
La prevalencia es mayor en el sexo masculino por debajo de los tres meses, aumentando la relación progresivamente a favor del sexo femenino, hasta hacerse más prevalente esta entidad en la población femenina a partir del año(1-3,8-12).
Así mismo, los pacientes de raza blanca presentan una frecuencia de ITU de dos a cuatro veces mayor que los de raza negra. Estudios en raza asiática demuestran una frecuencia aún mayor (6 veces más).
En cuanto a las tasas de recurrencia, estas son de hasta el 10-15 % durante el primer año tras el primer episodio, de ahí la importancia de su seguimiento. La recurrencia es más frecuente en lactantes con patología CAKUT, siendo el RVU la más frecuente, seguido de la duplicidad del sistema renal, de las valvas de uretra posterior y de la displasia renal. Se estima que entre el 18-38 % de los lactantes y niños entre 12-36 meses diagnosticados de ITU febril tienen un RVU asociado. Cabe destacar que a menor edad en el primer episodio mayor riesgo de uropatía de base(8,11).
Otros factores de riesgo de ITU dependientes del huésped, además de la raza blanca y las malformaciones urinarias, son: la fimosis, el estreñimiento, la disfunción vesical, la mala técnica de higiene perineal, la oxiurasis y la existencia de antecedentes familiares de primer grado con historia de ITU o RVU; ya que sabemos que existe una susceptibilidad genética individual para padecer ITU, resultando esta de una interrelación entre la capacidad defensiva del huésped y la virulencia bacteriana(10).
La lactancia materna es considerada en algunas publicaciones como un factor protector. Sin embargo, estos últimos factores son controvertidos como los relacionados con el desarrollo de la ITU pediátrica, precisándose más y mejores estudios para confirmar o rechazar su participación(1-3,8,10).
Etiopatogenia
E. coli continúa siendo el microorganismo más frecuentemente aislado en la orina de los pacientes pediátricos con ITU. Sin embargo, gérmenes multirresistentes están cobrando protagonismo. Los factores de virulencia bacterianos y la inmunidad del huésped influyen en la severidad de la infección.
E. coli continúa siendo el patógeno más frecuente causante de la ITU adquirida en la comunidad independientemente de la edad, siendo el responsable de la infección entre el 60 y el 80 % de los casos. Le siguen en frecuencia otros Gram negativos como: Proteus mirabilis, Klebsiella pnemoniae, Enterobacter cloecae, Citrobacter y Pseudomonas aeruginosa. En cuanto a los Gram positivos, Enterococcuss pp. es un patógeno que afecta principalmente a lactantes menores de tres meses y a pacientes portadores de uropatía malformativa. E. coli es el patógeno que produce con más frecuencia bacteriemia(1,2,7-10).
Los microorganismos uropatógenos pueden alcanzar la vía urinaria de dos formas diferentes. La vía hematógena es más frecuente en neonatos. En este grupo el diagnóstico continúa siendo un reto clínico, ya que en muchas ocasiones el único síntoma presente es la fiebre, la irritabilidad o el rechazo de tomas. Además, debido a la inmadurez de su sistema inmunológico este grupo presenta mayor riesgo de extensión de la infección, pudiendo progresar a una septicemia o, en ya raras ocasiones, a una meningitis secundaria(5). E. coli y S. agalactiae representan el 80 % de los microorganismos responsables de la pielonefritis en el período neonatal, seguidos de S. aureus, S. pneumoniae, Enterococcus spp. y enterobacterias como Enterobacter cloecae. La prevalencia de Listeria monocytogenes ha disminuido en los últimos años.
La vía ascendente es la más frecuente en el resto de la población pediátrica. La infección se produce por bacterias uropatógenas que se encuentran colonizando el intestino, que afectan en primer lugar a la región periuretral y ascienden posteriormente por el tracto urinario, adhiriéndose a las células uroteliales gracias a la presencia de “fimbriae” que les permite su colonización y posterior creación de un entorno favorable para su crecimiento, compitiendo por nutrientes necesarios para su supervivencia, como el hierro. La inmunidad innata del huésped y los factores de virulencia bacteriana (como el lipopolisacárido bacteriano LPS, componente mayoritario de la membrana externa de las bacterias Gram negativas, y la hemolisina) contribuyen al desarrollo y al grado de severidad de la ITU(1). La activación de los Toll-Like Receptor (TLR, principalmente TLR4) origina la liberación de factores de transcripción como IRF3, que producen el reclutamiento de neutrófilos y la producción de citoquinas, causantes de la sintomatología de la ITU. Asimismo, las células uroteliales liberan IL8 (que atrae a los neutrófilos en la orina, produciendo piuria) e IL6, que activa la producción de proteína C reactiva (PCR) y de IgA(1,7-8).
En cuanto a la ITU nosocomial, aunque E. coli siga siendo el patógeno más frecuente, cobran especial importancia bacterias atípicas como Klebsiella spp. y Pseudomonasaeruginosa(7). Este patógeno también es muy frecuente en grupos de riesgo (enfermedad de base, portadores de dispositivos como catéter doble J, inmunodeprimidos). En estos casos puede ser más laborioso diagnosticar la infección (Pseudomonas produce leucocituria sin piuria); además pueden tener mayor relevancia la resistencia a los antibióticos de uso común. Diversos estudios han confirmado el preocupante aumento de gérmenes como Klebsiella spp., Enterococcus spp., Proteus spp. y Pseudomonas spp. en detrimento de E. coli, con la alarma asociada del creciente problema de resistencia a la antibioterapia existente, como revela este estudio multicéntrico europeo(15).
Aparte de las infecciones bacterianas, debe recordarse la posibilidad de aislar virus uropatógenos, como los adenovirus y el virus BK, causantes de la cistitis hemorrágica, relegada de manera prácticamente exclusiva a los pacientes inmunodeprimidos, o bien las producidas por hongos (principalmente Candida spp. en las unidades de cuidados intensivos neonatales).
Manifestaciones clínicas, ¿cuándo sospechar una ITU?
Las manifestaciones clínicas suelen ser muy heterogéneas y dependientes de la franja etaria; cuanto menor sea la edad, más inespecífica suele ser la clínica acompañante. Por ello, debemos tener un alto índice de sospecha para establecer un diagnóstico y tratamiento tempranos.
Las manifestaciones clínicas de la ITU en la edad pediátrica son muy variadas y dependientes de la edad. Los síntomas suelen ser muy inespecíficos cuando la edad del niño es inferior a los dos años; por lo que si no tenemos una alta sospecha clínica, podremos infradiagnosticar a nuestros pacientes. En neonatos y lactantes el signo guía suele ser la fiebre sin foco(4,11) (aunque cabe recordar que la presencia de un foco no excluye la ITU, pero sí reduce su probabilidad), además de la presencia de irritabilidad, vómitos, letargia o somnolencia, dificultades en la succión o rechazo en la toma, oliguria y/o poliuria y, en ocasiones, ictericia prolongada. De hecho, la Academia Americana de Pediatría recomienda el despistaje de infección de orina en los lactantes menores de ocho semanas con ictericia, sobre todo si esta es a expensas de bilirrubina conjugada.
En los pacientes prematuros una infección del tracto urinario puede debutar con bradicardia y pausas de apnea(1-3,11).
Aunque los pacientes con PNA suelen tener fiebre, en el paciente menor de dos años es muy difícil, en el ámbito clínico, diferenciar una cistitis de una pielonefritis aguda.
Shaik et al. han diseñado una herramienta(6) para ayudar a estimar la probabilidad de ITU en niños febriles de 2 a 23 meses. Se testan cinco variables para predecir riesgo de ITU (edad, temperatura, historias previas de ITU, sexo, duración de la fiebre y presencia de otro foco de infección), expresándose en porcentaje un riesgo determinado que nos puede guiar a la hora de solicitar un urianálisis o buscar otro foco para la fiebre.
En ausencia de foco que justifique la fiebre, se debería descartar ITU en niños de raza blanca, menores de 12 meses y con fiebre mayor de 39°C de más de 24-48 horas de evolución(4). En mayores de dos años, la clínica suele ser más orientativa, soliendo expresar sintomatología miccional como: disuria, polaquiuria, urgencia miccional y tenesmo, en caso de ITU baja; y fiebre, escalofríos, dolor abdominal y/o en fosa renal y malestar general en la PNT(7).
Anamnesis y exploración física
La realización de una historia clínica minuciosa y una exploración física detallada nos ayudará a optimizar el tratamiento y a evitar pruebas innecesarias.
Ante la sospecha de un primer episodio de ITU febril es importante realizar una anamnesis completa que ayude a decidir los estudios necesarios, y en caso de confirmación optimizar su tratamiento, dirigir otras pruebas complementarias y planificar su seguimiento en Atención Primaria o Especializada.
Son puntos fundamentales de este proceso(3,9,10):
• Antecedentes familiares: deberemos hacer hincapié en la posible existencia de enfermedad renal, HTA, sordera o litiasis en la familia, así como averiguar si existe historia de diálisis o trasplante renal. En un primer episodio de ITU febril en lactante deberemos preguntar si existe consanguinidad.
• Historia prenatal: conocer si el embarazo ha sido controlado, obteniendo información de las ecografías prenatales. Averiguar si existió oligoamnios y si se estableció algún diagnóstico prenatal. Es importante recoger si ha habido consumo materno de fármacos como IECA/ ARA II o consumo de tóxicos. Asimismo, el desarrollo de diabetes gestacional, ya que puede predisponer a la displasia renal multiquística.
• Historia perinatal (parto y periodo perinatal): se debe preguntar si el parto fue eutócico, instrumental o por cesárea y los datos del peso al nacimiento (pequeño para edad gestacional /macrosoma), la edad gestacional y motivo de la prematuridad si existiese. Es importante indagar si existieron en la exploración neonatal hallazgos que nos hicieran sospechar patología renal (la arteria umbilical única se asocia a RVU y a displasia renal).
• Historia postnatal: reflejar la curva pondoestatural desde el nacimiento y el desarrollo psicomotor del menor. Indagar sobre la cronología del control de esfínteres, del patrón miccional y del hábito intestinal y nutricional (si recibió lactancia materna y durante cuánto tiempo y cuál es su hábito actual, prestando atención a la ingesta de líquidos, lácteos y sal).
Se deben anotar alergias, ingresos, patologías, como ITUs previas o enfermedades asociadas, como anomalías oculares o sordera, así como el uso previo de fármacos nefrotóxicos (furosemida, aminoglucósidos, vancomicina o AINES).
En el paciente adolescente se debe preguntar por el consumo de tóxicos.
En el examen clínico del paciente, ha de realizarse una exploración sistematizada por aparatos, con especial atención a la palpación abdominal (la mayoría de masas abdominales son de origen renal), la exploración neurológica, la exploración genital con el estadio de Tanner, y exploración lumbar (explorar región sacra, ya que lesiones en esta zona pueden asociarse a la vejiga neurógena). Se deben plasmar en su historia datos antropométricos como el peso, la talla y la presión arterial con percentiles según sexo, edad y talla.
Diagnóstico
El diagnóstico se inicia por el estudio urinario, con el análisis sistemático de una muestra aislada mediante tira reactiva y estudio del sedimento. Debemos conocer la correcta interpretación del urocultivo según el método de recolección de la orina.
Estudio de la orina y métodos de recolección
El estudio de un niño con sospecha de infección de las vías urinarias debe iniciarse por el análisis de la orina, siendo este el primero de los estudios. El uso de la tira reactiva es una práctica generalizada; además de resultar rápida, útil, fácil y económica, pudiendo realizarse en nuestra consulta o a la cabecera del enfermo. Para poder confiar en el análisis es importante la técnica de recolección de la orina y el tiempo transcurrido hasta su estudio.
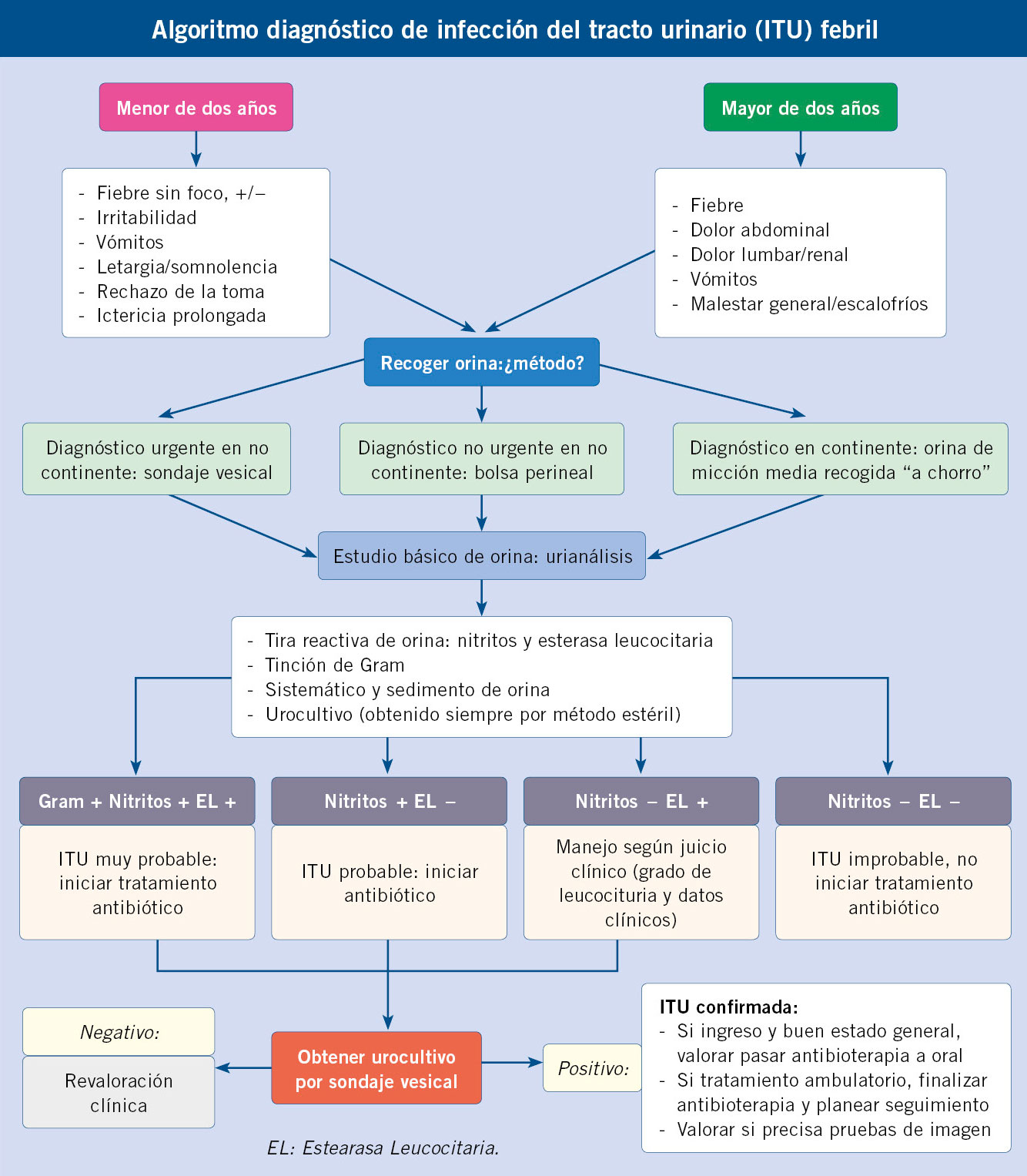
Previo a la obtención de la muestra, se procederá al lavado de genitales (con la retracción del prepucio en niños si es posible y la separación de los labios mayores en niñas). Los métodos dependerán de si el menor es continente o no. Para el paciente continente los métodos no invasivos incluyen el “chorro medio” (desechando la primera y última parte de la micción) y, para el no continente, el uso de una bolsa perineal colectora adhesiva (con alto riesgo de contaminación) y la recogida “al acecho”, esperando el inicio de una micción espontánea. La bolsa autoadhesiva es útil como primer cribado: un resultado negativo no precisa confirmación por su alto valor predictivo negativo; sin embargo, un resultado positivo siempre nos obliga a confirmar el diagnóstico mediante un método invasivo. Entre los métodos invasivos contamos con el cateterismo o sondaje vesical y la punción suprapúbica. Son las técnicas más fiables para descartar ITU en neonatos y lactantes pequeños y las que debemos realizar de entrada en el niño no continente con necesidad de tomar una decisión urgente(1-3,7,9,10-14).
En una muestra aislada se puede realizar: una tira de orina, un análisis sistemático y microscópico con el estudio del sedimento, una tinción Gram, un urinocultivo, para conocer el germen causal, y un antibiograma que nos permita suspender o modificar el tratamiento antibiótico.
Interpretación de la tira reactiva de orina y del sedimiento
En la interpretación de la tira de orina debemos atender fundamentalmente a la esterasa leucocitaria y al test de nitritos. La esterasa leucocitaria es liberada por los leucocitos, siendo, por tanto, signo indirecto de la presencia de una inflamación en las vías urinarias, aunque no necesariamente de origen infeccioso, pudiendo la leucocituria aislada estar presente por la presencia de fiebre, deshidratación, otro foco de infección como una apendicitis, o la existencia de litiasis o vulvovaginitis, entre otros(1,2,7-10).
El test de nitritos se basa en la capacidad de las bacterias Gram negativas (no de las Gram positivas ni pseudomonas) en reducir los nitratos a nitritos(10).
La positividad de leucocitos y nitritos en una tira de orina sugiere infección urinaria con una alta sensibilidad y especificidad. La positividad exclusiva de nitritos hace una ITU probable, y con la presencia única de leucocituria la probabilidad de ITU será interpretada desde el juicio clínico. Podríamos obviar la realización de tinción Gram si aparecen nitritos por la alta sospecha de E. coli(9).
Por otro lado, el estudio microscópico de orina(11) permite identificar la presencia de piuria (definida como la presencia de más de 5 leucocitos/campo) y bacteriuria (observación de cualquier número de bacterias).
¿Cuándo obtener un urocultivo y cómo interpretarlo?
Para la realización de un urocultivo se debe obtener una muestra no contaminada. La información por parte del laboratorio de bacteriología de un resultado positivo con suficiente número de microorganismos permite confirmar el diagnóstico y orientar un tratamiento dirigido. Debe practicarse siempre en caso de lactante menor de tres meses con fiebre sin foco, mayor de tres meses con anomalías urinarias asociadas o ITU previa, si no existe correlación entre la clínica y los resultados de la tira reactiva de orina y ante una fiebre sin foco mayor de cinco días en un niño de cualquier edad(1-4).
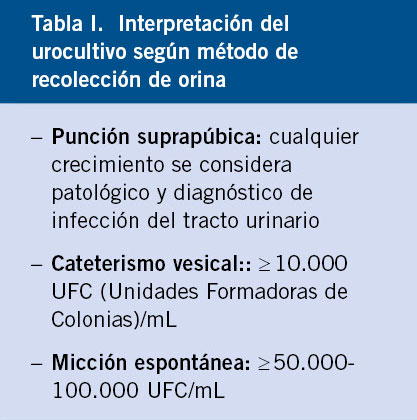
El recuento de unidades formadoras de colonias (UFC) se interpreta según el método elegido para recolectar la orina, considerándose positivo cualquier recuento obtenido mediante punción suprapúbica, un recuento ≥ 10.000 UFC/ml en orina procedente de sondaje vesical y ≥ 50.000-100.000 UFC/ml si la orina ha sido recogida por micción espontánea(7,9,12) (Tabla I).
La realización de un antibiograma nos permitirá conocer la sensibilidad a los antibióticos del germen, pudiendo así aumentar nuestras posibilidades de éxito en el tratamiento.
Exploraciones complementarias
En pacientes mayores de dos años diagnosticados de cistitis no es preciso realizar ninguna prueba complementaria. En lactantes febriles o menores de dos años con sospecha de PNA, así como en niños urópatas con mal estado general o que vayan a requerir ingreso deberemos realizar una analítica sanguínea para obtener un hemograma, un ionograma para evaluar la función renal y reactantes de fase aguda (PCR, PCT, VSG)(11,14,17).
La elevación de PCT > 0,5 mg/L sería un indicador precoz y específico de PNA y afectación parenquimatosa. La alteración de la capacidad de concentración de la orina también nos orienta a PNA(9,11,17).
En los pacientes menores de tres meses, si presentan mal estado general o probabilidad de septicemia asociada se debe valorar la realización de una punción lumbar(4,7).
El rendimiento del hemocultivo es bajo y no nos va a condicionar el tratamiento posterior; si bien se aconseja su obtención en menores de tres meses si se sospecha bacteriemia, en pacientes con malformaciones nefrourológicas y en inmunodeprimidos.
Las pruebas de imagen (ecografía renal) no se realizarán en el momento agudo salvo sospecha de complicaciones, como la extensión de la infección a tejidos perirrenales o que se trate de una ITU atípica(10).
Tratamiento
Los objetivos principales del tratamiento de la ITU son mejorar la clínica del paciente y evitar las complicaciones a corto y largo plazo. La decisión de iniciar tratamiento empírico debe basarse en la sospecha clínica de ITU tras la historia clínica, la exploración física y el urianálisis.
El tratamiento inicial es empírico hasta disponer del antibiograma, por lo que debemos conocer el patrón de resistencias de nuestro medio y, si la infección es nosocomial, de nuestro hospital.
La elección del antibiótico debe tener una adecuada cobertura para E. coli. En la actualidad, se estima que entre el 50-80 % de las cepas de E. coli son resistentes a ampicilina. También está documentada la creciente resistencia de dicho germen a amoxicilina y cotrimoxazol (18-38 %). E. coli presenta buena sensibilidad a las cefalosporinas de segunda y tercera generación, a los aminoglucósidos, a la fosfomicina y a la amoxicilina-clavulánico, aunque en los últimos años están documentadas resistencias locales de hasta el 15 % a este último antimicrobiano(1,7,9,11-14).
Enterococcus faecalis presenta buena sensibilidad a la ampicilina y amoxicilina-clavulánico, por lo que la tinción de Gram puede ser útil a la hora de elegir el tratamiento empírico, permitiendo identificar la presencia de cocos grampositivos en menores de tres meses y en pacientes con malformaciones nefrourológicas asociadas, lo que puede aconsejar la ampliación de cobertura antibiótica con ampicilina(9).
Las ITU causadas por Pseudomona aeruginosa pueden representar un problema terapéutico, ya que las fluorquinolonas (levofloxacino) son el único principio oral activo frente a este germen, sabiendo que su utilización en Pediatría es fuente de controversia por el riesgo de alteraciones en el cartílago de crecimiento(10). Cabe, en este caso, considerar la administración ambulatoria de un aminoglucósido por vía intramuscular, que evitaría afrontar los costes de una hospitalización si el estado clínico del paciente lo permite.
La primera consideración a la hora de establecer el tratamiento terapéutico empírico apropiado es diferenciar entre dos situaciones clínicas: ITU baja o cistitis y PNA. En ambos casos, la administración del tratamiento por vía oral y por vía parenteral es igual de eficaz y, por tanto, es de elección la vía oral salvo criterios de ingreso hospitalario (Tabla II).
Si iniciamos tratamiento parenteral y la evolución es favorable, siendo el uropatógeno sensible según la información del antibiograma, se puede continuar tratamiento por vía oral durante 7-10 días (en PNA en menores de dos años se aboga por mantener diez días). En los niños mayores de 2-3 meses con buen estado general y sin factores de riesgo asociados se puede considerar el tratamiento oral desde un primer momento, ya que no se ha comprobado peor evolución ni mayor riesgo de complicaciones(1,7,9,13) (Tabla III).
En el caso de ITU baja, el tratamiento será ambulatorio siempre que sea posible. Se ha comprobado además la eficacia de regímenes cortos (3-5 días) en pacientes sin complicaciones y siempre y cuando se encuentren sin fiebre. Si no se cumplen dichos requisitos, se siguen recomendando pautas de 7-10 días de duración(7,14).
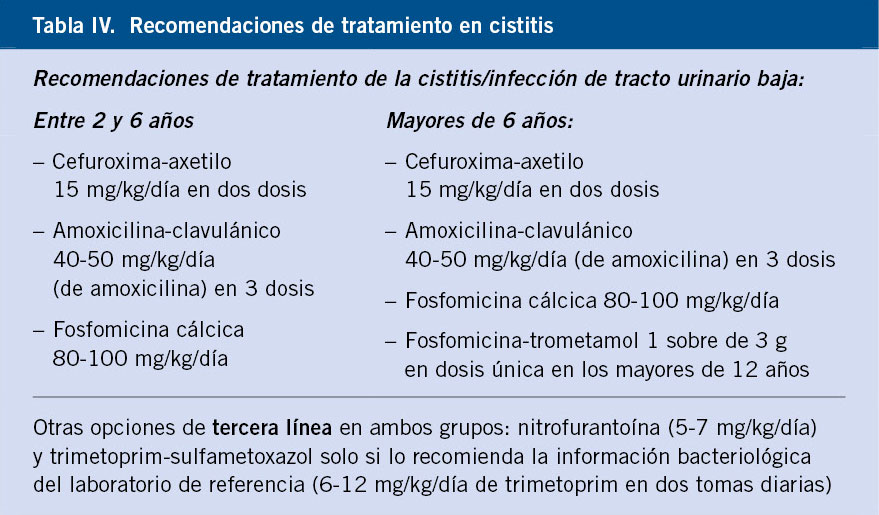
Los antimicrobianos considerados adecuados para el tratamiento de la cistitis son: en primer lugar, la cefuroxima-axetilo (pauta de 15 mg/kg/día cada 12 h); y en segundo lugar, la amoxicilina-clavulánico (40-50 mg/kg/día de amoxicilina cada 8 horas). En mayores de seis años se puede emplear cualquiera de los anteriores y fosfomicina-trometamol (3 g) únicamente en mayores de 12 años (Tabla IV).
Otras opciones de tercera línea son la nitrofurantoína (5-7 mg/kg/día) y el trimetoprim-sulfametoxazol (6-12 mg/kg/día de trimetropim).
En cuanto a la ITU alta o PNA, para el tratamiento vía oral se recomienda la utilización de cefalosporinas de 3ª generación (cefixima 8 mg/kg/día, con posibilidad de doblar dosis el primer día) y, como alternativa, amoxicilina-clavulánico o cefalosporinas de segunda generación siempre y cuando su sensibilidad sea superior al 80-90 % para E. coli(9).
Para la vía parenteral, las cefalosporinas de 3ª generación (cefotaxima 150-200 mg/kg/día, ceftriaxona 50-75 mg/kg/día) y los aminoglucósidos (gentamicina 5-7,5 mg/kg/día) son buenas opciones en el tratamiento de primera línea. Se prefiere gentamicina a amikacina por su menor nefrotoxicidad, administrada en dosis única(9).
Si existe sepsis o meningitis concomitante emplearemos cefotaxima a altas dosis (200-300 mg/kg/día), asociando ampicilina (100-150 mg/kg/día) en pacientes menores de 2-3 meses de edad por la posibilidad de infección por Enterococo, al menos, hasta obtener tinción de Gram o cultivo(7,13).
En determinados casos puede recurrirse al tratamiento vía intramuscular de forma ambulatoria con una dosis diaria de ceftriaxona, gentamicina o tobramicina(14).
Para circunstancias más especiales quedarían en reserva ceftazidima, carbapenémicos y quinolonas. Si existe riesgo de bacteria BLEE (bacterias productoras de betalactamasas de espectro extendido), deberemos iniciar tratamiento con amikacina o carbapenem(7).
En los niños con alergia a penicilina puede considerarse la administración de cefalosporinas de segunda o tercera generación. El tratamiento con trimetropim-sulfametoxazol, ciprofloxacino oral o gentamicina intramuscular serían también buenas opciones, dependiendo de la disponibilidad.
Pruebas de imagen y patología de base asociada: RVU
Las nuevas guías clínicas asumen que las pruebas de imagen se deberían realizar si el manejo posterior del paciente puede disminuir el riesgo de futuras ITU, de daño renal y de secuelas a largo plazo. Deberemos buscar RVU ante ITU febriles recurrentes o tras primer episodio con alteración en la ecografía o gammagrafía, sobre todo en menores de seis meses.
Se debe realizar una prueba de imagen para descartar una enfermedad renal o de las vías urinarias asociada en el caso de primer episodio de ITU febril en el paciente menor de 6 meses, en ITU atípica y en ITU recurrente, siendo la ecografía renovesical o abdominal la prueba de primera línea, por la ausencia de irradiación, su disponibilidad y su bajo coste(7). En primer episodio de ITU febril típica entre los seis meses y el año de edad se debe individualizar; ya que diferentes guías de otros países europeos así lo respaldan(16). Se recomienda la realización de una ecografía a cualquier edad en la fase aguda de una ITU atípica para valorar la presencia de anomalías urinarias o complicaciones. En los lactantes menores de seis meses y con buena respuesta inicial al tratamiento, la ecografía se puede realizar ambulatoriamente a las seis semanas del diagnóstico(10).
La gammagrafía con DMSA (ácido dimercapto-succínico) es el patrón oro de estudio de daño renal asociado, y se recomienda su realización a los 6-12 meses del episodio agudo en pacientes con ITU atípica o recurrente menores de tres años(7). En esta prueba, porcentajes de captación de dicho riñón menores del 45 % del total (una función renal diferencial mayor del 10 %, lo que quiere decir que la participación en la función renal del paciente del riñón afecto es inferior al 40 %) corresponden a la existencia de lesiones renales y es relevante en el pronóstico. No obstante, la existencia de una función renal diferencial menor del 10 % no excluye la existencia de cicatrices. Para poder asegurar mediante gammagrafía con DMSA el diagnóstico de cicatriz renal, el tiempo mínimo necesario es de 6 meses tras un episodio documentado de ITU(1,7,9,12-14).
La cistouretrografía miccional seriada (CUMS) sigue siendo la prueba de elección para identificar el RVU, salvo en niños continentes en los que puede ser sustituida por la cistografía isotópica indirecta (no requiere sondaje). Como principal inconveniente, se trata de una prueba con alta tasa de radiación(14).
La ecocistografía miccional con contraste (EC) está ganando importancia en los últimos años, aportando información similar a la CUMS, pero sin radiar al niño; no obstante, su utilización está aún limitada a determinados hospitales. La uroresonancia magnética presenta la misma sensibilidad y especificidad que la CUMS y no radia, pero debido a su alto coste aún cuenta con poca disponibilidad.
La guía NICE (National Institute of Health and Care Excellence) recomienda la realización de CUMS en todo lactante menor de 6 meses con ITU atípica o recurrente.
La guía española de práctica clínica (GPC) aboga por realizar CUMS en todas las ITUs febriles recurrentes o tras primera ITU febril si es atípica y/o si existe alteración en ecografía o gammagrafía DMSA, especialmente en menores de seis meses (Tabla V).
Fuera de estas premisas, la realización de estudios de imagen para identificar reflujo ante una primera infección no se considera necesaria.
Patología de base asociada a la ITU: RVU
La anomalía más frecuente del sistema colector renal es el RVU, aunque en ocasiones pueden coexistir diferentes anomalías en un mismo paciente debido a la existencia de genes que actúan en el desarrollo embrionario del parénquima renal y del sistema urinario.
El reflujo se produce por el paso retrógrado no fisiológico de orina desde la vejiga hacia los uréteres.
Se clasifica en primario o secundario(9,11,14,19):
• RVU primario: por incompetencia congénita del sistema valvular de la unión ureterovesical.
• RVU secundario: por obstrucción anatómica de la vía urinaria a nivel uretral (valvas de uretra posterior) o funcional (vejiga neurógena), que causan un aumento de la presión intravesical.
Como ya se ha mencionado previamente, un 20-30 % de los pacientes entre 12 y 36 meses con ITU tienen un RVU asociado. La prevalencia de RVU disminuye con la edad, con una tasa de resolución espontánea del 10-15 % anual (incluso mayor en varones menores de un año). Así, la mayoría se resolverán entre los 5 y 8 años tras la maduración del sistema antirreflujo.
El RVU favorece el daño renal –nefropatía por reflujo (NR) o nefropatía cicatricial (NC)– secundario a infecciones repetidas del tracto urinario. Se estima que los niños con ITU que tienen RVU presentan NC en un 40 % de los casos, aceptándose que a mayor grado de RVU y a mayor edad con ITUs repetidas se aumenta el riesgo: en un primer episodio de ITU sin reflujo la probabilidad de NC se estima en un 15 %; y en un reflujo grado III-V la prevalencia es de hasta el 50 %(1,8,14,15,20).
A su vez, un 10-20 % de los niños con NC desarrollan HTA. También está documentada su relación con la enfermedad renal crónica (ERC), siendo la NR una de las principales causas pediátricas de insuficiencia renal terminal y de inclusión en programa de diálisis y trasplante renal.
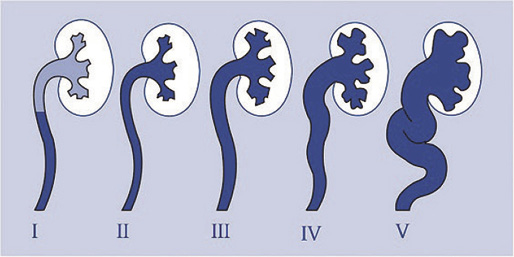
Para diagnosticar y graduar el RVU utilizaremos la CUMS y lo estratificaremos en grados siguiendo la clasificación del International Reflux Study Committee:
I. Solo llega al uréter, sin dilatarlo.
II. Alcanza uréter, pelvis y cálices, sin dilatarlos.
III. Produce leve dilatación del uréter, pelvis y cálices, pero preservando el fórnix.
IV. Se produce moderada dilatación con cierto grado de tortuosidad manteniendo la visualización de las impresiones papilares.
V. Produce gran dilatación ureteropielocalicial con tortuosidad del uréter y pérdida de la morfología calicial normal. Las impresiones papilares no se visualizan. (Fig. 1).
Figura 1. Grados de reflujo vésico-ureteral.
A la hora de valorar una NR o NC, las primeras pruebas alteradas suelen ser la capacidad de concentración de la orina, la microalbuminuria y la tensión arteria(1-3,9,12-14,20) (Tabla VI).
Quimioprofilaxis y otras medidas preventivas
El papel de la quimioprofilaxis es controvertido y su uso está limitado a determinadas situaciones. No se debe utilizar de manera rutinaria, porque favorece la proliferación de gérmenes resistentes a los antibióticos.
La profilaxis medicamentosa se refiere al uso de fármacos antimicrobianos para reducir el riesgo de infección, incrementado cuando está presente una situación de riesgo elevado para su desarrollo. Por tanto, el papel fundamental de la quimioprofilaxis es intentar prevenir futuras ITU y la aparición de cicatrices renales. Sin embargo, se ha comprobado que no disminuye la aparición de daño renal y, en cambio, conlleva un gran riesgo para la colonización por gérmenes multirresistentes(1,2,9,11). Así, aunque ha sido uno de los pilares básicos en el tratamiento conservador del RVU, su uso cada vez está más en entredicho.
Actualmente, se recomienda el uso de profilaxis antibiótica en los siguientes casos(1-3,9,11-14,18):
• Niñas con RVU grados III-V durante un año o hasta que se evalúe nuevamente el grado de RVU.
• Niños varones con RVU grados IV y V durante un año o hasta que se evalúe de nuevo el RVU.
En niños varones con RVU I-III y niñas con RVU I-II uni o bilateral tras diagnosticarse de una primera ITU febril se recomienda la abstención en su realización. Si presentan ITU febril recurrente se administrará profilaxis durante un año y se volverá a evaluar. Si persistiesen las PNA, a pesar de la antibioterapia profiláctica con persistencia del RVU, se valoraría la intervención quirúrgica del mismo.
La profilaxis antibiótica se administra en una dosis única nocturna, empleando un tercio de la dosis utilizada para el tratamiento(7). Generalmente, se emplea de entrada, en lactantes menores de dos meses, amoxicilina asociada o no a ácido clavulánico (10 mg/kg/día) y, en pacientes mayores de esa edad, utilizaremos trimetoprim o cotrimoxazol (2 o 2/10 mg/kg/día). Si fracasasen estas opciones, podríamos usar cefalosporinas de segunda generación y fosfomicina (Tabla VII).
Ya no se acepta el tratamiento con nitrofurantoína como quimioprofilaxis, tras la alerta farmacológica de la AEMPS (Agencia Española de Medicamentos y Productos Sanitarios) sobre el riesgo existente de daño hepático y pulmonar con su uso prolongado(9). Tampoco se ha documentado beneficio con la rotación de fármacos.
Como medidas preventivas generales deberemos de recomendar la ingesta abundante de líquidos, la higiene local, hábitos miccionales adecuados como la realización de micciones completas, regulares y frecuentes cada 2 o 3 horas (en caso de inmadurez vesical se puede valorar la prescripción de anticolinérgicos como la oxibutinina), y si fuera preciso, la corrección del estreñimiento y la oxiurasis(9,10).
Seguimiento
Las consecuencias a largo plazo incluyen hipertensión arterial y fracaso renal, pero aún no se conoce la frecuencia real de estas complicaciones.
El pronóstico de una primera ITU con buena respuesta al tratamiento en menos de 48 horas es muy bueno. Si la evolución clínica es la esperable, no se recomienda la realización de un urocultivo durante el tratamiento o tras la finalización del mismo(7).
Identificar a los niños con mayor riesgo de daño renal no es tarea fácil y suele suponer un reto (Tabla VIII).
¿Cuándo derivar de Atención Primaria a Atención Especializada?
La necesidad de seguimiento en Atención Especializada sigue siendo una decisión controvertida en la actualidad. La guía NICE recomienda que los niños que presenten daño parenquimatoso permanente bilateral, alteración de la función renal, hipertensión arterial y/o proteinuria deberían ser controlados por nefrología pediátrica. Diferentes autores incluyen otras circunstancias: infección urinaria febril o ITU en menores de dos años o en pacientes que no controlan la micción y a los que no se puede realizar estudio en Atención Primaria; infecciones urinarias recurrentes; infección urinaria atípica: germen no habitual; anomalía estructural, riñón único o anomalías funcionales nefrourológicas; daño renal permanente confirmado en estudios de imagen o mediante marcadores en sangre (urea, creatinina, cistatina C) u orina (proteinuria, osmolalidad máxima urinaria); retraso del crecimiento; antecedentes familiares de enfermedad nefrourológica o enfermedad renal crónica; y ansiedad familiar.
Función del pediatra de Atención Primaria
Es fundamental la buena coordinación entre los dos niveles asistenciales: Atención Primaria y Especializada.
La función del pediatra de Atención Primaria es fundamental. El conocimiento actualizado de la infección pediátrica del tracto urinario nos ayudará, por un lado, a no solicitar estudios invasivos innecesarios y, por otro lado, a evitar el deterioro de la función renal en un futuro. Deberemos conocer el seguimiento y actitud que debemos llevar a cabo en nuestra consulta (con monitorización antropométrica y de tensión arterial seriada, así como optimizando los hábitos higiénico-dietéticos del menor) y cuándo derivar a Atención Especializada para lograr el mejor manejo integral posible del paciente.
Conflicto de intereses
No hay conflicto de interés en la elaboración del manuscrito.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio de los autores.
1.** Simoes e Silva AC, Oliveira EA, Mak RH. Urinary tract infection in pediatrics: an overview. J Pediatr (Rio J). 2020; 96: 65-79.
2. Tullus K, Shaikh N. Urinary tract infections in children. Lancet. 2020; 395: 1659-68.
3.** Grupo de trabajo de la Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica. Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad, Política Social e Igualdad. Instituto Aragonés de Ciencias de la Salud; 2011. Guías de Práctica Clínica en el SNS: I+CS Nº 2009/01.
4. Mintegi Raso S, Gómez Cortés B. Lactante febril. Protoc diagn ter pediatr. 2020; 1: 141-51.
5. Giménez T, Malín ME. Prevalencia de meningitis bacteriana en niños febriles entre 28 y 90 días de vida con diagnóstico de infección urinaria. Emerg Pediatr. 2022; 1: 78-82.
6. Shaikh N, Hoberman A, Hum SW, Alberty A, Muniz G, Kurs-Lasky M, et al. Development and Validation of a Calculator for Estimating the Probability of Urinary Tract Infection in Young Febrile Children. JAMA Pediatr. 2018; 172: 550556. Disponible en: https://uticalc.pitt.edu.
7.** Piñeiro Pérez R, Cilleruelo Ortega MJ, Ares Álvarez J, Baquero-Artigao F, Silva Rico JC, Velasco Zúñiga R, et al.; Grupo colaborador de infección urinaria en Pediatría. Recomendaciones sobre el diagnóstico y tratamiento de la infección urinaria. An Pediatr (Barc). 2019; 90: 400.e1-e9.
8.** Shaikh N, Hoberman A. Urinary tract infections in children: Epidemiology and risk factors. En: UpToDate Torchia MM (ed.), UpToDate, Waltham, MA, 2019. Disponible en: www. uptodate.com.
9.** González Rodríguez JD, Justa Roldán MJ. Infección de las vías urinarias en la infancia. Protoc diagn ter pediatr. 2022; 1: 103-29.
10. Martínez Suárez V, Taborga Díaz E. Infección de las vías urinarias. Pediatr Integral. 2009; XIII: 530-40.
11. Benítez Fuentes R, Jiménez San Emeterio J. Infección del tracto urinario. Pediatr Integral. 2013; XVII: 402-11.
12. Mattoo TK, Shaikh N, Nelson CP. Contemporary Management of Urinary Tract Infection in Children. Pediatrics. 2021; 147: e2020012138. DOI: 10.1542/peds.2020-012138. Erratum in: Pediatrics. 2022; 150: PMID: 33479164.
13. Okarska-Napierala M, Wasilewska A, Kuchar E. Urinary tract infection in children: Diagnosis, treatment, imaging – comparison of current guidelines. J Pediatr Urol. 2017; 13: 567-73.
14. Shaikh N, Hoberman A. Urinary tract infections in infants older than one month and young children: Acute management, imaging, and prognosis. 2022. Disponible en: www. uptodate.com.
15.** Alberici I, Bayazit AK, Drozdz D, Emre S, Fischbach M, Harambat J, et al. ESCAPE Study Group; PREDICT Trial. Pathogens causing urinary tract infections in infants: a European overview by the ESCAPE study group. Eur J Pediatr. 2015; 174: 783-90.
16. Brandström P, Lindén M. How Swedish guidelines on urinary tract infections in children compare to Canadian, American and European guidelines. Acta Paediatr. 2021; 110: 1759-71.
17. Shaikh KJ, Osio VA, Leeflang MM, Shaikh N. Procalcitonin, C-reactive protein, and erythrocyte sedimentation rate for the diagnosis of acute pyelonephritis in children. Cochrane Database Syst Rev. 2020; 9: CD009185.
18. Shaikh N, Rajakumar V, Peterson C, Gorski J, Ivanova A, Gravens Muller L, et al. Cost-utility of antimicrobial prophylaxis for treatment of children with vesicoureteral reflux. Front Pediatr. 2020; 7: 530.
19. Hewitt I, Montini G. Vesicoureteral reflux is it important to find? Pediatr Nephrol. 2021; 36: 1011-7.
20. Shaikh N, Craig JC, Rovers MM, Da Dalt L, Gardikis S, Hoberman A, et al. Identification of children and adolescents at risk for renal scarring after a first urinary tract infection: a meta-analysis with individual patient data. JAMA Pediatr. 2014; 168: 893.
Bibliografía recomendada
– Garin EH, Olavarria F, García Nieto V, Valenciano B, Campos A, Young L. Clinical significance of primary vesicoureteral reflux and urinary antibiotic prophylaxis after acute pyelonephritis: a multicenter, randomized, controlled study. Pediatrics. 2006; 117: 626-32.
Estudio de referencia sobre la profilaxis de las ITU que ha modificado las pautas previas de su manejo. Propone la restricción del uso de fármacos que inhiban el crecimiento bacteriano, limitando los inconvenientes que estos pueden originar y sin representar riesgos de lesión renal.
– Simoes e Silva AC, Oliveira EA, Mak RH. Urinary tract infection in pediatrics: an overview. J Pediatr (Rio J). 2020; 96(S1): 65-79.
Artículo que revisa todos los aspectos novedosos relacionados con la ITU en la población pediátrica, así como los aspectos que aún continúan en debate.
– Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica. Guiasalud 2011 [en línea]. Disponible en: http://www.guiasalud.es/egpc/ ITU/completa/index.html.
Revisión de la infección urinaria en niños respaldada por el Ministerio de Sanidad, con enfoque en el diagnóstico, prevención, seguimiento y tratamiento de la misma. Muy útil, aunque pendiente de nueva actualización.
– Shaikh N, Hoberman A. Urinary tract infections in children: Epidemiology and risk factors. En: UpToDate Torchia MM (ed.), UpToDate, Waltham, MA, 2019. Disponible en: www. uptodate.com.
Revisión actualizada sobre la epidemiología y los factores de riesgo asociados a la infección urinaria en la población pediátrica.
– Piñeiro Pérez R, Cilleruelo Ortega MJ, Ares Álvareza J, Baquero-Artigao F, Silva Rico JC, Velasco Zúñiga R, et al. Recomendaciones sobre el diagnóstico y tratamiento de la infección urinaria. An Pediatr (Barc). 2019; 90: 400.e1-e9. Disponible en: https://doi.org/10.1016/j.anpedi.2019.02.009.
Recomendaciones del grupo de trabajo de Infectología Pediátrica para el tratamiento de la ITU en Pediatría.
– Alberici I, Bayazit AK, Drozdz D, Emre S, Fischbach M, Harambat J, et al. ESCAPE Study Group; PREDICT Trial. Pathogens causing urinary tract infections in infants: a European overview by the ESCAPE study group. Eur J Pediatr. 2015; 174: 783-90.
Revisión europea que nos pone de manifiesto la problemática actual con el aumento de la prevalencia de bacterias atípicas multirresistentes como uropatógenos causantes de ITU.
– González Rodríguez JD, Justa Roldán MJ. Infección de las vías urinarias en la infancia. Protoc diagn ter pediatr. 2022; 1: 103-29.
Protocolo recién actualizado de la Asociación Española de Pediatría (AEP) que revisa todos los aspectos en relación con la ITU pediátrica, siendo muy útil para la práctica clínica diaria.
| Caso clínico |
|
Acude a nuestra consulta de Atención Primaria un niño de 3 meses con fiebre de 38,5ºC de 24 horas de evolución. Asocia irritabilidad, decaimiento y rechazo de la ingesta. La madre nos refiere que ha presentado un vómito de contenido alimenticio el día previo. No existen cambios en las deposiciones. Sin clínica respiratoria ni ambiente epidémico en la familia. En cuanto a los antecedentes perinatales, el embarazo fue controlado en todo momento, el parto fue a término, vaginal y eutócico. El niño ya ha iniciado el calendario vacunal. Sigue alimentación con lactancia mixta y su desarrollo pondo-estatural es adecuado. No existen antecedentes familiares de interés. En la exploración física destaca fiebre de 39ºC e irritabilidad, sin un foco en la exploración. Se decide derivar a Hospital de tercer nivel para estudio y valoración. En el Servicio de Urgencias se obtiene tira reactiva de orina por sondaje uretral para análisis y urocultivo, se solicita analítica completa con reactantes de fase aguda y hemocultivo. En la tira reactiva se observa leucocituria y nitrituria, y en el sedimento se confirma la presencia de piuria y bacteriuria. En la analítica destaca leucocitosis con neutrofilia y elevación de reactantes de fase aguda, con función renal conservada e ionograma normal. Debido a la edad del menor y a la clínica de decaimiento e irritabilidad se decide realizar una punción lumbar, sin hallazgos patológicos en el análisis de líquido cefalorraquídeo y sin crecimiento microbiológico en el cultivo. Se inicia antibioterapia empírica con ampicilina y gentamicina endovenosa y se decide ingreso hospitalario dada la edad y el aspecto general, hasta comprobar evolución y sensibilidad antimicrobiana en el urocultivo. Durante su ingreso se aprecia mejoría progresiva, manteniendo ingesta y adecuado estado general y desapareciendo la fiebre a las 24 horas de iniciado el tratamiento antibiótico. El hemocultivo resulta negativo. A las 48 horas avisan de Microbiología por crecimiento en el urocultivo de más de 100.000 UFC/ml de E. coli multisensible, por lo que dada la evolución satisfactoria y la posibilidad de control ambulatorio por su pediatra se decide alta, indicándole realizar un total de 10 días de tratamiento oral con una cefalosporina de tercera generación.
|







 Hypercalciuria and hypocitraturia. The concept of prelithiasis in Pediatrics
Hypercalciuria and hypocitraturia. The concept of prelithiasis in Pediatrics 