|
| Temas de FC |
S. Fernández-Plaza*. B. Reques Llorente**
*Pediatra de Atención Primaria. Centro de salud Galapagar. Galapagar. Madrid.**Pediatra de Atención Primaria. Centro de salud Somosaguas. Pozuelo de Alarcón. Madrid
| Resumen
La supervivencia del cáncer infantil ha mejorado de forma significativa en los últimos años. Este descenso de la mortalidad ha sido consecuencia de la aplicación de nuevos y mejores procedimientos diagnósticos y terapéuticos. El abordaje multidisciplinar del diagnóstico y tratamiento de los tumores en la edad pediátrica ha supuesto un claro beneficio para este grupo de pacientes. Finalmente, hay que reseñar que la investigación y el desarrollo de mejores medidas de soporte, también han contribuido a disminuir su morbi/mortalidad. En este artículo, se han revisado las bases del tratamiento del cáncer infantil. El objetivo de la investigación de las nuevas terapias se dirige, de un lado, a mejorar la supervivencia de los pacientes y, de otro, a minimizar la toxicidad a corto y, en especial, en la población pediátrica a largo plazo. |
| Abstract
Treatment of paediatric cancer: principles of multimodal therapy Survival of childhood cancer has significantly improved over the last years. The decrease of mortality has been based on the investigation of new and better diagnostic and therapeutic procedures. Investigation and development of better support therapies has contributed significantly to this improvement. In this article we review the different aspects of treatment of childhood cancer. New treatments are designed to improve the results on survival and to decrease the toxicities and long term secondary effects. |
Palabras clave: Terapia multimodal; Quimioterapia; Radioterapia; Trasplante de progenitores hematopoyéticos
Key words: Multimodal therapy; Chemotherapy; Radiotherapy; Hematopoietic stem cell transplantation
Pediatr Integral 2016; XX (7): 465-474
Bases del tratamiento del cáncer en Pediatría: principios de la terapia multimodal
Incidencia y supervivencia del cáncer infantil
Los avances terapéuticos en relación con el cáncer infantil han sido enormes en las últimas décadas. Estos avances han permitido un descenso de la mortalidad, casi un 60% desde los años sesenta hasta finales del siglo pasado. En los últimos años, se ha mantenido esta tendencia decreciente. A pesar de esto, el cáncer sigue siendo la principal causa de muerte por enfermedad a partir del primer año de vida y hasta la adolescencia. En 2013, el cáncer ocasionó el 29% de las muertes entre 1 y 14 años, y el 18% entre 15 y 19 años(1,2).
El cáncer infantil es una enfermedad relativamente infrecuente. Según la información publicada por el Registro Español de Tumores Infantiles para el periodo 2010-2012, en España, se diagnosticaron aproximadamente, un caso por cada 6.500 niños menores de 15 años al año, lo que se traduce en aproximadamente 1.100 nuevos casos anuales en niños entre 1 y 14 años. España se sitúa en el contexto europeo occidental, en cuanto al patrón de incidencia y la distribución por grupos tumorales.
Según los datos proporcionados por el RNTI-SEOP, el cáncer infantil más frecuente es la leucemia aguda (30%). Casi el 80% de las leucemias son linfoblásticas agudas (LLA) y alrededor del 18% son leucemias agudas mieloblásticas (LMA). Le siguen en frecuencia: los tumores del sistema nervioso central (21,7%), que constituyen casi una cuarta parte de todos los tumores infantiles, y los linfomas (12,7%) que, en menores de 15 años, son mayoritariamente no Hodgkin (62%), incluyendo el linfoma de Burkitt. El 18% de los tumores infantiles son embrionarios, como el neuroblastoma (9%) y el tumor de Wilms (5%). El retinoblastoma (3%), los tumores hepáticos (1%) y los tumores germinales, también pertenecen a este grupo(1,2). Los tumores óseos malignos representan el 6% de los cánceres infantiles, los dos más frecuentes: el osteosarcoma y el tumor de Ewing (Fig. 1).
Figura 1. Distribución por grupo diagnóstico de los tumores infantiles en España. 0-14 años.2000-2011.RETI-SEOP.
La frecuencia de cada uno de ellos varía según el grupo de edad de los niños. Así, en los menores de 5 años, el tumor más frecuente es la leucemia y le siguen los tumores del sistema nervioso central y los neuroblastomas. Sin embargo, esta última entidad es prácticamente inexistente en mayores de 14 años, donde los linfomas pueden, en algunas series, llegar a ser el tumor más frecuente. Globalmente, para la mayoría de tumores, la incidencia es mayor en niños que en niñas.
Las leucemias y tumores del sistema nervioso central (SNC) son los responsables de la mayoría de las muertes por cáncer infantil. El descenso de la mortalidad producido desde la década de los años 80 es similar en ambos sexos y afecta a todos los grupos de edad, aunque es menos acusado en menores de un año. La mejoría de la supervivencia no se ha debido a una disminución de la incidencia, sino a las mejoras diagnósticas, terapéuticas y asistenciales, en general. Esto es, al incremento de la efectividad de la asistencia. Tres cuartas partes de los niños diagnosticados de cáncer en España, superan los 5 años de supervivencia (Fig. 2).
Figura 2. Supervivencia a los 5 años del diagnóstico de los tumores infantiles en España. Evolución desde 1980 por años de diagnóstico, 0-14 años. RETI-SEHOP.
Entre los tumores con supervivencia a los 5 años de diagnóstico, superior al 90%, están: los linfomas Hodgkin, los nefroblastomas, los retinoblastomas y los tumores germinales gonadales. Con supervivencias superiores al 80%: las LLA, los linfomas no Hodgkin y los hepatoblastomas. Los neuroblastomas presentan supervivencias más modestas, aunque superiores al 70% y, el resto de tumores se encuentran por encima del 60%, excepto los osteosarcomas.
Quimioterapia del cáncer infantil
El origen del tratamiento quimioterápico está en el reconocimiento del cáncer como una enfermedad diseminada con tendencia a presentar micrometástasis no visibles.
La eficacia del tratamiento oncológico depende de múltiples factores farmacológicos y biológicos(3):
• La comprensión a nivel molecular de los mecanismos de acción y de los de resistencia a fármacos.
• La sensibilidad de los distintos subtipos histológicos tumorales a cada fármaco antineoplásico.
• Del perfil farmacocinético de cada agente y sus implicaciones farmacodinámicas.
• Del conocimiento de las interacciones antagónicas o sinérgicas de diferentes fármacos administrados en combinación, su actividad antitumoral y sus efectos secundarios.
• La identificación de los patrones normales de toxicidad en cada órgano para cada antineoplásico aislado y su combinación.
Formas de quimioterapia
1. Quimioterapia de inducción. Se emplea como tratamiento primario en pacientes con enfermedad avanzada o diseminada, o en aquellos enfermos en los que no exista otra posibilidad de tratamiento. Ofrece varias ventajas: el tratamiento actúa sobre todas las posibles localizaciones tumorales incluidas las microscópicas y permite un tratamiento más agresivo.
2. Quimioterapia adyuvante. Consiste en administrar quimioterapia sistémica tras el control local del tumor primario mediante cirugía y/o radioterapia en pacientes con alto riesgo de recaída metastásica, como los que presentan tumores de gran volumen. La finalidad de la quimioterapia adyuvante es eliminar la enfermedad microscópica presente al diagnóstico y que no se elimina con el tratamiento inicial. Se ha demostrado eficaz en algunos tumores pediátricos frecuentes, incluyendo: el tumor de Wilms, los linfomas, el sarcoma de Ewing, el osteosarcoma y el rabdomiosarcoma. Existen varios factores que pueden justificar su eficacia: en primer lugar, las células que constituyen la enfermedad microscópica se encuentran en fase de división celular activa, lo cual las hace susceptibles al efecto de los citostáticos; en segundo lugar, reduce las posibilidades de que surjan clones quimioresistentes debido al escaso número de células que conforman las micrometástasis; y finalmente, todas las células están expuestas a una concentración adecuada del fármaco.
3. Quimioterapia neoadyuvante. Consiste en el empleo de la quimioterapia como tratamiento inicial en los enfermos con cáncer localmente avanzado, aunque todavía limitado. Reduce el tamaño del tumor y facilita el tratamiento quirúrgico/radioterápico posterior, también disminuye las posibilidades de complicaciones derivadas de estos procedimientos, como hemorragias o diseminación tumoral intraoperatoria. Además, permite valorar la respuesta histológica del tumor al tratamiento inicial con citostáticos y proporciona tratamiento precoz de la enfermedad microscópica metastásica.
4. Quimioterapia de rescate. El fracaso de los protocolos de terapia combinada reduce las posibilidades de éxito en el tratamiento del tumor. En caso de recidiva de la enfermedad, se debe emplear una segunda línea de tratamiento compuesta por fármacos con diferentes mecanismos de acción a los empleados con anterioridad. Este tipo de tratamiento tiene como objetivo, obtener una nueva remisión completa de la enfermedad. Los resultados terapéuticos de este tipo de tratamiento son peores, de modo general, a los obtenidos con los esquemas iniciales.
Resistencia a fármacos
El principal motivo de fracaso terapéutico en el cáncer infantil es la resistencia a citostáticos. Los mecanismos de quimiorresistencia tienen un papel fundamental a la hora de seleccionar los fármacos que se incluyen en los distintos regímenes de quimioterapia y en los tratamientos de segunda línea (quimioterapia de rescate). Esta resistencia puede existir desde el inicio del tratamiento en tumores expuestos a quimioterapia por primera vez o bien puede adquirirse a lo largo del tratamiento. También, puede ser específica para un solo agente o inespecífica, afectando entonces de forma simultánea a distintas clases de antineoplásicos, es lo que se conoce como resistencia a múltiples drogas (RMD). La RMD tiene un origen genético y se relaciona con la amplificación de determinados genes en las células tumorales resistentes(4). El mecanismo mejor conocido consiste en un aumento de la eliminación del fármaco fuera de la célula, con la consecuente disminución de su concentración intracelular. La glicoproteína transportadora de membrana P (gp-P), codificada por el gen mdr-1 y que como bomba de flujo y transporte fuera de la célula de los fármacos, estaría implicada en este mecanismo. La RMD se asocia con menor probabilidad de supervivencia y menor duración de la remisión de la enfermedad.
Nuevas terapias en oncología pediátrica
En los últimos años, han aparecido nuevas moléculas en el campo de la oncología y algunas de ellas han resultado realmente innovadoras. El desarrollo de nuevos tratamientos en Pediatría ha sido muy inferior al realizado en adultos por diversas razones, como la baja frecuencia de los tumores infantiles o diferente fisiología y farmacología de los pacientes pediátricos respecto de los adultos, entre otras. Muchos de los nuevos agentes están dirigidos contra las alteraciones genéticas y moleculares que se creen implicadas en la génesis del cáncer o en la resistencia a la terapia. Gran parte de los esfuerzos, también se han orientado a incrementar el arsenal terapéutico de los especialistas en oncología, modificando agentes ya conocidos, para cambiar sus perfiles farmacocinéticos y/o su distribución tisular y, de este modo, mejorar su eficacia y/o disminuir sus toxicidades. Es el caso de las formas pegiladas y liposomales de citostáticos ya conocidos, como: la asparaginasa pegilada, o la daunorrubicina liposomal(3).
Tratamiento quirúrgico en el cáncer
El cirujano infantil debe trabajar en colaboración con el oncólogo y el radioterapeuta para elaborar y consensuar la estrategia de tratamiento en los tumores infantiles. El papel de la cirugía, cada vez menos radical, incluye en algunos casos, la resección completa; pero, en muchos otros: la biopsia para diagnóstico y estadiaje, la citorreducción, la colocación de accesos venosos centrales y el tratamiento de las complicaciones de la quimio/radioterapia.
Antes de la aplicación de la radioterapia y quimioterapia, la cirugía constituía el único tratamiento posible de los tumores sólidos; no obstante, solo un pequeño porcentaje de pacientes con tumores localizados se curaban. Actualmente, es conocido que el abordaje del cáncer infantil requiere un tratamiento multimodal, siendo la cirugía una parte importante de este.
Existen algunas diferencias de los tumores infantiles respecto a los de los adultos, que es necesario tener en cuenta a la hora de planificar la cirugía(5):
• Suelen estar muy vascularizados.
• Suelen ser tumores de gran tamaño al diagnóstico.
• Hay que minimizar las secuelas, ya que estas serán de por vida.
• La pérdida de calor en la cirugía, puede llegar a tener consecuencias importantes para el niño.
Las indicaciones de la cirugía en el ámbito de la oncología, incluyen las que se citan a continuación.
Prevención del cáncer
Existen una serie de enfermedades y síndromes que predisponen la aparición de tumores, en algunos de estos casos, el cirujano debe realizar exploraciones y/o extirpaciones periódicas para prevenir el desarrollo de enfermedades malignas. Es el caso de: las poliposis familiares, la neurofibromatosis, el síndrome de Beckwith-Widemann, el síndrome WARG…
Diagnóstico de cáncer
Los tumores infantiles no siempre precisan de la obtención de material anatomopatológico para su diagnóstico, las pruebas de imagen y/o la existencia de marcadores tumorales específicos, en algunos casos, como el neuroblastoma o los tumores de células germinales, permiten realizar un diagnóstico de forma incruenta. Sin embargo, en otros casos, la cirugía es imprescindible(5). El diagnóstico histológico de las distintas neoplasias precisa, en la mayoría de los casos, realizar una biopsia. Con la biopsia, también se obtiene material con el que se pueden llevar a cabo estudios genéticos, bioquímicos o inmunológicos, gracias a los cuales se ha podido conocer mejor la biología de los tumores infantiles. No debemos olvidar, que la biopsia es un procedimiento con riesgos, limitaciones y consecuencias, que deben ser explicadas al paciente (si la edad lo indica) y a su familia. La punción aspiración con aguja fina (PAAF) es la prueba menos agresiva y tiene escasas complicaciones, pero su resultado depende mucho de la habilidad del cirujano y la experiencia del patólogo. Solo se puede emplear para el estudio citológico. En el caso de la biopsia con Tru-cut, se extrae un cilindro de tejido y el material que se obtiene es suficiente para realizar estudio histológico. Las biopsias abiertas constituyen la mejor forma de obtener suficiente tejido tumoral y permiten explorar: la afectación/infiltración de los órganos vecinos, la consistencia tumoral y la relación del tumor con las estructuras vecinas. No obstante, esta técnica tiene más probabilidad de complicaciones, como el sangrado intraoperatorio o las infecciones. La segunda aplicación de la cirugía en el diagnóstico consiste en realizar el estadiaje del tumor, aunque, en los últimos años, su utilidad se ha reducido considerablemente debido a los avances de las pruebas de imagen.
Tratamiento del cáncer
El papel tradicional de la cirugía en el tratamiento del cáncer, ha sido el de la extirpación tumoral. Sin embargo, en ocasiones, nos encontramos con tumores irresecables por compromiso de estructuras vitales, es en estos casos cuando el niño puede beneficiarse de la reducción de la masa tumoral mediante resecciones parciales o casi totales, para posteriormente administrar radio y/o quimioterapia; es decir, practicando una citorreducción del tumor. La resección de las metástasis en el cáncer infantil se suele realizar con un fin curativo y no suelen abordarse hasta no haber resecado el tumor primario. Los tumores que con más frecuencia requirieren la resección de metástasis son: el ostosarcoma, el sarcoma de Ewing, el tumor de Wilms, el hepatoblastoma y los tumores de partes blandas. En muchos de estos tumores, las metástasis suelen ser pulmonares.
Las indicaciones quirúrgicas varían de unos tumores a otros. A continuación, exponemos las peculiaridades del tratamiento quirúrgico de algunos de los tumores más frecuentes en Pediatría:
• El tratamiento quirúrgico del tumor de Wilms es controvertido, los dos principales grupos cooperativos recomiendan esquemas de tratamiento opuestos, la Sociedad Europea de Oncología Pediátrica recomienda administrar quimioterapia neoadyuvante y, posteriormente, realizar la resección quirúrgica del tumor, con el fin de reducir el tamaño tumoral por un lado y, por otro, la posibilidad de complicaciones asociadas a la cirugía, como la hemorragia o la diseminación tumoral. El Grupo de Estudio del Tumor de Wilms propone realizar una nefrectomía radical inicial sin quimioterapia neoadyuvante previa, alegando la necesidad de obtener un diagnóstico histopatológico y correcto estadiaje del tumor desde el principio.
• En el neuroblastoma, el papel de la cirugía es variable, en función de la localización y extensión del tumor. Los tumores en estadios precoces y con marcadores biológicos favorables se benefician de la resección quirúrgica sin asociar otras modalidades de tratamiento. En el resto de tumores, el tamaño tumoral o la localización hacen que la resección completa inicial sea poco probable o muy compleja quirúrgicamente, por lo que precisan de quimioterapia neoadyuvante.
• Los rabdomiosarcomas son tumores de origen mesenquimal que se localizan con mayor frecuencia en el cuello (35%), el tracto genitourinario (25%) y las extremidades (19%). Suelen extirparse aquellos cuya extensión es limitada y la localización accesible quirúrgicamente; en el resto de los pacientes, la quimioterapia y la radioterapia son el tratamiento de elección.
• El papel de la cirugía en el tratamiento de los linfomas, como los linfomas de Hodgkin, se limita, en la mayoría de los casos, a establecer el diagnóstico mediante la biopsia. En épocas pasadas, el estadiaje de estos tumores se realizaba mediante laparotomía abdominal y esplenectomía. Con la mejora de las técnicas de diagnóstico por imagen, la mayoría de los protocolos contemplan su estadiaje clínico y no quirúrgico.
Terapia de soporte
Finalmente, la cirugía mantiene un papel muy importante en la terapia de soporte (cirugía adyuvante). La colocación de accesos vasculares venosos ha facilitado de forma significativa el tratamiento de los niños con cáncer. La mayoría de estos pacientes reciben tratamientos de quimioterapia prolongados y a través de estos accesos vasculares se extraen muestras de sangre para analítica, se administran hemoderivados, fluidos y antibióticos, así como la quimioterapia. Los catéteres pueden ser temporales o permanentes, externos o internos.
• Catéteres externos temporales, implantados periféricamente, su principal ventaja radica en que se pueden colocar con sedación y retirar con anestesia local.
• Catéteres externos permanentes (tipo Hickman o Broviac) son tunelizados en el tejido subcutáneo, reduciendo el riesgo de infección respecto a los anteriores. Pueden tener una o dos luces y precisan anestesia general para colocarlos y retirarlos.
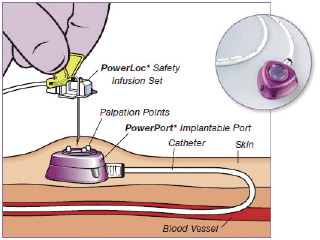
• Catéteres internos permanentes, implantables con reservorio cutáneo (portacaths subcutáneos). Tienen algunas ventajas, como un menor riesgo de infección, mejor calidad de vida del paciente y mínimo dolor en su manipulación. Requieren anestesia general para colocarlos y retirarlos y unas condiciones de estricta asepsia (Fig. 3).
Figura 3. Porta-cath subcutáneo.
Las complicaciones de un acceso venoso central pueden ser mecánicas, infecciosas o relacionadas con la infusión. Las complicaciones infecciosas son las más frecuentes y están en relación directa con el descenso del recuento de neutrófilos en pacientes sometidos a quimioterapia. Entre las complicaciones mecánicas, se incluyen: neumotórax, sangrado por desgarro venoso o lesión arterial, taponamiento cardiaco y trombosis.
Los niños con cáncer también precisan, en muchas ocasiones, un soporte nutricional adicional; aquí, el cirujano junto con el oncólogo pueden decidir realizar gastrostomías que faciliten el manejo nutricional de estos pacientes.
Radioterapia en el tratamiento del cáncer infantil
La oncología radioterápica es un procedimiento de gran utilidad en el tratamiento de los tumores pediátricos. El balance riesgo-beneficio de este tipo de tratamiento es fundamental en la infancia.
La radioterapia constituye un procedimiento terapéutico de gran eficacia en todos los grupos de edad. No obstante, su aplicación en la infancia requiere una especial atención, debido a sus potenciales efectos sobre los tejidos en fase de crecimiento y desarrollo y el riesgo de segundos tumores a largo plazo. En los últimos años, se han producido importantes avances tecnológicos en el empleo de esta modalidad terapéutica, que permiten radiar de forma precisa el tumor, minimizando los efectos secundarios(6,7).
La radioterapia consiste en depositar una determinada cantidad de energía en un área específica de tejido previamente seleccionada, con el objetivo de destruir las células malignas. Produce daños en el ADN de las células, tanto sanas como malignas, mediante una ionización de sus átomos. Las células sanas, en general, son capaces de reparar estos daños con más facilidad, mientras que las células tumorales tienen alterados los mecanismos de reparación normales y resultan más afectadas por el tratamiento.
Las bases biológicas de la radioterapia se fundamentan en las diferentes respuestas del tejido sano y tumoral a las radiaciones ionizantes, en función de la dosis y los tiempos de administración. La dosis total de radiación se administra con frecuencia de forma fraccionada en distintas sesiones, durante un periodo de tiempo variable que oscila entre 3-6 semanas en la mayoría de los casos, esto se conoce como fraccionamiento de la dosis. El fraccionamiento de la dosis total de radiación permite a las células normales reparar los daños subletales ocasionados por la radiación sin permitir que lo hagan las tumorales. El acumulo de lesiones subletales en la célula neoplásica provoca un daño letal en esta. La relación tiempo/dosis de la radioterapia se define por: la dosis total de radiación (medida en grays), el número de “fracciones” necesarias para administrar la dosis total, la dosis por fracción y la duración del tratamiento.
Las dosis de radiación empleadas y la forma de administración dependen de la edad del paciente, la localización, el tipo y la radiosensibilidad del tumor. La existencia de enfermedades asociadas y el uso de otras modalidades terapéuticas, como la quimioterapia y la cirugía, también tienen gran importancia a la hora de planificar la radioterapia.
Esquemas de fraccionamiento
En la mayoría de los centros, el fraccionamiento convencional consiste en administrar entre 1,8 y 2 Grays (Gy) por fracción, una vez al día, durante 5 días a la semana, hasta completar dosis totales de radiación entre 50-60 Gy (Tabla I).
En niños, tanto la dosis por fracción como la dosis total de radiación, se ajustan de forma individualizada al tipo de tumor. Tumores muy radiosensibles, como los linfomas Hodgkin, la leucemia aguda y los germinomas reciben dosis mínimas por fracción de 1,5 Gy (Tabla II).
Diferentes estudios, realizados en la década de los años 70 y 80, mostraron que reduciendo la dosis por fracción se pueden alcanzar dosis acumuladas de radiación superiores, minimizando así los efectos a largo plazo sobre los tejidos normales y manteniendo el control del tumor. Con el hiperfraccionamiento, se administra una dosis por fracción reducida que permite programar dos sesiones de tratamiento al día, separadas por 6-8 horas.
El fraccionamiento acelerado también emplea dos fracciones diarias de dosis convencional (1,5-1,8 Gy por fracción), pero sin incrementar la dosis total de radiación. Este esquema consigue reducir el tiempo de tratamiento, lo cual es útil en tumores con una elevada capacidad de crecimiento. En general, se emplea poco en Pediatría.
Modalidades de radioterapia
Radioterapia con haz externo
La forma más habitual de administrar la radiación es a través de una fuente localizada externamente al paciente. Para ello, se emplean aceleradores capaces de generar haces de fotones, electrones o partículas pesadas. Los fotones tienen más penetrancia y capacidad de alcanzar órganos internos y los electrones se usan habitualmente para objetivos más superficiales(6-8).
La radioterapia con haces de protones es de gran interés en el tratamiento del cáncer en niños, principalmente en los tumores del sistema central. Los protones son partículas pesadas que no eliminan su energía según van penetrando en los tejidos como ocurre con los fotones, su máximo pico de radiación se libera cuando se para en el interior de los tejidos, propiedad que permite calcular la energía del haz de protones y cuál será su trayectoria. Está técnica reduce de forma significativa la dispersión de la radiación en los tejidos sanos.
Uno de los grandes avances en la radioterapia oncológica se produce en los años 80 con la introducción de la tomografía computerizada (TC), que permite realizar reconstrucciones tridimensionales del área clínica a irradiar. Con la radioterapia de conformación tridimensional (TC3D) se obtienen imágenes con TC o resonancia magnética nuclear (RMN) que permiten al radioterapeuta delimitar de forma precisa el área del tumor y las zonas de diseminación microscópica, evitando estructuras vitales y tejidos normales. Otra modalidad de radioterapia introducida en los últimos años, ha sido la radioterapia de intensidad modulada (IMRT), que utiliza múltiples campos de radiación y modifica la intensidad de los haces de colimación localmente durante la radiación, a diferencia de la radiación convencional en la que el haz de radiación es uniforme a lo largo del campo. Esta técnica presenta, sin embargo, un inconveniente, el riesgo elevado de no irradiar zonas de enfermedad microscópica debido a la gran definición que posee. Este problema se intenta obviar mediante las técnicas de imagen funcionales, como la tomografía de emisión de positrones (PET) o la resonancia magnética espectroscópica (RMS). Con estas técnicas, pueden incluso crearse zonas cóncavas de distribución de la dosis, lo cual es muy útil en determinadas localizaciones, como en algunos tumores de tejidos blandos o para evitar radiar la médula espinal o la cabeza del húmero. Su papel también es fundamental, cuando queremos evitar sobrerradiar determinadas estructuras de importancia próximas al tumor, como la cóclea en el tratamiento de los tumores de fosa posterior (meduloblastoma). Con las nuevas tecnologías, se ha conseguido reducir hasta un 65% las dosis de radiación sobre la cóclea y, consecuentemente, disminuir la ototoxicidad en niños.
La radioterapia fraccionada estereotáctica constituye otra modalidad de radioterapia de reciente uso en Pediatría.
Braquiterapia
Consiste en colocar sustancias radioactivas en contacto directo con el tejido tumoral, con el fin de depositar dosis muy elevadas de radiación en el tumor. En la población infantil, la braquiterapia puede presentar ventajas sobre la radiación externa en determinados tumores, como: rabdomiosarcomas pélvicos (uterinos, vaginales o perirrectales), retinoblastomas (cuando el tumor es de pequeño tamaño, unilateral y con mínimo riesgo de enfermedad multifocal) o en sarcomas de tejidos blandos de las extremidades inferiores, reduciendo las dosis de radiación en los cartílagos de crecimiento. Su uso no está muy extendido, ya que desde el punto de vista práctico, la braquiterapia se limita a lechos tumorales cuyo diámetro mayor no es superior a los 5-10 cm.
Finalmente, hay que mencionar la radioterapia metabólica con I131 meta-yodo-bencilguanidina (MIG) y la radioinmunoterapia. Marcando MIBG con I131 pueden administrarse dosis elevadas de radiación en las células del neuroblastoma. Existen estudios experimentales en niños diagnosticados de neuroblastomas refractarios con enfermedad progresiva, con resultados esperanzadores a expensas de una toxicidad aceptable.
Otras aplicaciones de la radioterapia
En algunos protocolos de acondicionamiento previo al trasplante alogénico de progenitores hematopoyéticos, se combina de forma secuencial la irradiación corporal total (12 Gy en 6 fracciones) con las altas dosis de quimioterapia.
La radioterapia también se usa con fines paliativos en los tumores infantiles. Se ha demostrado eficaz en el tratamiento del dolor que no responde a analgésicos, narcóticos u otros procedimientos. Las pautas de tratamiento son variables en función de la expectativa de vida del paciente, desde una sola sesión hasta tratamientos durante varias semanas.
Por último, no hay que olvidar la aplicación de la radioterapia en situaciones de urgencia oncológica, como los síndromes de compresión medular o el síndrome de vena cava superior, entre otros.
Toxicidad de la radioterapia
La toxicidad de la radioterapia sobre los tejidos normales puede observarse durante el tratamiento o años después. Según el momento de aparición, los efectos adversos se pueden agrupar en: agudos, aquellos que tienen lugar durante o inmediatamente después de la radiación y que pueden modificarse con la intensidad de la dosis; subagudos, los efectos adversos que tienen lugar entre los 3 y 9 meses del tratamiento y, finalmente, efectos tardíos, los que aparecen de forma característica al año de recibir la radioterapia(6).
La toxicidad de la radiación, depende de factores, como: el área anatómica irradiada, los parámetros del tratamiento (dosis de radiación total, esquemas de fraccionamiento y dosis por fracción), factores intrínsecos del huésped (estado nutricional, hipoxemia y factores genéticos celulares que predisponen al daño por radiación) y de la asociación de otros tratamientos de forma simultánea (cirugía y/o quimioterapia).
• Toxicidad aguda: los efectos secundarios agudos son considerados normales y esperables. Aparecen en tejidos con un elevado índice de proliferación celular, como: los epitelios, el aparato digestivo y las células hematopoyéticas. Los cambios en los epitelios pueden objetivarse de forma inmediata tras la exposición a la radiación. El eritema cutáneo y la sialoadenitis se manifiestan a las pocas horas y son más frecuentes en la radiación corporal total que en la radioterapia local. La alopecia aparece en la tercera semana de la radiación craneal y la recuperación parcial o total del pelo se produce a los 3 meses del tratamiento, dependiendo de las dosis de radiación que recibe la zona tratada. La afectación de las mucosas presenta características similares a las lesiones de la piel, se manifiesta como un intenso enantema que, en ocasiones, se complica al sobreinfectarse por cándida. Cuando las lesiones se extienden a la hipofaringe y esófago, el niño puede presentar distintos grados de odinofagia. Los efectos secundarios sistémicos (náuseas, vómitos, astenia y anorexia) ocurren a los días de iniciar el tratamiento, y su frecuencia e intensidad dependen de la superficie y localización en la zona irradiada. La afectación de la hematopoyesis es variable, la radiación local de la médula ósea provoca una linfopenia precoz. Al final de la segunda semana de tratamiento, descienden los recuentos de neutrófilos de forma poco significativa, en los procedimientos con superficies radiadas de gran tamaño (radiación cráneo-espinal, torácica o abdominal extensa). En aquellos procedimientos en los que se irradia la médula ósea (pelvis), las cifras de neutrófilos disminuyen de forma significativa; de forma similar las plaquetas bajan, también, entre la segunda y tercera semana de tratamiento.
La quimioterapia asociada puede aumentar, acelerar o retrasar la aparición de toxicidad aguda en los tejidos normales, especialmente cuando se administra actinomicina D, metotrexate o cisplatino. El cisplatino a bajas dosis, administrado junto con la radiación, produce un efecto sinérgico conocido como radiosensibilización. Por el contrario, la radioterapia también puede alterar el metabolismo de los citostáticos aumentando su toxicidad, un ejemplo sería el de la radiación craneal, que asociada a la administración de metotrexate sistémico puede producir un cuadro de leucoencefalopatía necrotizante en los pacientes pediátricos.
• La toxicidad subaguda y tardía, se manifiesta después de 3 meses de la radiación. Los efectos a largo plazo pueden aparecer hasta años después del tratamiento. Estos efectos tardíos son irreversibles y progresivos, y se deben principalmente a la lesión del endotelio vascular y de las células parenquimatosas del tejido radiado. Incluyen: cuadros de fibrosis progresiva pulmonar intersticial, pericarditis, disfunción tiroidea e hipofisaria, nefritis y obstrucción intestinal, entre otros. Sin embargo, uno de los principales inconvenientes de la radioterapia en la infancia es su efecto sobre los tejidos en crecimiento y desarrollo. Se han objetivado secuelas neurológicas y cognitivas en los niños con tumores del sistema nervioso central irradiados a edades tempranas. La toxicidad subaguda sobre el sistema nervioso central produce la destrucción progresiva de la sustancia blanca junto con cambios en los astrocitos responsables del mantenimiento de la barrera hematoencefálica. Clínicamente, la toxicidad subaguda de la radioterapia craneal se traduce en el denominado “síndrome de somnolencia” (somnolencia, anorexia y febrícula) que típicamente aparece a las 4-8 semanas de la radiación en la leucemia aguda linfoblástica o en los tumores primarios del SNC. De forma paralela, durante las 4-8 semanas (aunque puede prolongarse hasta 12 meses), la radiación puede empeorar de forma transitoria los síntomas propios de la enfermedad como consecuencia de la necrosis tumoral que produce el tratamiento, los síntomas responden al tratamiento con esteroides. Los efectos tardíos sobre el SNC son secundarios a la necrosis focal que aparece a los 6-24 meses de la radiación, se produce cuando la dosis total supera los 60Gy o en dosis por fracción superiores a los 2,4-3 Gy y la probabilidad de estas lesiones es mayor en niños menores de 5 años. Los efectos neurocognitivos provocados por la radioterapia están claramente descritos en la literatura. La magnitud del grado de afectación del coeficiente intelectual (CI) depende de la dosis y de la edad del niño, y suele manifestarse a los 2-5 años de la radioterapia. El descenso del CI es secundario al déficit de atención y la alteración en los procesos de memoria, pudiendo contribuir, también, los déficits neurológicos tras la neurocirugía. Este descenso del CI afecta principalmente a los niños entre 3-5 años, por lo que muchos protocolos de tratamiento no incluyen la radiación craneal en niños menores de esta edad. También, se ha comprobado un efecto sobre el crecimiento óseo por alteración de los cartílagos epifisarios. La magnitud de dicho retraso dependerá de la edad en el momento de la radiación y de la dosis administrada; en general, dosis superiores a 20 Gy tienen un efecto significativo en el crecimiento óseo.
Finalmente, el desarrollo de tumores secundarios está documentado hasta en un 5,8% de los supervivientes de cánceres infantiles que recibieron radioterapia durante el tratamiento de su neoplasia. Los tumores secundarios a radiación más frecuentes son: el cáncer de mama, los sarcomas de tejidos blandos, como el osteosarcoma, y los carcinomas de piel y tiroides, que se desarrollan entre 9 y 16 años después de la radiación.
Trasplante de progenitores hematopoyéticos
La reconstitución de la hematopoyesis mediante la infusión de progenitores o células madre hematopoyéticos es un procedimiento terapéutico usado en el tratamiento de múltiples enfermedades malignas infantiles. De todos los niños con cáncer, solo un 10-20% precisará un trasplante(9). La indicación vendrá determinada, en primer lugar, por: la enfermedad de base y el momento evolutivo de la misma, las condiciones generales del paciente y la disponibilidad de un donante apropiado en el momento preciso del curso de la enfermedad.
En relación al origen de células precursoras, existen dos tipos de trasplante: autólogo y alogénico. Se entiende por trasplante autólogo, el procedimiento en el que la fuente de las células progenitoras hematopoyéticas es el propio paciente. En el trasplante alogénico, la fuente de progenitores es un donante sano diferente del receptor. Los precursores hematopoyéticos en el trasplante alogénico pueden obtenerse de un hermano gemelo univitelino idéntico, denominándose entonces trasplante singénico. También, puede realizarse de un hermano que ha heredado el mismo HLA (la forma más habitual), siendo entonces un trasplante familiar HLA idéntico. En otras situaciones, el donante es un familiar no compatible totalmente, en estos casos, recibe el nombre de trasplante alogénico parcialmente compatible (haploidéntico). El principal problema de este trasplante, es el riesgo de enfermedad injerto contra huésped. El tiempo necesario para localizar estos donantes es corto, lo cual supone una ventaja importante en determinadas circunstancias. Finalmente, cuando se recurre a un donante obtenido a través de los registros internacionales se denomina trasplante no emparentado.
Obtención de progenitores
Inicialmente, los progenitores hematopoyéticos se obtenían exclusivamente de la médula ósea, en un procedimiento quirúrgico (realizado en condiciones estériles y bajo anestesia general) consistente en la punción-aspiración directa de las crestas ilíacas posteriores, para posteriormente infundirla por vía intravenosa al paciente. La utilización de células hematopoyéticas de sangre periférica como fuente de progenitores ha alcanzado una gran difusión, siendo la fuente de elección en el trasplante autólogo. Existe una relación equilibrada entre los precursores de la médula ósea y los presentes en sangre periférica. La sangre periférica contiene un 0,1% de progenitores, frente al 1% de la médula ósea. Para poder realizar este procedimiento es necesario aumentar el número de progenitores en sangre periférica mediante la movilización, que consiste en la administración de factores estimulantes de colonias granulocíticas (G-CSF) con el fin de aumentar el número de estos en la sangre circulante, para más tarde ser recolectados mediante leucoaféresis. Entre las ventajas de la sangre periférica, se encuentra una recuperación hematopoyética más rápida que cuando se usa médula ósea, aunque con mayor incidencia de enfermedad injerto contra huésped crónica. En las últimas décadas, se está consolidando, especialmente en las unidades de Pediatría, el uso de progenitores obtenidos desde sangre de cordón umbilical para el trasplante de donantes no emparentados y se han creado bancos de cordón umbilical por todo el mundo. Las células precursoras en sangre de cordón tienen una composición y funcionalidad diferente a las de la médula ósea y la sangre periférica, que determina menos enfermedad injerto contra huésped, incluso cuando existe disparidad HLA. Entre sus desventajas se encuentra, por un lado, la disponibilidad de una sola unidad en cada procedimiento (uso único), la posibilidad de transmitir enfermedades congénitas no detectadas por la historia familiar o pruebas de laboratorio o la disparidad del tamaño con el receptor.
El tratamiento que recibe el paciente en los días previos al trasplante, se denomina régimen de acondicionamiento y, clásicamente, los objetivos eran:
• Conseguir una inmunosupresión que garantice el prendimiento de los progenitores del donante en el receptor.
• Eliminar células tumorales residuales.
• Conseguir espacio físico para que se implanten los nuevos precursores.
Los regímenes de acondicionamiento se componen de dos o más quimioterápicos con adición o no de irradiación corporal total. En la última década, se ha extendido el uso de regímenes de acondicionamiento que causan citopenias y toxicidades mínimas. Estos protocolos se han empleado en niños con comorbilidades, en fases avanzadas de enfermedad o en determinadas patologías no oncológicas. En la tabla III y IV, se detallan las complicaciones más frecuentes post-trasplante.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. Registro Español de Tumores Infantiles (RETI SHEOP) 2014.
2.*** Incidencia y supervivencia del cáncer infantil. En: Madero L, Lassaleta A, Sevilla ed. Hematología y oncología pediátricas Madrid Ergon S.A.; 2015. P. 331-78.
3.*** ***Merino Arribas JM. Quimioterapia en el cáncer infantil. En: Madero L, Lassaleta A, Sevilla ed. Hematología y oncología pediátricas Madrid Ergon S.A.; 2015. P. 263-70.
4.* Chan H DeBoer G, Haddad G, Gallie BL, et al. Multidrug resistance in pediatric malignancies. Hematol Oncol Clin N Am. 1995; 9: 275-317.
5.*** Morató Robert P. Tratamiento quirúrgico del cáncer infantil. En: Madero L, Lassaleta A, Sevilla ed. Hematología y oncología pediátricas Madrid Ergon S.A.; 2015. P. 383-90.
6.** Ramos Albiac M, Giralt López de Sagrado J. Oncología radioterápica en el cáncer infantil. En: Madero L, Lassaleta A, Sevilla ed. Hematología y oncología pediátricas Madrid Ergon S.A.; 2015. P. 391-400.
7.** Swift P. Novel Techniques in the delivery of radiation in pediatric oncology. Pediatr Clin N Am. 2002; 49: 1107-29.
8. Timur M. Radiation therapy techniques in cancer treatment. UpToDate.
9.*** González Vicent M, Díaz Pérez MA. Trasplante de progenitores hematopoyéticos en oncohematología pediátrica. En: Madero L, Lassaleta A, Sevilla ed. Hematología y oncología pediátricas Madrid Ergon S.A.; 2015. P. 411-40.
Bibliografía recomendada
- Principles and Practice of Pediatric Oncology. Ed: Lippincott Williams and Wilkins; Edición: 6th Revised edition (1 de octubre de 2010).
Es un excelente libro recomendado para pediatras especializados en Oncología y quienes quieran profundizar en el tema.
| Caso clínico |
|
Paciente de 5 años que acude a urgencias por pérdida de peso de aproximadamente 400 g en los últimos días. No astenia, no sangrados, ni dolor óseo. Refiere cefalea y disuria intermitente en la última semana. Exploración Peso: 17,4 kg; TA: 115/75 mm Hg; Fc: 135 lpm; Tª: 37ºC. Buen estado general, no aspecto séptico, bien hidratada y perfundida, sin exantemas ni petequias. Palidez cutánea, no de mucosas. ACP normal, sin ruidos patológicos, ni distrés. ORL: faringe hiperémica con tímpanos normales. Presenta 2 adenopatías laterocervicales profundas derechas <1 cm de diámetro. Una adenopatía axilar derecha de 1-1,5 cm, no adherida a planos profundos, blanda, y varias axilares izquierdas de <1 cm. Adenopatía inguinal izquierda de 1 x 0,5 cm, no adherida, de consistencia blanda. Taquicárdica: soplo pansitólico II/VI. Abdomen: hígado palpable a 2 cm de reborde costal y se palpa bazo a 3 cm de reborde. Neurológico: sin alteraciones. Exploraciones complementarias Análisis de sangre a. Hemograma • Serie blanca: - Leucocitos: 9,35 x 10³/mm³, neutrófilos: 1 x 10³/mm³, linfocitos: 5,2 x10³/mm³, monocitos: 0,06 x 10³/mm³, eosinófilos: 0,03 x 10³/mm³, basófilos: 0,2 x 10³/mm. - Células atípicas: 31%. • Serie roja: - Hematies: 2,9 x 106/mm3. – Hemoglobina: 8,1 g/dl, hematocrito: 24,1%, volumen corpuscular medio: 83,1 fL, hemoglobina corpuscular media: 27,9 pg, concen. hemoglob. corpuscular media: 35,2 g/dl. • Serie plaquetar: – Plaquetas: 56 x 10³/mm³, volumen plaquetario medio: 7,1. b. Bioquímica básica Glucosa: 120 mg/dl, bilirrubina total: 0,7 mg/dl, ALT: 70 UI/, GGT: 28 UI/l, LDH: 663, Na: 137 mEq/l, K: 4 mEq/l, Cl: 105 mEq/l, Ca: 9,9 mEq/l, urea: 28 mg/dl, creatinina: 0,32 mg/dl. c. Coagulación Fibrinógeno: 348 mg/dl, índice protombina: 88%, tiempo de cefalina: 26,6 s, control de tiempo de cefalina: 27 s. Médula ósea Aspirado de médula ósea: médula ósea infiltrada por una población blástica leucémica del 83%, que desplaza al resto de las series medulares. Inmunofenotipo compatible con leucemia aguda linfoblástica B común. Evolución clínica A su ingreso, tras confirmar el diagnóstico de leucemia linfoblástica aguda B común y colocación de Porta-cath en quirófano, inicia tratamiento según protocolo SEHOP PETHEMA 2013, grupo riesgo intermedio. Recibe, inicialmente, quimioterapia de inducción IA. En el día +8 de quimioterapia, se objetiva ausencia de blastos en sangre periférica y en la médula del día +15 de tratamiento presenta 2% de blastos con enfermedad mínima residual del 0%.
|