|
| Temas de FC |
M.B. Roldán Martín, M. Martín Frías, M. Alonso Blanco
Unidad de Endocrinología y Diabetes Pediátrica. Hospital Universitario Ramón y Cajal. Universidad de Alcalá. Madrid
| Resumen
Los andrógenos son hormonas esteroideas con acciones androgénicas y anabólicas. Actúan a nivel del tejido reproductivo, piel, músculo, hueso e hígado. En la mayoría de los casos, el hiperandrogenismo es debido a un exceso en la producción o en la acción de los andrógenos endógenos. Las manifestaciones clínicas del exceso androgénico varían dependiendo de la causa, la edad y el sexo del paciente. La hiperandrogenemia es una causa frecuente de irregularidades menstruales en las adolescentes y es, junto a la insulinorresistencia, un hallazgo habitual en jóvenes obesas; de ahí, la importancia de realizar un diagnóstico precoz y adecuado. |
| Abstract
Androgens are steroid hormones that have androgenic and anabolic actions. Androgen target organs include the reproductive tract, skin, muscle, bone, and liver. In most instances, hyperandrogenism is due to excessive production or action of endogenous androgens. The clinical features of androgen excess vary depending on the cause as well as the age and sex of the patient. Hyperandrogenia is a prevalent endocrine disorder in adolescents with menstrual disturbances and is frequently associated to insulin resistance in obese young women, which emphasizes the importance of its early diagnosis. |
Palabras clave: Hiperandrogenismo; Hirsutismo; Adrenarquia; Síndrome de ovario poliquístico
Key words: Hyperandrogenism; Hirsutism; Adrenarche; Polycystic ovary syndrome
Pediatr Integral 2015; XIX (7): 498-508
Hiperandrogenismo
Introducción
El hiperandrogenismo es una situación de producción y/o acción androgénica excesiva.
Se presenta con diferentes síntomas y signos a lo largo de la vida dependiendo de la causa, de la edad y el sexo de los pacientes y de que haya otros problemas hormonales asociados(1). Es la patología endocrinológica más frecuente en la mujer. En las recién nacidas, se manifiesta en forma de genitales ambiguos; en la etapa prepuberal, de pubarquia o axilarquia prematuras; en mujeres ya adolescentes y adultas, como: hirsutismo, acné, alopecia androgénica e irregularidades menstruales, dando lugar a un síndrome de ovario poliquístico (SOP).
En este artículo, se revisan los aspectos más destacados de la fisiopatología, las manifestaciones derivadas del exceso de andrógenos, las causas de hiperandrogenismo y su diagnóstico y tratamiento.
Fisiopatología
La adrenarquia se define como el inicio de la secreción androgénica suprarrenal que precede al incremento de gonadotropinas y a la gonadarquia(2).
Es la maduración de la zona reticular de las glándulas suprarrenales y se produce a una edad aproximada entre los 6 y los 8 años.
La pubertad es la consecuencia de una compleja interacción entre factores: fisiológicos, genéticos y ambientales (estado nutricional y estilo de vida). Durante la pubertad, se produce la reactivación del eje hipotálamo-hipofisario con la secreción pulsátil de la hormona liberadora de gonadotropinas (GnRH) que se inicia al final del estadio prepuberal y que da lugar a un patrón de secreción característico de las hormonas luteinizante (LH) y folículo-estimulante (FSH), con un predominio de la secreción de LH. Además de la adrenarquia, durante la pubertad, aumenta la secreción de hormona de crecimiento (GH) y del factor de crecimiento relacionado con la insulina-1 (IGF-1) y se produce una insulinorresistencia fisiológica.
Los andrógenos son secretados por las gónadas y glándulas suprarrenales en respuesta a las hormonas LH y adrenocorticotropina (ACTH) respectivamente (Fig. 1). Los esteroides considerados como andrógenos son: dehidroepiandrosterona (DHEA), sulfato de dehidroepiandrosterona (DHEAS), Δ4-androstenediona (Δ4-A), testosterona y 5α-dihidrotestosterona (DHT), y son responsables de los cambios relacionados con la aparición de vello con características sexuales, acné y aumento de función de las glándulas apocrinas. La testosterona y DHT son los andrógenos bioactivos más importantes. Los andrógenos ováricos son fundamentalmente Δ4-A, DHEAS y testosterona. La testosterona y estradiol circulan en plasma unidos fundamentalmente a la globulina transportadora de hormonas sexuales SHBG (“sex hormone binding globulin”) y solo la fracción libre de la testosterona puede entrar en los tejidos diana.
Figura 1. Síntesis de hormonas esteroideas a nivel suprarrenal, ovárico y testicular. Se detallan las enzimas esteroidogénicas y productos intermedios. 3β-HSD2, 3β-hidroxiesteroide deshidrogenasa tipo 2; 17β-HSD1, 17β-hidroxiesteroide deshidrogenasa tipo 1; 17β-HSD3, 17β-hidroxiesteroide deshidrogenasa tipo 3; 17OH-pregnenolona, 17-hidroxipregnenolona; 17OH-progesterona, 17-hidroxiprogesterona; 18OH-corticosterona, 18-hidroxicorticosterona; CYP11A, colesterol desmolasa; CYP11B1, 11β-hidroxilasa; CYP11B2, aldosterona sintetasa; CYP17, 17β-hidroxilasa/17,20-desmolasa; CYP19, aromatasa; CYP21, 21-hidroxilasa; DHEA, dehidroepiandrosterona; DHEAS, dehidroepiandrosterona sulfato; DHT, 5α-dihidrotestosterona; DOC, deoxicorticosterona; StAR, proteína reguladora aguda de la esteroidogénesis.
Manifestaciones clínicas del exceso de andrógenos
Los signos y síntomas derivados del hiperandrogenismo son diferentes dependiendo de la edad en la que se ponen de manifiesto.
Durante la etapa prenatal, la principal manifestación clínica del hiperandrogenismo es la virilización de los genitales externos en la recién nacida, mientras que en los varones, puede pasar desapercibido o manifestarse como un aumento del tamaño del pene. En la etapa prepuberal, puede cursar con: aparición precoz de vello púbico o axilar (pubarquia prematura), cambios de olor corporal, aceleración del crecimiento y de la edad ósea, aumento del vello corporal, hipertrofia muscular, acné, cambios en la gravedad de la voz, hipertrofia del clítoris (niñas) o aumento del tamaño del pene (niños). Finalmente, en las adolescentes y mujeres adultas, los principales signos y síntomas derivados del hiperandrogenismo son: el hirsutismo, las irregularidades menstruales, el acné severo, la atrofia mamaria, la alopecia de distribución androgénica y la infertilidad.
Causas de hiperandrogenismo
En las adolescentes, el hiperandrogenismo es generalmente secundario a un exceso de la síntesis de andrógenos en el ovario y/o la suprarrenal.
Solo en una minoría de los casos existe un trastorno específico responsable del hiperandrogenismo (hiperplasia suprarrenal congénita, tumores, síndrome de Cushing, hipersecreción de hormona de crecimiento, fármacos u otros). En los niños prepuberales, el hiperandrogenismo refleja una producción excesiva de andrógenos por las glándulas suprarrenales o las gónadas (Tabla I).
Hiperandrogenismo de origen suprarrenal
Pubarquia prematura
La pubarquia prematura es la aparición de vello púbico antes de los 8 años en niñas y de los 9 años en niños, y es con frecuencia, secundaria a una adrenarquia prematura(3). Puede ir acompañada o no de la aparición de vello axilar, acné y aumento del olor corporal, y la edad ósea se suele corresponder al crecimiento lineal de los pacientes. Las concentraciones de andrógenos suprarrenales (especialmente de DHEAS) están elevadas para la edad cronológica, pero dentro del rango normal para el estadio de desarrollo puberal. Aun cuando suele ser una variante normal del desarrollo, en ocasiones, se asocia con antecedentes de bajo peso al nacimiento, insulinorresistencia y el posterior desarrollo de síndrome metabólico y SOP(4). Así, aproximadamente el 24% de las niñas que presentan una adrenarquia prematura desarrollarán un síndrome metabólico, asociado a obesidad en la mayoría de los casos(5).
Hiperplasia suprarrenal congénita
Las hiperplasias suprarrenales congénitas (HSCs) son un grupo de trastornos de herencia autosómica recesiva que resultan de mutaciones que reducen o anulan la actividad de enzimas y proteínas involucradas en la síntesis de esteroides suprarrenales y ováricos y resultan en una secreción excesiva de andrógenos suprarrenales(6). La forma más frecuente de HSC es la deficiencia de 21-hidroxilasa (95% de los casos), cuya prevalencia en la forma no clásica es de 1/1.000 y que es debida a mutaciones en el gen CYP21A2, que dan lugar a un aumento de las concentraciones de 17-hidroxiprogesterona y de andrógenos. La aparición de una pubarquia prematura puede ser la primera manifestación clínica de una HSC no clásica en niños y la presencia de virilización y una aceleración de la edad ósea sugieren el diagnóstico.
Síndrome de Cushing
El síndrome de Cushing en niños y adolescentes suele ser consecuencia de la administración de glucocorticoides exógenos(7). Cursa con: ganancia ponderal, enlentecimiento del crecimiento, pubertad retrasada (posiblemente secundaria al hipogonadismo inducido por el hipercortisolismo), cambios de personalidad, hipertensión, aparición de estrías cutáneas y una disminución de la mineralización ósea. Algunos pacientes también muestran manifestaciones asociadas al exceso androgénico, tales como un desarrollo sexual prematuro, hirsutismo, acné e irregularidades menstruales.
El síndrome de Cushing endógeno es secundario a un aumento de la secreción de cortisol, ACTH o CRH (hormona liberadora de corticotropinas), y puede ser ACTH-dependiente o ACTH-independiente. La enfermedad de Cushing hace referencia al síndrome de Cushing secundario a tumores hipofisarios productores de ACTH. El diagnóstico del síndrome de Cushing endógeno aparece en el algoritmo 1 al final del artículo. El tratamiento de elección para la mayoría de tumores que causan una enfermedad de Cushing es la resección quirúrgica.
Tumores suprarrenales productores de andrógenos
Los tumores suprarrenales productores de andrógenos, no asociados a síndrome de Cushing, son raros en la infancia y excepcionales en adultos. En las niñas se presentan con virilización y clitoromegalia. Deben sospecharse cuando el inicio de los síntomas sea brusco, en un momento diferente de la menarquia, y con una rápida progresión. Suelen aparecer en la primera década de la vida y tienen una alta mortalidad. El diagnóstico se basa en la realización de un TC (tomografía axial computarizada) y/o RM (resonancia magnética nuclear). El tratamiento es primariamente quirúrgico.
Resistencia a glucocorticoides
En este trastorno, excepcional por su rareza, mutaciones con pérdida de función en el receptor glucocorticoideo alteran la acción de los glucocorticoides en los tejidos diana. Como consecuencia, se produce un aumento de la secreción de ACTH y una hipersecreción de cortisol y andrógenos suprarrenales. La forma familiar de este defecto se hereda con carácter autosómico dominante. Los pacientes presentan concentraciones elevadas de cortisol en ausencia de manifestaciones del síndrome de Cushing por la resistencia a su acción. Los sujetos asintomáticos normotensos no precisan tratamiento, mientras que los pacientes sintomáticos pueden beneficiarse del uso de glucocorticoides a altas dosis.
Hiperandrogenismo de origen ovárico
Síndrome de ovario poliquístico
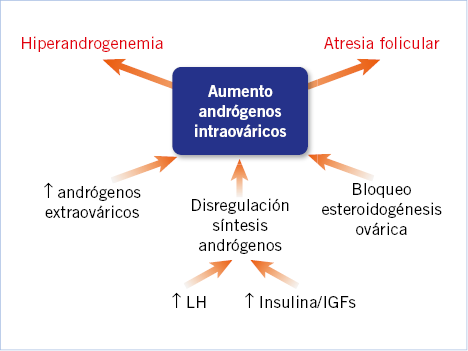
El SOP es un trastorno de presentación heterogénea, cuyas manifestaciones pueden ser diferentes entre pacientes y en una misma paciente a lo largo de la vida. Es uno de los motivos de consulta más frecuente de las adolescentes en las consultas de endocrinología. Su etiología es multifactorial y se implican factores: genéticos, raciales y ambientales. La patogenia del síndrome está en discusión, aunque se piensa que es el resultado de un círculo vicioso entre hiperandrogenismo e hiperinsulinismo(8) (Fig. 2). Se desconoce cuál es la prevalencia del SOP en las adolescentes, aunque recientemente se ha publicado una cifra del 4,3% (en población adulta, de un 5 a un 10% –en España 6,5%–)(9). Aproximadamente, el 55-73% de las pacientes adolescentes con SOP asocian sobrepeso u obesidad y es motivo de preocupación que la incidencia del síndrome está en aumento (asociado a obesidad de predominio central) y que la insulinorresistencia, que es frecuente en pacientes obesas con un aumento del perímetro cintura y de la grasa visceral, puede empeorar las manifestaciones metabólicas y reproductivas del síndrome.
Figura 2. Patogenia del SOP. Hipótesis de la insulina/IGF-1. Esta teoría sugiere que la hiperinsulinemia característica de la pubertad y los niveles elevados de IGF-1 inducen un síndrome parecido al SOP en adolescentes predispuestas. LH: hormona luteinizante; IGFs: factores de crecimiento similares a la insulina.
Las manifestaciones clínicas del SOP son: el hirsutismo, las irregularidades menstruales (oligomenorrea > 45 días que persiste más de dos años después de la menarquia, amenorrea o hemorragia uterina disfuncional), acné, alopecia y, durante la etapa reproductiva, infertilidad. La acantosis nigricans puede aparecer como un signo de insulinorresistencia, aunque esta y/o la hiperinsulinemia no deben ser utilizadas para el diagnóstico del SOP en las adolescentes.
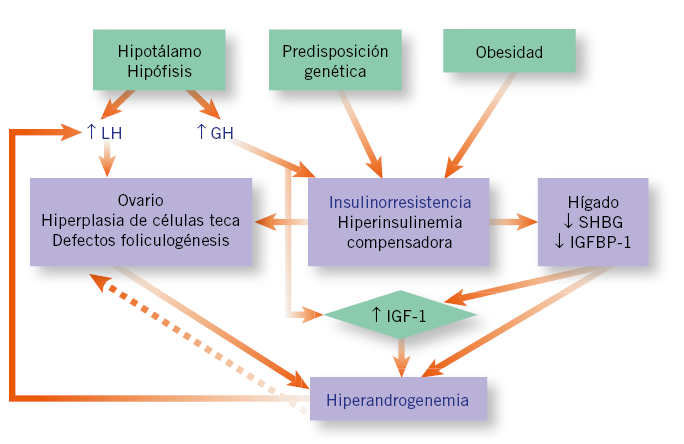
Los criterios diagnósticos del SOP en las adolescentes son controvertidos y, en la actualidad, se discute que los niveles elevados de andrógenos a esta edad puedan predecir los niveles en mujeres adultas o que la anovulación hiperandrogénica de las adolescentes de lugar a un SOP en la edad adulta(10). De hecho, durante la pubertad se producen de forma fisiológica (aunque exagerada) cambios hormonales que recuerdan un SOP (Fig. 3).
Figura 3. Pubertad fisiológica: hallazgos similares a los encontrados en el síndrome de ovario poliquístico. LH: hormona luteinizante; GH: hormona de crecimiento; SHBG: proteína ligadora de hormonas sexuales; IGFBP1: proteína ligadora de factores de crecimiento similares a la insulina tipo 1; IGF-1: factor de crecimiento similar a la insulina-1.
Las niñas pueden presentar acné, un aumento del crecimiento del vello terminal e irregularidades menstruales durante el primer año después de la menarquia y, a veces, los hallazgos de SOP son transitorios. Los ciclos menstruales son, con frecuencia, anovulatorios en los primeros años después de la menarquia (85% en el primer año a 59% en el tercer año), el acné está presente en el 70% de las adolescentes –y no relacionado con otras manifestaciones del SOP– y el hirsutismo es leve por el corto tiempo de evolución de las pacientes. La valoración del hirsutismo se realiza con la escala de Ferriman-Gallwey modificada y una puntuación = 8 en mujeres de raza caucásica es considerada diagnóstica, aunque en adolescentes no existen datos normalizados y probablemente el punto de corte deba ser menor(11) (Fig. 4).
Figura 4. Escala de Ferriman-Gallwey modificada para la valoración del hirsutismo(11). Se valoran 9 zonas corporales con 1 a 4 puntos. Los valores superiores a 8 son diagnósticos de hirsutismo.
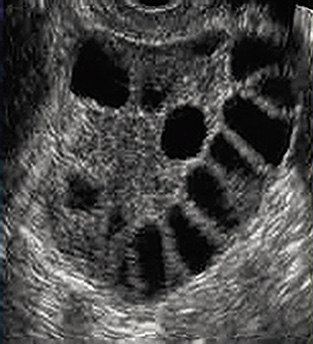
Además, tampoco existen datos normalizados para definir los valores de los andrógenos durante la adolescencia (el estudio hormonal debe realizarse en la fase folicular del ciclo menstrual o en amenorrea). Por último, el volumen ovárico es mayor en las adolescentes y el 30% tienen ovarios > 10 cc, observándose ovarios poliquísticos en un 10% de las adolescentes con reglas regulares, 28% en las que tienen reglas irregulares y 45% en las que presentan oligomenorrea(10,12-13) (Fig. 5).
Figura 5. Ecografía ovárica: ovarios poliquísticos.
El diagnóstico del SOP es de exclusión, tras descartar otras patologías que suponen un exceso androgénico y no existen guías clínicas(10,12-13). Tres conferencias internacionales han desarrollado criterios diferentes, aunque solapados para el diagnóstico del SOP en la edad adulta: la conferencia del Instituto Nacional de la Salud (NIH) en 1990, el consenso de Rotterdam (2003) (Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group 2004) y el consenso de la Adrogen Excess-PCOS Society (2006)(14-16). Los criterios de NIH incluyen: el hiperandrogenismo, la anovulación crónica y la exclusión de otras causas(14). El panel de expertos de la AE-PCOS establece, como criterio central para el diagnóstico del síndrome, el hiperandrogenismo clínico y/o bioquímico y la disfunción ovárica (oligo-anovulación dos años después de la menarquia y/o ovarios poliquísticos) y, probablemente, estos son los criterios que deberíamos utilizar en las adolescentes para evitar sobreestimar el valor diagnóstico del hallazgo ecográfico de ovarios poliquísticos en este grupo de edad(16) (Tabla II). El diagnóstico ecográfico de los ovarios poliquísticos es difícil en las adolescentes, especialmente en pacientes obesas, ya que la calidad de la imagen no es buena al no utilizarse la vía transvaginal, en la mayoría de los casos; de ahí que posiblemente el aumento del volumen ovárico por encima de los 10 cc sea el mejor marcador en las jóvenes, aunque no es un requisito para el diagnóstico del síndrome(17). Las niñas no hiperandrogénicas presentan una alta prevalencia de ovarios con morfología poliquística y, además, este hallazgo ecográfico no predice el desarrollo de SOP en el futuro.
En 2013, la Sociedad de Endocrinología de EE.UU. advirtió sobre la necesidad de ser cautos en el diagnóstico del SOP en las niñas adolescentes por las posibles implicaciones futuras sobre su salud ginecológica, metabólica y mental(18). En cualquier caso, se deberá realizar el seguimiento a largo plazo de la adolescente con síntomas sugerentes de SOP que inicialmente no reúna los criterios diagnósticos del síndrome.
Las adolescentes con SOP pueden asociar otras manifestaciones clínicas. La prevalencia de alteración de la tolerancia a la glucosa en adolescentes con SOP obesas es de un 27%. Además, las adolescentes con SOP presentan un aumento de los niveles de colesterol total y de la fracción LDL del colesterol, disminución de la fracción HDL del colesterol, alteraciones en la secreción de las adipocitoquinas y de los marcadores inflamatorios y modificaciones en la tensión arterial. Un 11,8% de las adolescentes con SOP presentan un síndrome metabólico y, aproximadamente, el 35% de las adolescentes con SOP y sobrepeso u obesidad lo asocian(19).
El tratamiento de las adolescentes con SOP debe contemplar objetivos a corto y largo plazo, incluyendo la mejora de su imagen corporal y la autoestima(20) (Fig. 6).
Figura 6. Tratamiento del síndrome de ovario poliquístico en las adolescentes orientado a las manifestaciones clínicas principales(18). ACOs: anticonceptivos orales; DM2: diabetes tipo 2; ATG: alteración de la tolerancia a la glucosa.
Resulta fundamental modificar el estilo de vida de las pacientes, insistiendo en cambios en sus hábitos de alimentación e incremento del ejercicio. La pérdida de un 5-10% de peso en las pacientes adultas con SOP y sobrepeso se traduce, en muchos casos, en la recuperación de la regla y la aparición de ciclos ovulatorios. El tratamiento farmacológico de elección para el control de los síntomas y signos del SOP son los anticonceptivos orales, especialmente cuando las pacientes solo presentan irregularidades menstruales. Cuando el motivo de consulta principal sea el hirsutismo o el acné, además de indicar la aplicación de medidas cosméticas, utilizaremos anticonceptivos que contengan un antiandrógeno (en España, acetato de ciproterona). El efecto de los anticonceptivos orales sobre las reglas y el acné es evidente en 1-3 meses, sobre el hirsutismo a los 6-9 meses. Para destruir los folículos afectados es necesario utilizar electrolisis o láser. No existen criterios aceptados para el uso de metformina, aunque este fármaco mejora la sensibilidad a la insulina en pacientes con SOP e hiperinsulinemia u obesidad. La metformina está indicada en pacientes con alteración de la tolerancia a la glucosa o con síndrome metabólico, aunque no existen estudios a largo plazo que demuestren los resultados y no es eficaz en el tratamiento del hirsutismo(18,20).
Es fundamental motivar a las adolescentes con SOP y reforzar la importancia de la prevención de los factores de riesgo asociados al síndrome metabólico. Se aconseja revisar periódicamente: peso, tensión arterial, niveles de glucosa y lípidos y realizar una sobrecarga oral de glucosa cuando las pacientes presenten anovulación e hiperandrogenismo, acantosis nigricans, obesidad (IMC > 30 kg/m2) e historia familiar de diabetes tipo 2(12).
Tumores secretores de andrógenos de origen gonadal
Los tumores ováricos secretores de andrógenos son muy infrecuentes en la edad pediátrica y en ellos los niveles de Δ4-A o testosterona o de ambas están aumentados. En la mayoría de los casos, derivan de las células germinales. Deben sospecharse cuando se produzca una virilización rápida en las niñas. Las adolescentes pueden presentar oligomenorrea o amenorrea, acné o hirsutismo.
Los tumores de células de Leydig pueden dar lugar en niños prepuberales a una pubertad precoz con aceleración de la velocidad de crecimiento y de la edad ósea, aumento del volumen testicular y concentraciones elevadas de testosterona con niveles suprimidos de gonadotropinas.
El tratamiento de los tumores gonadales es quirúrgico.
Otras causas de hiperandrogenismo
La hiperprolactinemia puede cursar con: hiperandrogenismo peri y postpuberal, amenorrea, galactorrea, cefaleas y alteraciones visuales, y es producida, en ocasiones, por fármacos (antidepresivos, cimetidina…). La acromegalia asocia hiperandrogenismo, presumiblemente por la acción directa del IGF-1. La insulinorresistencia secundaria a mutaciones en el gen del receptor de la insulina también puede cursar con hirsutismo, oligomenorrea e hiperandrogenismo. El uso del valproato en mujeres con epilepsia ha sido asociado con irregularidades menstruales, hiperandrogenismo y ovarios poliquísticos.
Otros trastornos asociados con hiperandrogenismo
Los defectos en la síntesis de testosterona o en la acción de los andrógenos pueden ocasionar trastornos en la diferenciación sexual, que pueden presentarse clínicamente con síntomas de hiperandrogenismo, aunque etiológicamente no se puedan considerar trastornos hiperandrogénicos. Los defectos genéticos asociados con ambigüedad sexual al nacimiento y síntomas hiperandrogénicos en la pubertad son: la insensibilidad parcial a andrógenos y los déficits de 5α-reductasa y 17β-hidroxiesteroide deshidrogenasa.
Diagnóstico
La interpretación de los datos analíticos puede resultar compleja en algunos casos.
Otras pruebas de fácil acceso para los pediatras de Atención Primaria, tales como la radiografía de mano-muñeca y la ecografía pélvica en las niñas, constituyen un pilar fundamental en la aproximación al diagnóstico. La historia clínica dirigida, los antecedentes familiares y personales, la exploración física y las pruebas diagnósticas y analíticas y de imagen, nos orientarán al diagnóstico diferencial.
Diagnóstico clínico
Anamnesis: detallar la edad cronológica de la aparición de los caracteres sexuales secundarios y la progresión de los mismos. Interrogar sobre la existencia de otros trastornos del eje hipofisario, alteraciones visuales, cefalea…, así como del contacto con esteroides exógenos (cremas y cosméticos…).
Antecedentes personales: prematuridad, bajo peso para la edad gestacional.
Antecedentes familiares: recoger datos sobre tallas familiares y posibles adelantos puberales, hipertricosis, hirsutismo, irregularidades menstruales, historia familiar de anomalías de la diferenciación sexual que sugiera una causa genética…
Exploración física: recoger cuidadosamente los parámetros antropométricos (talla, peso), valorar el grado de desarrollo (estadios de Tanner I-V) y otros datos sugerentes de desarrollo puberal, virilización o feminización (flujo vaginal, olor corporal, acné, tamaño del clítoris, ginecomastia, galactorrea, pigmentación areolar, volumen y simetría testicular…). La pubertad en las niñas se asocia en sus comienzos a una aceleración de la velocidad de crecimiento, y es especialmente útil disponer de su gráfica de crecimiento. El sobrepeso es un factor estimulador del desarrollo en las niñas. La presencia de clitoromegalia sugiere la presencia de niveles elevados de andrógenos y es siempre un hallazgo anormal. En los niños, un volumen testicular de 4 ml sugiere la acción de las gonadotropinas y la aparición de pubarquia en presencia de testículos de tamaño prepuberal sugiere la acción de andrógenos de origen suprarrenal (en especial, HSC), testicular o exógenos. Los tumores testiculares suelen ser unilaterales.
Pruebas complementarias
Datos analíticos: los valores normales para las diferentes hormonas varían con el estadio puberal, siendo así importante interpretar los resultados con la edad cronológica del paciente y el estadio puberal. En el ámbito hospitalario, se realizará una analítica general y se determinarán los niveles de hormonas tiroideas, LH, FSH y de los andrógenos DHEA, Δ4-androstenediona y testosterona. Las concentraciones de DHEAS estiman la producción de andrógenos por la suprarrenal y sus niveles pueden aparecer elevados en la pubarquia prematura o muy elevados en los tumores de origen suprarrenal junto con las concentraciones de otros andrógenos. En ocasiones, resulta necesario realizar el diagnóstico diferencial de la pubarquia prematura con HSC. Una concentración basal de 17-hidroxiprogesterona < 2 ng/mL (6 nmol/L) descarta una HSC por deficiencia de 21-hidroxilasa, mientras que cifras superiores obligan a la realización de una prueba de estímulo con 1-24 ACTH (Synacthen®, a dosis habitual de 250 mcg, intravenoso). Las respuestas de 17-hidroxiprogesterona al test de ACTH > 10 ng/mL (30 nmol/L) confirman el diagnóstico y correlacionan con genotipos moleculares consistentes con HSC. La velocidad de crecimiento acelerada de la pubertad se traduce en mayor secreción de GH y valores puberales de IGF-1.
Para el diagnóstico de un SOP, deben calcularse los niveles de testosterona o del índice de andrógenos libre (IAL) –calculado a partir de los valores de testosterona y SHBG–. Unos valores muy elevados de testosterona asociados a un hirsutismo de rápida progresión y síntomas de virilización sugieren un tumor productor de andrógenos, siendo necesarias pruebas de imagen. Dada la asociación de SOP e insulinorresistencia, es aconsejable medir los niveles de glucosa e insulina y el perfil lipídico de estas pacientes. Se hará una sobrecarga oral de glucosa en las pacientes obesas o con antecedentes familiares de diabetes tipo 2 o alteraciones del metabolismo de la glucosa.
Técnicas de imagen: la maduración sexual se correlaciona más estrechamente con la maduración ósea y con la edad estatural (edad en que el niño medio tiene la talla del paciente) que con la edad cronológica; de ahí, la importancia de emplear una radiografía de mano-muñeca no dominante para evaluar la progresión de la pubertad. El método más usado para su lectura es el de Greulich y Pyle. La ecografía pélvica correctamente interpretada resulta muy útil para definir el inicio puberal en la niña, el volumen ovárico y la presencia de ovarios poliquísticos, aunque la presencia de ovarios poliquísticos no es necesaria para el diagnóstico del SOP. Para el diagnóstico de tumores ováricos, testiculares o suprarrenales productores de esteroides, es necesaria la realización de una ecografía abdominal y, en el caso del varón, una ecografía testicular. La resonancia magnética nuclear es la mejor técnica para visualizar la región hipotálamo-hipofisaria, en los casos en los que se sospeche una enfermedad de Cushing.
Al final del artículo, se presenta un algoritmo para la valoración del hiperandrogenismo en niñas y adolescentes que puede ser útil para establecer la sospecha diagnóstica y el criterio de derivación desde las consultas de Atención Primaria a las de Endocrinología Infantil (ver Algoritmo 2 al final del artículo).
Función del pediatra de Atención Primaria
El papel del pediatra de Atención Primaria es fundamental en la detección precoz de los trastornos hiperandrogénicos.
El diagnóstico es clínico y basado en el conocimiento de la normalidad del crecimiento y desarrollo puberal de la población que controlamos en nuestras consultas, conceptos que no son siempre fáciles de interpretar y que están influenciados por factores genéticos, metabólicos y ambientales. Es fundamental su papel en la prevención y tratamiento de la obesidad infantil, ya que esta se asocia a adelantos puberales, a pubarquia prematura y a SOP de presentación ya en la edad adolescente.
El SOP es causa potencial de problemas en las jóvenes, no solo físicos, sino también psicológicos. Por ello, es importante que los médicos presten atención a las quejas de las adolescentes, que se impliquen en la sospecha diagnóstica del SOP y en la prevención de las posibles asociaciones del síndrome en la etapa adulta participando en la educación de los pacientes y sus familias para la adquisición de hábitos de vida saludables que incluyan una alimentación adecuada y la realización de ejercicio físico de forma regular.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** Roldán MB, Witchel SF. Hyperandrogenism in children and adolescents. En: Pescovitz OH, Eugster EA, eds. Pediatric Endocrinology. Mechanisms, manifestations, and management. Philadelphia: Lippincott Williams & Wilkins; 2004; p. 360-75.
2.** Oberfield SE, Sopher AB, Gerken AT. Approach to the girl with early onset of pubic hair. J Clin Endocrinol Metab. 2011; 96: 1610-22.
3.*** Ghizzoni L, Gasco V. Premature pubarche. Horm Res Paediatr. 2010; 73: 420-2.
4.*** Ibañez L, Díaz R, López-Bermejo A, Marcos AV. Clinical spectrum of premature pubarche: Links to metabolic syndrome and ovarian hyperandrogenism. Rev Endocr Metab Disord. 2009; 10: 63-76.
5.** Utriainen P, Jääskeläinen J, Romppanen J, Voutilainen R. Childhood metabolic syndrome and its components in premature adrenarche. J Clin Endocrinol Metab. 2007; 92: 4282-5.
6.*** Speiser PW, Azziz R, Baskin LS, et al. Congenital adrenal hyperplasia due to steroid 21-hydroxylase deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2010; 95: 4133-60.
7.*** Stratakis CA. Cushing syndrome in pediatrics. Endocrinol Metab Clin N Am. 2012; 41: 793-803.
8.** Diamanti-Kandarakis E, Dunaif A. Insulin resistance and the polycystic ovary syndrome revisited: an update on mechanisms and implications. Endocr Rev. 2012; 33: 981-1030.
9.** Gambineri A, Fanelli F, Prontera O, Repaci A, Di Damazi G, Zanotti L. Prevalence of hyperandrogenic states in late adolescent and young women: epidemiological survey on italian high-school students. J Clin Endocrinol Metab. 2013; 98: 1641-50.
10.*** Witchel SF, Oberfield S, Rosenfield RL, et al. The diagnosis of polycystic ovary syndrome during adolescence. Horm Res Paediatr. 2015 Apr 1. [Epub ahead of print].
11.** Yildiz BO, Bolour S, Woods K, Moore A, Azziz R. Visually scoring hirsutism. Hum Reprod Update. 2010; 16: 51-64.
12.** Hardy TS, Norman RJ. Diagnosis of adolescent polycystic ovary syndrome. Steroids. 2013; 78: 751-4.
13.** Mani H, Potdar N, Gleeson H. How to manage an adolescent girl presenting with features of polycystic ovary syndrome (PCOS); an exemplar for adolescent health care in endocrinology. Clin Endocrinol (Oxf). 2014; 81: 652-6.
14.** Zawadski JK, Dunaif A. Diagnostic criteria for polycystic ovary syndrome: towards a rational approach. En: Dunaif A, Givens JR, Haseltime FP, Merriam GR, eds. Polycystic ovary syndrome. Boston: Blackwell Scientific Publications; 1992; p. 377-84.
15.** Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod. 2004; 19: 41-7.
16.** Azziz R, Carmina E, Dewailly D, et al. Position statement: criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: an Androgen Excess Society guideline. J Clin Endocrinol Metab. 2006; 91: 4237-45.
17.** Dewailly D, Lujan ME, Carmina E, Cedars MI, Laven J, Norman RJ, Escobar-Morreale HF. Definition and significance of polycystic ovarian morphology: a task force report from the Androgen Excess and Polycystic Ovary Syndrome Society. Hum Reprod Update. 2014; 20: 334-52.
18.*** Legro RS, Arslanian SA, Ehrmann DA, Hoeger KM, Murad MH, et al. Diagnosis and treatment of polycystic ovary syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2013; 98: 4565-92.
19.** Hart R, Doherty DA, Mori T, Huang RC, Norman RJ, Franks S, et al. Extent of metabolic risk in adolescent girls with features of polycystic ovary syndrome. Fertil Steril. 2011; 95: 2347-53.
20.** Legro RS. Impact of metformin, oral contraceptives, and lifestyle modification on polycystic ovary syndrome in obese adolescent women: do we need a new drug? J Clin Endocrinol Metab. 2008; 93: 4218-20.
Bibliografía recomendada
- Ghizzoni L, Gasco V. Premature pubarche. Horm Res Paediatr. 2010; 73: 420-2.
Revisión actualizada sobre la patogenia y el diagnóstico y diagnóstico diferencial de la pubarquia prematura con otras entidades.
- Ibañez L, Díaz R, López-Bermejo A, Marcos AV. Clinical spectrum of premature pubarche: Links to metabolic syndrome and ovarian hyperandrogenism. Rev Endocr Metab Disord. 2009; 10: 63-76.
Artículo revisión sobre la pubarquia prematura y el hiperandrogenismo ovárico que presta especial atención a la génesis del síndrome de ovario poliquístico, a su asociación con el síndrome metabólico y con factores de riesgo cardiovascular.
- Speiser PW, Azziz R, Baskin LS, et al. Congenital adrenal hyperplasia due to steroid 21-hydroxylase deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2010; 95: 4133-60.
Guía clínica consensuada para el diagnóstico y tratamiento de la hiperplasia suprarrenal congénita, entidad frecuente en su forma no clásica que ha de ser incluida en el diagnóstico diferencial del hiperandrogenismo.
- Stratakis CA. Cushing syndrome in pediatrics. Endocrinol Metab Clin N Am. 2012; 41: 793-803.
Revisión del síndrome de Cushing en la edad pediátrica que resuelve temas relacionados con la fisiopatología y el correcto diagnóstico del hipercortisolismo y profundiza en el tratamiento del síndrome.
- Witchel SF, Oberfield S, Rosenfield RL, et al. The diagnosis of polycystic ovary syndrome during adolescence. Horm Res Paediatr. 2015 Apr 1. [Epub ahead of print].
Consenso que intenta dar respuestas al diagnóstico y tratamiento de los trastornos derivados del exceso androgénico y el síndrome de ovario poliquístico en adolescentes y mujeres jóvenes. Realizado por expertos endocrinólogos pediatras y médicos del adolescente.
- Legro RS, Arslanian SA, Ehrmann DA, Hoeger KM, Murad MH, et al. Diagnosis and treatment of polycystic ovary syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2013; 98: 4565-92.
Revisión del origen y fisiopatología del síndrome de ovario poliquístico. Guía clínica orientada al correcto diagnóstico e interpretación de los fenotipos clínicos para realizar un tratamiento adecuado a la causa del síndrome en adolescentes y mujeres adultas.
| Caso clínico |
|
Motivo de consulta y enfermedad actual Adolescente de 16 años remitida por su médico de Atención Primaria por obesidad. En encuesta alimentaria refiere tomar dieta rica en hidratos de carbono y grasas, pobre en verdura y vegetales. Régimen de vida muy sedentario. Tuvo la menarquia a los 11 años y en la actualidad las reglas son regulares cada 25-28 días. No toma medicaciones. Antecedentes familiares Madre, obesidad (IMC 32 kg/m2). Padre, obesidad (IMC 38,5 kg/m2). Ambas abuelas, obesidad y diabetes tipo 2. No constan HTA, hipercolesterolemia, infartos agudos de miocardio o accidentes cerebrovasculares ni tromboembolismos venosos. Antecedentes personales Embarazo controlado y normal. Parto con fórceps a edad gestacional probable de 36 semanas. PRN: 2.400 g (p38, -0.3 DE). Exploración física Peso: 109 kg. Talla: 166 cm (+1,0 DE). IMC: 39,5 kg/m2 (+5,3 DE). Perímetro de cintura: 96 cm. TA: 118/62 mmHg. Obesidad generalizada, estrías nacaradas en abdomen, nalgas y raíz de miembros. Acné facial y en parte superior de espalda. No acantosis. Ferriman-Gallwey: 18. ACP: normal. Abdomen: normal. Cuello libre. Tanner V. Estudios complementarios Analítica (extracción realizada en 7º día del ciclo menstrual): - Hemograma y Bioquímica: normal. Glucemia: 91 mg/dl. Creatinina: 0,9 mg/dl. GOT/GPT: 16/18 UI/L. Lipidograma: colesterol total: 104 mg/dl. TG: 49 mg/dl. Colesterol HDL: 41 mg/dl. Colesterol LDL: 53 mg/dl. - Insulina: 21,3 mU/L. - Indice HOMA: 4,7 (N <3,8). - Estudio hormonal basal: TSH: 2,12 µU/ml (0,5-4,5). T4L: 0,8 ng/dl (0,4-1,4). PRL: 17 ng/ml (2-20). Testosterona: 0,7 ng/ml (0,1-0,8). SHBG: 10,9 nmol/l (20-140). FAI (índice de andrógenos libres): 22,2 (N <5). Androstendiona: 6,1 ng/ml (0,5-4,7). DHEA-S: 351 µg/dl (120-360). 17-OHP: 2,1 ng/ml (0,1-1,5). - Sobrecarga oral de glucosa (75 g v.o.): Glucemia (mg/dl) a tiempo (0 min) 71, (30 min) 98, (60 min) 112, (90 min) 101, (120 min) 93 e Insulina (mU/ml) a tiempo (0 min) 16,9, (30 min) 145, (60 min) 178, (90 min) 210, (120 min) 112. - Test de estímulo con ACTH (250 mcg i.v.) para 17-OHP (0 min) 2,1 ng/ml (0,1-1,5 ng/ml) y (60 min): 4,2 ng/ml. Estudios de imagen Ecografía abdominal (realizada en el 5º día del ciclo menstrual): útero de 7,1 cm de ecoestructura normal. Ovario derecho de 7,8 cc y ovario izquierdo de 8,5 cc, sin lesiones quísticas. Diagnóstico Obesidad + Insulinorresistencia + Hiperandrogenismo clínico y bioquímico. No reúne criterios diagnósticos de síndrome de ovario poliquístico en el momento actual. Tratamiento 1. Modificaciones en el estilo de vida: - Recomendaciones dietéticas. - Ejercicio físico diario durante 60 minutos. 2. No presenta alteración de la tolerancia a la glucosa, por lo que no está indicado el tratamiento con metformina y es fundamental insistir en el punto 1 del tratamiento. 3. Considerar la utilización de un anticonceptivo oral que contenga un antiandrógeno (etinilestradiol 0,035 mg + acetato de ciproterona 2 mg) para el tratamiento del hirsutismo junto con medidas cosméticas. Evolución Es necesario realizar el seguimiento a largo plazo de la paciente. El tratamiento de las adolescentes con SOP debe contemplar objetivos a corto y largo plazo, incluyendo la mejora de su imagen corporal y la autoestima(20) (Fig. 6).
|