|
| Regreso a las bases |
M. Fernández-Benítez
Ex-Consultor Departamento de Alergología e Inmunología Clínica. Clínica Universidad de Navarra, Pamplona
Pediatr Integral 2013; XVII(8): 581-585
Metodología diagnóstica en alergia infantil
Introducción
La importancia de hacer un buen diagnóstico, en cualquier tipo de patología tendrá como consecuencia el poder administrar un tratamiento adecuado. En alergología, podríamos clasificar las pruebas diagnósticas como: técnicas in vivo, que son aquellas que se realizan en el propio paciente, y técnicas in vitro, que son las que se realizan en el laboratorio, todas ellas encaminadas a determinar el alérgeno responsable de la patología presentada.
La responsabilidad del antígeno podemos demostrarla bien poniendo de manifiesto la reacción Ag (antígeno) Ac (anticuerpo), pero también midiendo los mediadores responsables de esta reacción.
Pruebas cutáneas
Se define como alérgeno a aquella sustancia capaz de producir anticuerpos (Ac) en un organismo sensibilizado y dar lugar a una reacción antígeno-anticuerpo (Ag-Ac) al nuevo contacto del organismo con el alérgeno. El descubrimiento del antígeno (Ag) y su correspondiente (Ac) específico, responsable de la reacción Ag-Ac y, por lo tanto, de la sintomatología clínica, es la base del diagnóstico etiológico en las enfermedades alérgicas. Una anamnesis detallada nos dará el grado de agresividad del antígeno que buscamos y, por lo tanto, una pauta para elegir la prueba diagnóstica adecuada, evitando así riesgos innecesarios para el paciente.
Tipos de test cutáneos
Se clasifican los test cutáneos según el tipo de sensibilización que queramos estudiar.
l.Sensibilización de tipo inmediato: mediada por IgE, para lo cual utilizamos la prueba del Prick o la prueba intracutánea como métodos más habituales(1,2). La reacción objetivada con estas pruebas está inducida, fundamentalmente, por la degranulación de los mastocitos cutáneos al contacto con el alérgeno, con la consiguiente liberación de mediadores como la histamina, triptasa, neuromediadores, etc., responsables de la respuesta inmediata. Podemos encontrar una respuesta tardía a las 6-8 horas, como consecuencia de procesos asociados a la respuesta inicial; ya que, muchos de los mediadores liberados por los mastocitos activados son mediadores quimiotácticos que actúan atrayendo hacia el lugar de la reacción células inflamatorias como eosinófilos, neutrófilos macrófagos, que contribuyen a perpetuar la inflamación. Los linfocitos CD4+ juegan un papel en la puesta en marcha y regulación de la respuesta tardía, por la generación y liberación de citoquinas.
2.Sensibilización tardía en la que interviene la inmunidad celular (linfocitos T), para lo que utilizamos las pruebas epicutáneas, también conocidas como pruebas del parche. La reacción alcanza su máxima expresión entre las 24-72 horas y las células que participan en el infiltrado son, predominantemente, linfocitos del tipo Th1 y monocitos.
Técnicas cutáneas de hipersensibilidad inmediata
Prick test
Es la prueba más utilizada para el diagnóstico in vivo.
Se realiza colocando gotas de los extractos que queremos estudiar y de la solución control sobre la superficie volar del antebrazo. Posteriormente, con una aguja, siendo las más estandarizadas las derivadas de la aguja Morrow-Brown, o bien con aguja hipodérmica, se hace una puntura a través de la gota y se inserta en la epidermis con un pequeño ángulo. Hay que tener la precaución de colocar las gotas con una separación adecuada con el fin de evitar reacciones enmascaradas (Figs. 1 y 2). Es necesario utilizar para cada extracto una aguja diferente. El prick test es una técnica segura, en la que es raro que se desencadenen reacciones sistémicas.

Figura 1. Material necesario prick.

>Figura 2. Técnica de prick.
Intracutánea
Era la prueba más difundida y utilizada de las pruebas cutáneas antes de que se estableciese el prick test.
Consiste en la inyección intradérmica de 0,05-0,07 ml de extracto alergénico, formando una pápula de 2-3 mm de diámetro. Las pruebas se pueden realizar en el antebrazo o en la espalda, al igual que con el prick, manteniendo entre los diferentes alérgenos una distancia de al menos 2 cm con el fin de evitar resultados enmascarados en caso de que se produzcan positividades; si se realizan en la espalda, también hay que cuidar la distancia a la línea vertebral ya que se pueden dar falsos positivos debido a los reflejos axónicos.
A diferencia del prick test, las pruebas intracutáneas pueden desencadenar reacciones sistémicas. Las precauciones y errores más frecuentes, así como las diferencias existentes entre las dos técnicas de pruebas cutáneas para el estudio de la hipersensibilidad inmediata, podemos verlos en las tablas I y II.
Extractos alergénicos y soluciones control
Los extractos utilizados hoy en día están estandarizados y son de alta calidad, esto permite un diagnóstico fiable y que las técnicas sean reproducibles. Únicamente y en ocasiones con alérgenos alimentarios, no utilizamos extractos estandarizados, sino el alimento en crudo, es lo que conocemos como prick-prick, tiene la ventaja de contener todas las proteínas presentes en el alimento.
Cualquier estudio con test cutáneos requiere testificar con un control negativo y un control positivo. El control negativo habitualmente es el conservante utilizado para los extractos alergénicos; como control positivo, habitualmente se utiliza la histamina.
Medición e interpretación de los test cutáneos
La respuesta cutánea inmediata frente a extractos alergénicos, caracterizada por la presencia de pápula y eritema en el lugar de la prueba, se obtiene en los primeros 20 minutos, entre 8-10 minutos para la histamina y entre 15-20 para los alérgenos. Habitualmente, utilizamos una regla milimetrada y calculamos la media entre el diámetro mayor y el menor de la pápula y/o eritema. Otras mediciones más sofisticadas, como las ultrasónicas o mediante Doppler con láser, nos permiten cuantificar el grosor y volumen de la pápula y poder estudiar la diferente reactividad de las pruebas.
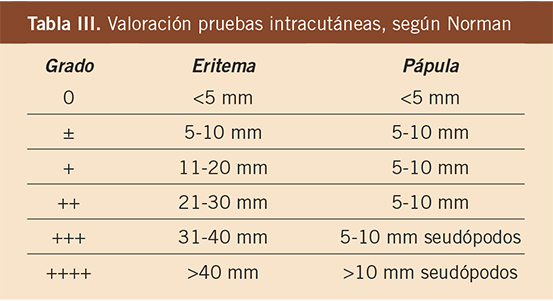
Los criterios de positividad de las pruebas han sido estudiados por diferentes autores. Sabemos que en prick, positividades de más de 3 mm de pápula y 10 mm de mácula eritematosa son susceptibles de sensibilización clínica, pero siempre teniendo en cuenta la reactividad cutánea individual, así como la utilización de extractos estandarizados. Para las pruebas intracutáneas, seguiremos los criterios de Norman valorando pápula y eritema (Tabla III). Un test intracutáneo lo consideramos positivo cuando es un habón de 5 mm de diámetro, restando ya el diluyente control (Fig. 3).

Figura 3. Resultados prick.
En la interpretación de las positividades encontradas hay que ser cautelosos, ya que la positividad cutánea frente a un antígeno, por sí sola, no implica la repercusión del antígeno en las manifestaciones clínicas si no hay una clara relación con la anamnesis, pudiendo tratarse de positividades subclínicas o apatógenas, que merecen seguir su evolución. En otras ocasiones, nos obliga a reinterrogar al paciente y tratar de confirmar si existe repercusión clínica mediante técnicas in vitro o, incluso, una prueba de provocación controlada.
No hay que olvidarse de las positividades encontradas a panalérgenos responsables de la reactividad cruzada, tal y como ocurre con pólenes-frutas, etc.
Factores que pueden modificar la respuesta cutánea
El primer factor es la edad del paciente, y se sabe que, a partir del primer mes de vida, se puede obtener por prick una pápula significativa con el control positivo (histamina); no obstante, esta pápula va a ser más pequeña que en edades posteriores. Por eso, cuando realizamos pruebas cutáneas en lactantes, debido a esta menor reactividad, los criterios de positividad frente a los extractos van a tener que compararse con la reactividad frente al control positivo.
Cuando realizamos un estudio con pruebas cutáneas, sabemos que los resultados pueden verse alterados por múltiples factores. En primer lugar, porque la técnica no ha sido correcta; en este sentido, sabemos que la reactividad cutánea no es la misma en todas las partes del cuerpo, así la espalda es más reactiva que el antebrazo, la zona cubital es más reactiva que la radial, y la zona distal de la muñeca es menos reactiva que la proximal. Por otra parte, ya hemos dicho que la calidad de los extractos influye en la reactividad. Los extractos no estandarizados dan reacciones mayores que los estandarizados, muchas de ellas inespecíficas. Hay que tener en cuenta el ritmo circadiano; existe un pico de reactividad a última hora de la tarde y la reactividad es menor en la primera hora de la mañana.
Otro factor es también, dependiendo de los alérgenos que estemos probando, la estación del año; así, por ejemplo, pacientes con sensibilización al polen de gramíneas, durante la primavera presentarán mayor reactividad debido a la presencia de pólenes ambientales, situación que tenemos que tener presente para tomar precauciones, sobre todo con los test intracutáneos.
También, puede interferir en los resultados la toma de medicación, como ocurre con los antihistamínicos; los corticoides parece que únicamente influyen los administrados por vía tópica cutánea y, sobre todo, en la respuesta tardía, al igual que pasa cuando hay corticoterapia prolongada por vía sistémica.
La inmunoterapia específica por un tiempo prolongado también puede modificar la respuesta cutánea al alérgeno en estudio. Se ha visto disminución de la respuesta sobre todo con inmunoterapia frente a veneno de himenópteros y algunos neumoalérgenos, utilizando este parámetro para ver la respuesta al tratamiento.
Técnicas cutáneas de hipersensibilidad tardía
Pruebas epicutáneas
Estas técnicas las utilizamos para estudiar la hipersensibilidad tardía. Este tipo de pruebas se puede realizar por vía intradérmica, o aplicando directamente el alérgeno sobre la piel, prueba del parche o prueba epicutánea; tienen especial interés en el diagnóstico de las dermatitis alérgicas de contacto y hay estudios en las dermatitis atópicas(3).
El objetivo de estas pruebas es reproducir la lesión cutánea, limitando local y temporalmente la reacción(4).
La prueba consiste en la aplicación de una determinada sustancia, a una concentración ya establecida, sobre la piel del paciente en un lugar sensible. Para ello, utilizamos las zonas paravertebrales y la cara anterior del antebrazo. Esta sustancia se mantiene 48-72 horas.
La sustancia a testar se coloca sobre una superficie algodonosa y una capa aislante que queda fijada a la piel mediante esparadrapo; la piel debe estar limpia y libre de lesiones. Se recomendará no mojar la zona; si se presenta prurito intenso, acudir a la consulta antes de las 48 horas; no exponerse a las radiaciones solares, etc., ya que pueden modificarse los resultados.
Las reacciones pueden ser desde eritema hasta pápulas, vesículas o ampollas (Tabla IV). En el caso de pruebas negativas, es conveniente volver a ver al paciente a las 24 horas siguientes por si hubiera aparecido alguna reacción.

Figura 4. Técnica de espirometría.
Pruebas de función respiratoria
La exploración funcional respiratoria nos sirve para confirmar el diagnóstico de asma, cuantificar la gravedad de la enfermedad, monitorizar la evolución y objetivar la respuesta al tratamiento(5).
Espirometría
La espirometría permite el estudio de:
a.Capacidad vital forzada (CVF), volumen de aire espirado durante la maniobra de espiración forzada.
b.Flujo espiratorio en el primer segundo (FEV1), volumen de aire espirado en el primer segundo de la maniobra de espiración forzada.
c.Flujos espiratorios medios o mesoflujos (FEV25-75%), parámetro que indica el flujo espiratorio y que es independiente del esfuerzo; tiene un inconveniente que es la gran variabilidad de un enfermo a otro, incluso de una prueba a otra en el mismo paciente, por lo que no se debe valorar de una forma aislada;
d.Flujo espiratorio máximo (PEF), pico espiratorio de flujo.
e.Cociente FEV1/CVF, que es un parámetro indicador de flujo espiratorio, que en el niño se correlaciona más con la gravedad del asma que el FEV1.
Cada uno de estos parámetros nos va a dar una información de gran importancia en el asma bronquial. La disminución del FEV1 orienta hacia una obstrucción de vía aérea central (mayor de 2 mm de diámetro), el FEV25-75% informa de la vía aérea periférica (menor de 2 mm de diámetro) y la relación FEV1/CVF nos informa del grado de obstrucción. En cuanto al PEF, tiene indicaciones muy precisas, como objetivar la variabilidad en un asma inestable o ver la respuesta al tratamiento de una manera puntual, pero no se puede tomar como único criterio.
La técnica de espirometría consiste en una maniobra de capacidad vital forzada; es decir, a partir de una espiración normal efectuar una inspiración máxima, unos segundos de apnea y una espiración forzada hasta el volumen residual.
Interpretación de la espirometría
Los parámetros espirométricos nos permiten clasificar las alteraciones de la capacidad ventilatoria y establecer el grado de alteración funcional. Las alteraciones de tipo obstructivo cursan con un aumento de la resistencia de vías aéreas, y las que cursan con una reducción del volumen pulmonar, es decir, de la capacidad vital forzada (CFV), serían alteraciones de tipo no obstructivo. Hay patologías que cursan con características de ambos tipos de alteración ventilatoria, reducción de volumen y limitación al flujo aéreo; en este caso, hablaremos de alteraciones ventilatorias de tipo mixto.
De acuerdo con los criterios de la Americam Thoracic Society, se considera un patrón de tipo obstructivo cuando el cociente FEV1/CVF <75% (80% en niños), permaneciendo la CVF normal o ligeramente disminuida. El cociente FEV1/CVF es un parámetro más sensible, alterándose en mayor medida que el FEV1.
Test de broncodilatación (TBD)
El test de broncodilatación se debería realizar en todo paciente asmático al hacer la espirometría; ya que, por mínima que fuese la obstrucción, si el test es positivo, significa que existe una obstrucción al flujo aéreo, y no podrá considerarse una función pulmonar normal.
El Consenso Español(6) sobre el tratamiento del asma en pediatría establece realizar una espirometría forzada a los 15 minutos de administrar 400 µg de salbutamol = 4 puffs o equivalente de terbutalina, preferiblemente con cámara espaciadora, con un minuto de intervalo entre ambas, esperando de 10 a 20 minutos con el niño sentado y repitiéndose la espirometría forzada. Consideraremos un test de broncodilatación positivo cuando exista un porcentaje de cambio del FEV1 =12% sobre el FEV1 basal, o bien un FEV1 =9% sobre el FEV1 teórico, o un FEF25-75 =35%.
En algunas ocasiones, nos podemos encontrar que con 400 µg de salbutamol el test de broncodilatación es negativo, pudiéndose recurrir a una pauta corta (10 días) de corticoides orales y repetir la prueba.
Existen otras técnicas, como son la pletismografía o la oscilometría por impulsos, para niños que no saben colaborar con la maniobra de capacidad vital forzada.
Determinación de óxido nítrico en aire exhalado (ONex)
El ON juega un papel importante en el reclutamiento, migración e infiltración de eosinófilos y otras células en el árbol bronquial de los sujetos asmáticos. Se ha demostrado que el aumento del ONex está relacionado con factores que incrementan la inflamación en el asma(7), como la exposición a alérgenos y las infecciones respiratorias. Los esteroides orales o inhalados reducen los valores de ONex de forma dosis dependiente. Algunos estudios sugieren la correlación entre los valores del ONex y la intensidad de los síntomas, la hiperrespuesta bronquial, la atopia y otros marcadores de la inflamación.

Figura 5. Determinación de ONex.
Se realiza habitualmente por un método sencillo electroquímico que no precisa de calibración y es adecuado para niños a partir de los 5 años. La concentración se expresa en partes por billón (ppb), que equivale a nanolitros por litro (nl/l).
En la actualidad, se pueden medir otros marcadores de inflamación en condensado de aire exhalado, como son los isoprotanos, prostaglandinas, leucotrienos, etc.
Pruebas de provocación
Las pruebas de provocación consisten en poner de manifiesto la sintomatología clínica referida por el paciente tras la exposición al alérgeno, cuando no es posible demostrarlo por otras técnicas diagnósticas. De la propia definición, podemos deducir que son pruebas que conllevan un riesgo para el paciente, por lo que hay que tomar todas las precauciones(8).
Este tipo de pruebas las utilizamos cuando, por la historia clínica y las diferentes técnicas del laboratorio, es difícil encontrar el factor etiológico pese a que éste se sospecha. Otras veces existe una discordancia entre la historia clínica y los resultados de los test, in vivo e in vitro, y es necesario demostrar cuál de los alérgenos tiene repercusión clínica. En ocasiones, este mismo tipo de pruebas las utilizamos con el fin de demostrar una tolerancia al alérgeno(9,10).
Las pruebas de provocación pueden ser bronquiales, nasales, conjuntivales u orales, dependiendo del alérgeno que queramos estudiar y del órgano de choque.
Técnicas in vitro
Los avances de la inmunología han permitido estudiar los fenómenos implicados en las reacciones de hipersensibilidad. Hoy en día contamos con una serie de técnicas que permiten establecer un correcto diagnóstico alergológico y nos sirven de ayuda en la monitorización del enfermo alérgico y su respuesta al tratamiento.
Las pruebas in vitro nos confirman el diagnóstico sospechado por la historia y test cutáneos, o bien las reservamos para cuando no se puedan realizar los test in vivo, por circunstancias especiales de los pacientes.
Podríamos clasificar las técnicas in vitro en dos grandes grupos: las que estudian la reacción antígeno-anticuerpo, como serían la IgE, IgE antígeno específica(11) e IgG; y las que permiten determinar mediadores que se liberan en la reacción antígeno-anticuerpo, tales como: test de liberación de histamina, determinación de leucotrienos, determinación de triptasa test de activación de basófilos, proteína catiónica del eosinófilo, etc.
Bibliografía
1.Chan E, Dundas I, Bridge PD, Healy MJ, Mckenzie SA. Skin Prick testing as a diagnostic aid for childhood asthma. Pediatr Pulmonol. 2005; 39: 558-62.
2.Heinzerling L, Frew AJ, Bindslev-Jensen C, Bonini S, Bousquet J, Bresciani M, et al. Standard skin prick testing and sensitization to inhalant allergens across Europe- a survey from GA2Len network. Allergy. 2005; 60: 1287-300.
3.Nocerino R, Granata V, Di Costanzo M, PezellaV, Leone C, Passariello A, et al. Atopy patch test are useful to predict oral tolerance in children with gastrointestinal symtoms related non –IgE- mediated cow’smilk allergy. Allergy. 2013; 68(2): 246-8.
4.Van derValk PG, Devos SA, Coenraads PJ. Evidence-Based diagnosis in patch testing. Contac Dermatitis. 2003; 48: 121-5.
5.GEMA (Guía Española para el Manejo del Asma). Madrid: Editorial Luzán 5 SA; 2009.
6.Castillo Laita JA, de Benito Fernández J, Escribano Montaner A, Fernández-Benítez M, García de la Rubia S, Garde Garde J, et al, Consensus statement on the management of paediatric asthma. Update 2007.Allergol Immunopathol. 2008; 36(1): 31-52.
7.Kaiser G, Lim FCCP, Mottram C. The use of fraction of Exhaled Nitric Oxide in pulmonary practice. Chest. 2008; 133: 1232-42.
8.Martín Mateos MA. Tratado de alergología pediátrica. 2ª edición. Madrid: Ergon; 2011.
9.García-Ara MC, Boyano MT, Díaz Pena JM, Quirce S. Eliciting doses of positive challenge test in cow´s milk specific IgE levels. Allergol et Immunopathol. 2008; 36(6): 315-9.
10.Martorell A, Gaecía Ara MC, Plaza AM, Boné J, Nevot S, Echeverría L, et al. The predictive value of specific immunoglobulin E levels in serum for the outcome of the development of tolerance in cow´smilk allergy. Allergol et Immunopathol. 2008; 36(6): 325-30.
11.Cabrera-Freitag P, Fernández-Benítez M, Goikoetxea MJ, Sanz ML. Diagnosis by microarray technique in anaphylaxis. Allergy. 2008; 63(Suppl 88): 514.