Enseñanza no reglada y sin carácter oficial. Los créditos de formación continuada, no son aplicables
a los profesionales que estén formándose como especialistas en Ciencias de la Salud.

 |
| Temas de FC |
R. Benítez Fuentes*, J. Jiménez San Emeterio**
Pediatra de Atención Primaria. *Centro de Salud Barrio del Pilar. Madrid. **Centro de Salud Gandhi. Madrid
| Resumen
La infección del tracto urinario (ITU) es una de las infecciones bacterianas más frecuentes en la infancia. Constituye una entidad de especial interés para el pediatra por varios motivos: su frecuencia, la inespecificidad de su clínica, la controversia que rodea a su diagnóstico, tratamiento, seguimiento y prevención y por ser susceptible de producir complicaciones a corto plazo (sepsis, bacteriemia) y a largo plazo (recurrencia, cicatrices renales). En este capítulo, se revisan las pautas de diagnóstico, tratamiento, seguimiento y prevención que pretenden evitar dichas complicaciones con el propósito de reducir la variabilidad de la práctica clínica en el manejo de la ITU en la población pediátrica. |
| Abstract
The urinary tract infection (UTI) is one of the most frequent bacterial infection in childhood. It is an especially interesting object of study for various reasons: its frequency, its non specific clinical features and the controversy that surrounds its diagnosis, treatment, follow up and prevention, as well as for its capacity to develop complications in the short term (sepsis, bacteremia) and in the long term (recurrence, renal scarring). In this chapter we review the diagnosis, treatment, follow up and prevention regimens which attempt to prevent the complications already mentioned in order to reduce the variation of the clinical management of UTI in the paediatric population. |
Palabras clave: Infección urinaria; Pielonefritis; Cistitis; Bacteriuria; Reflujo vésico-ureteral.
Key words: Urinary tract infection; Pyelonephritis; Cystitis; Bacteriuria; Vesico-ureteral reflux.
Pediatr Integral 2013; XVII(6): 402-411
Introducción
Es fundamental establecer un diagnóstico fiable de ITU para evitar complicaciones derivadas de un infradiagnóstico o yatrogenia por su sobrediagnóstico.
La ITU se define como la presencia y proliferación de microorganismos patógenos en el tracto urinario (en condiciones normales, estéril) con síntomas clínicos.
La colonización bacteriana del tracto urinario en ausencia de síntomas y de inflamación recibe el nombre de bacteriuria asintomática y ocurre hasta en el 1-3% de los preescolares. Puesto que esta colonización asintomática no se relaciona con el desarrollo de complicaciones, no está indicado su tratamiento(1,2). Según la localización de la infección en la vía urinaria alta o baja hablamos, respectivamente, de pielonefritis aguda (afectación del parénquima renal) y de infección urinaria de vías bajas (cistitis). Otros conceptos que debemos aclarar son los de ITU atípica e ITU recurrente. Hablamos de ITU atípica(3) en los siguientes casos: persistencia de fiebre a las 48 horas de iniciado un tratamiento antibiótico adecuado, septicemia, patógeno productor diferente de E. coli, flujo urinario escaso, elevación de creatinina o presencia de masa abdominal o vesical. Se considera ITU recurrente cuando se producen(3): 2 episodios de ITU alta, la suma de un episodio de ITU alta y otro de ITU baja o 3 episodios de ITU baja.
Epidemiología
Es una infección frecuente en la infancia. Existe riesgo de recurrencia y de desarrollar complicaciones a largo plazo.
Es la infección bacteriana potencialmente grave más frecuente en los menores de 36 meses, predominando en los 2 primeros años de vida (7%). Se estima que una de cada 10 niñas y uno de cada 30 niños padecerán una ITU durante su infancia. De estos niños con un primer episodio de ITU, un 15% desarrollarán cicatrices renales en los 2 años siguientes. El riesgo de recurrencia de ITU febril por año es de hasta un 6% y se ha relacionado con un mayor riesgo de padecer cicatrices renales, especialmente a partir del tercer episodio de ITU(4). Estudios recientes estiman una prevalencia de reflujo vésico-ureteral (RVU) de entre un 18 y un 38% en la población pediátrica con diagnóstico de ITU(2) y un mayor riesgo de cicatrices renales si existe RVU, especialmente grado III-IV (riesgo doble frente al RVU de menor grado)(5).
Etiología
Las enterobacterias son los uropatógenos más frecuentes y, entre ellas, la principal es Escherichia coli (85%)(6).
Otras bacterias gram negativas frecuentes son: Proteus, Klebsiella, Enterobacter, Pseudomonas y Serratia sp. Entre las bacterias gram positivas, cabe destacar: Streptococcus B, Enterococcus sp. y Staphylococcus aureus. En neonatos, debemos tener en cuenta otras posibles etiologías, como: Lysteria monocytogenes, Streptococcus agalactiae y Enterococcus sp.(6-8) y, en mujeres adolescentes, Staphilococcus saprophyticus(9). Otros patógenos posibles son: adenovirus (cistitis hemorrágica), Candida spp y parásitos (como Schistosoma haematobium)(2).
Favorecen la infección por gérmenes diferentes a E. coli, la antibioterapia previa, la hospitalización o la coexistencia de una uropatía.
Fisiopatología
La ITU puede producirse por vía hematógena o por vía ascendente. Existen factores de riesgo para padecer ITU dependientes del huésped y del patógeno.
Las infecciones del tracto urinario pueden producirse por dos mecanismos(6,7,9): por diseminación hematógena a partir de una bacteriemia (más frecuentemente en neonatos y lactantes pequeños) o por vía ascendente, mediante el paso de gérmenes procedentes del área perineal a través de la uretra (en las niñas, la proximidad uretra-recto facilita esta vía).
Son factores de riesgo de ITU dependientes del huésped los siguientes(2,7,9): raza blanca, malformaciones urinarias, RVU, disfunción vesical, estreñimiento, instrumentación de la vía urinaria, mala técnica de higiene perineal, oxiurasis, la actividad sexual en las adolescentes, no estar circuncidado, tener familiares de primer grado con historia de ITU o de RVU y dilatación piélica. Actualmente, se acepta la existencia de una predisposición genética e individual para padecer ITU. Los pili o fimbrias que poseen algunos serotipos de E. coli se consideran factor de riesgo de ITU dependientes del patógeno y facilitan la adhesión al epitelio urinario(6). La lactancia materna es un factor protector(2).
Clínica
La presentación clínica puede ser inespecífica y diferente según la edad del niño, por lo que debemos tener un alto índice de sospecha.
La clínica es más inespecífica cuanto menor es la edad del niño. El signo más común es la fiebre(6). La presencia de fiebre alta (=39°C) con diagnóstico clínico de ITU podría ser un indicador práctico de pielonefritis según la Academia Americana de Pediatría (AAP)(10). Otros síntomas dependientes de la edad son:
• En niños menores de 2 años(1,7): rechazo del alimento, llanto durante la micción, irritabilidad, vómitos o estancamiento ponderal. En neonatos: ictericia prolongada o sepsis, y en prematuros: bradicardia y pausas de apnea.
• En niños mayores de 2 años, la clínica puede ser más orientativa(1,7). En caso de ITU alta: fiebre, dolor en fosa renal, malestar general y escalofríos. En caso de ITU baja: disuria, polaquiuria, tenesmo vesical, urgencia miccional y dolor suprapúbico.
La presencia de otro foco de infección clínicamente objetivo no excluye la posibilidad de tener una ITU, pero reduce la probabilidad a la mitad(8,11). Debemos hacer especial hincapié en descartar ITU en niños/as de raza blanca, menores de 12 meses, con fiebre mayor de 39°C de más de 24-48 horas de evolución, sobre todo en ausencia de otro foco que justifique la fiebre(6).
Diagnóstico
El diagnóstico de sospecha se basa en el análisis de orina. El diagnóstico de confirmación precisa la realización de un urocultivo.
En la anamnesis, indagaremos síntomas y signos de ITU y factores de riesgo para padecer una ITU. La exploración física(1,8) debe ser completa por aparatos, registrando constantes vitales y datos antropométricos.
Existen diferentes técnicas de recogida de orina y la elección debe individualizarse en función de la edad, continencia y estado clínico del paciente, así como de la experiencia del personal encargado de recogerla(12). El método de recogida va a determinar la interpretación del resultado del urocultivo. No existe un consenso absoluto en cuanto a los recuentos de microorganismos que se consideran significativos para cada técnica de recogida(2,6) (Tabla I).
La obtención de muestra de orina para su estudio debe realizarse, en todo caso, en las mejores condiciones de asepsia posibles (no demorar más de 4 horas el procesamiento y, si no es posible cultivarla en este tiempo, se aconseja que sea refrigerada)(2).
• Recogida de orina por bolsa perineal: puede estar indicada en niños incontinentes de bajo riesgo en los que el diagnóstico de ITU sea poco probable o no sea urgente(12). Este método tiene una alta sensibilidad, pero con un elevado número de falsos positivos. Se podría mejorar la precisión si la bolsa se recoge antes de 30 minutos(14), pero aun así, el riesgo de contaminación es alto. Por este motivo, el urocultivo recogido con esta técnica tendrá validez tan sólo si es negativo(1,3) (menos de 100.000 UFC/ml) y los resultados positivos requerirán siempre confirmación por sondaje uretral o punción suprapúbica antes de iniciar antibioterapia(2,12).
• Recogida de orina por micción media(2,12): de elección en niños con control de esfínteres.
• Recogida de orina por sondaje uretral: actualmente es la técnica más utilizada en lactantes en los servicios de urgencias y es parcialmente estéril. Es el método de elección en niños incontinentes, salvo neonatos y aquellos lactantes pequeños en los que el sondaje uretral no sea viable y que, por tanto, precisen punción suprapúbica(1,2,12). Su sensibilidad y especificidad superan el 95%(1).
• Recogida de orina por punción suprapúbica: indicada como primera opción en neonatos y también en lactantes pequeños en los que no se pueda realizar un sondaje uretral(2,12) (fimosis o sinequia vulvar intensa que lo impida). Como inconvenientes frente al cateterismo uretral presenta una mayor tasa de dolor asociada, requiere experiencia en su realización y tiene menores probabilidades de éxito en la obtención de orina (aunque bajo control ecográfico se puede aumentar la rentabilidad de la prueba)(11).
El análisis de orina es útil para realizar un diagnóstico de presunción de ITU con el fin de iniciar el tratamiento antibiótico empírico en espera del resultado del urocultivo(6). Puede realizarse mediante tira reactiva o mediante estudio microscópico de orina.
a. Tira reactiva de orina: es una técnica accesible en todos los centros de salud y servicios de urgencias, rápida, barata y viable con pequeñas cantidades de orina. Las determinaciones más importantes para la valoración de una posible ITU son:
– Leucocito esterasa (LE): enzima liberada por los leucocitos y signo indirecto de inflamación (no necesariamente infección). Tiene sensibilidad alta y baja especificidad. La contaminación bacteriana es causa frecuente de falsos positivos. Son causas de falsos negativos las dosis diarias altas de cefalexina o gentamicina, la proteinuria >500 mg/dl y la glucosuria >2 g/dl.
– Nitritos: este test se basa en la capacidad de las bacterias (excepto las gram positivas y Pseudomonas) de reducir los nitratos a nitritos. Este proceso requiere la permanencia de la orina en la vejiga aproximadamente 4 horas. Tiene especificidad elevada y baja sensibilidad (especialmente en lactantes, que vacían la vejiga con frecuencia)(13). Son causa de falsos negativos la orina diluida, presencia de ácido ascórbico, bacterias no reductoras de nitratos y la inhibición bacteriana por antibióticos o quimioterápicos.
Valorando la combinación de ambos parámetros (nitritos y LE) se aumenta el rendimiento de la tira reactiva y su interés radica, principalmente, en su alto valor predictivo negativo (96-100%) (Tabla II).
b. Estudio microscópico de orina: los inconvenientes de este método frente a la tira reactiva son su menor disponibilidad y que requiere mayor equipación y entrenamiento(1). Analiza la presencia de piuria(6) (definida como la presencia de más de 5 leucocitos/campo) y bacteriuria (observación de cualquier número de bacterias) (Tablas III y IV).
En relación a la elección del método de análisis de orina más conveniente sabemos que, en mayores de 3 años, la tira reactiva es tan útil y segura como el estudio microscópico(3). En cambio, en menores de 3 meses, el estudio microscópico de orina es el método de elección. En general, en caso de estar disponible, el análisis microscópico es la técnica preferible en menores de 3 años(2,3,14).
Urocultivo
Son indicaciones para realizar urocultivo(2,6): lactante menor de 3 meses con fiebre sin foco (FSF); síndrome miccional; FSF y antecedentes de ITU o anomalías urinarias; FSF de más de 7 días de evolución; y cuando no hay correlación entre la clínica y los resultados de la tira reactiva de orina(3). En el paciente sin control de esfínteres, dada la dificultad mayor para la recogida de orina y el menor tiempo de permanencia de ésta en la vejiga (con riesgo de falsos negativos en la tira reactiva), cuando se consiga la muestra es aconsejable solicitar a la vez un urocultivo.
Salvo evolución desfavorable, no existe la necesidad de repetir el urocultivo(2,3,10,12), aunque algunos autores siguen recomendando un urocultivo de control al finalizar el tratamiento(6). Sí existe consenso en la recomendación de no realizar urocultivos en niños asintomáticos, puesto que la bacteriuria asintomática no aumenta el riesgo de cicatriz renal(2,3,7,10).
Otras pruebas complementarias
La indicación de realizar otras pruebas complementarias debe individualizarse. El gran reto actual es encontrar un método fiable para hacer diagnóstico diferencial entre ITU de vías bajas e ITU de vías altas/pielonefritis con el fin de establecer un pronóstico más certero y orientar el seguimiento del proceso.
La gammagrafía renal con ácido dimercaptosuccínico (DMSA) es el patrón de referencia para el diagnóstico temprano de lesiones parenquimatosas renales, pero tiene como inconvenientes su coste, la disponibilidad y el empleo de contraste radiactivo.
La leucocitosis (>15.000/microL) y la elevación de reactantes de fase aguda (VSG >30 mm, proteína C reactiva >30 mg/l, procalcitonina >0,5-1 ng/ml, interleucina 6 en orina >15 pg/ml) son parámetros de los que no existen hasta el momento trabajos concluyentes acerca de su utilidad en el diagnóstico diferencial de ITU alta o baja(1,2,6).
El hemocultivo está indicado en aquellos casos con sospecha de bacteriemia, aunque su positividad no modifica la elección del antibiótico(1,2).
Tratamiento
El tratamiento inicial es empírico, teniendo en cuanta el patrón de resistencias local. La vía oral es de elección salvo presencia de criterios de ingreso hospitalario.
El tratamiento se iniciará en función de la sensibilidad local de los patógenos a los antibióticos(2,6,10,11). En España, E. coli presenta un alto porcentaje de resistencia a ampicilina (50-80%) y cotrimoxazol (18-38%) y buena sensibilidad a cefalosporinas de 2ª y 3ª generación, aminoglucósidos, fosfomicina y amoxicilina-clavulánico(10) (aunque en algunas áreas ya existe hasta un 15% de resistencias al último(11)). El Enterococcus faecalis presenta, en cambio, buena sensibilidad a la ampicilina y amoxicilina-clavulánico(2,11).
La administración del tratamiento por vía oral y por vía parenteral es igual de eficaz, siendo de elección la vía oral(2). La vía intravenosa queda reservada para los pacientes que requieren ingreso (Tabla V). En estos casos, a las 48-72 horas, si la evolución es satisfactoria, el tratamiento se puede continuar por vía oral según antibiograma(10).
La duración del tratamiento(2,6,12,13) suele ser de entre 7 a 14 días. En ITU de alto riesgo o sospecha de ITU de vías altas o menores de 2 años (con mucho mayor riesgo de cicatriz si la ITU no evoluciona bien), el tratamiento debe realizarse al menos durante 10 días(13). En niños mayores de 2 años con clínica clara de ITU de vías bajas están aprobadas pautas de tratamiento más cortas(2,3,6,10).
La elección del antibiótico empírico y la duración del tratamiento propuestas por los expertos(2,6,12,13) quedan reflejadas en la tabla VI.
En casos especiales, existe la posibilidad de realizar un tratamiento por vía intramuscular de forma ambulatoria, con una dosis diaria de ceftriaxona, gentamicina o tobramicina(15).
Seguimiento y pruebas de imagen
La realización de pruebas de imagen en el seguimiento evolutivo de la ITU es un tema objeto de controversia y en revisión en los últimos tiempos.
Hasta hace unos años, se consideraba indispensable la realización de pruebas de imagen en todo niño con un primer episodio de ITU. Esta práctica ha permitido llegar a las siguientes conclusiones: la mayor parte de los RVU son asintomáticos y de bajo grado, la prevalencia de RVU disminuye con la edad, la mayoría de las cicatrices renales no tienen significación clínica y la mayoría de las malformaciones nefrourológicas significativas son ya visibles en la ecografía prenatal. En este apartado, analizaremos cada una de estas pruebas de imagen y sus indicaciones actuales, la mayoría basadas en consenso o en bajo nivel de evidencia(2,7).
• Ecografía nefrourológica: es poco sensible para la detección de pielonefritis aguda y RVU. En cambio, tiene alta sensibilidad para la detección de abscesos o pionefrosis, por lo que estaría indicado realizarla de forma precoz en caso de sospecha de estas complicaciones(16). Su indicación en el menor de 2 años/incontinente con un primer episodio de ITU febril está aún muy sujeta a controversia, aunque, dado su bajo riesgo, la AAP sigue recomendándola de forma rutinaria en este grupo si no existe el antecedente de una ecografía prenatal normal a las 30-32 semanas de gestación o si no se tiene acceso a la misma(2,15).
• Gammagrafía renal con DMSA: para el diagnóstico de cicatrices renales ha de realizarse al menos 4-6 meses después del episodio de ITU, porque en la fase aguda podría no discriminar entre lesiones de pielonefritis aguda y cicatrices renales preexistentes(10).
• Cistouretrografía miccional seriada (CUMS): es la prueba de elección para la identificación y clasificación del RVU. Los últimos estudios reflejan que no parece necesario diferirla a las 4-6 semanas tras el episodio de ITU y que podría realizarse incluso durante los últimos días del tratamiento(10,15). Sus principales inconvenientes son la necesidad de cateterización y la exposición radiológica(2). La ecocistografía, en cambio, evita la exposición a radiaciones y podría constituir por ello una alternativa apropiada a la CUMS. Aun así, es necesario evaluar su disponibilidad y rendimiento en cada área antes de que se pueda considerar sustitutiva de la CUMS(2,8).
Pronóstico
Los factores de riesgo relacionados con el desarrollo de lesión renal son los episodios recurrentes de ITU y el RVU.
La historia natural de la ITU a día de hoy no es bien conocida y el hecho de que muchos de los estudios hayan sido realizados en niños con RVU dificultan el emitir un pronóstico extrapolable a la población pediátrica general. Por otro lado, no está clara la relación de la ITU con el posterior desarrollo de enfermedad renal crónica. Parece que en ausencia de anomalías del tracto urinario, el riesgo de sufrir hipertensión arterial (HTA) y/o insuficiencia renal crónica (IRC) después de un episodio de ITU no es, en general, muy elevado. Este riesgo parece estar más relacionado con la extensión o gravedad de las cicatrices y con la presencia de displasia/hipoplasia renal(2).
Los factores de riesgo relacionados con el desarrollo de lesión renal son los episodios recurrentes de ITU y el RVU(2,7,17). Otros factores tradicionalmente asociados a mayor riesgo de cicatriz renal, como el sexo masculino o menor edad, han obtenido resultados discordantes en estudios más recientes(2).
Prevención
Es importante la prevención de recurrencia de ITU para evitar el desarrollo de lesiones renales. La quimioprofilaxis y la cirugía del RVU pierden importancia.
Las familias de los niños con un primer proceso confirmado de ITU deben ser advertidas de que, ante futuros procesos febriles, es recomendable que el niño sea evaluado en las primeras 48 horas con el fin de detectar posibles recurrencias(13); aunque, no se ha podido demostrar asociación entre el retraso en el inicio del tratamiento antibiótico y mayor riesgo de daño renal permanente(2).
Son recomendaciones generales para prevenir nuevas ITU(2,3,14): cumplimiento correcto del tratamiento, evitar la retención de orina, ingesta adecuada de líquidos, correcta higiene genital y la corrección del estreñimiento y de disfunciones vesicales. El tratamiento de la disfunción vesical e intestinal, no sólo reduce la probabilidad de recurrencia de ITU, sino que también está asociado con una más rápida resolución del RVU(17).
No existe evidencia científica suficiente para apoyar una recomendación a favor de ninguna de las siguientes medidas preventivas: vacunas con cepas uropatógenas, ácido ascórbico o probióticos. Aunque se estima una prevalencia de ITU mayor en varones no circuncidados respecto a los circuncidados, actualmente no se recomienda esta intervención de forma rutinaria(2,18). Existe evidencia de que el jugo de arándanos es eficaz en la prevención de ITU recurrentes en la mujer adulta, pero los estudios existentes en niños(19) son aún insuficientes y, aunque indican que no parece tener efectos secundarios de importancia, son de dudosa eficacia para la prevención de las recidivas.
Papel actual de la quimioprofilaxis
En los últimos años, han surgido investigaciones que sugieren que esta práctica se asocia con un aumento del riesgo de infecciones por patógenos resistentes(2,3,10,14) y, además, no existen pruebas de que se asocie con una reducción de la recurrencia de ITU o con la aparición de nuevas cicatrices renales(2,20). Las recomendaciones actuales al respecto son las siguientes:
• Bacteriuria asintomática(2): no se recomienda.
• Primer episodio de ITU(2,3,6,16): no se recomienda de forma rutinaria.
• ITU recurrente(2): se recomienda valorar de forma individualizada cada caso de ITU recurrente, previo estudio que descarte anomalías del tracto urinario.
• RVU(2): mientras que la AAP no la considera indicada en ningún caso, la guía de práctica clínica española la recomienda en niñas con RVU grados III-V y niños con RVU grados IV-V.
• Hidronefrosis(2): se recomienda en niños con dilatación de la vía urinaria y sospecha de obstrucción hasta que se confirme el diagnóstico y ésta sea tratada.
• Anomalías funcionales del tracto urinario(2): no pueden hacerse recomendaciones puesto que no existen estudios que evalúen su eficacia.
• Sondaje vesical(2): en el caso de sondaje vesical mantenido, se recomienda si éste es debido a cirugía. En el caso de sondaje vesical intermitente limpio o aislado (cistoscopia y otros estudios diagnósticos), algunos autores no la recomiendan salvo riesgo por enfermedad asociada (cardiopatías, ITU recurrente o atípica, sospecha de RVU IV-V o malformaciones)(2). Otros autores la recomiendan durante 3 días en los niños a los que se les realice una cistografía (realizando la prueba en el día 2)(3).
Se debe seleccionar el antibiótico de menor espectro de acción posible con el fin de evitar la aparición de resistencias(2,10,12) (Tabla VIII).
Cirugía del RVU: el tratamiento quirúrgico se reserva para casos de RVU de alto grado o fallos de la profilaxis antibiótica. La cirugía abierta ha sido desplazada por la cirugía endoscópica y las técnicas de laparoscopia(10).
Función del pediatra de Atención Primaria(1,2,7)
El seguimiento en Atención Primaria de todo niño con antecedente de ITU febril debe incluir monitorización regular antropométrica y de la tensión arterial(1). El tratamiento de la disfunción vesical e intestinal debe ser iniciado desde Atención Primaria. En niños con estreñimiento crónico, el tratamiento con laxantes ha demostrado que reduce significativamente las recurrencias de ITU(18).
Deben ser valorados por Nefrología/Urología infantil los siguientes casos(2,7): ITU alta recurrente o atípica; presencia de anomalías nefrourológicas, RVU, cicatrices renales, HTA, proteinuria; disfunción vesical que no responde a medidas generales (rehabilitación vesical, corrección del estreñimiento); y siempre que el estudio indicado no pueda realizarse desde Atención Primaria.
Una adecuada coordinación entre los niveles asistenciales, sin duda, contribuirá a un mejor seguimiento y control de los niños con ITU.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. Shaikh N, Hoberman A. Clinical features and diagnosis of urinary tract infections in infants and children older than one month [Monografía en Internet], Waltham (MA): UpToDate; 2012 [acceso 15 de octubre de 2012]. Disponible en: http://www.uptodate.com/
2.*** Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica. Guiasalud 2011 [en línea] [fecha de consulta: 15-VII-2012]. Disponible en: http://www.guiasalud.es/egpc/ITU/completa/index.html
3.*** National Collaborating Centre for Women’s and Children’s Health. National Institute for Health and Clinical Excellence (NICE) Guideline. Urinary Tract Infection in Children: Diagnosis, Treatment and Long-term Management. London: RCOG Press; 2007. [Último acceso 15-10-2012] http://www.nice.org.uk/nicemedia/pdf/CG54fullguideline.pdf.
4.** Roberts KB, Finnell SM, Downs SM. Response to the AAP Section on Urology concerns about the AAP Urinary Tract Infection Guideline. Pediatrics. 2012; 129: 1054-6.
5.** Shaikh N, Ewing AL, Bhatnagar S, et al. Risk of renal scarring in children with a first urinary tract infection: a systematic review. Pediatrics. 2010; 126: 1084.
6.*** Molina Cabañero JC. Manejo de la infección urinaria en urgencias. An Pediatr Contin. 2011; 9: 7-14.
7. Hernández Marco R, Daza A, Marín Serra J. Infección urinaria en el niño (1 mes-14 años). Protocolos Diagnóstico Terapeúticos de la AEP: Nefrología Pediátrica [Monografía en Internet]. Madrid: Asociación Española Pediatría; 2008. [Último acceso 15-10-2012]. Disponible en: http://www.aeped.es/sites/default/files/documentos/5_4.pdf.
8. Martínez Suárez V, Taborga Díaz E. Infección de las vías urinarias. Pediatr Integral. 2009; XIII: 530-40.
9. Palazzi DL, Campbell JR. Acute cystitis in children older than two years and adolescents. [Monografía en Internet], Waltham (MA): UpToDate; 2012 [acceso 15 de octubre de 2012]. Disponible en: http://www.uptodate.com/
10.*** Saadeh SA, Mattoo TK. Managing urinary tract infections. Pediatric Nephrology. 2011; 62: 1967-76
11. Eiros Bouza JM, Ochoa Sangrador C. Perfil etiológico de las infecciones urinarias y patrón de sensibilidad de los uropatógenos. An Pediatr (Barc). 2007; 67: 461-8.
12. Ochoa Sangrador C, Málaga Guerrero S, Panel de Expertos y Grupo Investigador de la Conferencia de Consenso. Recomendaciones de la Conferencia de Consenso “Manejo diagnóstico y terapéutico de las infecciones del tracto urinario en la infancia”. An Pediatr (Barc). 2007; 67: 517-25. Disponible en: http://db.doyma.es/cgi-bin/wdbcgi.exe/doyma/mrevista.salta_a_ultimo?pident=37
13. Subcommittee on Urinary Tract Infection and Steering Committee on Quality Improvement and Management. Urinary tract infection: clinical practice guideline for diagnosis and management of the initial UTI in febrile infants and children 2 to 24 months. Pediatrics. 2011; 128: 595-601.
14. Price E, Pallett A, Gilbert RD, Williams C. Microbiological aspects of the UK National Institute for Health and Clinical Excellence (NICE) guidance on urinary tract infection in children. J Antimicrob Chemother. 2010; 65: 836-41.
15. Shaikh N, Hoberman A. Acute management, imaging, and prognosis of urinary tract infections in infants and children older than one month [Monografía en Internet], Waltham (MA): UpToDate; 2012 [acceso 15 de octubre de 2012]. Disponible en: http://www.uptodate.com/
16. Finnell SM, Carroll AE, Downs SM; Subcommittee on Urinary Tract Infection Technical report-Diagnosis and management of an initial UTI in febrile infants and young children. Pediatrics. 2011; 128(3): e749-70.
17. Shaikh N, Hoberman A. Epidemiology and risk factors for urinary tract infections in children. [Monografía en Internet], Waltham (MA): UpToDate; 2012 [acceso 15 de octubre de 2012]. Disponible en: http://www.uptodate.com/
18.** Shaikh N, Hoberman A . Long-term management and prevention of urinary tract infections in children [Monografía en Internet], Waltham (MA): UpToDate; 2012 [acceso 15 de octubre de 2012]. Disponible en: http://www.uptodate.com/
19. Esparza Olcina MJ, Benito Herreros AM. Los preparados de arándano, inocuos pero de dudosa eficacia para la infección urinaria en niños. Evid Pediatr. 2012; 8: 30.
20. Dai B, Liu Y, Jia J, Mei C. Long-term antibiotics for the prevention of recurrent urinary tract infection in children: a systematic review and meta-analysis. Arch Dis Child. 2010; 95: 499-508.
Bibliografía recomendada
– Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica. Guiasalud 2011 [en línea] [fecha de consulta: 15-VII-2012]. Disponible en: http://www.guiasalud.es/egpc/ITU/completa/index.html
Avalada por el Ministerio de Sanidad, es una exhaustiva revisión actualizada que abarca todos los aspectos relacionados con la infección de orina en niños.
– National Collaborating Centre for Women’s and Children’s Health. National Institute for Health and Clinical Excellence (NICE) Guideline. Urinary Tract Infection in Children: Diagnosis, Treatment and Long-term Management. London: RCOG Press; 2007. [Último acceso 15-10-2012]. http://www.nice.org.uk/nicemedia/pdf/CG54fullguideline.pdf.
Guía publicada en el Reino Unido donde se revisan todas las pautas de actuación en las infecciones de orina. De imprescindible lectura, especialmente en aspectos relacionados con el seguimiento e indicación de pruebas complementarias.
– Shaikh N, Ewing AL, Bhatnagar S, et al. Risk of renal scarring in children with a first urinary tract infection: a systematic review. Pediatrics. 2010; 126: 1084.
Aun con limitaciones metodológicas reconocidas por los propios autores, se insiste en que la aparición de cicatrices renales no depende sólo de la presencia de RVU, idea predominante durante décadas. Además, la disminución de la prevalencia de cicatrices renales probablemente está más relacionada con un mejor diagnóstico prenatal.
– Roberts KB, Finnell SM, Downs SM. Response to the AAP Section on Urology concerns about the AAP Urinary Tract Infection Guideline. Pediatrics. 2012; 129: 1054-6.
Los autores afirman que, en los estudios con seguimiento a largo plazo, el tratamiento del RVU no parece disminuir los casos de IRC.
– Molina Cabañero JC. Manejo de la infección urinaria en urgencias. An Pediatr Contin. 2011; 9: 7-14.
Este artículo en español revisa, de forma práctica y concisa, todos los aspectos relacionados con la ITU en niños. Muy útil para la consulta diaria y para la urgencia.
– Saadeh SA, Mattoo TK. Managing urinary tract infections. Pediatric Nephrology. 2011; 62: 1967-76.
Completa y actualizada revisión del diagnóstico y manejo de la ITU en niños, incluyendo las indicaciones de pruebas complementarias y de tratamiento quirúrgico.
– Shaikh N, Hoberman A. Long-term management and prevention of urinary tract infections in children [Monografía en Internet], Waltham (MA): UpToDate; 2012 [acceso 15 de octubre de 2012]. Disponible en: http://www.uptodate.com/
Revisión actualizada sobre el manejo y seguimiento a largo plazo de la ITU en niños.
| Caso clínico | |
|
Varón de 5 meses de vida que acude al Centro de Salud con cuadro de 48 horas de evolución de fiebre de 39°C junto con hiporexia, un vómito alimentario aislado e irritabilidad. No tiene antecedentes neonatales, ni personales, familiares de interés. En la exploración física, los únicos hallazgos llamativos son: fiebre de 38,7°C y congestión nasal, con buen estado general. Se decide recoger orina por bolsa adhesiva perineal y se realiza tira reactiva que revela test de leucocito esterasa y de nitritos positivos. Con sospecha de infección del tracto urinario, se remite a Urgencias, donde se obtiene nueva muestra de orina por sondaje uretral para análisis y urocultivo. La microscopía confirma piuria y bacteriuria. Puesto que no hay criterios de ingreso, el paciente es dado de alta, pautándose tratamiento empírico con cefixima. A las 48 horas, acude de nuevo al Centro de Salud para revisión (como se le recomendó en Urgencias). La evolución ha sido satisfactoria, con desaparición de la fiebre (temperatura más alta en las últimas 12 horas de 37,4°C) y exploración física normal. Una vez confirmado el diagnóstico de infección del tracto urinario y la correcta sensibilidad al antibiótico empírico pautado en Urgencias, se le indica realizar un total de 10 días de tratamiento. |
|
 |
| Temas de FC |
M.C. Tauler Girona
ABS Sant Vicenç dels Horts, Barcelona
| Resumen
La hematuria y la proteinuria son signos de enfermedad de las vías urinarias que se encuentran con relativa frecuencia en la orina en los niños. Las causas son muy variadas: puede tratarse de trastornos transitorios, de patología renal de evolución benigna o bien que exista una enfermedad renal más severa subyacente. |
| Abstract
Haematuria and proteinuria are signs of renal tract disease. You can find them often on children ́s urine. There are different causes, from transient abnormalities, benign renal pathology or more serious subjacent ones. |
Palabras clave: Hematuria; Proteinuria; Diagnóstico.
Key words: Haematuria; Proteinuria; Diagnosis.
Pediatr Integral 2013; XVII(6): 412-421
Hematuria
Introducción
Es habitual encontrar hematuria en los niños. Existe un gran número de causas que la originan, de pronóstico variable. Cuando la hematuria va asociada a proteinuria hay más riesgo de enfermedad renal seria.
En la consulta de Pediatría es frecuente encontrar hematuria al realizar algún control de orina. En la mayoría de ocasiones, es una hematuria microscópica asintomática, muchas veces transitoria, que puede encontrarse incluso al realizar una revisión de un niño aparentemente sano. En otras situaciones, puede haber hematuria más intensa o asociada a otros síntomas o acompañada de proteinuria. El diagnóstico de hematuria provoca preocupación a los padres. Tener un criterio adecuado para no realizar un exceso de pruebas al niño y, por otro lado, no minimizar una patología que puede llegar a ser grave es fundamental.
Definición
La hematuria se define como un aumento de eliminación de sangre en la orina. Puede presentarse de dos maneras: la macrohematuria, que es la presencia de sangre en orina que es objetivable a simple vista, y la microhematuria, en la que se detecta sólo tras realizar un estudio de la muestra de orina.
En la hematuria macroscópica, las orinas se ven coloreadas de color rosado, rojo, parduzco o “coca-cola”. Corresponde a más de 500.000 hematíes/ minuto (Gubler, 1981). Es importante señalar que el color rojo de la orina no indica la cantidad de sangre que se pierde por la orina ya que sólo 1 ml de sangre en 1 litro de orina puede producir orinas de color rojo.
Se considera microhematuria la presencia de 5 o más eritrocitos/por campo de orina fresca centrifugada o bien más de 5 hematíes/mm3 en muestra no centrifugada en 3 muestras consecutivas en el plazo de varias semanas(1,2). Es esencial realizar estos controles de orina repetidos para descartar un proceso transitorio.
Epidemiología
La hematuria microscópica asintomática tiene una prevalencia en edad escolar de un 3-6% si consideramos una única muestra de orina(3,4). Esta alta prevalencia baja al 1% si se analizan dos o más muestras con algunas semanas de intervalo. Finalmente, sólo un tercio presentará hematuria persistente seis meses después(5). La asociación hematuria y proteinuria tiene una prevalencia inferior al 0,7%(5). La incidencia de hematuria macroscópica es de un 0,13%(2).
Detección y diagnóstico
La tira reactiva es la prueba que se usa para detectar hematuria; el sedimento de orina establece el diagnóstico.
La tira reactiva (Dipstick) es el test más utilizado para el screening de hematuria. Es sencillo y barato. Detecta sangre basándose en la actividad peroxidasa de la hemoglobina. Es útil en la hematuria microscópica. Tiene una sensibilidad de un 100% y una especificidad aproximadamente de un 99%. La tira detecta 5-10 hematíes intactos/mm3 que corresponde a 2-5 hematíes/campo en sedimento de orina de una muestra centrifugada(3,5). Pueden existir falsos positivos cuando la orina es muy alcalina, muy diluida o no es fresca(5), o por contaminación de productos de higiene perineal. Los falsos negativos son excepcionales (altas concentraciones de ácido ascórbico), por este motivo, una tira reactiva negativa descarta hematuria. Además, existen sustancias que pueden colorear la orina, dando un aspecto falso de hematuria, como: alimentos (remolacha…), fármacos (nitrofurantoína, salicilatos, sulfonamidas) o toxinas (benceno).
El sedimento de orina es un método sensible, imprescindible para el diagnóstico de hematuria. Permite detectar elementos que no se encuentran siempre en las tiras, como: hematíes, leucocitos, células epiteliales o acantocitos; también, descarta los falsos positivos que puede haber en situaciones como la hemoglobinuria o la mioglobinuria. Se consideran patológicos valores de más de 5 hematíes/campo en orina fresca no centrifugada. Hay que recordar siempre a la familia la importancia de que las orinas sean recogidas con adecuadas normas de higiene y que las muestras sean frescas. Una vez centrifugada la orina, si el sobrenadante queda claro y el color rojo está sólo en el sedimento, se tratará de una hematuria verdadera.
Diferenciación hematuria glomerular/no glomerular (Tabla I)
Para diferenciar entre hematuria de glomerular y extraglomerular, existen varios indicadores. En primer lugar, es importante realizar una anamnesis detallada para poder diferenciar entre una y otra. Cuando la hematuria es glomerular, el aspecto de la orina es marrón oscuro, ocre o recuerda de aspecto a la “coca-cola”, no hay dolor acompañante, ni síntomas urinarios asociados. La hematuria de origen urológico es de color rojo con cambios durante la micción, puede haber síndrome miccional acompañante y coágulos.
En lo referente al laboratorio, son sugestivos de enfermedad glomerular:
1. Presencia de acantocitos (es patognomónico). Si existe más de un 5% la posibilidad es aún más alta.
2. Existencia de hematíes dismórficos en un porcentaje superior al 30%.
3. Proteinuria superior a 100 mg/m2.
Aunque todos son signos de enfermedad glomerular, su ausencia no la descarta. También, hay que tener en cuenta que esta identificación requiere una cierta práctica del laboratorio(5).
Etiología
Las causas más frecuentes de hematuria macroscópica son las infecciones urinarias, traumatismos o alteraciones del tracto urinario. En menor proporción, la litiasis, enfermedades glomerulares, trastornos de la coagulación y tumores. Si la hematuria es microscópica y persistente, la etiología más común es la nefropatía por IgA, el síndrome de Alport, la enfermedad de las membranas finas, la hipercalciuria, la glomerulonefritis postestreptocócica y el síndrome de “cascanueces” (Tabla II).
Formas clínicas
La microhematuria aislada asintomática es la forma de presentación más frecuente y tiene un pronóstico bueno. Los síntomas que acompañan a la hematuria ayudarán, en muchas ocasiones, a determinar la causa más probable. En la hematuria macroscópica se conoce la causa en la mitad de los casos.
En el año 2000, Diven describió cuatro formas clínicas de presentación que permiten categorizar la hematuria y establecer las pruebas diagnósticas que pueden ser más oportunas en cada situación. Esta clasificación sigue siendo útil hoy con alguna adaptación posterior de algunos autores. Estas formas son:
a. Como hallazgo casual en una revisión en forma de microhematuria asintomática.
b. Microhematuria asociada a proteinuria.
c. Paciente con síntomas urinarios o generales en el que se detecta microhematuria.
d. Hematuria macroscópica.
Microhematuria aislada asintomática (MHA)
La prevalencia de la enfermedad en la población escolar es de un 3-6%; esta cifra va disminuyendo si se realizan dos o más exámenes de orina en las dos o tres semanas posteriores. Después de seis meses, un tercio de estos niños presentarán una microhematuria, el resto tendrán un control de orina normal (microhematuria transitoria); es importante tener en cuenta este dato al diagnosticarla.
Es una patología benigna. En dos revisiones realizadas recientemente de niños que presentaban microhematuria asintomática aislada (una con 325 pacientes y otra con 342), en las que se realizó analítica de sangre y estudio radiológico, no se encontraron hallazgos significativos en un alto porcentaje de casos. Por este motivo, si la exploración es normal se recomendaría realizar sólo urocultivo para descartar infección urinaria sin realizar otros exámenes complementarios, excepto si existen síntomas asociados, como: HTA, proteinuria o edemas(5).
Entre las enfermedades que cursan con microhematuria asintomática aislada, están la hipercalciuria y las glomerulopatías familiares. Con menor incidencia, la nefropatía por IgA y el síndrome de cascanueces. La hipercalciuria es una causa frecuente, su diagnóstico es importante por el riesgo de presentar litiasis renal. Hay que realizar una anamnesis dirigida para descartar posibles antecedentes de esta enfermedad en la familia. Para investigar nefropatías hereditarias, como la enfermedad de las membranas finas o el síndrome de Alport hay que preguntar si existe historia familiar de hematuria, insuficiencia renal, sordera o alteraciones oculares(4). En caso positivo, podría estar indicado realizar tiras reactivas de cribaje a los padres y hermanos(3,5). La nefropatía por IgA tiene una forma de presentación variable, generalmente cursa con hematuria macroscópica recurrente, pero también puede presentarse como microhematuria aislada. El síndrome de “cascanueces”, debido a la compresión de la vena renal izquierda entre la aorta y la arteria mesentérica superior, también puede debutar de esta manera.
Seguimiento:
Se recomienda realizar controles de tensión arterial y sedimento de orina cada 3-6 meses durante como mínimo un año. Si aparecen hallazgos nuevos, como proteinuria y/o HTA, hay que valorar realizar otras pruebas. Si persiste la microhematuria más allá de 6-12 meses, es conveniente determinar el cociente en orina de calcio/creatinina (Ca/Cr), que estará alterado si existe hipercalciuria (patológico >0,2 mg/mg en niños mayores de 6 años en la primera orina de la mañana). También es aconsejable realizar una tira reactiva a los padres y hermanos del paciente y descartar glomerulopatías familiares(5). En el caso de que se exista ya historia familiar positiva de litiasis renal o algún familiar de primer grado con hematuria, hay autores que son partidarios de adelantar el estudio y realizarlo cuando se diagnostica la hematuria(3,7).
Microhematuria con proteinuria
La existencia de proteinuria asociada a la microhematuria debe hacer sospechar una patología renal importante (Dodge). El cociente proteinuria/ creatinina (Pr/Cr) en la primera orina de la mañana (valores patológicos >0,2 (mg/mg) en niños y 0,5 en lactantes) es útil para cuantificar la proteinuria. Si la proteinuria es dudosa, hay que realizar más de un análisis de orina en el plazo de unas 2-3 semanas para asegurar la persistencia de ambos signos y la intensidad de la proteinuria. Si se confirma la microhematuria con una proteinuria significativa mantenidas, es aconsejable remitir al paciente al nefrólogo pediátrico para un estudio más amplio. Se recomienda realizar analítica de sangre con hemograma, creatinina, ASLO, test de detección de estreptococo, albúmina, complemento y anticuerpos antinucleares. También, puede estar indicada una ecografía renal.
Microhematuria con síntomas asociados
Los síntomas pueden ser generales (fiebre, astenia, artralgias), renales (disuria, tenesmo, incontinencia urinaria, edema, HTA) o extrarrenales (artritis, púrpura). En la mayoría de casos, servirán para establecer el diagnóstico. La púrpura o las artralgias sugieren el síndrome de Schönlein-Henoch. La semiología renal puede encontrarse tanto en enfermedades urológicas como en glomerulares. Si existe fiebre, dolor en costado o náuseas, habrá que pensar en afectación alta de las vías urinarias.
La historia clínica también ayuda a investigar la etiología. Una historia familiar de hematuria es indicador de litiasis renal, enfermedad de las membranas finas o síndrome de Alport. El antecedente de faringitis o de infección cutánea es característico de la glomerulonefritis postinfecciosa, si existe una infección respiratoria 24-48 horas previas, de la nefropatía IgA. Si hay antecedentes de síndrome miccional, disuria, o incontinencia urinaria, habrá que descartar infección urinaria.
Seguimiento:
Los estudios se realizarán en función de la patología sospechada. Si existen signos de sospecha de enfermedad glomerular, como: HTA, proteinuria significativa, edemas o alteraciones analíticas, debe remitirse al niño al nefrólogo pediátrico para completar el estudio.
Hematuria macroscópica
Se sospecha hematuria macroscópica cuando la orina es de color rojo, rosado o marrón. Hay que asegurar siempre el diagnóstico, ya que existen situaciones que pueden confundir, presentándose con orinas coloreadas. La ingesta de determinados alimentos, medicamentos o algunas enfermedades metabólicas (hemoglobinuria, mioglobinuria), son causas de falsa hematuria.
En más de la mitad de casos (56%) se conoce la causa de la hematuria(4). Las causas más frecuentes son: infección urinaria, traumatismos o irritación del meato o del periné. La etiología de la macrohematuria en niños varía en función de las características del centro donde se han realizado las revisiones: urgencias pediátricas de un hospital de tercer nivel, urología pediátrica o nefrología pediátrica(6). Dentro de las enfermedades origen urológico, las más frecuentes son la infección urinaria, la irritación perineal, los traumatismos y la hipercalciuria; en menor proporción, la estenosis del meato y la nefrolitiasis. En la mayoría de casos, puede realizarse el diagnóstico y abordarse desde la consulta del pediatra de cabecera. La derivación a urología puede ser necesaria en casos especiales. Entre las causas de hematuria glomerular, están la nefropatía por IgA, la glomerulonefritis aguda postinfecciosa, el síndrome de Alport, la glomerulonefritis membrano proliferativa y el síndrome nefrótico. Son menos comunes los trastornos de la coagulación, los tumores renales, la anemia de células falciformes y la cistitis hemorrágica por fármacos.
Seguimiento:
Según la historia clínica y los antecedentes, se realizará un estudio más dirigido. Si existe sospecha de enfermedad glomerular (HTA, aumento de la creatinina, proteinuria) o se trata de una hematuria macroscópica mantenida, es conveniente remitir al paciente al nefrólogo pediátrico.
Proceso diagnóstico de estudio de la hematuria
La historia clínica detallada, la exploración física y la analítica son fundamentales para el enfoque de la hematuria.
Historia clínica
• Hay que preguntar si existen antecedentes familiares de enfermedad renal (glomerulopatías familiares, como enfermedad de las membranas finas, nefrolitiasis) o sordera (síndrome de Alport).
• El antecedente de amigdalitis o infección cutánea previa de dos o tres semanas es característico de la glomerulonefritis postinfecciosa; si se produce infección faríngea sólo 24-48 horas antes de la hematuria, puede tratarse de una nefropatía por IgA.
• Si la hematuria cursa con disuria, síndrome miccional o incontinencia, hay que descartar infección urinaria. También podría haber fiebre asociada en este caso.
• El color de la orina es muy útil para diferenciar la hematuria glomerular de la no glomerular. Las orinas son oscuras u ocres en la hematuria glomerular y rojizas o rosadas en la hematuria de origen urológico.
• La hematuria que cursa en brotes, frecuentemente asociada a infecciones respiratorias, es sospechosa de nefropatía por IgA.
• Un dolor lumbar unilateral asociado apoya el diagnóstico de obstrucción de las vías urinarias.
Exploración física
Es importante tomar la tensión arterial para descartar HTA. También, valorar el aspecto general del niño y ver si presenta palidez, edemas (enfermedad glomerular), un posible aumento de peso o hay algún exantema característico (vasculitis). En la auscultación cardiopulmonar, puede haber estertores por sobrecarga de volumen. A nivel del abdomen, buscar si existen masas (poliquistosis renal, tumor renal) y explorar también en el aparato genital posible sangrado, lesión genital o irritación de la uretra(8).
Exámenes complementarios
Analítica de orina
En el sedimento de orina se buscarán acantocitos o hematíes dismórficos para determinar una posible lesión glomerular. Hay que cuantificar la proteinuria, si está elevada es indicativo de enfermedad glomerular. El urocultivo es esencial para diagnosticar infección urinaria, aunque puede ser negativo en infecciones urinarias por adenovirus; el cociente calcio/creatinina (Ca/Cr) en orina de la mañana es útil para descartar la hipercalciuria.
Analítica de sangre
Los niveles de creatinina, urea, electrolitos, hemograma y albúmina son necesarios para investigar si existe una insuficiencia renal oculta. Si hay sospecha de infección previa por estreptococo, es conveniente cursar ASLO y C3. Puede ser útil también la serología hepatitis B y C, el estudio de complemento, VIH y ANA (nefritis lúpica) en determinados casos.
Estudio radiológico
La ecografía renal está indicada en la hematuria macroscópica(2), en otras situaciones hay que valorarla, ya que permite detectar posibles alteraciones renales congénitas, asimetrías, tumores renales, trombosis de la vena renal y algunos cálculos(7). La radiografía de abdomen sólo estaría indicada si se sospecha litiasis producida por piedras de calcio o cistina, que son radioopacos. Los cálculos de ácido úrico no se ven en una radiografía. Otros estudios más especializados pueden estar indicados según la valoración del nefrólogo/urólogo infantil. La ecografía Doppler cuando existe una sospecha de “síndrome de cascanueces”. La cistografía en niños si hay sospecha de reflujo vesicoureteral importante. La cistoscopia se usa raramente en el estudio de la hematuria en el niño. El escáner está indicado si hay un antecedente de traumatismo importante.
Criterio de derivación:
Remitir a un nefrólogo infantil en el caso de hematuria macroscópica sin etiología clara, de episodios recurrentes de hematuria macroscópica, hematuria asociada a proteinuria importante, signos de insuficiencia renal o historia familiar sugestiva de nefritis hereditaria(1,4,6).
Proteinuria
Introducción
La proteinuria es importante por su relación directa con el riesgo de enfermedad renal.
Cuando se detecta proteinuria, lo más habitual es que se trate de una proteinuria transitoria o de proteinuria ortostática, ambas de evolución benigna. Si es persistente, el pronóstico cambia, ya que existe una relación directa entre proteinuria y posible lesión renal. Además, la proteinuria es el primer indicador de enfermedad renal silente(9). Si se detecta proteinuria significativa que persiste (excluida la ortostática), hay que intentar llegar a un diagnóstico lo más rápidamente posible.
Definición
Se considera proteinuria patológica en el niño una excreción superior a 100 mg/m2/día (superior a 4 mg/m2/hora) o 150 mg/día excepto en el neonato, en que la excreción de proteínas en orina es más alta(10). En Atención Primaria es más práctico usar el cociente proteínas/creatinina (Pr/Cr) en una muestra de orina de la mañana; son patológicos valores >0,2 (mg/mg) o >0,5 en lactantes.
Epidemiología
Un 10% de niños en edad escolar pueden presentar proteinuria en algún momento(11), disminuyendo claramente esta incidencia si se realizan varios exámenes de orina. En un estudio en niños de edad escolar en los que se realizaron hasta cuatro exámenes de orina repetidos, la incidencia bajó al 1%(12). Otros autores refieren valores de un 0,1 % de niños con proteinuria persistente(10). Estos datos sugieren la importancia de realizar más de un control de proteinuria en el niño.
Fisiopatología
En el niño, hay dos mecanismos básicos de exceso de eliminación urinaria de proteínas: la proteinuria glomerular y la tubular. En la proteinuria glomerular, se produce proteinuria por aumento de permeabilidad de la membrana del glomérulo por: defectos de la membrana, pérdida de su carga negativa o lesión directa por inmunocomplejos(9). También, puede ser consecuencia de una reducción del número de nefronas(11). El glomérulo filtra de la sangre proteínas grandes, como la albúmina y las inmunoglobulinas. Cuando la proteinuria es tubular, hay alteración del túbulo proximal, que produce una disminución de la reabsorción de proteínas de bajo peso molecular (beta 2 microglobulina y otras). Existe un tercer mecanismo de proteinuria en el que hay un aumento de excreción de proteínas de bajo peso molecular por una sobreproducción de una proteína especial; este tipo de proteinuria no se ve habitualmente en el niño.
Detección y diagnóstico
La tira reactiva sirve para detectar proteinuria, pero no para cuantificarla. El cociente proteína/ creatinina en orina (Pr/Cr) (mg/mg) es muy útil en pediatría para diagnosticar la proteinuria y para su control posterior. Se considera patológico un Pr/Cr >0,2 (mg/mg) en la primera orina de la mañana en niños mayores de 2 años.
La tira reactiva es útil para la detección de posible proteinuria. Es sensible y especifica en un 99% para la albuminuria pero no para otro tipo de proteínas (no detectan proteínas de bajo peso molecular). Es un método colorimétrico, el color cambia de amarillo a azul según la intensidad de la proteinuria: trazas (10 mg/dl) 1+ (30 mg/dl), 2+ (100 mg/dl), 3+ (300 mg/dl) 4+ (1.000 mg/dl). Se consideran normales valores negativos o trazas de proteinuria. Puede haber falsos positivos (contaminación por antisépticos, orina alcalina, hematuria importante, excesiva inmersión de la tira en la orina, orina muy concentrada) y falsos negativos (orina muy diluida, presencia de otras proteínas que no son albúmina en la orina) (Tabla III).
Test del ácido sulfosalicílico:
Sirve para detectar en la orina la presencia de proteínas de bajo peso molecular. Se usa poco en pediatría.
Medición cuantitativa
La determinación de la proteinuria en orina de 24 horas es el test diagnóstico mejor para determinar el grado de proteinuria. La excreción normal de proteínas en el niño es de 4 mg/kg/hora o <100 mg/kg/día. En el niño, esta medición resulta difícil o imposible en muchas ocasiones debido a las dificultades de la recogida de orina. Se ha encontrado que existe una buena correlación entre la proteinuria de 24 horas y el cociente proteína/creatinina en la primera orina de la mañana (multiplicando el cociente por 0,63 se estimaría la cantidad total de proteinuria por g/m2/24 horas)(11).
El método más sencillo para la cuantificación de la proteinuria y el más útil para el pediatra de cabecera es el cociente proteína/creatinina (Pr/Cr) (mg/mg) en orina, patológico si >0,2 (>0,5 en niños de 6-24 meses). Es importante que sea la primera orina de la mañana, así excluiremos también proteinuria ortostática. Para el control de niños diabéticos, es mejor la medición de la microalbuminuria, ya que es más sensible. Los valores superiores a 30 de albúmina/creatinina (mg/g) en la primera orina de la mañana son considerados anormales.
Medición cualitativa
La medición cualitativa de las proteínas se realiza por el método de nefelometría, permitiendo diferenciar proteinuria glomerular y tubular.
Tipos de proteinuria (Tabla IV)
Proteinuria transitoria
Multitud de procesos pueden originar proteinuria en algún momento: fiebre, estrés, ejercicio, exposición al frío o deshidratación. La prevalencia es de un 5-15%(9). Esta proteinuria remite cuando desaparece la causa desencadenante.
Proteinuria ortostática
Es relativamente frecuente en los adolescentes. Se produce por aumento de la excreción de proteínas en la posición de bipedestación, esta proteinuria se normaliza siempre en decúbito. La causa está en discusión, podría tratarse de una compresión de la vena renal izquierda(12). La proteinuria ortostática suele ser de baja intensidad, no superior a 1 g/m2/24 horas. El diagnóstico se realiza cuando el cociente de proteína/creatinina (Pr/Cr) (mg/mg) es <0,2 en la primera orina de la mañana. Es importante recordar que el niño debe haber estado la noche previa entera en decúbito. En una segunda muestra de orina recogida unas seis horas después de estar de pie se aprecia un aumento del cociente Pr/Cr en orina >0,2. La evolución de la proteinuria ortostática a largo plazo es buena. Existen datos de función renal normal a los 20-50 años de seguimiento en un estudio realizado a un grupo de pacientes(10,11).
Proteinuria persistente
La importancia de la proteinuria persistente radica no solamente por tratarse de un signo de enfermedad renal, sino que es el mejor marcador de enfermedad renal progresiva(12). Además, si la proteinuria va asociada a hematuria, HTA o alteración funcional renal, aumenta la posibilidad de nefropatía.
Puede ser de origen glomerular o tubular. La proteinuria glomerular es la más frecuente en el niño. Existe un aumento de albúmina e inmunoglobulina G en orina. Las enfermedades glomerulares pueden cursar con nefrosis y/o nefritis. Cuando hay nefrosis, existe una proteinuria importante (superior a 1 g/m2/día o el cociente Pr/Cr en orina >2) con edema e hipoalbuminemia. En la nefritis hay HTA, oliguria y hematuria, con presencia de acantocitos y hematíes/leucocitos en orina. La proteinuria tubular está asociada a patología del túbulo renal (glucosuria, acidosis renal tubular proximal). La proteinuria es moderada y a expensas de proteínas de bajo peso molecular; suele detectarse antes la enfermedad subyacente que la proteinuria.
Proceso diagnóstico de estudio de la proteinuria
Si la tira reactiva detecta >1+ de proteínas en orina, debe repetirse la prueba en una segunda muestra en la primera orina de la mañana. En esta orina, podría cursarse también cociente Pr/Cr y así cuantificar la proteinuria. Si la tira reactiva es negativa o trazas y el cociente es normal, indicaría proteinuria transitoria. Si la tira reactiva es negativa y el cociente Pr/Cr es normal en la mañana pero con tira patológica, al cabo de unas horas de bipedestación indicaría proteinuria ortostática. En ambos casos, sería recomendable repetir la tira reactiva al cabo en 1 año(10-12).
Cuando Pr u/Cr u >0,2 en la orina de la mañana y la tira de orina es positiva habría que realizar, en primer lugar, un sedimento buscando posibles signos de lesión glomerular (hematuria, piuria, acantocitos en orina). Además, hay que revisar la historia clínica y realizar una buena exploración física, controlando la tensión arterial. Es conveniente cursar un análisis de sangre, determinando: creatinina, colesterol, ionograma, albúmina y test de detección de estreptococo. También pueden ser útiles: C3, C4, complemento total, anticuerpos antinucleares, serología hepatitis B y C y VIH.
La ecografía renal está indicada si hay infección urinaria, para buscar posibles alteraciones anatómicas(11). En niños con enfermedad renal crónica, también puede ser útil, aunque la prueba mejor para detección de cicatrices renales es la gammagrafía renal(11).
El niño con proteinuria persistente puede presentar síntomas inespecíficos (fiebre, pérdida de peso), generales (púrpura, artritis) o específicos de enfermedad renal (edemas, HTA), que pueden ayudar al diagnóstico. Si el diagnóstico es claro y se puede controlar por el pediatra de cabecera, se realizarán los controles oportunos. Si existe sospecha de patología renal complicada, se remitirá al nefrólogo pediátrico(10). Es recomendable controlar de cerca al niño con proteinuria persistente inferior a 500 mg/m2 con análisis periódicos.
Criterios de derivación al nefrólogo pediátrico:
En caso de que la proteinuria sea de rango nefrótico: Pr/Cr (mg/mg) >1 orina (o excreción urinaria superior a 1.000 g/24 h) asociada a edema, hipoalbuminemia e hipercolesterolemia, datos sugestivos de síndrome nefrótico. Si la proteinuria es persistente y se asocia a HTA, sedimento de orina anormal o aumento de la creatinina en sangre. Si la ECO renal es anormal o existe historia de infecciones urinarias de repetición, deberá remitirse para descartar la presencia de cicatrices renales.
Las indicaciones de biopsia renal están en discusión(10). Puede estar indicada en determinadas circunstancias, como: hipertensión arterial, disminución del filtrado glomerular superior a 3 meses, presencia de hematuria macroscópica persistente, hipoalbuminemia o signos de enfermedad sistémica (vasculitis).
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** Cara GM, Peña A. Hematuria. An Pediatr Contin. 2009; 7(2): 61-9.
2. Gattineni. Highlights for the management of a child with proteinuria and hematuria. Int J Pediatr. 2012: 1-7.
3.*** Diven SC, Travis LB. A practical primary care approach to hematuria of children.Pediatr Nephrol. 2000; 14: 65-72.
4. Massengill SD. Hematuria. Pediatr Rev. 2008; 29(10): 342-8.
5.** Gagnadoux MF. Evaluation of microscopic hematuria in children. Versión 15.0. Up to Date. 2012: 1-27 (Fecha acceso junio 2012).
6.** Gagnadoux MF. Evaluation of gross hematuria in children. Versión 12.0.Upto Date 2012: 1-16 (Fecha de acceso: julio 2012).
7. Meyers KEC. Evaluation of hematuria in children. Urol Clin North Am. 2004; 559-73.
8. Hernández R, Martin J. Hematuria. Protocolos diagnósticos y terapéuticos de la AEP; 2008. 2ª edición. p. 133-47.
9. Ariceta G. Clinical practice. Proteinuria. Eur J Pediatr. 2011; 170(1): 15-20.
10.*** Gagnadoux MF. Evaluation of proteinuria in children.Versión 7. 0.Up to Date 2012. (Fecha acceso mayo 2012).
11.* Hogg RJ, Portman RJ, Milliner D, Lemley KV, Eddy A, Ingelfinger J. Evaluation and management of proteinuria and nephrotic syndrome in children: recommendations from a pediatric nephrology panel established at National Kidney Fundation Conference on Proteinuria, Albuminuria, Risk assessment, Detection and Elimination (PARADE). Pediatrics. 2000; 105(6): 1242-50.
12. Leung AKC, Wong AHC. Proteinuria in children. Am Fam Physician. 2010; 82(6) 645-51.
Bibliografía recomendada
– Diven SC, Travis LB. A practical primary care approach to hematuria of children.Pediatr Nephrol. 2000; 14: 65-72.
Guía muy práctica sobre el manejo de la hematuria en el niño, con descripción de las distintas formas de presentación y propuesta de algoritmos de actuación dirigidos al pediatra de cabecera.
– Gagnadoux MF. Evaluation of microscopic hematuria in children. Versión 15.0. Up to Date. 2012: 1-27 (Fecha acceso junio 2012).
– Gagnadoux MF. Evaluation of proteinuria in children.Versión 7.0. Up to Date. 2012 (Fecha acceso mayo 2012).
En los dos artículos, se realiza una excelente puesta al día de la hematuria microscópica y la proteinuria en el niño, explicando con claridad el seguimiento del paciente, con pautas y criterios de derivación para los pediatras. Puede consultarse por Internet, por lo que periódicamente se va actualizando la información.
– Hogg RJ, Portman RJ, Milliner D, Lemley KV, Eddy A, Ingelfinger J. Evaluation and management of proteinuria and nephrotic syndrome in children: recommendations from a pediatric nephrology panel established at National Kidney Fundation Conference on Proteinuria, Albuminuria, Risk assessment, Detection and Elimination (PARADE). Pediatrics. 2000; 105(6): 1242-50.
Recomendaciones a los nefrólogos pediátricos del Comité Nacional Estadounidense PARADE (Proteinuria, Albuminuria, Risk, Assesment, Detection and Elimination) para valoración y tratamiento de la proteinuria y síndrome nefrótico en el niño.
| Caso clínico | |
|
Niño de 4 años sin antecedentes familiares ni personales de interés, que consulta por un cuadro clínico de cuatro días de evolución de hematuria, inicialmente macroscópica, que remite progresivamente en las últimas 24 horas. No hay fiebre ni otros síntomas asociados. Antecedente de infección respiratoria leve dos semanas antes del proceso. Exploración TA: 108/65. Afebril. Buen color, no exantemas. No edemas. ACR: normal. Abdomen: no doloroso, sin masas. PPL: negativa. GU: aspecto normal. ORL: leve congestión amigdalar. Exámenes complementarios Sedimento de orina: aspecto normal, pH: 6, leuc.: 25-30/ c, hematuria: 25-30/c, células epiteliales: 8-10/c, proteinuria (+++), ligera bacteriuria, no cilindruria, alguna célula renal granulosa. Orina Ca/Cr: 0,01. Orina Pr/Cr: 0,87. Se inicia tratamiento antibiótico con amoxicilina + clavulánico en espera del resultado del urocultivo. Cinco días más tarde, presenta nuevo aumento de la hematuria volviendo a ser macroscópica; en la exploración física sólo destaca valores de TA 114/58 (sist. perc. 97, diast. p 50), resto sin cambios. Se realiza nueva analítica. Orina: sedimento de orina: leuc.: 20/ c, hematíes: 350/c, proteinuria (+++). Urocultivo negativo. Orina Pr/ Cr: 2,56. Ca/ Cr: 0,01. Microalbuminuria: 594 mg/L. Sangre: hemograma: 8.000 L con recuento normal. Hematíes: 4.980.000, Hto: 40,8%, Hb: 12,4 g/ dl, VCM: 82. Plaquetas: normales. PCR: 0,5 mg. Proteínas totales: 6,68 g/dl; albúmina: 4,06 g/dl; urea: 36 mg/dl; creatinina: 0,68 mg/dl; VSG: 20; glucemia: 88 mg/dl; Ca: 9,89 mg/dl; P: 5,5 mg/dl; Na: 140 mEq/L; K: 5,2 mEq/; ácido úrico: 5,09 mg (dl); GPT: 17 UI; gammaGT: 12,46 UI; fosfatasas alcalinas: 393 UI; colesterol: 152 mg/dl; triglicéridos: 86 mg/ dl; T de protrombina: 100%; y ASLO: 289 UI/ml. IgG: 1.184 mg/dl; IgA: 135 mg/dl; IgM: 305 mg/dl; C3: 4 mg/dl (v.n: 50-120 mg/dl); C4: 18,51 mg/dl (v.n.: 10-40 mg/dl); HBsAg: 0,20 (valor índice); HcAc: 0,77 (valor índice); HIV: 0,27 (valor índice); y ANA <0,5 (valor índice). Radiología: ECO renal y vesical: normales. Evolución Sigue dieta hiposódica y normoproteica con normalización rápida de la TA a las pocas horas, remisión de la hematuria macroscópica y diuresis normal. En los dos meses posteriores, ha estado asintomático. Analítica de control dos meses después. Sedimento de orina: leucocitos: 12-15/c, hematíes: 20-25/c, no cilindros y proteinuria negativa. Microalbuminuria: 38 mg/L. C3: 64 mg/dl. C4: 29 mg/dl. |
|
 |
| Temas de FC |
D. González-Lamuño
Profesor Titular de Pediatría. Unidad de Nefrología-Metabolismo Infantil. Servicio de Pediatría. Hospital Universitario M. Valdecilla-Universidad de Cantabria. Santander
| Resumen
La hipercalciuria es una excreción urinaria de calcio superior a 4 mg/kg/día, en el contexto de una dieta normal en calcio, proteínas y sodio. La calciuria puede estimarse en una orina aislada, determinando la relación calcio/creatinina. Por encima del año, una relación >0,2 sugiere hipercalciuria. La mayoría de las hipercalciurias están asociadas a una hipercalcemia, siendo la causa más frecuente en el niño la hiperdosificación de vitamina D. Otras causas de hipercalciuria secundaria son el hiperparatiroidismo, la inmovilización prolongada, el síndrome de Cushing, tratamiento con corticosteroides, síndrome de Fanconi, síndrome de Bartter o la acidosis tubular distal. La hipercalciuria también se puede observar en la enfermedad de Dent y asociada al raquitismo hipofosfatémico. |
| Abstract
Hypercalciuria is a urinary calcium excretion more than 4 mg/kg/day, in the context of a normal diet in calcium, protein and sodium. The calciuria can be estimated in a isolated urine by determining the calcium/creatinine ratio. A ratio >0.2 suggests hypercalciuria. Most hypercalciuria are associated with hypercalcemia, the most common being the child hiperdosificación vitamin D. Other causes are secondary hypercalciuria hyperparathyroidism, prolonged immobilization, Cushing syndrome, treatment with corticosteroids, Fanconi syndrome, Bartter syndrome and distal renal tubular acidosis. Hypercalciuria can also be observed in Dent’s disease and associated with hypophosphatemic rickets. |
Palabras clave: Hipercalciuria; Tubulopatías; Nefrocalcinosis; Litiasis renal.
Key words: Hypercalciuria; Tubulopathies; Nephrocalcinosis; Renal stones.
Pediatr Integral 2013; XVII(6): 422-432
Introducción
La hipercalciuria se define como una excreción urinaria de calcio superior a 4 mg/kg/día, en el contexto de una dieta normal en cuanto al contenido de calcio, proteínas y sodio. La calciuria también puede ser estimada en una orina aislada, determinando la relación calcio/creatinina (Ca/Cr), expresada en mg/mg. Por encima del año de edad, una relación superior a 0,2 mg/mg sugiere hipercalciuria. Durante los primeros 6 meses de vida, los valores considerados normales son inferiores a 0,8 mg/mg y, desde los 6 meses al año de vida, de 0,6 mg/mg.
La hipercalciuria se define como una excreción urinaria de calcio superior a 4 mg (o 0,1 mmol) por cada kg de peso y día, en el contexto de una dieta normal en cuanto al contenido de calcio, proteínas y sodio. La calciuria también puede ser estimada en una orina aislada, determinando la relación calcio/creatinina (Ca/Cr), expresada en mg/mg o mmol/mmol. Por encima del año de edad, una relación superior a 0,2 mg/mg sugiere hipercalciuria.
Es complejo definir los valores de calciuria con potencial significado patológico, ya que existe una gran variabilidad en la incidencia de patología asociada a esta alteración y a que los niveles de calciuria son extremadamente variables en distintas comunidades(1). Se entiende que los límites máximos de calciuria diaria normal son, de forma absoluta, de 250 mg para la mujer y de 300 mg para el hombre y, en la edad pediátrica, de 4 mg/kg/día a partir de los 2-3 años. Durante la lactancia, las cifras de calciuria consideradas normales son significativamente más elevadas, ya que la excreción de calcio urinario es mayor en lactantes y niños pequeños que durante la edad escolar. La hipercalciuria se define, por tanto, como una excreción diaria de calcio superior a 4 mg, o 0,1 mmol, por cada kg de peso, objetivada en varias ocasiones. De forma práctica, si no es posible realizar una recogida de orina de 24 horas, las cifras de calciuria pueden estimarse a partir de las concentraciones de calcio (Ca) y creatinina (Cr) obtenidas en una muestra aislada de orina, valorando la proporción o relación entre ambas. Una relación Ca/Cr, expresada en mg/mg superior a 0,2, sugiere hipercalciuria, teniendo en cuenta que los valores normales durante los primeros 6 meses de vida son hasta de 0,8 y, desde los 6 meses al año de vida, de 0,6(2). Expresados los valores en mmol/mmol, la proporción normal es menor de 2,4 mmol/mmol en el lactante y menor de 0,6 en el niño mayor(3) (Tabla I).
La excreción de calcio urinario está aumentada en lactantes e influenciada por la fuente de leche o tipo de fórmula. Los lactantes alimentados con leche materna presentan una mayor excreción de calcio urinario; mientras que, los lactantes alimentados con fórmulas de soja tienen la menor excreción de calcio urinario. La excreción de calcio no parece verse afectada por aspectos ligados al sexo o a componentes raciales, pero está afectada por factores geográficos y/o culturales. Esto se debe a que la influencia de la dieta en la calciuria es muy importante, tanto por su contenido en calcio como en otros nutrientes, como el sodio o las proteínas. La relación Ca/Cr puede aumentar hasta en un 40%, índice Ca/Cr de 0,28, tras una comida(4). Por tanto, en la evaluación de un niño con posible hipercalciuria debe recogerse de forma exhaustiva la historia dietética, con el fin de valorar si los factores dietéticos están en relación con la calciuria.
La “hipercalciuria idiopática”, es un defecto metabólico caracterizado por alteraciones en el transporte de calcio a nivel intestinal, renal y del hueso, que se identifica con frecuencia en la población pediátrica y, especialmente, en adultos con litiasis cálcica y osteoporosis. Este trastorno familiar es debido a diferentes combinaciones de factores genéticos y dietéticos.
Una excesiva eliminación urinaria de calcio en ausencia de hipercalcemia o de otras causas conocidas de hipercalciuria son las denominadas “hipercalciurias idiopáticas”, con calciurias superiores a 6 mg/kg/24 horas. Estas alteraciones metabólicas pueden normalizarse con la disminución de la ingesta de calcio; si bien, a veces necesita la asociación de un natriurético. Una vez descartadas las causas secundarias de hipercalciuria y se establece el diagnóstico de hipercalciuria primaria (Tabla II), el paso siguiente es evaluar si las modificaciones de la dieta pueden normalizar la excreción de calcio. Si las muestras de orina se han realizado en el contexto de una dieta rica en sodio, debe recogerse una nueva muestra de orina tras 2-4 semanas de restricción sódica (menos de 2-3 g de sal al día).
Dado el carácter genético de muchas condiciones asociadas a la hipercalciuria primaria, la posibilidad de incorporar estudios genéticos a la práctica clínica ha ido modificando la categorización de estas condiciones clínicas, con un menor peso de la denominación de idiopática.
Hipercalciurias con hipercalcemia
El hiperparatiroidismo primario por adenoma paratiroideo es raro en el niño y no suele observase antes de la adolescencia. Su presencia en sujetos jóvenes obligaría a investigar una “neoplasia endocrina múltiple” de tipo I.
Entre las causas genéticas de hipercalcemia del lactante que pueden causar una nefrocalcinosis, no es raro el síndrome de Williams-Beuren, un síndrome genético por microdeleción que asocia facies característica, retraso mental y cardiopatía, debido a una deleción del cromosoma 7 que incluye el gen de la elastina. La hipercalciuria formaba parte de los criterios clínicos que definieron el síndrome, aunque posteriormente se ha documentado que no es un elemento crítico asociado al síndrome. También, se han descrito casos de nefrocalcinosis con hipercalcemia e hipercalciuria en la trisomía 21.
Se describe hipercalcemia e hipercalciuria en algunos síndromes de malabsorción intestinal de azúcares y en los hipotiroidismos no tratados. Por último, en los casos en los que no se identifica una causa evidente, y que se agrupan en las denominadas “hipercalcemias infantiles idiopáticas”, a menudo complicadas con nefrocalcinosis, comienzan a identificarse alteraciones hereditarias del metabolismo de la vitamina D, que parece jugar un papel importante. Sin embargo, debe considerarse que, en la edad pediátrica, las causas más frecuentes de hipercalcemia son las iatrogénicas: sobrecarga de vitamina D, vitamina A y calcio, sobre todo en caso de nutrición parenteral total (Tabla III).
Hipercalciurias sin hipercalcemia
Enfermedades genéticas generadoras de hipercalciuria
Estudios de las formas monogénicas de nefrolitiasis hipercalciúrica, como la acidosis tubular distal, el síndrome de Bartter (alcalosis hipopotasémica, ocasionalmente asociado con sordera), la enfermedad de Dent (con proteinuria tubular), la hipomagnesemia familiar con hipercalciuria, la nefrolitiasis hipercalciúrica con hipofosfatemia y la hipercalciuria hipocalcémica autosómica dominante, han ayudado a identificar un número significativo de transportadores, canales y receptores involucrados en la regulación de la resorción tubular de calcio(5).
Otras enfermedades hereditarias que presentan una hipercalciuria con calcemia normal son: síndrome de Lowe (síndrome oculocerebrorrenal), raquitismo hipofosfatémico con hipercalciuria, síndromes de Toni-Debré-Fanconi y seudohipoaldosteronismo(6). Nos referimos a continuación a las formas más significativas:
1. La acidosis tubular distal (antes llamada “acidosis de Albright”), en sus diferentes formas genéticas, autosómicas recesivas (con sordera asociada) o autosómicas dominantes, provoca una nefrocalcinosis medular a través de la hipercalciuria debida a la acidosis crónica. Una excreción disminuida de citrato urinario debería alertar al clínico de la posibilidad de una acidosis tubular renal distal como causa de la hipercalciuria. En ausencia de tratamiento, de forma clásica ofrece una imagen de “granos de mijo”, marcando los cálices, dibujando, en ocasiones, los contornos de la papila. En los casos menos graves, la nefrocalcinosis es más discreta, con pequeños granos opacos medulares o sólo detectables en la ecografía. Un tratamiento alcalinizante precoz que normalice la calciuria evita la aparición de las formas graves de hipercalciuria (Fig. 1).
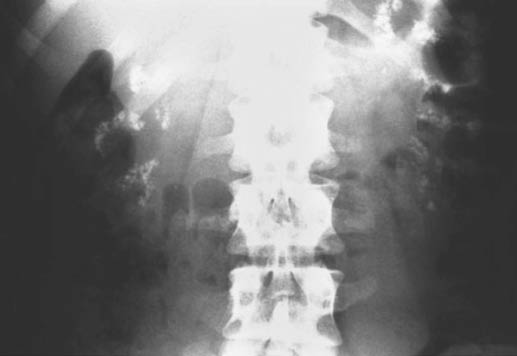
Figura 1. Ejemplo de nefrocalcinosis medular en la acidosis tubular distal.
2. El síndrome de Bartter, una enfermedad autosómica recesiva debida a mutaciones en el co-transportador de Na-K-Cl (NKCC2), el canal medular regulador de potasio (ROMK), el canal de cloro dependiente del voltaje CLC-Kb, la subunidad beta CLC-Kb o bartrina, o el receptor calcio sensible (CaSR) asociado a sordera, se acompaña de una hipercalciuria a menudo generadora de nefrocalcinosis y difícilmente controlable a pesar del uso de antiinflamatorios no esteroideos. Es la causa por la cual esta tubulopatía, caracterizada por una alcalosis hipopotasémica es, en la actualidad, una de las causas más frecuentes de nefrocalcinosis en el niño.
3. La enfermedad de Dent o “nefrolitiasis ligada al X”, donde la hipercalciuria está asociada a una proteinuria tubular de bajo peso molecular, es mucho más rara en el niño. Está asociada a mutaciones del gen que codifica un canal cloro, CLCN5 o, más raramente, del gen OCRL1 igualmente situado en el cromosoma X; OCRL1 es, con más frecuencia, responsable del síndrome de Lowe (oculocerebrorrenal), donde la hipercalciuria raramente destaca entre las pérdidas tubulares.
4. La hipomagnesemia familiar con hipercalciuria y nefrocalcinosis, enfermedad autosómica recesiva asociada a mutaciones de genes que codifican las “paracelinas” (Claudin 16 y 19)(7). Los miembros de la familia de proteínas de membrana claudinas, forman las uniones que conforman las barreras intercelulares de una gran variedad de epitelios. Estudios de estos genes han permitido conocer muchos aspectos de los mecanismos que regulan la resorción de calcio en el túbulo renal y predisponen a la hipercalciuria y nefrolitiasis.
5. El raquitismo hipofosfatémico con hipercalciuria, asociado a mutaciones autosómicas recesivas del gen SLC34A3, que codifica el co-transportador sodio-fosfato NaPi2c, puede complicarse con una nefrocalcinosis, así como la deleción del gen SLC34A1 en el marco de un síndrome de genes contiguos.
6. La hipercalciuria con hipocalcemia es excepcional. Es el resultado de un hipoparatiroidismo con defecto de reabsorción tubular del calcio por mutación activadora del receptor sensible al calcio. Se suele observar fácilmente en el periodo neonatal, con una hipercalciuria y una nefrocalcinosis asociada a grados variables de hipocalcemia.
7. Se han descrito casos de nefrocalcinosis por hipercalciuria en otras enfermedades hereditarias, entre ellas: cistinosis, enfermedad de Wilson y glucogenosis de tipo 1.
Otras hipercalciurias normocalcémicas
Son el resultado de una reabsorción ósea y/o hiperabsorción intestinal. Se trata de situaciones poco comunes: hipervitaminosis D, aporte alimentario excesivo de calcio (productos lácteos), aportes inapropiados de calcio o de fosfato en nutrición parenteral, corticoterapia, inmovilización, osteogénesis imperfecta, enfermedades inflamatorias y síndrome de Wiedmann-Beckwith.
Una de las causas principales de nefrocalcinosis del lactante es la hipercalciuria debida al uso de furosemida, teofilina y/o corticoides en el prematuro y en el recién nacido con insuficiencia cardiaca(8). Sin embargo, incluso sin estos tratamientos, existe en los grandes prematuros (menos de 1.500 g) una alta incidencia de nefrocalcinosis (del 10 al 60% en función de las series), en cuyo origen destaca la misma prematuridad por la inmadurez tubular y factores nutricionales debidos a la alimentación artificial de estos bebés(9).
En la actualidad, la corticoterapia prolongada en el niño mayor es raramente una causa, así como la sobredosis de vitamina D administrada a título preventivo en el niño sano o a título curativo en enfermedades como la hipofosfatasia, el raquitismo hipofosfatémico ligado al X y la hipocalcemia-hipercalciuria dominante debida a la mutación activadora del receptor sensible al calcio (CaSR)(10).
Hipercalciuria idiopática
La “hipercalciuria idiopática” es una anomalía metabólica de origen genético o familiar, que puede heredarse de modo autosómico dominante, caracterizada por una excesiva eliminación urinaria de calcio en ausencia de hipercalcemia o de otras causas conocidas de hipercalciuria. Este defecto está presente hasta en el 5-10% de la población general, y más frecuentemente en sujetos con litiasis cálcica o población adulta con osteoporosis. Hallazgos obtenidos de trastornos monogénicos caracterizados por cálculos cálcicos y/o hipercalciuria y/o nefrocalcinosis han permitido identificar un número de genes candidatos a participar en la patogénesis de la hipercalciuria idiopática como, por ejemplo: adenilato ciclasa soluble, receptor sensor de calcio, receptor de vitamina D y alfa 1-hidroxilasa, co-transportador 2 sodio-fosfato, claudina 16, canal de cloro-5, etc. Los hallazgos genéticos no apoyan la idea de la existencia de diferentes subtipos de hipercalciuria idiopática clásicos, definidos como: absortivos, renales y resortivos. Al contrario, sugieren que la hipercalciuria idiopática es un único trastorno caracterizado por alteraciones en el transporte de calcio a nivel intestinal, renal y del hueso, debido a diferentes combinaciones de múltiples factores genéticos y dietéticos(11).
Diagnóstico
La determinación en una muestra doble de orina que incluya la primera orina de la mañana y una muestra de orina post-prandial, puede dar suficiente información para identificar una hipercalciuria desde atención primaria. Si únicamente se dispone de muestras aleatorias, sería deseable recoger una muestra recogida tras 2-4 horas de una ingesta láctea. En dicha muestra si la relación Ca/Cr (mg/mg) es menor de 0,2, no sería necesaria una reevaluación de la hipercalciuria. De forma general, los test de sobrecarga de calcio no se recomiendan en la evaluación rutinaria de los niños con hipercalciuria.
El diagnóstico se establece ante una hipercalciuria aislada, en la que se han eliminado posibles causas secundarias, y en la que suelen existir antecedentes familiares de litiasis o nefrocalcinosis. Esta anomalía casi siempre es asintomática en la infancia, hasta su descubrimiento en la edad adulta por la litiasis. Con el tiempo, se observa a menudo una disminución de la densidad ósea, sobre todo cuando está asociada una hipocitraturia(7). Esta forma de hipercalciuria “idiopática” es la causa más frecuente de litiasis renal, tanto en la edad pediátrica como en la adulta, encontrándose en algunas series hasta en el 40% de los niños y en el 60% de los adultos con litiasis(1). Clásicamente, fue considerada una causa mayor de nefrocalcinosis en el niño, representando hasta un tercio de las causas, sin embargo, el descubrimiento de algunas tubulopatías hereditarias, actualmente bien identificadas, ha reducido el número de las hipercalciurias inexplicadas. Por lo tanto, este diagnóstico sólo puede establecerse tras una exploración tubular minuciosa. El conocimiento, cada vez más preciso, de los numerosos genes implicados en el metabolismo del calcio y de la vitamina D permite, de esta forma, desarticular progresivamente la entidad de “hipercalciuria idiopática”, cuyo carácter familiar es bien conocido.
Mecanismo fisiopatológico
La hipótesis más aceptada actualmente es la formulada por Weissinger, que ha postulado una teoría patogénica basada en los hallazgos de varios autores y en los suyos propios, en los que se ha observado un incremento de la actividad de interleucina-1a (IL-1) y de otras citocinas de origen monocitario que incrementarían la actividad osteoclástica, causante de la pérdida de masa ósea observada en estos pacientes(11). La IL-1 estimularía la producción de prostaglandina E2 y ésta, de forma secundaria, el aumento de la producción de calcitriol. La hipercalciuria sería, pues, de origen óseo (resortivo) e intestinal (incremento de la absorción intestinal de calcio). Queda por saber cuáles son las causas que estimulan la producción de citocinas. A pesar de ser un trastorno tan frecuente, aún no se ha descrito ninguna mutación genética responsable única de la hipercalciuria idiopática(12,13).
Manifestaciones clínicas
Referidos a las formas de hipercalciuria aislada o idiopática, la mayor parte de los casos son asintomáticos. En enfermedades en las que la hipercalciuria está presente junto a otras alteraciones, la clínica es variable dependiendo de la enfermedad primaria. Por su frecuencia, la litiasis es la manifestación más relevante, observándose hipercalciuria en un 30-80% de casos según las series.
Otras manifestaciones que pueden presentar los niños, y que permiten sospechar algunas formas de hipercalciuria idiopática, son la presencia de: disuria, polaquiuria, incontinencia urinaria, hematuria macro o microscópica o dolor abdominal recidivante. La hipercalciuria puede aparecer en niños con enuresis nocturna o asociado a infección urinaria recurrente. En ocasiones, sólo se advierte que el niño emite orinas turbias por la presencia de cristales, especialmente, en la primera orina del día. Se cree que los síntomas de la enfermedad se deben a la irritación tisular por la formación de microcristales, aunque se desconoce el mecanismo exacto por el que la hipercalciuria da lugar a hematuria o disuria(14).
Durante los últimos años, se ha evidenciado relación entre hipercalciuria, talla baja y disminución de la densidad mineral ósea(15) y, de forma excepcional, ha sido referido como primer síntoma la aparición de fracturas óseas ante traumatismos de poca intensidad.
Nefrolitiasis
La enfermedad litiásica renal o nefrolitiasis afecta al 3-5% de la población y, a menudo, se asocia a hipercalciuria. La nefrolitiasis hipercalciúrica es una enfermedad familiar que se presenta hasta en el 35% de los pacientes con litiasis, y puede ocurrir como un trastorno monogénico de presentación durante la infancia. Cuando la hipercalciuria predomina, se suele expresar en forma de oxalato de calcio o de fosfato de calcio.
La presencia de cálculos urinarios es una situación poco habitual en la edad pediátrica, pero que condiciona una serie de dilemas clínicos. Especialmente en los más jóvenes, se plantea el dilema de si existe una condición metabólica subyacente, o si existe la posibilidad de que el niño desarrolle, a lo largo de su vida, episodios recurrentes de cólicos nefríticos.
La presentación clínica de dolor cólico agudo es poco habitual en los niños y la sintomatología varía en función de la edad de los niños. Únicamente, la mitad de los niños con urolitiasis manifiestan dolor abdominal, en flancos o pélvico(16,17). En los más pequeños, el dolor puede simular un cólico de lactante. La hematuria, tanto micro como macroscópica, se describe en el 33-90% de los niños con cálculos(16). La hematuria puede preceder a la formación de cálculos en niños con hipercalciuria y ocasionalmente, con hiperoxaluria o hiperuricosuria(18). La urolitiasis puede complicarse con infecciones urinarias, especialmente en los más pequeños, aunque también puede observarse una piuria estéril. Los cálculos en vejiga o uretra con frecuencia se manifiestan con disuria y polaquiuria.
Cuando es posible analizar la composición del cálculo, es posible identificar el origen metabólico que causa la formación de la litiasis. En la edad pediátrica, los cálculos de oxalato de calcio suponen del 46 al 64%, seguidos de los cálculos de fosfato cálcico (14-30%)(16).
Nefrocalcinosis
La nefrocalcinosis se define como la presencia de depósitos de sales de calcio en el parénquima renal, en oposición a la litiasis renal, donde las calcificaciones se sitúan en las vías urinarias. Su frecuencia en el niño, que parecía baja cuando el diagnóstico se basaba en la radiografía de abdomen o en el estudio histológico del riñón, es más importante desde que la ecografía permite su detección precoz, principalmente en los prematuros, en los cuales no es raro detectar una nefrocalcinosis(9).
La nefrocalcinosis no es una enfermedad, sino un síntoma cuyas etiologías son múltiples, pero implican casi todas un trastorno metabólico, a menudo de origen genético o iatrogénico, que aumenta la excreción urinaria del calcio o del oxalato(9,19).
El diagnóstico etiológico está orientado por la edad del niño, el contexto clínico, el aspecto y la localización de las calcificaciones y, sobre todo, por las determinaciones biológicas (al menos un ionograma sanguíneo con determinación de bicarbonato, calcemia, fosfatemia, magnesemia, niveles de 25 OH D3 y 1,25-(OH)2 D3, calciuria y nivel de parathormona, PTH, en caso de hipercalcemia y oxaluria en caso de que la calcemia y la calciuria sean normales) (Fig. 2). En la mayoría de los casos, existe una hipercalciuria, secundaria o no a una hipercalcemia. Más raramente, se trata de depósitos de oxalato de calcio o de la calcificación de lesiones histológicas.
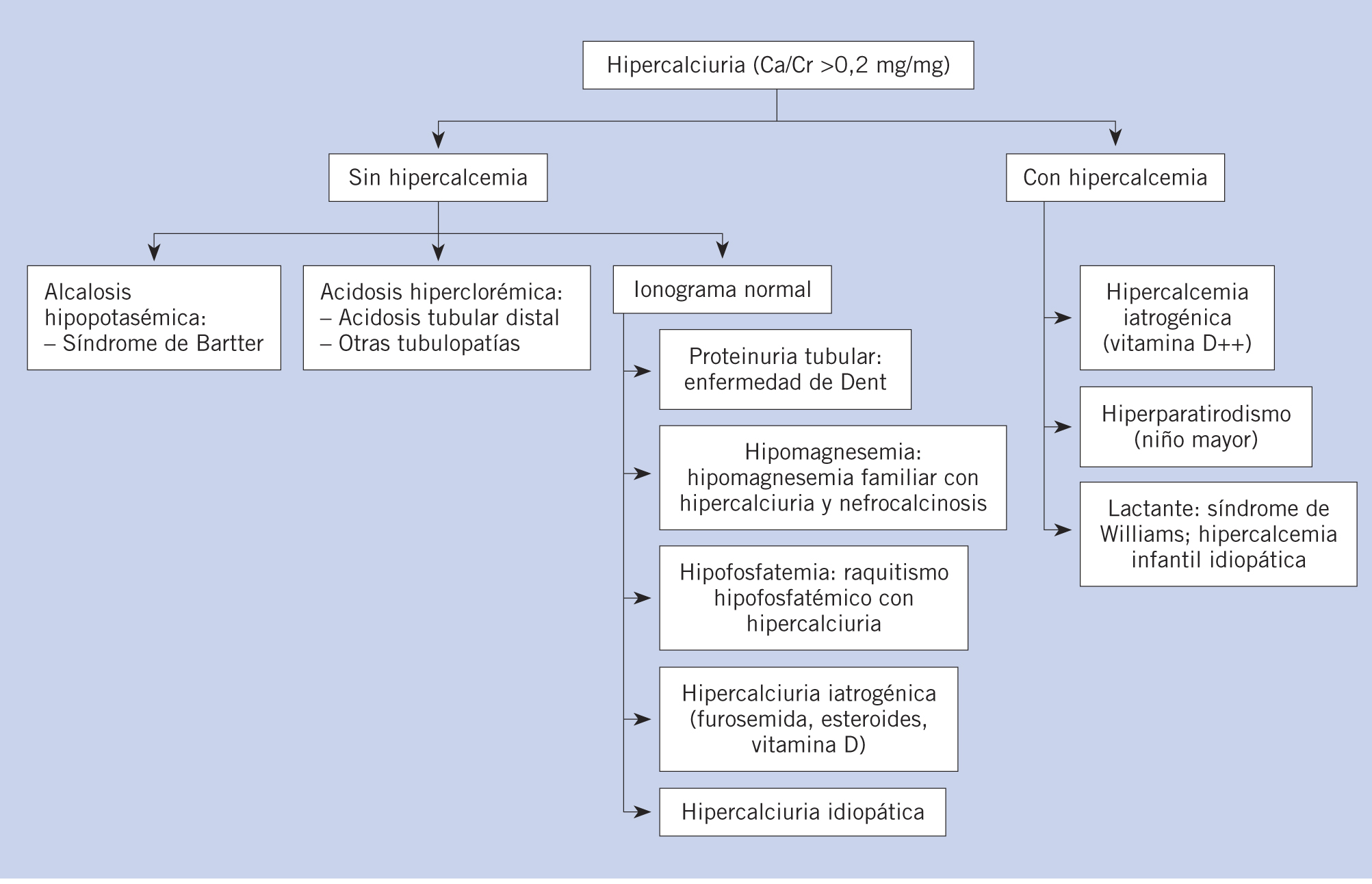
Figura 2. Árbol de decisiones. Conducta práctica ante una hipercalciuria.
La nefrocalcinosis, por sí misma, no suele provocar ningún síntoma clínico antes de llegar a un estadio muy avanzado, que es cuando repercute en la función renal. Casi siempre suele detectarse en una prueba de imagen motivada por los síntomas de una litiasis asociada, o de la enfermedad causal (dolor abdominal, infección urinaria, poliuria, retraso del crecimiento, etc.) o por la existencia de un riesgo conocido (grandes prematuros, ciertas tubulopatías, como el síndrome de Bartter). Los únicos síntomas que pueden imputarse directamente a la nefrocalcinosis son la hematuria, micro o macroscópica, la leucocituria estéril y la alteración de la concentración de la orina.
El diagnóstico suele establecerse cuando las calcificaciones son suficientemente grandes como para ser detectadas en las pruebas de imagen renal. La ecografía renal es la prueba de elección para detectar una nefrocalcinosis. Los depósitos cálcicos se manifiestan como zonas de hiperecogenicidad en el parénquima renal. En función de la localización, se distinguen las nefrocalcinosis medulares, las más frecuentes, en las que existen tres grados según la intensidad, y las nefrocalcinosis corticales o difusas(8,11).
Sin embargo, la hiperecogenicidad no es sinónimo de calcificación (salvo si se acompaña de un cono de sombra acústica) y se deben descartar algunas otras causas de hiperecogenicidad: microquistes de la poliquistosis recesiva, granulomas infecciosos, principalmente por Candida, precipitación intratubular de hematíes en la drepanocitosis (sobre todo, heterocigótica), de uratos en las hiperuricemias congénitas, o de proteína de Tamm-Horsfall en el recién nacido(11). Por otro lado, no hay que olvidar que la ecogenicidad cortical está fisiológicamente aumentada en el recién nacido, lo que puede requerir repetir la prueba al cabo de algunas semanas en caso de duda.
El diagnóstico de nefrocalcinosis debe igualmente confirmarse, primero con una radiografía simple de abdomen. Las calcificaciones pueden ser evidentes o, por el contrario, difícilmente visibles, en función de su tamaño. Son de aspecto variable (en forma de finas semillas, de red, de granos de mijo, grandes bloques opacos), en función de su etiología (Fig. 1). La tomografía computarizada es más sensible y permite detectar calcificaciones no visibles en la radiografía y sus localizaciones precisas, pero su coste y el riesgo ligado a la radiación no permiten su uso como prueba de detección. La resonancia magnética no está indicada en materia de calcificaciones.
Diagnóstico
Anamnesis e historia clínica
Mediante una adecuada historia dietética, debe investigarse la posible existencia de una ingesta excesiva de calcio, proteínas y sodio y, desde el punto de vista clínico, la presencia de dolores óseos o antecedentes de fracturas frecuentes, o las manifestaciones urinarias antes referidas (orinas turbias, disuria, polaquiuria, incontinencia, hematuria, dolores abdominales recidivantes, etc.). Deben recogerse, además, antecedentes familiares de hipercalciuria, de litiasis renal o de consanguinidad y, en la exploración física, considerar una talla ligeramente baja.
Según se recoge en el algoritmo diagnóstico (Figs. 2 y 3), la mayoría de las causas que se identifican como causa de hipercalciuria, y que deben descartarse en todos los casos, son las tubulopatías, alteraciones monogénicas poco frecuentes, en las que suelen existir antecedentes familiares o consanguinidad, fenotipo anómalo, importante retraso de crecimiento, a veces de inicio prenatal, raquitismo, alteraciones hidroelectrolíticas y/o del equilibrio ácido-base, disfunción renal, proteinuria y escasa respuesta al tratamiento (Tabla IV).
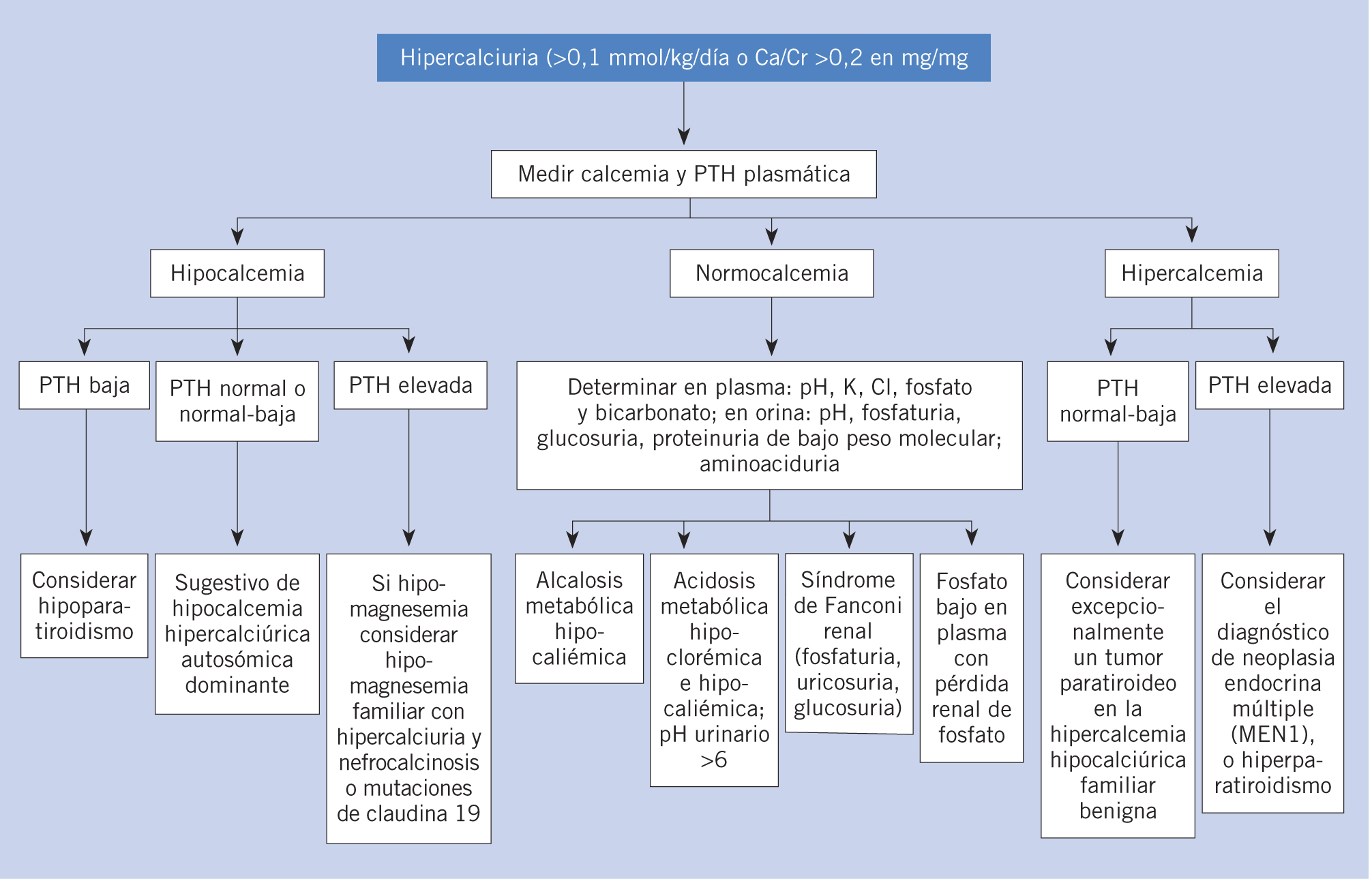
Figura 3. Algoritmo para el estudio de un niño con hipercalciuria y nefrolitiasis/nefrocalcinosis, basado en las determinaciones iniciales de calcemia y PTH plasmática.
Análisis de sangre y orina
Las determinaciones básicas en sangre y orina deben estar dirigidas a descartar otras causas de hipercalciuria.
En todos los niños con hipercalciuria deben determinarse, además de la calciuria, la excreción de citrato urinario y las concentraciones séricas de calcio, fósforo, bicarbonato, magnesio y hormona paratiroidea (PTH). Los estudios diagnósticos para detectar una posible hipercalciuria deben ser diferidos si el paciente tiene una infección urinaria; ya que, durante las pielonefritis, está incrementada la excreción urinaria de calcio.
En primer lugar, debe recogerse una muestra aislada de orina y determinar calcio y creatinina para calcular el cociente Ca/Cr (Tabla I). A partir de los 2-3 años de edad, se concede más valor cuando se trata de la 2ª micción de la mañana, en ayunas. Este cociente debe ser tomado como una aproximación, especialmente adecuada para personas de constitución normal, pero infravalora la calciuria en las muy musculadas. En los niños con escasa actividad muscular, como los portadores de distrofias musculares o mielomeningocele, el cociente sobrevalora la calciuria. Desde el punto de vista del desarrollo, en la pubertad, existe una clara tendencia a descender la eliminación urinaria de calcio.
Antes de realizar el diagnóstico de hipercalciuria, debe confirmarse la hipercalciuria en al menos dos muestras de orina. Una vez identificada la hipercalciuria, es muy importante determinar la citraturia; ya que, en ocasiones, está descendida, con lo que se incrementa el riesgo de litiasis y, quizás, de pérdida de masa ósea. Se considera hipocitraturia los valores inferiores a 8 mg/kg/día o un cociente citrato/creatinina inferior a 400 en mg/g en niños, y a 250 mg/g en adultos (Tabla V).
Una forma sencilla de controlar a los pacientes con hipercalciuria idiopática sería determinar el cociente Ca/Cr en la orina de la noche (al acostarse) y, al día siguiente, en la primera orina del día. El cociente calculado en la orina de la noche estudiaría el componente absortivo (intestinal) y el de la primera orina del día estudiaría el componente resortivo (óseo)(20).
Pruebas de acidificación urinaria
En caso de asociarse hipercalciuria e hipocitraturia, debe realizarse una prueba de acidificación con furosemida. Cuando se objetiva un defecto para descender el pH urinario por debajo de 5,5, debe considerarse la posibilidad de que pueda producirse una evolución hacia el desarrollo de una acidosis tubular distal incompleta.
Ecografía renal y de vías urinarias y otros estudios radiológicos
Permite identificar la existencia de litiasis o de microlitiasis (concreciones de menos de 3 mm de diámetro, sin sombra acústica) y de malformaciones asociadas (muchas malformaciones renales se acompañan de hipercalciuria).
Se solicita una radiografía de mano si la talla es baja. En los casos de fracturas, dolores óseos, hipercalciuria asociada a hipocitraturia, defecto de acidificación tras estímulo con furosemida o presencia de un cociente Ca/Cr elevado en la primera orina del día, está indicado solicitar una densitometría ósea(15). En el caso de encontrarse osteopenia, deben determinarse los niveles de PTH y de los marcadores de remodelado óseo. Los marcadores de formación ósea (función osteoblástica) más utilizados son la osteocalcina y la fosfatasa alcalina ósea. Son marcadores de resorción (función osteoclástica), los niveles de fosfatasa ácida-tartratorresistente y la eliminación urinaria de desoxipiridinolina o de la fracción telopeptídica C-terminal del colágeno en orina. En la mayoría de los casos, la pérdida de masa ósea es de origen resortivo, aunque, en raras ocasiones, existe un defecto en la función osteoblástica.
Tratamiento
Siempre que se identifique una hipercalciuria, el tratamiento dietético debe iniciarse desde Atención Primaria. Una adecuada ingesta de líquidos es crítica en la prevención de la sobresaturación de la orina, independientemente de la causa de la hipercalciuria. Además, está recomendada una dieta pobre en sodio, alta en potasio y baja en oxalatos, para reducir la excreción urinaria de calcio.
En los niños con hipercalciuria, debe garantizarse una adecuada ingesta de líquidos para la prevención de la sobresaturación de la orina, independientemente de la causa. Además, debe recomendarse una dieta pobre en sodio, alta en potasio y baja en oxalatos en los niños con hipercalciuria, oxaliuria y litiasis idiopática, debido al conocido efecto calciúrico de una dieta rica en sal. Una dieta aumentada en potasio puede reducir la excreción urinaria de calcio(21).
Si no se trata, la hipercalciuria conduce a nefrolitiasis en aproximadamente el 15% de los casos. En los casos refractarios, junto a la dieta, la administración de diuréticos tiazídicos por vía oral puede normalizar la excreción urinaria de calcio mediante la estimulación de la reabsorción de calcio en el túbulo contorneado proximal y distal. Dicha terapia detiene la hematuria macroscópica y la disuria y evita el desarrollo de nefrolitiasis. Sin embargo, aún no se han establecido de manera precisa las indicaciones del tratamiento con diuréticos tiazídicos en la hipercalciuria idiopática.
Normas dietéticas
La situación de riesgo que supone una hipercalciuria asintomática exige únicamente la instauración de medidas dietéticas protectoras e incremento de la práctica de ejercicio físico, evitando crear conciencia de enfermedad. La dieta debe ajustarse a las recomendaciones diarias para la edad para la ingesta de proteínas. Debe suspenderse el aporte de suplementos de vitamina C y/o vitamina D.
La situación de riesgo que supone una hipercalciuria asintomática exige únicamente la instauración de medidas dietéticas protectoras e incremento de la actividad física, evitando crear conciencia de enfermedad. En las formas no complicadas debe favorecerse el seguimiento desde Atención Primaria. La dieta debe ajustarse a las recomendaciones diarias para la edad respecto a la ingesta de proteínas, calcio y sal. Debe suspenderse el aporte de suplementos de vitamina C y/o vitamina D.
De forma general, las recomendaciones serían las siguientes:
a. Ingesta abundante de agua: 30 ml/kg/día sin exceder de 2 litros. Lo ideal sería conseguir diuresis superiores a 750 ml en lactantes, a 1.000 ml en niños menores de 5 años, a 1.500 ml en niños de 6 a 10 años y superiores a 2 litros en preadolescentes y adolescentes.
b. Evitar el exceso de calcio, adecuando los aportes a las necesidades, favoreciendo el consumo de frutas en vez de postres lácteos. La restricción de calcio no se recomienda por la asociación de la hipercalciuria con osteopenia, pero deben garantizarse las necesidades diarias de ingesta de calcio, sin que deban sobrepasarse, a pesar de los estímulos culturales hacia la ingesta de productos lácteos. La recomendación general es no exceder de 500 ml al día de lácteos.
La mayoría de leches comerciales contienen 120 mg/dl. De estos aportes se absorbe, a nivel intestinal, aproximadamente, el 40%, excepto cuando se trata de leche materna que alcanza el 60%.
c. Dado que la calciuria aumenta al hacerlo la natriuria, y disminuye cuando ésta lo hace o aumenta la kaliuria, está indicada una restricción relativa de sodio y favorecer el consumo de alimentos ricos en potasio. Entre los alimentos de consumo habitual que presentan mejor relación, podemos subrayar: legumbres (habas y alcachofas), verduras y hortalizas (tomates y berenjenas), frutas (plátano, uva, fresón, melón, cerezas, ciruela, níspero, higo y piña) y frutos secos (almendras, cacahuetes, avellanas y castañas). La monitorización de la natriuresis es de utilidad para evaluar el cumplimiento de las recomendaciones dietéticas. Las recomendaciones de ingesta de sal para los menores de 3 años serían de menos de 1,5 g/día, de 4 a 8 años menos de 1,9 g, de 9 a 13 años menos de 2,2 g y de 14 a 18 años menos de 2,3 g.
d. Aporte de citrato en la dieta. Los cítricos (naranja, limón) tienen un alto contenido en citrato, que es el principal inhibidor de la cristalización. En segundo lugar, la excreción urinaria de potasio disminuye la calciuria. Muchas frutas son además ricas en potasio (sandía, melón, naranja, mandarina, uvas, plátano).
e. Restricción del aporte de proteínas animales, ya que éstas incrementan la calciuria al elevar la excreción neta de ácido, al mismo tiempo que aumentan la eliminación de ácido úrico y de oxalato. La alternativa que suponen los cereales integrales y el pescado azul tiene la ventaja de aportar factores protectores de la formación de cálculos.
En la tabla VI, aparece un resumen de las normas dietéticas que puede ser entregado a las familias de los niños afectos(22).
Tratamiento farmacológico
1. En las hipercalciurias sintomáticas importantes o con riesgo de complicaciones, que no respondan a las medidas dietéticas y, más especialmente, en los niños con excreción reducida de citrato, se añade al tratamiento citrato potásico a dosis de 1-1,5 mEq/kg/24 horas. El citrato en la orina forma complejos con el calcio, reduciendo el calcio iónico y la formación de sales de oxalato y de fosfato cálcicos. Un aspecto adicional es que el citrato es una fuente de energía para el riñón y es un componente óseo (supone el 1% de su peso), pudiendo estar especialmente indicado en los niños con osteopenia.
2. En caso de no tolerarse el citrato o de no existir mejoría, se añade hidroclorotiazida: 1,5-2,5 mg/kg en dosis única matutina(23). Las tiazidas estimulan el transporte transcelular de calcio en el túbulo contorneado distal. La dosis se va incrementando hasta conseguir una excreción de calcio en orina de 24 horas menor de 4 mg/kg y la desaparición de las manifestaciones clínicas, si las hubiese. El tratamiento se mantiene un año, tras el cual, en el caso de las hipercalciurias idiopáticas, puede suspenderse, pero deberá reiniciarse en caso de recidiva de la hematuria macroscópica, de la nefrolitiasis o de la disuria.
Hay que tener en cuenta que el tratamiento con diuréticos tiazídicos puede tener efectos secundarios, lo cual obliga a realizar controles periódicos plasmáticos. El más frecuente e importante es la hipopotasemia, que puede evitarse asociando amiloride. Además, pueden favorecer hipomagnesemia, aumento de los niveles plasmáticos de glucosa, urato, colesterol y LDL, y reducir la eliminación urinaria de citrato.
3. En caso de osteopenia severa, se está estudiando el efecto antirresortivo de los bifosfonatos, cuya utilidad ha sido probada en adultos y niños hipercalciúricos con desmineralización ósea y en otras patologías pediátricas(24).
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** Milliner DA. Urolithiasis. En: Avner ED, Harmon WE, Niaudet P, eds. Pediatric Nephrology. 5ª ed. Philadelphia: Lippincott Willians & Wilkins; 2004. p. 1091-111.
2.* Sargent JD, Stukel TA, Kresel J, et al. Normal values for random urinary calcium to creatinine ratios in infancy. J Pediatr. 1993; 123: 393-7.
3.** Kruse K, Kracht U, Kruse U. Reference values for urinary calcium excretion and screening for hypercalciuria in children and adolescents. Eur J Pediatr. 1984; 143: 25-31.
4. Stapleton FB, Noe HN, Jerkins GR, et al. Urinary excretion of calcium following an oral calcium loading test in healthy children. Pediatrics. 1982; 69: 594-7.
5. Theodoropoulos DS, Shawker TH, Heinrichs C, Gahl W. Medullary nephrocalcinosis in nephropathic cystinosis Pediatr Nephrol. 1995; 9: 412-8.
6.* Cochat P, Pichault V, Bacchetta J, Dubourg L, Sabot C, Daudon M, et al. Nephrolithiasis related to inborn metabolic diseases. Pediatr Nephrol. 2010; 25: 415-24.
7. Vargas-Poussou R, Cochat P, Le Pottier N, Roncelin I, Liutkus A, Blanchard A, et al. Report of a family with two different diseases leading to early nephrocalcinosis Pediatr Nephrol. 2008; 23: 149-53.
8. Saarela T, Vaarala A, Lanning P, Koivisto M. Incidence, ultrasonic patterns and resolution of nephrocalcinosis in very low birth weight infants. Acta Paediatr. 1999; 88: 655-60.
9.* Schell-Feith EA, Kist-van-Holthe JE, van der Heijden AJ. Nephrocalcinosis in preterm neonates. Pediatr Nephrol. 2010; 25: 221-30.
10. Auron A, Alon US. Resolution of medullary nephrocalcinosis in children with metabolic bone disorders. Pediatr Nephrol. 2005; 20: 1143-5.
11.** Weisinger JR. New insights into the pathogenesis of idiopathic hypercalciuria: The role of bone. Kidney Int. 1996; 49: 1507-18.
12.*** Vezzoli G, Soldati L, Gambaro G. Update on primary hypercalciuria from a genetic perspective. J Urol. 2008; 179(5): 1676-82.
13.* Stechman MJ, Loh NY, Thakker RV. Genetic causes of hypercalciuric nephrolithiasis. Pediatr Nephrol. 2009; 24(12): 2321-32.
14. Alon U, Warady BA, Hellerstein S. Hypercalciuria in the frequency-dysuria syndrome of childhood. J Pediatr. 1990; 116: 103-5.
15. García-Nieto V, Ferrández C, Monge M, de Sequera M, Rodrigo MD. Bone mineral density in pediatric patients with idiopathic hypercalciuria. Pediatr Nephrol. 1997; 11: 578-83.
16. Milliner DS, Murphy ME. Urolithiasis in Pediatric Patients. Mayo Clin Proc. 1993; 68: 241-8.
17. Stapleton FB, Roy S, Noe HN. Hypercalciuria in children with hematuria. N Engl J Med. 1984; 310: 1345-8.
18. Voghenzi A, Bezzi TM, Luscardi P, et al. Acquired hyperoxaluria and haematuria in children. Pediat Nephrol. 1992; 6: 356-7.
19. Ammenti A, Pelizzoni A, Cecconi M, Molinari PP, Montini G. Nephrocalcinosis in children: a retrospective multi-centre study. Acta Paediatr. 2009; 98: 1628-31.
20. García-Nieto V, Monge Zamorano M, Rodrigo Jiménez MD, Callejón Callejón A, Gaspar Guardado A, García Rodríguez VE. Estudio evolutivo de la densidad mineral ósea en niños diagnosticados de hipercalciuria idiopática. Su relación con la calciuria y con la eliminación urinaria de desoxipiridinolina, determinadas en dos momentos del día. Nefrología. 2004; 24: 610.
21.* Osorio AV, Alon US. The relationship between urinary calcium, sodium and potassium excretion and the role of potassium in treating idiopathic hypercalciuria. Pediatrics. 1997; 100: 675-81.
22.** Fons J, García-Nieto V. Hipercalciuria idiopática. En: Protocolos Diagnóstico Terapéuticos de la AEP: Nefrología Pediátrica. Asociación Española de Pediatría; 2008. p. 182-8.
23.* Srivastava T, Alon US. Pathophysiology of hypercalciuria in children. Pediatr Nephrol. 2007; 22: 1659-73.
24. Barrios E, Hernández González MJ, Rodrigo Jiménez MD, Armas Suárez S, Claverie-Martín F, García-Nieto V. Efectiveness of treatment with bisphosphonates in childhood osteoporosis. Pediatr Nephrol. 2006, 21: 1588.
Bibliografía recomendada
– Milliner DA. Urolithiasis. En: Avner ED, Harmon WE, Niaudet P, eds Pediatric Nephrology. 5ª ed. Philadelphia: Lippincott Willians & Wilkins; 2004. p. 1091-111.
Trabajo clásico de fácil lectura en un texto de referencia en nefrología pediátrica. Desde el problema de la urolitiasis, se acerca a la hipercalciuria como condición metabólica relevante en pediatría. Se recogen todos los aspectos clínicos y terapéuticos relevantes.
– Vezzoli G, Soldati L, Gambaro G. Update on primary hypercalciuria from a genetic perspective. J Urol. 2008; 179(5): 1676-82.
Excelente revisión sobre los recientes hallazgos genéticos en la hipercacluria primaria. Se consideran aspectos patogénicos y su implicación con las posibles complicaciones de esta alteración metabólica asociada a trastornos del transporte del calcio en el intestino, riñón y hueso. Se documenta la elevada prevalencia de esta condición y las posibles manifestaciones en la edad pediátrica.
– Weisinger JR. New insights into the pathogenesis of idiopathic hypercalciuria: The role of bone. Kidney Int. 1996; 49: 1507-18.
Excelente trabajo para los lectores interesados en profundizar en las bases patogénicas de esta alteración. Especial interés en el metabolismo óseo.
– Stechman MJ, Loh NY, Thakker RV. Genetic causes of hypercalciuric nephrolithiasis. Pediatr Nephrol. 2009; 24(12): 2321-32.
Estos autores proponen un algoritmo de utilidad clínica para la investigación de las causas genéticas de nefrolitiasis a partir del hallazgo de una hipercalciuria.
– Kruse K, Kracht U, Kruse U. Reference values for urinary calcium excretion and screening for hypercalciuria in children and adolescents. Eur J Pediatr. 1984; 143: 25-31.
Trabajo clásico sobre valores de referencia útiles en pediatría y aplicables en múltiples estudios posteriores. Este trabajo dimensiona la magnitud de la hipercalciuria y la utilidad del cribado de esta condición.
– Fons J, García-Nieto V. Hipercalciuria idiopática. En: Protocolos Diagnóstico Terapéuticos de la AEP: Nefrología Pediátrica. Asociación Española de Pediatría 2008. p. 182-8.
Práctica publicación sobre el manejo clínico en Atención Primaria de las hipercalciurias idiopáticas, con especial hincapié en las recomendaciones dietéticas. Los autores tienen una amplia experiencia en las complicaciones de esta entidad y en la necesidad de realizar un abordaje dietético precoz asumible por el paciente.
| Caso clínico. |
|
Niña de 5 años de edad que consulta por disuria asociada a microhematuria. El cuadro clínico se inició un mes antes, con leves molestias urinarias y sin otros síntomas asociados. En el primer examen de orina realizado, en la tira de orina se detectó la presencia de microhematuria sin otras alteraciones, siendo el urocultivo negativo. En la entrevista clínica dirigida, la niña se queja únicamente de discreto dolor para orinar y en la exploración física no se detectan alteraciones significativas, con ausencia de edemas y peso, talla y tensiones arteriales normales para su edad. La familia niega la presencia de fiebre asociada al episodio, polaquiuria, hematuria, dolor lumbar o abdominal, y tampoco refieren historia de traumatismo ni episodios similares previos. Entre los antecedentes familiares, destaca una historia de litiasis en línea paterna (padre y abuelo). No se recogen otros antecedentes de interés. Ante la presencia de microhematuria, se solicita un sedimento urinario con estudio de la morfología de hematíes y una ecografía renal. En el sedimento urinario se detecta la presencia de hematuria microscópica (40.000 hematíes/mm3), sin proteinuria, dimorfismo de los hematíes ni otras alteraciones. Los estudios ecográficos de las vías urinarias son normales. Se solicita calcio (Ca) y creatinina (Cr) en una muestra aislada de orina para el cálculo de la relación Ca/Cr. La determinación en la primera muestra de orina, obtenida en ayunas, demuestra una relación de 0,24 mg/mg (valores normales <0,2), y en una segunda, postprandial, de 0,32. Se recoge orina de 24 horas para la estimación de la calciuria, que muestra un valor de 5,6 mg/kg/24 h (normal <4 mg/kg/24 horas), lo que confirma el diagnóstico de hipercalciuria. Otros exámenes realizados en sangre fueron los siguientes: gasometría (normal); urea, creatinina y ácido úrico (normales), electrolitos, incluyendo Na, K, Ca, P, Mg (normales); y PTH, normal. En orina, se solicita pH (6,5), natriuresis (200 mEq/L), oxaluria (normal), citraturia (disminuida) y uricosuria (elevada). Con el diagnóstico de hipercalciuria asociada a uricosuria se orienta a la familia acerca de la necesidad de aumentar la ingesta hídrica, restringir la ingesta de sodio en la dieta y ajustar la ingesta de lácteos a las recomendaciones para su edad. Durante el seguimiento, se monitoriza la natriuresis para evaluar la adherencia a las recomendaciones en relación a la ingesta de sodio. El primer control de sodio en orina fue de 189 mEq/L y el siguiente de 80 mEq/L. Se programa seguimiento ambulatorio con ecografía renal cada 12 meses y controles clínicos semestrales, incluyendo calciuria y natriuria. |
 |
| Regreso a las bases |
L.M. Rodríguez Fernández
Jefe de Sección. Unidad de Nefrología Pediátrica. Servicio de Pediatría. Complejo Asistencial Universitario de León (CAULE)
Pediatr Integral 2013; XVII(6): 433-440
Introducción
El riñón es un órgano par situado en la parte alta de la región retroperitoneal, a ambos lados de los grandes vasos paravertebrales a los que se une por su pedículo vascular, y provisto de un conducto excretor, el uréter, que desemboca en la vejiga urinaria. Está formado por una serie de estructuras vasculares y epiteliales que funcionan en relación estrecha y que lo convierten en el órgano primordial del sistema urinario. Este sistema es el encargado de formar la orina y de eliminarla del cuerpo. La secreción de orina y su eliminación son cometidos vitales, pues constituyen en conjunto uno de los mecanismos básicos de la homeostasis del medio interno; hasta el punto de que, como se ha dicho, la composición de la sangre y del medio interno está regida, no por lo que se ingiere, sino por lo que los riñones conservan.
Además de desempeñar este papel esencial, el riñón tiene la capacidad de producir hormonas y autacoides (sustancias que actúan en el lugar en el que se producen), como la eritropoyetina, la renina o las prostaglandinas, que tienen gran influencia sobre el control de la tensión arterial, el metabolismo óseo o la formación de glóbulos rojos, y que lo convierten también en un órgano endocrino.
Las funciones que realiza el riñón son posibles gracias a su morfología. Para alcanzar una comprensión elemental de la fisiología renal, es indispensable disponer de un conocimiento suficiente de las estructuras en las que tienen lugar los distintos procesos en los que participa este órgano.
Morfología renal
Anatomía macroscópica(1)
Dimensiones, forma y localización
Los riñones tienen característicamente forma de habichuela y en la edad adulta llegan a pesar una media de 140 a 150 g y a medir longitudinalmente un promedio de 11,5 cm. En general, el riñón izquierdo es algo más voluminoso que el derecho. Durante la infancia van aumentando de tamaño; de forma que, en los niños, su longitud se correlaciona muy directamente con la talla. En las figuras 1 y 2, procedentes del estudio de Gavela y cols., se presentan los valores que va adquiriendo la longitud de cada uno de los riñones en relación con la talla de los niños(2).
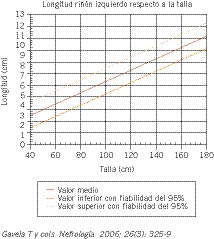
Figura 1. Valor normal del tamaño del riñón izquierdo según la talla.
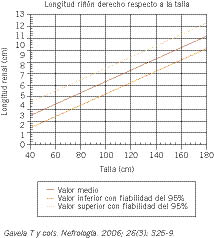
Figura 2. Valor normal del tamaño del riñón derecho según la talla.
Los riñones están situados detrás del peritoneo parietal contra la pared posterior del abdomen, un poco por fuera de las apófisis transversas de la 11ª y 12ª vértebras dorsales y las dos primeras vértebras lumbares, dentro de una celda celuloadiposa cerrada, limitada por una fascia perirrenal de tejido conectivo, que los fija a las estructuras adyacentes y ayuda a que conserven su situación normal, con el eje mayor algo inclinado hacia fuera. Por el lugar que ocupa el hígado, el riñón derecho se ve desplazado un poco más abajo que el izquierdo.
Estructura externa(1,3)
Cada riñón está rodeado por una cápsula resistente de tejido fibroso blanquecino que se interrumpe a nivel del hilio renal, una concavidad situada en su borde interno, por la que penetran en el riñón el uréter y los vasos sanguíneos.
Aunque hay un gran número de variaciones individuales en la vascularización renal, cada riñón está irrigado por una arteria renal que se origina de la aorta y que, poco antes de llegar al hilio, se bifurca en sus ramas anterior y posterior. Las venas renales se sitúan por delante de las arterias y desembocan en la vena cava inferior.
Estructura interna(1,3)
Al practicar la hemisección de los riñones a lo largo de su eje mayor, es posible observar que están formados por dos tipos de sustancia: la capa externa granulosa, corteza, y la porción interna o central de aspecto estriado, médula (Fig. 3). Esta última queda dividida en una docena o más de cuñas triangulares, las pirámides renales de Malpighi. La base de estas pirámides está orientada hacia la corteza y su vértice, orientado hacia el seno renal, forma unas eminencias redondeadas que protruyen en los cálices, denominadas papilas renales. La corteza se prolonga entre dos pirámides adyacentes, en formaciones que se llaman columnas renales de Bertin.
Figura 3. Aspecto macroscópico del corte frontal de un riñón.
El seno renal es una cavidad cuya abertura coincide con el hilio renal y cuyas paredes están constituidas por el parénquima renal. Contiene, en un tejido celuloadiposo, las ramificaciones de los vasos, los nervios y los primeros segmentos del aparato excretor urinario: los cálices y la pelvis renal.
Anatomía microscópica
La nefrona es la unidad estructural y funcional del riñón y comprende un elemento filtrante (corpúsculo renal de Malpighi) y un túbulo renal (Fig. 4). Se estima que cada riñón de un sujeto adulto sano contiene un millón de nefronas.
Figura 4. Descripción esquemática de la nefrona (las flechas en el interior de los túbulos indican la dirección del flujo).
Corpúsculo renal(1,3)
El corpúsculo renal de Malpighi está compuesto por el glomérulo capilar y la cápsula de Bowman que lo recubre (Fig. 5). Existe un espacio dentro de la cápsula, espacio de Bowman, hacia donde pasa el líquido filtrado procedente del glomérulo. La barrera de filtración del corpúsculo renal o membrana glomerular consta de tres capas: el endotelio de los capilares glomerulares, la membrana basal y una capa de células epiteliales especializadas con fenestraciones. Las células mesangiales se sitúan en la parte central del glomérulo entre las asas capilares, a veces penetrando en ellas de forma que conectan íntimamente con la célula endotelial. Estas células tienen función contráctil, gracias a los filamentos de actina y miosina, que les permiten regular el coeficiente de ultrafiltración en respuesta a distintos agonistas. Además, tienen capacidad fagocítica y pueden sintetizar y degradar la matriz extracelular. Intervienen también en la síntesis de determinados autacoides y factores de crecimiento que pueden actuar de forma autocrina y paracrina.
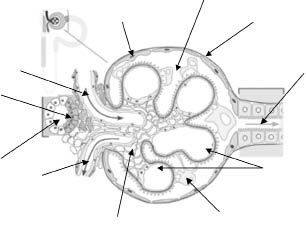
Figura 5. Esquema de un corpúsculo renal.
Túbulos renales(1,3)
El túbulo renal comienza con el túbulo próximal que inicialmente forma varias espiras (porción convoluta del túbulo proximal o túbulo contorneado proximal), seguida de una porción recta. El siguiente segmento es la rama delgada descendente del asa de Henle, que posee una morfología en horquilla, comenzando en su final con un ascenso paralelo a la rama descendente. En las asas largas, la primera porción de la zona ascendente permanece delgada, denominándose rama delgada ascendente del asa de Henle. Más allá de esta región, las asas largas se ensanchan en la rama ascendente gruesa del asa de Henle, en cuya parte final existe una zona engrosada denominada mácula densa, en la que el túbulo transcurre entre las arteriolas que irrigan su propio glomérulo. Tras ella comienza la parte convoluta del túbulo distal o túbulo contorneado distal que, a través de los conductos conectores, llega a los tubos colectores corticales que entran en la médula, convirtiéndose en tubos colectores medulares externos e internos. Estos últimos se unen a otros y todos los de una pirámide renal convergen para formar una estructura que desemboca en la papila renal en uno de los cálices menores.
Aparato yuxtaglomerular(1,3)
Está situado entre la primera porción del túbulo contorneado distal y las arteriolas aferente y eferente, pertenecientes al corpúsculo renal de su propia nefrona (Fig. 5). Lo componen tres tipos de células: las células yuxtaglomerulares, que son células mioepiteliales que rodean el final de la arteriola aferente, ricas en gránulos de secreción y que secretan el 90% de la renina; las células de la mácula densa, un tipo de células epiteliales diferenciadas de la pared del túbulo recto distal ascendente que en esta zona de contacto con el glomérulo, se vuelven más altas y estrechas, controlan la secreción de renina y la velocidad de filtración glomerular, y las células de Goormaghtigh o del lacis, que son células mesangiales extraglomerulares que responden a múltiples mediadores y controlan la superficie de filtrado.
El corpúsculo renal y los túbulos contorneados se encuentran en la corteza renal; en cambio, el asa de Henle y la mayor parte de los túbulos colectores se sitúan en la médula renal.
Ultraestructura de la barrera de filtración glomerular
La barrera de filtración glomerular es una barrera molecular situada entre la sangre y el espacio urinario capaz de evitar el paso, a su través, de la mayoría de las proteínas plasmáticas, pero que permite el paso del agua, de pequeñas moléculas de soluto y de iones. Está formada por tres capas: el endotelio vascular fenestrado, la membrana basal glomerular y la hendidura del poro y la zona que queda entre los pedicelos de los podocitos (Fig. 6).
Figura 6. Esquema de la barrera de filtración glomerular.
Endotelio vascular(1,3,4)
Está constituido por células de citoplasma aplanado, perforadas por poros o fenestraciones de 70-100 nm de diámetro, cuya superficie está cargada negativamente por la presencia de una proteína polianiónica, la podocalixina. La aglomeración de moléculas superficiales aniónicas y fenestraciones hace que el endotelio glomerular se diferencie de otras membranas plasmáticas endoteliales y permita el paso de moléculas de bajo peso molecular; aunque, no es muy eficiente para impedir el paso de macromoléculas.
Membrana basal glomerular(1,3)
La membrana basal glomerular impide el paso de macromoléculas en forma mecánica y eléctrica. Su integridad estructural es clave para el mantenimiento de la función de permeabilidad de la barrera al agua, pequeños solutos, iones y proteínas menores de 70 KDa. Está compuesta por dos capas finas, la lámina rara interna y la lámina rara externa, y una capa central gruesa, la lámina densa. Las células endoteliales y epiteliales adyacentes secretan moléculas tales como colágeno tipo IV, laminina, fibronectina y proteoglicanos de heparán sulfato, dando lugar a una estructura semejante a un enrejado.
Podocito y poro de filtración glomerular(1,3)
El tercer elemento de la barrera de filtración glomerular lo constituyen las células epiteliales viscerales o podocitos, encargados de sintetizar la membrana basal glomerular y formar los poros de filtración. Los podocitos son células muy diferenciadas que expresan una serie de proteínas específicas, indispensables para el mantenimiento de la compleja estructura de la barrera de filtración con los procesos pedicelares interdigitados (pedicelos) y los diafragmas de hendidura, pequeñas hendiduras cubiertas por una película proteica.
La superficie del podocito podría ser dividida, sin entrar en demasiado detalle, en tres dominios con diferentes localizaciones, componentes proteicos y funciones. En cada dominio existen proteínas, que son fundamentales para el mantenimiento y estabilidad global de la arquitectura del podocito. En el dominio apical encontramos podocalixina, ezrina y el complejo NHERF-2, que cubren la superficie del podocito. En el dominio del diafragma de filtración se encuentra la principal responsable de la de selectividad del diafragma, la nefrina. A este nivel, también encontramos P-cadherina, neph-1, podocina, filtrina, etc. El dominio basal o de anclaje es el encargado de fijar al pedicelo a la membrana basal glomerular, y en él encontramos el complejo distroglicano, el complejo integrina a3 b1 y la megalina(4).
Función renal
La función básica del riñón es la formación de orina para su eliminación a través del sistema excretor urinario. Dos procesos distintos determinan esta formación: la filtración de líquido a través de los capilares glomerulares hacia el espacio de Bowman y la modificación del volumen y de la composición del filtrado glomerular en los túbulos renales.
Filtrado glomerular(5,6)
El líquido pasa de los capilares glomerulares a la cápsula de Bowman por la existencia de un gradiente de presión entre estas dos áreas. Este proceso está favorecido por dos características estructurales que convierten los corpúsculos renales en membranas de filtración especialmente eficaces: los capilares glomerulares tienen un número de poros mucho mayor que otros capilares y la arteriola eferente tiene un diámetro menor que la aferente, provocando una mayor resistencia a la salida del flujo sanguíneo del glomérulo y aumentando la presión hidrostática glomerular. En condiciones normales se producen 120 ml/minuto o 180 l/día de filtrado. La tasa de filtración glomerular está determinada, además de por la diferencia de presión en el capilar glomerular, por el flujo plasmático renal y por el coeficiente de ultrafiltración glomerular, dependiente del área de filtración y de la permeabilidad de la membrana a través de la que ésta se produce.
Presión efectiva de filtración
La presión efectiva de filtración (PEF) es el resultado de la interacción de presiones a través de la membrana capilar glomerular, de acuerdo con la siguiente ecuación: PEF = (Presión hidrostática glomerular + Presión osmótica capsular) – (Presión osmótica glomerular + Presión hidrostática capsular).
La presión hidrostática glomerular es la fuerza impulsora fundamental del filtrado y tiende a expulsar líquido de los glomérulos; mientras que, la presión hidrostática capsular y la presión coloidosmótica sanguínea actúan en dirección opuesta. En sujetos sanos, la presión oncótica en la cápsula de Bowman debe ser cero, porque el filtrado glomerular no contiene proteínas. La presión hidrostática glomerular guarda cierta relación con la tensión arterial sistémica. La pérdida urinaria de proteínas aumenta inicialmente la tasa de filtrado glomerular al descender la presión osmótica sanguínea y aumentar la presión osmótica capsular.
Flujo plasmático renal
El flujo a través de un órgano depende de la presión de perfusión y de la resistencia al paso del mismo. Así, cambios en la presión producirían cambios en el mismo sentido en el flujo sanguíneo renal. Sin embargo, esto está modulado por la existencia de un sistema de autorregulación intrínsecamente renal que se produce incluso en ausencia de estímulos nerviosos u hormonales y que mantiene constante el flujo plasmático renal dentro de un rango de tensión arterial mediante modificaciones en la resistencia al flujo. El lugar principal donde se ejerce esta autorregulación es la arteriola aferente a través de dos mecanismos:
• Mecanismo miogénico: el estiramiento de la pared vascular, causado por aumento de presión, provoca contracción de su músculo liso e incremento de la resistencia al flujo.
• Retroacción tubuloglomerular: mantiene constante el flujo plasmático renal mediante modificación primaria de la tasa de filtración glomerular; de forma que, cuando existe un aumento de la tensión arterial, se produce inicialmente un aumento del flujo plasmático renal y se elevan la tasa de filtración glomerular, la velocidad del flujo y la oferta de sodio a través del túbulo. La mácula densa detecta estos cambios, desencadenando la producción de sustancias vasoconstrictoras (adenosina, ATP…) que actúan sobre la arteriola aferente disminuyendo el flujo plasmático renal al nivel basal. Sucede lo contrario en las situaciones de hipotensión.
El objetivo básico de la autorregulación renal es mantener un adecuado balance de líquido y sodio en el organismo, así como la preservación de la estructura glomerular.
Coeficiente de ultrafiltración glomerular
Finalmente, la tasa de filtración glomerular depende del coeficiente de ultrafiltación glomerular, que se expresa como el producto de la constante de permeabilidad hidráulica de la pared glomerular por la superficie disponible para la filtración. La permeabilidad de la membrana puede verse afectada en diferentes patologías glomerulares y el área de filtración puede sufrir modificaciones por contracción mesangial o en respuesta a sustancias vasoactivas, cuyo efecto permite al glomérulo modificar la superficie de filtración, tanto en condiciones normales como patológicas.
La función renal en el feto se caracteriza por una baja tasa de filtración glomerular determinada por una tensión arterial y un flujo plasmático renal bajos, un área de filtración menor y unas elevadas resistencias vasculares renales. Sin embargo, tras el nacimiento la función renal aumenta debido al ascenso de la tensión arterial y al importante descenso de las resistencias vasculares renales (Tabla I)(7).
Función tubular renal(5,8)
El ultrafiltrado glomerular es modificado en los túbulos renales por dos procesos: la reabsorción y la secreción tubulares.
• Reabsorción tubular: recuperación de solutos y de la mayor parte del agua filtrada en los glomérulos desde el fluido tubular hacia la sangre de los capilares peritubulares.
• Secreción tubular: adición de solutos al fluido tubular desde la sangre de los capilares peritubulares o desde las células tubulares.
El complejo equilibrio entre estos dos procesos, en ocasiones regulado por influjo hormonal y que se revisará a continuación someramente, posibilita la formación de orina con unas características determinadas y mantiene estable la composición del medio interno. De esta forma, entre el 97 y el 99% del agua y una parte importante de los solutos filtrados en el glomérulo volverán a la sangre y no formarán parte de la orina.
Manejo renal de sodio, cloro y agua
• En el túbulo proximal se produce reabsorción del sodio (Na+) filtrado, acompañado de un anión para mantener la electroneutralidad (75% Cl- y 25% HCO3-); también, se reabsorbe buena parte del agua filtrada gracias a la fuerza osmótica generada por la absorción de Na+ (Fig. 7).
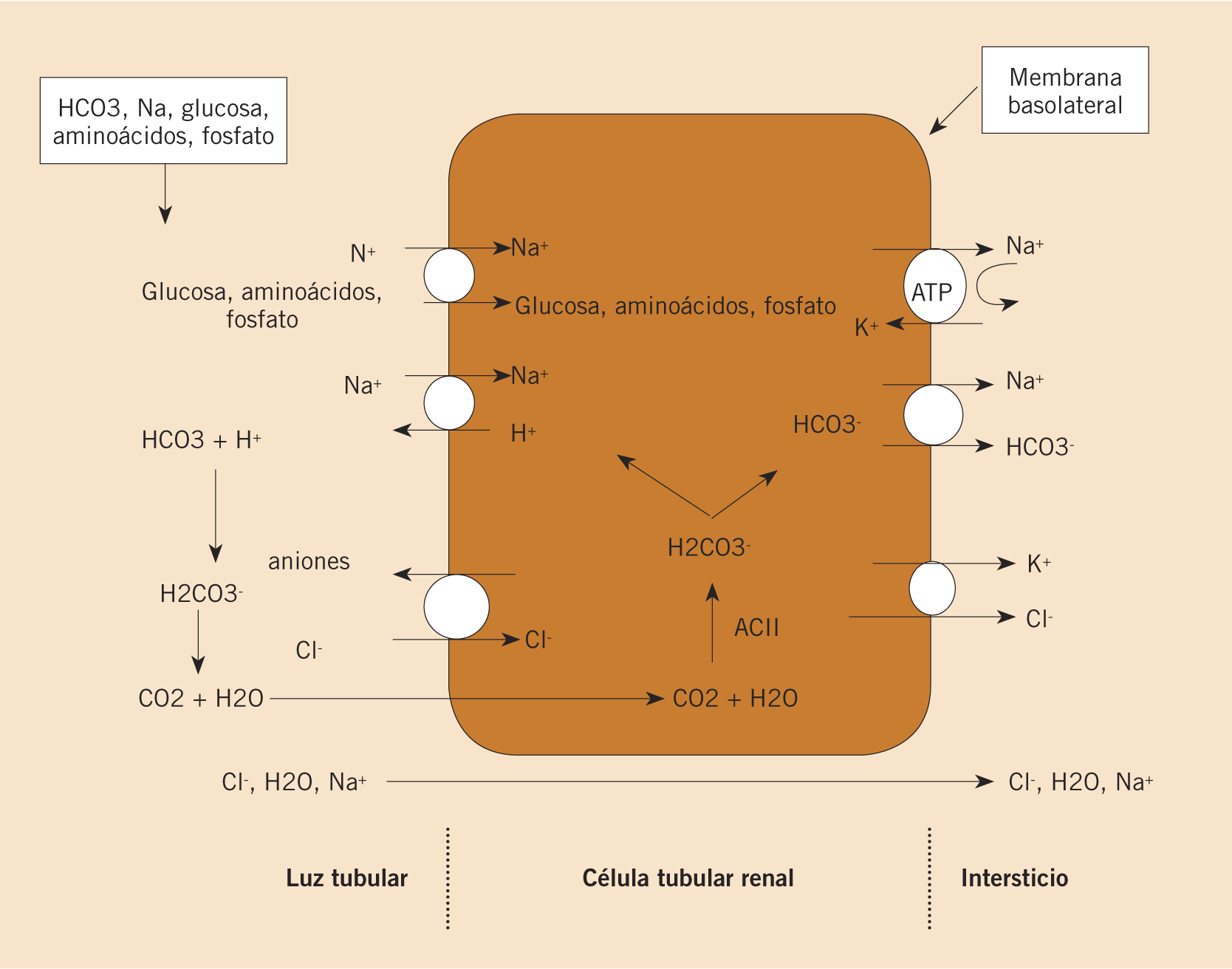
Figura 5. Esquema de un corpúsculo renal.
• En la rama ascendente gruesa del asa de Henle, el Na+ y el Cl- son trasportados activamente desde la luz tubular por el cotransportador Na+-K+-2Cl- (NKCC2) en la membrana apical. Esta reabsorción de Na+ y Cl- sin reabsorción de agua aumenta la osmolaridad del intersticio, promoviendo la salida de agua de las asas descendentes del asa de Henle. A medida que asciende, la luz tubular de la rama ascendente gruesa del Asa de Henle se va volviendo hipotónica y, a nivel de la corteza, está diluida con respecto al plasma. El intersticio medular alcanza su mayor osmolaridad en la zona más profunda.
• En la parte convoluta del túbulo distal y en los conductos conectores existe reabsorción activa de Na+ y Cl- a través de un cotransportador Na+/Cl- activado por la aldosterona y por el aumento en la ingesta de sal.
• En los tubos colectores corticales, la reabsorción de Na+ se produce por canales de Na+ (ENaC) en las células principales sensibles a la acción de la aldosterona.
• El transporte de agua en los segmentos distales de la nefrona está sujeto a un estricto control fisiológico. Así, cuando la osmolaridad del plasma aumenta, los receptores hipotalámicos responden liberando hormona antidiurética (ADH) que se une a los receptores V2 en la membrana basolateral de los tubos conectores y colectores e induce la inserción en la membrana apical de canales para el agua (acuaporina 2), causando reabsorción de agua desde la luz tubular a medida que los túbulos colectores se dirigen hacia la papila, descendiendo a través del intersticio hiperosmótico. En ausencia de ADH no se produce reabsorción de agua a este nivel, por lo que la orina es muy diluida.
En resumen, el 65% del Na+, Cl- y agua filtrados se reabsorben en el túbulo proximal, el 20%, en la rama ascendente gruesa del asa de Henle, el 10%, en la parte convoluta del tubo distal y un 3-5%, en los conductos colectores.
Manejo renal del potasio
El K+ se filtra libremente en el glomérulo.
• El 50-60% del K+ filtrado se reabsorbe en el túbulo proximal de forma pasiva vía paracelular siguiendo la reabsorción de agua y Na+.
• En la rama ascendente gruesa del asa de Henle, la reabsorción de K+ se lleva a cabo por el cotrasportador NKCC2 (25% del K+ filtrado). El Na+ que entra en la célula es enviado al intersticio por la Na+/K+ ATPasa; mientras que, parte del K+ reabsorbido es reciclado a la luz tubular mediante canales ROMK. Además, la secreción tubular de K+ crea un gradiente eléctrico que favorece su reabsorción paracelular.
• La nefrona distal es el lugar más importante de la regulación renal de K+. Aquí el Na+ difunde pasivamente al interior de la célula principal por los canales ENaC apicales, siendo trasportado posteriormente al intersticio por la Na+/K+ ATPasa, lo que aumenta la concentración intracelular de K+, creando un gradiente que favorece su difusión a la luz tubular a través de canales selectivos. Existen también canales basolaterales de K+ que lo reciclan al intersticio, manteniendo la eficiencia de la Na+/K+ ATPasa. Además de esta secreción de K+ por las células principales, la nefrona distal es capaz de reabsorber K+ en situaciones de depleción del mismo o de acidosis metabólica a través de la acción de la H+/K+ ATPasa de las células intercaladas.
En contraste con otros iones, los cambios en la excreción urinaria de K+ son determinados principalmente por cambios en su secreción tubular y no por cambios en la reabsorción y filtración. La excreción urinaria de K+ en la nefrona distal se eleva en respuesta a diferentes factores, como son la mayor oferta de Na+, la mayor velocidad de flujo en el tubo distal que ocurren, por ejemplo, durante la expansión del volumen extracelular, acidosis metabólica y, sobre todo, en presencia de aldosterona, su regulador hormonal más potente.
Control renal del equilibrio ácido-base
• En el túbulo proximal (donde se reabsorbe un 80% del HCO3- filtrado), la anhidrasa carbónica (AC) intracelular cataliza la formación de HCO3- y H+. Los H+ salen a la luz tubular mediante el transportador NHE3 intercambiándose por Na+ reaccionando con el HCO3- filtrado formando ácido carbónico (H2CO3-) que, por acción de la AC de la membrana apical, se escinde en agua y CO2. Mientras, el HCO3- pasa al intersticio por intercambio con Cl- o en simporte con Na+.
• El mecanismo de reabsorción de HCO3- en la rama ascendente gruesa del asa de Henle y en los túbulos distales es similar (aproximadamente un 15%).
• En los túbulos colectores corticales, las células intercaladas son las responsables de la secreción de H+ a la luz tubular gracias a la existencia de una H+-ATPasa y una H+/K+-ATPasa apicales. El HCO3- reabsorbido (4%) sale de la célula por intercambio con Cl-.
Además de este mecanismo conservador del HCO3- filtrado, el riñón es capaz de añadir HCO3- a la sangre por otros dos mecanismos: la excreción de acidez titulable (AT) y la excreción de amonio (NH4+).
Manejo renal de fósforo
Aproximadamente un 80% del fósforo (P) filtrado se reabsorbe en el túbulo proximal. El paso de P al interior de la célula tubular se lleva a cabo por cotransportadores de Na+y P que forman parte de la superfamilia de transportadores de solutos SLC34. Los subtipos NaPi-IIa y NaPi-IIc existen en la membrana apical de las células tubulares. Un transportador tipo III de la familia SLC20 participa también en la conservación renal de P con la isoforma PiT2.
La reabsorción renal de P disminuye en las situaciones de acidosis metabólica, dietas ricas en P, hiperpotasemia, en presencia de hormona paratiroidea que actúa modificando las proteínas encargadas del transporte de los NaPi-II hacia la membrana apical, y en presencia de las denominadas fosfatoninas, que son proteínas con efecto fosfatúrico. La más importante, desde el punto de vista renal es el factor de crecimiento fibroblástico 23 (FGF-23) producido en el hueso y que aumenta la eliminación de P e inhibe la síntesis de vitamina D. El FGF-23 precisa para unirse a sus receptores de la célula tubular un cofactor, la proteína Klotho(9).
Manejo renal del calcio
La porción libre de calcio (Ca+2) es filtrada libremente, mientras que el resto es retenido en el plasma unido a albúmina. Sólo un 1-2% del Ca+2 filtrado se excreta en orina.
• Un 70% se reabsorbe en el túbulo proximal y un 10-15% en la rama ascendente gruesa del asa de Henle de forma pasiva vía paracelular a través de canales iónicos (claudinas) gracias al gradiente electroquímico y de concentración generado por la reabsorción de Na+ y agua en estos segmentos.
• En los túbulos distales se reabsorbe una pequeña cantidad de Ca+2. Aquí la entrada apical de Ca+2 se produce pasivamente a través de canales iónicos TRPV5 regulados por la PTH de forma directa en relación al balance de Ca+2 del organismo, mientras el paso hacia el intersticio está mediado por un intercambiador con Na+ y por la Ca+2-ATPasa. La reabsorción de Ca+2 en los conductos colectores es mínima.
Un elemento importante en el transporte renal del Ca+2 es el receptor sensible al calcio (CaSR) que se expresa en diferentes lugares del túbulo renal. En la membrana apical del túbulo proximal su activación disminuye la respuesta fosfatúrica de la PTH. En la membrana basolateral de la rama ascendente gruesa del asa de Henle disminuye la actividad de los canales ROMK, disminuyendo la reabsorción de Na+ y de Ca+2. Además, inhibe la fosforilación de Claudina-16, disminuyendo su acción paracelular impidiendo la reabsorción de Ca+2. Se encuentra también en la membrana apical de los tubos colectores donde interfiere con el tráfico de acuaporina 2 hacia la membrana apical, provocando dilución de la orina a la vez que aumenta la secreción de H+ por las células intercaladas.
Regulación renal de la presión arterial(10)
El riñón participa de manera importante en la regulación de la presión arterial merced a su acción sobre el equilibrio del Na+, un determinante importante de la presión arterial. La concentración de Na+ en el líquido tubular proximal se percibe en la mácula densa, parte del aparato yuxtaglomerular. En este lugar se valora también la presión de perfusión de la sangre, un indicador importante del estado del volumen intravascular en circunstancias normales. La escasez del Na+ y la menor presión de perfusión actúan como un estímulo para la liberación de la renina. La renina, una proteasa elaborada en las células yuxtaglomerulares, escinde el angiotensinógeno sanguíneo para generar angiotensina I, transformada en angiotensina II por la enzima convertidora de angiotensina. La angiotensina II aumenta la presión arterial provocando vasoconstricción y estimulando la secreción de la aldosterona, que favorece la retención del Na+ y del agua en el túbulo colector.
La depleción del volumen intravascular también desencadena la liberación de vasopresina. Receptores en el cuerpo carotídeo y otros captan la disminución en la presión arterial y activan las vías neurales autónomas y la liberación de vasopresina en el hipotálamo. En la membrana plasmática apical del túbulo colector renal, la vasopresina facilita la inserción de canales para el agua, aumentando su cantidad y, por tanto, la reabsorción de agua libre y, secundariamente, la tensión arterial.
Los riñones también tienen la capacidad de producir mensajeros químicos, como las prostaglandinas, las quininas y el óxido nítrico que participan en mecanismos hipotensores.
Función endocrina
El riñón sintetiza dos hormonas: la eritropoyetina y el calcitriol o vitamina D activa.
La eritropoyetina es una glicoproteína, producida por un grupo especial de células del intersticio renal que se libera, principalmente, en respuesta a la hipoxia y estimula la eritropoyesis en la médula ósea. En algunas patologías renales, especialmente en la enfermedad renal crónica, se produce un déficit en la producción de esta hormona y consecuentemente se acompaña de anemia.
La vitamina D se forma a partir del 7-dehidrocolesterol que, por acción de la luz solar en la piel, se convierte en colecalciferol. Esta sustancia es hidroxilada en el hígado, convirtiéndose en 25-hidroxicolecalciferol, pero el metabolíto más activo, llamado 1,25 dihidroxicolecalciferol o calcitriol se forma tras sufrir una nueva hidroxilación en las células del túbulo renal. El calcitriol, que interviene de forma principal en el metabolismo óseo tiene, por tanto, origen renal. Su déficit explica, en parte, el hipocrecimiento y la osteodistrofia de la enfermedad renal crónica(9).
Glucogénesis
Finalmente, es preciso señalar que, en los periodos de ayuno prolongado, los riñones son capaces de sintetizar glucosa a partir de ciertos aminoácidos y otros precursores, liberándola la sangre en cantidades que representan el 80% de la glucosa producida por el hígado.
Bibliografía
1. Kriz W, Bankir L. A standard nomenclature for structures of the kidney. The Renal Commission of the International Union of Physiological Sciences (IUPS). Kidney Int. 1988; 33: 1-7.
2. Gavela T, Sánchez Bayle M, Gómez Mardones G, Gallego S, Martínez Pérez J, Moya MT. Estudio ecográfico del tamaño renal en niños. Nefrología. 2006; 26: 325-9.
3. Arévalo Gómez MA. El riñón normal. Anatomía e histología. En: Hernando Avendaño L, ed. Nefrología Clínica. 3ª edición. Editorial Médica Panamericana; 2008. p. 3-10.
4. Cherñavvsky DR, Gómez RA. Morfogénesis renal. En: Rudolph CD, Rudolph AM, Hostetter MK, Lister G, Siegel NJ, eds. Pediatría de Rudolph. 21ª edición. McGraw-Hill Interamericana; 2004. p. 1765-8.
5. Baum M. Desarrollo de la función renal. En: Rudolph CD, Rudolph AM, Hostetter MK, Lister G, Siegel NJ, eds. Pediatría de Rudolph. 21ª edición. McGraw-Hill Interamericana; 2004. p. 1768-74.
6. Franco M, Sánchez-Lozada LG, Herrera Acosta J. Fisiología glomerular. En: García Nieto V, Santos F, Rodríguez Iturbe B, eds. Nefrología Pediátrica. 2ª edición. Grupo Aula Médica; 2006. p. 3-8.
7. Santos F, García Nieto V. Función renal basal. En: García Nieto V, Santos F, Rodríguez Iturbe B, eds. Nefrología Pediátrica. 2ª edición. Madrid: Editorial Aula Médica Ediciones; 2006. p. 39-49.
8. Barac Nieto M. Funciones de los túbulos renales. En: García Nieto V, Santos F, Rodríguez Iturbe B, eds. Nefrología Pediátrica. 2ª edición. Grupo Aula Médica; 2006. p. 9-38.
9. Haussler MR, Whitfield GK, Kaneko I, Foster R, Saini R, Hsieh JC, et al. The role of vitamin D in the FGF 23, klotho, and phosphate bone-kidney endocrine axis. Rev Endocr Metab Disord. 2012; 13: 57-69.
10. Navar LG. The role of the kidneys in hypertension. J Clin Hypertens. 2005; 7: 542-9.
 |
| Editorial |
L. Sánchez Santos
residente de la ECPCPC. Junta directiva de la SEPEAP
«La tendencia previsible en los próximos años es al descenso de la presencia de Pediatras de Atención Primaria en Europa» |
Hace dos años, publicábamos una editorial en Pediatría Integral, donde dábamos a conocer a nuestros socios la Confederación Europea de Pediatras de Atención Primaria (ECPCP), y su posicionamiento como una herramienta de interés estratégico para reforzar y defender el modelo de asistencia a la infancia y adolescencia, basado en la presencia de pediatras en el primer nivel asistencial.
Una vez más, tengo el placer de escribir unas líneas para Pediatría Integral, en este caso para dar a conocer la Strategic Pediatric Alliance (SPA), una estructura desde la cual las tres asociaciones pediátricas europeas, unen esfuerzos con la misión de hacer “lobby” en las Instituciones para defender, entre otras cosas, el modelo de atención al niño a todos los niveles asistenciales, basado en la presencia de profesionales con formación específica, es decir, pediatras. Las tres Asociaciones Pediátricas son la Academia Europea de Pediatría (EAP), la Asociación Europea de Pediatría (EPA) y la ECPCPC, que tengo el honor de presidir.
¿Por qué crear una estructura de lobby si la presencia de pediatras a nivel hospitalario es generalizada y en Atención Primaria, en nuestro país por tomar un modelo de ejemplo, no hay pediatras que no puedan acceder a un puesto de trabajo? Una respuesta obvia es que, como sucede en la realidad, los modelos sanitarios de otros países poco o nada tienen que ver con el nuestro y, en ellos, la presencia de pediatras en el primer nivel asistencial es, como poco, errática.
Sin embargo, no es esa la cuestión más relevante, como así demuestra la explotación de datos de diferentes encuestas profesionales, realizadas en toda Europa (entendido este concepto en sentido amplio). Entre ellas cabe destacar la realizada a lo largo del año 2012, por la Academia, y la realizada por la propia SPA, presentada en junio en Glasgow, con ocasión del Congreso Europediatrics. ¿Qué conclusiones podemos obtener del análisis de los datos? En breve, podemos decir que la tendencia previsible en los próximos años es al descenso de la presencia de Pediatras de Atención Primaria en Europa, bien por escasez de renovación de los mismos, bien por una apuesta decidida por algunos Gobiernos a cambiar el actor principal del Pediatra al Médico General, en este último caso, sin ser una decisión que descanse en un análisis coste/efectividad de la probidad del ejercicio de uno u otro profesional, sino más bien por la fuerza del lobby de los médicos de familia.
Otras cuestiones de interés que ponen de manifiesto estas encuestas, es que la formación y entrenamiento de los residentes de Pediatría dista mucho de ser uniforme y que aún con los esfuerzos que se están realizando desde las tres Sociedades, las competencias y su diseño curricular no han sido totalmente definidas en nuestra profesión. Una iniciativa esencial en este contexto, es la definición de indicadores de calidad en el ámbito asistencial de Atención Primaria, proyecto conocido como COSI, con resultados más que interesantes y que fue presentado por nuestro Vicepresidente, Dr. Gottfried Huus, en el último Congreso de la AEP, y que lo será nuevamente, en el Congreso de Canarias de la SEPEAP.
Sin embargo, no todo debe ser pesimismo, la ECPCP ha tomado un mayor protagonismo en los últimos meses, reflejado en el Congreso que tuvo lugar en Tel Aviv el pasado mes de julio, con una más que destacada presencia de pediatras españoles, tanto en la inscripción, como en el Programa Científico, como en el protagonismo en el envío de comunicaciones. A todos ellos debo agradecer de corazón su esfuerzo y dedicación.
Desde la SEPEAP y desde la ECPCP queremos trasladar a nuestros socios la importancia de defender nuestro modelo, sin duda el que más calidad asistencial aporta a los pacientes, y defenderlo con datos tanto de salud, como económicos, además de ser proactivos para poner de manifiesto que esta situación donde la Unión Europea dedica la mayor parte de su esfuerzo económico al gasto (presupuesto dirigido a la tercera edad) y no a la inversión (presupuesto dirigido a la infancia y adolescencia), es un error estratégico cuyas consecuencias sin duda, tendremos que afrontar durante décadas.
 |
| Temas de FC |
C. Gutiérrez Segura, Á. Gómez Farpón, C. Granell Suárez
Médicos Adjuntos (FEA) del Servicio de Cirugía Pediátrica.
Hospital Universitario Central de Asturias
| Resumen
Las anomalías congénitas del riñón y del tracto urinario (CAKUT) representan aproximadamente el 20-30% de todas las anomalías identificadas en el periodo neonatal, dando lugar a una amplia variedad de desórdenes. |
| Abstract
Congenital anomalies of the kidney and urinary tract (CAKUT) account for approximately 20-30% of all abnormalities identified in the neonatal period resulting in a wide variety of disorders. |
Palabras clave: Hipoplasia y displasia renal; Riñón multiquístico; Ectopia renal; Riñón en herradura; Estenosis pielo- ureteral; Duplicidad renal y ureteral; Megauréter; Uréter ectópico; Ureterocele; Válvulas de uretra; Reflujo vésico-ureteral.
Key words: Renal hipoplasia and displasia; Renal ectopia; Horseshoe Kidney; Multicystic dysplastic Kidney; Urete- ropelvic junction obstruction; Duplicate collecting systems; Megaureter; Ectopic uréter; Ureterocele; Posterior urethral valve; Vesicoureteral reflux.
Pediatr Integral 2013; XVII(6): 391-401
Anomalías congénitas del riñón y del tracto urinario (CAKUT)
Las CAKUT constituyen cerca del 20-30% de todas las malformaciones identificadas(1), ocurriendo en el 0,3-1,6/1.000 recién nacidos vivos (RNV), ocasionando un 30-50% de insuficiencia renal terminal (IRT), siendo importante su diagnóstico y tratamiento precoz para minimizar el daño renal.
Representan una amplia variedad de desórdenes que provienen de los siguientes procesos de desarrollo renal anormal:
a. Malformación del parénquima renal: hipoplasia, displasia, agenesia renal y riñón multiquístico (DRMQ).
b. Anomalías relacionadas con la migración de los riñones: ectopia renal y anomalías de fusión.
c. Anomalías en el desarrollo del sistema colector: estenosis pielo-ureteral (EPU), duplicidades ureterales, megauréter primario, uréter ectópico, ureterocele y válvulas de uretra posterior (VUP).
Revisaremos aquellos que tienen un mayor impacto y repercusión clínica desde el punto de vista quirúrgico.
Malformaciones del parénquima renal
Su patogénesis es multifactorial, siendo debidas a factores genéticos y ambientales. En modelos animales, se ha demostrado cómo la deficiencia de vitamina A está asociada con malformaciones urogenitales e hipoplasia renal.
Hipoplasia renal
Existe un bajo número de nefronas, estructuralmente normales (sin cicatrices), dando lugar a un riñón disminuido de tamaño y una hipertrofia del riñón contralateral.
Displasia renal
Caracterizada por la presencia de tejido renal malformado, puede ser uni o bilateral, ocurriendo en 2-4/1.000 RNV. El diagnóstico frecuentemente es casual durante la realización de una ecografía. Suelen ser de tamaño más pequeño y su evolución, en general, es buena, en casos unilaterales.
Debido a la frecuente asociación con otras anomalías del sistema colector, la cistouretrografía miccional seriada (CUMS) debería ser considerada en todos los pacientes con displasia renal. La gammagrafía isotópica (DMSA) puede proporcionar información adicional de la función renal diferencial (FRD) de cada riñón. Se deben realizar ecografías periódicas para controlar el crecimiento compensatorio contralateral y posibles cambios en la medida del riñón displásico.
Displasia renal multiquística (DRMQ)
Es un riñón no funcionante, con múltiples quistes no comunicantes separados por tejido displásico con un uréter ausente o atrésico. La incidencia global es de 0,3-1/1.000 RNV, con más de la mitad de los casos diagnosticados antes del nacimiento. Suele existir involución o desaparición del riñón multiquístico en el 90% de los casos. Debido a ello, se recomienda tratamiento conservador con seguimiento a largo plazo.
La mayoría son unilaterales, afectando más frecuentemente a varones en el riñón izquierdo con hipertrofia compensadora en el riñón contralateral sano. Se asocia con anomalías genitales, renales o ureterales contralaterales, siendo el reflujo vésico-ureteral (RVU) lo más frecuente (25% de los casos)(2).
Seguimiento. Evaluación ecográfica seriada hasta los 10 años para monitorizar el crecimiento del riñón contralateral y la involución del DRMQ. Exámenes rutinarios de toma de presión arterial, análisis de orina para detectar proteinuria y estudios de función renal, especialmente en niños con anomalías en el riñón contralateral. Si hubiera historia de infecciones del tracto urinario (ITU) o hidronefrosis (HN), hay que realizar CUMS para diagnosticar la existencia del RVU.
Tratamiento. Algunos clínicos han recomendado eliminar el riesgo de malignidad (tumor de Wilms), extirpando el DRMQ. Sin embargo, en una revisión de la literatura realizada sobre un total de 1.041 niños con riñón multiquístico, ninguno desarrolló tumor de Wilms(3).
Anomalías de la migración y de la fusión
El crecimiento caudal rápido del embrión da lugar a la migración del riñón en desarrollo desde la pelvis a la fosa renal retroperitoneal. Al tiempo que ambos riñones ascienden, rotan 90°, de manera que el hilio renal se dirige hacia medial una vez completada su formación hacia la 8ª semana de gestación.
Ectopia renal
Ocurre cuando el riñón no asciende normalmente para alcanzar la fosa renal. Su incidencia es de 1/5.000 RNV. La mayoría son asintomáticos. El riñón ectópico suele tener una FRD disminuida. La anomalía acompañante más frecuente es el RVU (20%). En ausencia de otras anomalías, el pronóstico de los pacientes con ectopia renal es bueno.
La ectopia puede ser simple, cuando el riñón alcanza una posición anómala pero en el lado correspondiente, y cruzada, cuando cruza la línea media ocupando el lado contralateral. Ésta puede ocurrir con o sin fusión con el riñón contralateral. Si el riñón no asciende se denomina riñón pélvico. En los riñones ectópicos falla la rotación, lo que ocasiona desviación del eje renal, quedando la pelvis renal dirigida anteriormente, siendo el aporte vascular variable y anómalo.
Clínica. Los casos sintomáticos son debidos a ITU, obstrucción o cálculos renales. Pueden existir anomalías acompañantes génito-urinarias o asociación con síndromes, como CHARGE y el de VACTERL.
Diagnóstico. La ecografía postnatal confirma los hallazgos prenatales y define la anatomía. Deben realizarse estudios de función renal en casos de enfermedad renal bilateral o hidronefrosis. Si la función renal está disminuida o si el riñón contralateral es anormal, se debe realizar DMSA para medir la FRD. Si existe HN y la CUMS es normal, entonces se debe realizar MAG-3 para detectar obstrucción.
Fusión renal
Ocurre cuando una parte de un riñón se fusiona con el otro riñón.
Riñón en herradura
Es la anomalía de fusión más frecuente, ocurriendo en 0,4-1,6/10.000 RNV. Un tercio a mitad de los pacientes tienen anomalías congénitas urológicas y genitales acompañantes, así como alteraciones genéticas. Una gran parte de los pacientes tienen un buen pronóstico; sin embargo, estos niños parecen tener un riesgo incrementado de desarrollar tumor de Wilms(4).
En más del 90% de los casos, la fusión ocurre en los polos distales, manteniendo dos sistemas excretores renales y ureterales separados. La porción fusionada o istmo puede estar formado por parénquima o tejido fibroso en la línea media. Los ejes renales están desviados, situándose generalmente las pelvis renales anteriormente, cruzando ambos uréteres por encima del istmo renal fusionado.
Clínica. La mayoría son asintomáticos, aunque la hidronefrosis ocurre en un 80% de los casos, siendo las causas un RVU u obstrucción del sistema colector por compresión ureteral debida a vasos aberrantes, cálculos renales (20%) o por EPU, debido a la inserción alta de los uréteres en la pelvis renal.
Diagnóstico. La ecografía define la alteración anatómica y permite apreciar la HN. Si hay historia de ITU, se debe realizar CUMS para determinar si existe RVU. La creatinina permite evaluar la función renal. Si está elevada, se debe realizar DMSA para medir la FRD y descartar cicatrices renales. En pacientes con HN no debida a RVU debe realizarse MAG-3 para estudiar la EPU.
Tratamiento. El riñón en herradura debe ser intervenido solamente cuando en él se desarrolle un proceso patológico que evolucione desfavorablemente. A la hora de operar un RVU o una HN, es útil tener un mapa arteriográfico, debido a la vascularización anárquica que presenta el riñón en herradura.
Anomalías en el desarrollo del sistema colector
Estenosis pieloureteral (EPU)
La estenosis entre la pelvis renal y el uréter produce una interrupción parcial o total al flujo de orina, lo que conlleva una HN y, en ciertos casos, una pérdida progresiva de función renal. No obstante, la HN es un signo radiológico, no siempre sinónimo de obstrucción, por lo que, ante una dilatación renal, debemos descartar otras causas (Tabla I).
Epidemiología. Es la causa más común de HN prenatal, aunque muchas de éstas desaparecen. 1/500 fetos tienen una EPU funcionalmente significativa. Es 2 veces más frecuente en el lado izquierdo, predomina ligeramente en varones y en el 10-40% es bilateral.
Etiología. Las EPU pediátricas son fundamentalmente congénitas, pudiendo encontrar algún caso adquirido secundario a cálculos, tumores o cirugías. A su vez, las causas congénitas pueden dividirse en: intrínsecas, las más frecuentes, producidas por un segmento ureteral adinámico e hipoplásico; y extrínsecas, debido a factores mecánicos que comprimen el uréter proximal, como vasos polares, angulaciones de la unión o pólipos.
Clínica. Desde la introducción del screening prenatal, menos del 20% de los casos se diagnostican por su clínica. Cuando esto sucede, lo más frecuente es tras un episodio de ITU febril y, en menor medida, por hematuria tras un traumatismo banal, dolor abdominal, como un hallazgo incidental o formando parte de un síndrome, como en el VACTERL. La crisis de Dietl es típica de escolares mayores, con episodios de vómitos y dolor abdominal cólico asociados a hidronefrosis intermitente secundaria a vasos polares.
Diagnóstico:
• Ecografía: útil para el seguimiento del paciente. No puede diagnosticar la obstrucción per se; ya que, la dilatación severa no es específica de la obstrucción. Debemos prestar atención al grado de dilatación pielocalicial, el tamaño renal, el adelgazamiento cortical, la ecogenicidad cortical, la dilatación ureteral, el grosor vesical y la orina residual. Dos son los sistemas de clasificación del grado de HN: el diámetro antero-posterior de la pelvis (DAP), medida fácilmente reproducible, y el propuesto por la Society for Fetal Urology (SFU). Durante la etapa prenatal, se acepta como HN un DAP >4 mm antes de las 33 semanas de gestación y >7 mm después de esa semana. En la etapa posnatal, toda HN diagnosticada prenatalmente debe estudiarse una vez transcurridos unos 5 días de vida, evitando al menos las primeras 48 horas donde la oliguria fisiológica puede darnos un falso negativo. Sólo en casos seleccionados, como una HN de alto grado, casos bilaterales en varones con el fin de descartar VUP, HN en pacientes monorrenos u oligohidramnios, debe efectuarse antes.
• CUMS: su indicación es controvertida, al ser una prueba invasiva. A su favor está el hecho de que, en la bibliografía, figura una prevalencia de RVU del 25% en HN postnatales, sin embargo, este RVU podría carecer de repercusión clínica y no modificar nuestra actitud terapéutica.
• Renograma diurético MAG-3: es la principal herramienta diagnóstica de obstrucción del tracto urinario, valorando la FRD, que es la proporción de trazador captado de la sangre por cada riñón, y la excreción renal. Debe realizarse transcurrido el mes de vida, cuando el sistema renal es más maduro.
Durante el estudio, se administra un diurético (furosemida), generalmente a los 20 minutos de la máxima actividad del radiotrazador. La valoración del renograma incluye tres aspectos: la visualización de las imágenes secuenciales, las curvas de captación-eliminación (Fig. 1) y los datos cuantitativos, destacando la FRD y el T1/2 (tiempo medio de eliminación)(5). Se considera una FRD deteriorada cuando es <40%. En este punto, es básico recordar que la FRD es un estudio comparativo, es decir, se asume que conjuntamente ambos sistemas renales poseen una función total del 100%, viendo cuánto contribuye cada uno. Por lo tanto, en pacientes monorrenos o con afectación bilateral, este parámetro no es útil. Respecto al T1/2 a los 10 y 20 minutos, o tiempo que tarda en eliminar el 50% del radiofármaco, diferenciamos distintos patrones renográficos. De este modo, un T1/2 <10 minutos es normal (no obstructivo), >20 minutos está alterado (generalmente, asociado con obstrucción) y entre 10 y 20 minutos se considera indeterminado(6). Para lograr un diagnóstico preciso, es esencial prestar atención a múltiples factores que pueden alterar el resultado y producir una curva falsamente obstructiva. Por ello, un drenaje alterado en el renograma no es sinónimo de obstrucción. Sin embargo, una eliminación adecuada implica la ausencia de obstrucción.
Figura 1. Curva de captación-eliminación en el MAG-3.
• DMSA: proporciona una evaluación más exacta de la FRD que el MAG-3, especialmente en pacientes con riñones poco funcionantes, aunque con una dosis de radiación superior.
• Otras pruebas: en desuso han quedado los estudios de presión-flujo o la UIV, en detrimento de pruebas más precisas, como la urografía por RMN y el TC con contraste.
• Criterios de obstrucción y cirugía: las indicaciones de cirugía se encuentran en continuo debate. Por un lado, no hay ningún parámetro que, por sí solo, pueda indicarnos tratamiento quirúrgico, y la mera observación de la curva de eliminación es un manejo simplista de un problema muy complejo. Por otro lado y, gracias al uso de la ecografía prenatal, se sabe que la mayoría de las HN (75%) diagnosticadas en este periodo permanecen estables o mejoran, sin poder determinar los factores de deterioro renal y pronosticar qué pacientes no necesitarán cirugía. En general, la mayoría de las HN con DAP >30 mm precisarán cirugía (90%) frente al 10% con pelvis <20 mm. En los pacientes con pelvis de 20-30 mm, la mejoría (60%) es casi tan probable como el deterioro. Los criterios de cirugía son la presencia de síntomas, descenso de la FRD o incremento de la HN. En casos dudosos, debemos seguir regularmente al paciente con ecografía y MAG-3(7).
Tratamiento:
a. Pieloplastia: la pieloplastia desmembrada de Anderson-Hynes sigue considerándose el tratamiento de elección: se reseca la estenosis y parte de la pelvis renal redundante y se anastomosan pelvis y uréter. Esta técnica puede llevarse a cabo por cirugía abierta, laparoscopia o robótica.
b. Endourología: este tipo de procedimientos técnicos mínimamente invasivos están ampliamente instaurados en el adulto por su simplicidad e inocuidad. Sin embargo, en el paciente pediátrico tienen unos resultados muy discutidos y las dificultades técnicas hace que se lleven a cabo en centros muy concretos. Se puede acceder a la zona estenótica a través de la uretra y del uréter (retrógradamente) o a través de la pelvis renal (anterógradamente) y, con diferentes dispositivos, conseguir vencer esta estenosis (balón de dilatación de alta presión, endopielotomía…)(8).
Seguimiento postoperatorio. La mejoría del lavado del trazador en el MAG-3 después de la pieloplastia es muy variable, pudiendo, en ocasiones, permanecer obstruido o equívoco al menos durante 6 meses. Si la FRD permanece estable, no hay necesidad de preocuparse.
Megauréter congénito
La definición de “megauréter” es puramente descriptiva: es aquel uréter con un diámetro superior a 7 mm, acompañado o no de dilatación del sistema colector alto y sin hacer referencia a la obstrucción o el RVU.
Se diferencian 4 tipos con diferente etiopatogenia, en función de que sea obstructivo y/o refluyente:
1. Obstruido no refluyente o megauréter primario obstructivo (MOP), secundario a una obstrucción parcial por una alteración en la musculatura ureteral distal(9). Aunque, para otros autores, el hecho de que algunos se resuelvan de forma espontánea hace pensar que sea una falta de maduración del uréter(10).
2. Obstruido y refluyente, en el cual el trayecto tunelizado urétero-vesical es anormal y la orina refluye al uréter pero es incapaz de volver a la vejiga.
3. No obstruido refluyente, donde la orina refluye y drena a vejiga sin dificultad (véase sección RVU).
4. No obstruido, no refluyente. En estos pacientes existe una dilatación ureteral pero, paradójicamente, no presentan reflujo ni obstrucción(11).
Clínica. Representa el 23% de los casos de hidronefrosis en el RN de causa obstructiva. Es más frecuente en niños y más común en el lado izquierdo. Ocurre de manera bilateral en el 25%. Son diagnosticados incidentalmente en la ecografía prenatal y típicamente la exploración física es normal. Los casos que no son diagnosticados de forma prenatal suelen presentar posteriormente ITUs, hematuria, dolor abdominal, masa o uremia. Es raro que evolucione a IRT.
Diagnóstico. La ecografía es la primera prueba a realizar, confirma la dilatación ureteral. Se debe determinar mediante la realización de un MAG-3 qué megauréteres son obstructivos y, mediante una CUMS, cuáles tienen RVU, así como los casos en los que se combinen obstrucción y RVU. Incluso los pacientes que no tienen RVU ni obstrucción requieren ser identificados para un seguimiento estrecho(12).
Tratamiento. No hay parámetros que determinen qué pacientes van a requerir cirugía. Dado que el 70% de los casos se resuelven espontáneamente antes de los 2 años y que las intervenciones quirúrgicas tempranas se relacionan con tasa de complicación altas, no se recomienda el tratamiento quirúrgico excepto en megauréteres con ITUs recurrentes, deterioro de la FRD u obstrucción significativa. La edad idónea para realizar la reparación quirúrgica será entre el año de vida y los 2 años(13,14).
Seguimiento. Si permanece estable, se debe seguir de 2 a 4 años con ecografía y MAG-3 cada 6-12 meses(15). Tras la intervención, se debe solicitar una CUMS y MAG-3 más allá de los 3 meses para descartar RVU y obstrucción, respectivamente.
Duplicidad renal: ureterocele y uréter ectópico
La duplicación del sistema renal es una de las anomalías congénitas más frecuentes del tracto urinario, cursando de forma asintomática.
Embriología: las duplicaciones del tracto urinario superior son el resultado del desdoblamiento de la yema ureteral primitiva. De cada conducto de Wolf surge una yema ureteral que se une con el blastema metanéfrico para formar el riñón, y al seno urogenital para formar la vejiga. El grado de duplicación ureteral depende del momento en el que tiene lugar la separación inicial de las yemas; mientras que, el de la duplicación renal tiene relación con la distancia que existe entre ellas antes de alcanzar el blastema metanéfrico. Si brotan varias yemas ureterales, la ley de Weigert-Meyer indica que el uréter que drena la porción superior del riñón (uréter del hemisistema superior), termina de manera más caudal y medial que el que drena su porción inferior (uréter del hemisistema inferior). El desplazamiento del uréter superior de su posición habitual hace más probable que desemboque ectópicamente y se asocie a un ureterocele que condicione obstrucción; mientras que, el menor tiempo de desarrollo del uréter inferior disminuye su capa muscular, facilitando la aparición de RVU.
Ureterocele
Es el resultado de la dilatación quística del segmento terminal intravesical del uréter (Fig. 2). La forma más frecuente de presentación es una ITU en los primeros meses de vida. La mayoría precisan tratamiento quirúrgico, siendo la punción endoscópica la técnica de elección.

Figura 2. Imagen del ureterocele.
Epidemiología. Es 4 a 7 veces más frecuente en mujeres de raza blanca, con un 10% de los casos bilaterales. Suele estar asociado al pielón superior de un doble sistema completo (80%).
Clínica. La forma más frecuente de presentación es una ITU en los primeros meses de vida. Otros son detectados incidentalmente en ecografía prenatal o como una masa abdominal palpable secundaria a obstrucción renal. Aunque la obstrucción uretral es rara, una de sus causas más frecuentes en niños es el prolapso uretral de un ureterocele.
Diagnóstico. La primera prueba a efectuar, la ecografía, muestra una masa quística intravesical bien definida en la parte posterior de la vejiga. Se puede ver también un uréter proximal dilatado y, muy a menudo, un riñón doble ipsilateral en el que el hemirriñón superior está displásico. La CUMS se debe realizar siempre, ya que, en más del 50% de los casos, el pielón inferior ipsilateral y en el 25% del contralateral tienen RVU. Además, se puede observar el ureterocele como un defecto de llenado en la vejiga en las primeras imágenes de la prueba. El DMSA permite valorar la función del hemirriñón superior y el MAG-3 la eliminación cuando se sospecha obstrucción. La UIV, en desuso, mostrará el “signo de la cobra” en la vejiga y el “signo de la flor marchita” si hay sistema doble.
Tratamiento. Éste depende del tipo de ureterocele y del modo de presentación. La mayoría de pacientes precisan cirugía. La primera opción terapéutica es la punción endoscópica, con un éxito del 90% en los ureteroceles intravesicales y 50% en los ectópicos y, si ésta falla, se debe realizar una reconstrucción por cirugía abierta. En caso de anulación funcional del pielón superior, el procedimiento de elección es la heminefrectomía, habitualmente por cirugía mínimamente invasiva(16). En los pacientes con sepsis secundaria a obstrucción, el tratamiento inmediato es la nefrostomía.
Uréter ectópico
Es el uréter cuyo meato termina en una posición caudal a la inserción normal del uréter en el trígono. Es más frecuente en mujeres, manifestándose como ITU e incontinencia en niñas mayores.
El orificio se encuentra siempre a lo largo del trayecto del desarrollo normal del sistema mesonéfrico, por tanto, en niños es en el cuello vesical, próstata (a nivel del orificio del conducto eyaculatorio) o, incluso, a lo largo del trayecto del sistema genital masculino, incluyendo el epidídimo. En niñas, el orificio puede terminar en el cuello vesical, uretra, vagina o, de forma más rara, en cérvix y útero.
Epidemiología. Más frecuente en mujeres, un 70% asocia duplicación ureteral completa con una alta incidencia de tejido renal displásico en el hemirriñón superior correspondiente al uréter ectópico(11).
Clínica. Lo más frecuente son ITUs de repetición. Dependiendo del sexo, observaremos incontinencia en niñas mayores, con pérdida de orina a pesar de tener un buen hábito miccional. Esto no ocurre en el varón; ya que, siempre desemboca antes del esfínter uretral externo. Si el uréter drena en el conducto genital, puede provocar orquiepididimitis. En ambos casos, se puede apreciar HN en la etapa prenatal si el orificio ureteral está obstruido, por ejemplo, secundario al drenaje a nivel del epidídimo en el varón o del esfínter en la mujer, o un riñón displásico si el uréter es extrauretral.
Diagnóstico. En la ecografía se aprecia un uréter distal dilatado. En los casos en los que no esté dilatado, por ejemplo en niñas mayores en las que el uréter drena a la vagina, el TC o RNM con contraste pueden determinar con precisión la localización del uréter. La cistoscopia normalmente no es diagnóstica por sí sola, pero puede ser útil para identificar el ostium ureteral en la uretra, lo cual es muy complejo si el orificio está dentro de la vagina.
Tratamiento. Diferenciamos dos situaciones en el tratamiento del uréter ectópico:
• Sistema doble: como la mayoría de los casos están asociados con un polo superior displásico; la exéresis de este segmento y del uréter proximal es normalmente curativa.
• Sistema único: en niñas, el riñón asociado con el uréter ectópico es normalmente pequeño y con función muy pobre. Si el riñón es funcionante, el tratamiento es la resección del uréter ectópico distal y la reimplantación. Si no, se realiza nefroureterectomía por cirugía abierta o laparoscopia.
Válvulas de la uretra posterior (VUP)
Las VUP son unos pliegues membranosos dentro de la luz uretral de los varones, siendo una de las causas más frecuentes de obstrucción del tracto urinario, pudiendo ocasionar en el periodo neonatal un amplio espectro de severidad, ocurriendo en 1/5.000-8.000 embarazos(17).
Fisiopatología. La obstrucción de salida al flujo urinario produce hipertrofia y depósito de colágeno en el detrusor que ocasionan alteración de la compliance o acomodación vesical, aumentando la presión intravesical que se transmite a todo el TUS, pudiendo ocasionar ureterohidronefrosis, RVU y lesión renal (disfunción glomerular y tubular) (Fig. 3). Sin embargo, si se alivia la obstrucción de forma temprana, estos cambios pueden revertirse, excepto cuando exista displasia renal acompañante(18). El RVU está presente entre 1/3 y 1/2 de los pacientes con VUP. El RVU unilateral actúa como mecanismo de escape de la presión intravesical, salvaguardando la función del riñón contralateral a corto plazo, denominándose síndrome VURD(19) (vesicoureteral reflux unilateral renal dysplasia), aunque con el tiempo no parece que la preserve. Otros mecanismos de descarga de presión del TUS incluyen grandes divertículos vesicales, ascitis urinaria prenatal debida a la extravasación calicial y urinoma penirrenal. La disfunción vesical se presenta, según las distintas series, entre un 15 a 70% de los casos con VUP. Las alteraciones vesicales presentes constituyen el denominado “síndrome de la vejiga valvular”, existiendo tres patrones urodinámicos: hiperactividad del detrusor, baja acomodación vesical y fallo miogénico(20). Para algunos autores, estos patrones representan diferentes etapas de un mismo proceso. El más frecuente es la hiperactividad del detrusor (70%), siendo los 2 últimos los de peor pronóstico, evolucionando un 50% al fracaso renal con la necesidad de trasplante.
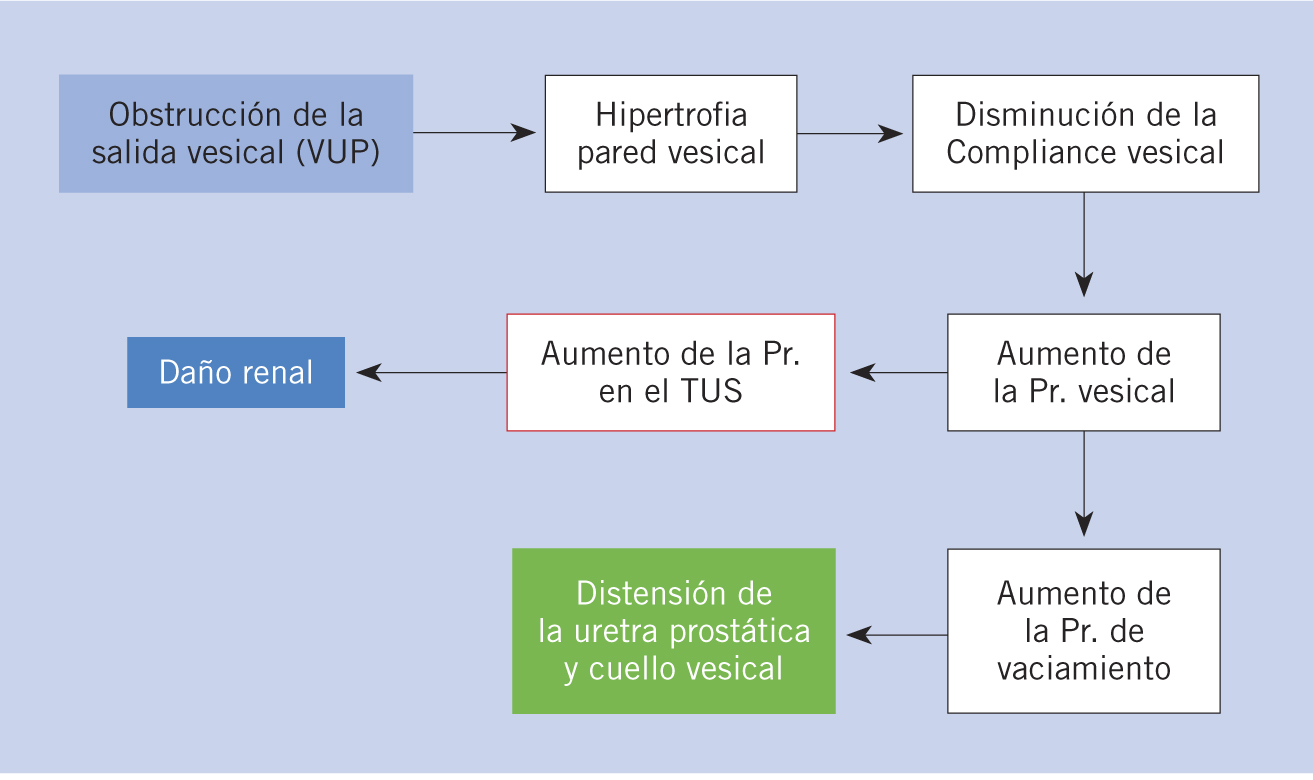
Figura 3. Fisiopatología de las válvulas de uretra posterior (VUP) (A. Gómez Fraile).
Diagnóstico. En la actualidad, la mayoría de las VUP se detectan por ecografía prenatal. Este descubrimiento permite el tratamiento temprano postnatal. Las imágenes sugestivas de VUP son la ureterohidronefrosis bilateral, aumento del tamaño de la vejiga y uretra posterior dilatada. En ocasiones, veremos engrosamiento de la pared vesical (>3 mm) y signos de displasia renal (aumento de la ecogenicidad renal y quistes corticales). La CUMS confirma el diagnóstico al nacimiento. La uretra posterior presenta una importante dilatación y el cuello de la vejiga está estrechado y engrosado con el canal urinario desplazado hacia la parte anterior (Fig. 4). El RVU suele ser intenso y aparece en la mitad de los lactantes. El DMSA y el MAG-3 valoran el estado del parénquima renal y el grado de obstrucción, respectivamente. Los estudios de laboratorio incluyen la determinación de urea, creatinina y electrolitos para valorar la función renal. Una creatinina mayor de 0,8-1 mg/dl, al año de la ablación valvular, sugiere deterioro de la TGF (<70 ml/min/1,73 m2) y función renal deficiente a largo plazo(21).
Figura 4. En la CUMS se aprecia gran dilatación en la uretra prostática, vejiga de lucha y gran reflujo vésico-ureteral unilateral.
Tratamiento prenatal. Cuando el oligohidramnios está presente en el 2º trimestre del embarazo, la mortalidad perinatal puede llegar al 90-95%. Por ello, la cirugía fetal puede considerarse en fetos con alto riesgo de muerte intraútero o neonatal debido a la existencia de un oligohidraminos severo, debiendo tener un cariotipo normal y una buena función renal estudiada en muestras de orina tomadas por punción de la vejiga fetal. En estos casos, la cirugía debería ser realizada en centros con gran experiencia debido al riesgo de mortalidad fetal (43%). Sin embargo, los resultados a largo plazo indican que la intervención prenatal no parece que mejore la función renal(22).
Tratamiento postnatal. Se inicia con la evaluación radiológica (ecografía, CUMS, MAG-3) y colocación de un catéter vesical para el drenaje del tracto urinario, pautando profilaxis antibiótica mientras se mantenga ésta y se descarte la presencia de RVU. Otras opciones de cirugía derivativa son la vesicostomía previa a la resección valvular, frecuentemente en niños prematuros, la pielostomía o ureterostomía alta, raramente realizadas debido a que precisan la reconstrucción posterior del TUS. Por otro lado, alteran el ciclo miccional de la vejiga, lo cual puede afectar a la función vesical, no mejorando los resultados de la vesicostomía. Podrían estar indicadas cuando, a pesar de un buen drenaje vesical, persiste la alteración de la función renal o dilatación ureteral. Una alternativa es la nefrostomía bilateral temporal. El tratamiento de elección, definitivo, se basa en la cistoscopia diagnóstica y terapéutica, mediante ablación endoscópica de las VUP, para la resolución de la obstrucción uretral(20).
Seguimiento. Después del procedimiento quirúrgico de las válvulas de uretra, el tratamiento incluye la detección de la disfunción vesical mediante pruebas de imagen y estudio urodinámico, además de la monitorización de la función renal. Un tercio de los pacientes con disfunción vesical severa requerirán sondaje limpio intermitente y medicación anticolinérgica y/o a-bloqueante, dependiendo de los resultados de la urodinamia. A pesar del diagnóstico prenatal y de la intervención precoz, un 15 a 20% progresan hacia la IRT, precisando trasplante renal(21).
Reflujo vésico-ureteral (RVU)
Proceso heterogéneo y multifactorial en el que se produce el paso retrógrado, no fisiológico, de orina al TUS. Anatómicamente, el uréter terminal atraviesa la pared vesical en un túnel submucoso que desemboca en el trígono. Mediante la presión intravesical, la porción terminal del uréter es comprimida contra el detrusor, creando un mecanismo valvular pasivo que impide el ascenso de orina.
Prevalencia. En población sana es desconocida. Se asume una prevalencia del 1% en RNV y muy superior, hasta un 30-70%, tras una ITU febril.
Grupos. Raza: más frecuente en niños de raza blanca presentando, además, mayor grado de RVU. Edad: mayor prevalencia cuanto menor es el niño. Sexo: después del primer año, la prevalencia de ITU es 2 veces superior en la mujer. Sin embargo, los niños tienen, entre todos los pacientes con ITU, más probabilidad de tener RVU (hombre:mujer de 2:1), además de ser normalmente diagnosticados durante el periodo prenatal. Los varones con antecedentes familiares de RVU tienen mayor riesgo de daño congénito(23) (Tabla II).
Genética. Existe un importante componente familiar, evidenciado por la alta incidencia de RVU en hermanos (30%) y en hijos de padres con RVU (35-50%). Sólo estaría indicado el estudio genético en caso de: hipoplasia, displasia, fallo renal crónico no explicado o alteraciones extrarrenales que puedan tener algún significado sindrómico.
Tipos de RVU. Tradicionalmente, el RVU se ha clasificado en primario y secundario:
• Primario: debido a un debilitamiento del funcionamiento del sistema valvular antirreflujo por inmadurez o alteración de la unión vésico-ureteral. Dentro de este grupo, podemos discernir 2 entidades: el reflujo congénito, diagnosticado por ecografía prenatal, y el RVU tras una ITU.
• Secundario: asociado a un funcionamiento anómalo de la vejiga con presiones intravesicales altas (vejiga neuropática o VUP). Este RVU tiende a mejorar cuando las presiones vesicales se normalizan.
Clínica. La ITU representa la forma más común de presentación (30%). Un síntoma asociado es el dolor, aunque se debe más a su relación con la pielonefritis. En alguna ocasión, el RVU se manifiesta como IRT y/o HTA en pacientes con poca o ninguna historia de ITU previa, lo cual podría ser secundario a una displasia renal congénita. Desde el advenimiento de la ecografía, debemos incluir las formas asintomáticas como otra opción de debut, así como los RVU prenatales.
Diagnóstico. Existen diferentes técnicas de imagen para diagnosticar y graduar el RVU: la cistografía isotópica directa, la ecocistografía con contraste y la CUMS. Sin embargo, es esta última la que, pese a su invasividad y radiación, continúa siendo el gold estándar, proporcionando un detalle anatómico superior, muy importante en varones, y valorando la presencia de reflujo intrarrenal. La clasificación más admitida, basada en la magnitud del paso retrógrado de orina de la vejiga al uréter, es la proporcionada por el International Reflux Study Committee(24). En general, se acepta que los RVU grado I y II son leves; el grado III moderado y los grados IV y V graves (Tabla III). Otra prueba complementaria es el DMSA, la más sensible para visualizar cicatrices y cuantificar la FRD(25). Para evaluar las cicatrices nos podemos guiar por la clasificación de Goldraich. Un RVU con un DMSA normal es de bajo grado y tiene un elevado porcentaje de resolución. Screening en hermanos: aunque sería interesante, éste no se suele llevar a cabo debido a la invasividad de las pruebas. La ecografía continúa siendo, pese a su baja sensibilidad (<50%), la prueba de elección.
Nefropatía por RVU (NR). Puede ocurrir en la vida fetal en forma de hipoplasia-displasia pero, en su mayoría, ocurre después del nacimiento y, sobre todo, en relación con la ITU. Es más frecuente en mujeres y se ha asociado a HTA, IRC, IRT y complicaciones en el embarazo.
Tratamiento. El enfoque terapéutico del RVU ha cambiado, adoptando una actitud más conservadora, como consecuencia de la falta de evidencia de beneficio significativo del tratamiento quirúrgico frente al médico. Diversos estudios han demostrado que la evolución natural del RVU es hacia la corrección espontánea, a razón de 10-15% por año. De este modo, el grado del RVU es el principal factor predictor a la hora de valorar la probabilidad de resolución espontánea. Además, se sabe que el RVU no suele dañar el riñón en ausencia de pielonefritis aguda asociada (PNA). El tratamiento conservador debe considerarse el modelo terapéutico de elección inicial (Fig. 5)(26).
Figura 5. Manejo del reflujo vésico-ureteral (RVU).
• Médico:
– Medidas generales para evitar la proliferación de gérmenes: estimulación de hábitos miccionales correctos con micciones completas y frecuentes, así como ingesta de abundantes líquidos y corrección del estreñimiento.
– Profilaxis antibiótica: no se recomienda de forma sistemática, debido a que no disminuye la progresión de daño renal(27). Se debe administrar en niños con RVU primario grado I-III con ITU de repetición y en los grados IV-V durante 1 año o hasta efectuar la siguiente CUMS, siendo el trimetoprim a 1-2 m/kg/día en dosis única nocturna el más utilizado.
• Quirúrgico: a mayor grado de RVU, menor probabilidad de resolución espontánea con mayor riesgo de daño renal. El tratamiento quirúrgico ha demostrado ser útil en reducir el número de PNA, pese a que no disminuye la progresión del daño renal. Por tanto, la principal indicación quirúrgica, y que debe plantearnos cambiar la actitud terapéutica, es la PNA. Para ello, disponemos de 2 tipos de cirugías, la reimplantación ureteral, generalmente abierta, más invasiva, pero con porcentajes de éxito >95%, y el tratamiento endoscópico, menos invasivo y con un porcentaje variable de éxito en función del número de procedimientos realizados, edad y sexo del paciente, grado de RVU y anatomía vésico-ureteral, ya que los dobles sistemas renales son más resistentes a la curación(28). Con esta técnica, se crea un habón submucoso a nivel del ostium ureteral mediante la inyección de un material (Deflux®, Macroplastique®), que disminuye el orificio y dificulta el paso retrógrado de orina.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. Queisser-Luft A, Stolz G, Wiesel A, Schlaefer K, Spranger J. Malformations in newborn: results based on 30,940 infants and fetuses from the Mainz congenital birth defect monitoring system (1990-1998). Arch Gynecol Obstet. 2002; 266(3): 163-7.
2. Onal B, Kogan BA. Natural history of patients with multicystic dysplastic kidney-what followup is needed? J Urol. 2006; 176(4 Pt 1): 1607-11.
3. Narchi H. Risk of Wilms’ tumour with multicystic kidney disease: a systematic review. Arch Dis Child. 2005; 90(2): 147-9.
4. Neville H, Ritchey ML, Shamberger RC, Haase G, Perlman S, Yoshioka T. The occurrence of Wilms tumor in horseshoe kidneys: a report from the National Wilms Tumor Study Group (NWTSG). J Pediatr Surg. 2002; 37(8): 1134-7.
5.*** Lupton EW, Testa HJ, O’Reilly PH, Gosling JA, Dixon JS, Lawson RS, et al. Diuresis renography and morphology in upper urinary tract obstruction. Br J Urol. 1979; 51(1): 10-4.
6. Fernbach SK, Maizels M, Conway JJ. Ultrasound grading of hydronephrosis: introduction to the system used by the Society for Fetal Urology. Pediatr Radiol. 1993; 23(6): 478-80. Disponible en: http://www.uab.edu/images/peduro/SFU/sfu_grading_on_web/sfu_grading_on_web.htm.
7.*** Essentials of paediatric urology. second ed. Informa Healthcare; 2008.
8.*** Parente HA, Angulo Madero JM, Romero Ruiz RM, Rivas VS, Lain FA, Fanjul GM. Medium-term results of the endourological management with balloon dilatation of the ureteropelvic junction stenosis in infants. Actas Urol Esp. 2009; 33(4): 422-8.
9. Kang HJ, Lee HY, Jin MH, Jeong HJ, Han SW. Decreased interstitial cells of Cajal-like cells, possible cause of congenital refluxing megaureters: Histopathologic differences in refluxing and obstructive megaureters. Urology. 2009; 74(2): 318-23.
10. Shokeir AA, Nijman RJ. Primary megaureter: current trends in diagnosis and treatment. BJU Int. 2000; 86(7): 861-8.
11. Michael DiSandro. Hydroureteronephrosis. En: Laurence S, Baskin BAK, editores. Handbook of pediatric urology. 2nd Edition ed. Lippincott Williams & Wilkins; 2005.
12. Hodges SJ, Werle D, McLorie G, Atala A. Megaureter. ScientificWorldJournal. 2010; 10: 603-12.
13. Arena F, Baldari S, Proietto F, Centorrino A, Scalfari G, Romeo G. Conservative treatment in primary neonatal megaureter. Eur J Pediatr Surg. 1998; 8(6): 347-51.
14. Peters CA, Mandell J, Lebowitz RL, Colodny AH, Bauer SB, Hendren WH, et al. Congenital obstructed megaureters in early infancy: diagnosis and treatment. J Urol. 1989; 142(2 Pt 2): 641-5.
15. Trobs RB, Heinecke K, Elouahidi T, Nounla J, Kluge R. Renal function and urine drainage after conservative or operative treatment of primary (obstructive) megaureter in infants and children. Int Urol Nephrol. 2006; 38(1): 141-7.
16. Nerli RB, Vernekar R, Guntaka AK, Patil SM, Jali SM, Hiremath MB. Laparoscopic hemi/partial nephrectomy in children with ureteral duplication anomalies. Pediatr Surg Int 2011; 27(7): 769-74.
17. Brown T, Mandell J, Lebowitz RL. Neonatal hydronephrosis in the era of sonography. AJR Am J Roentgenol. 1987; 148(5): 959-63.
18. Gómez Fraile A, López Vázquez F. Alteraciones del tracto de salida vesical. En: Gutiérrez Segura C, editor. Patología funcional urológica y urodinámica pediátrica. Siglo SL; 2008.
19. Hoover DL, Duckett JW, Jr. Posterior urethral valves, unilateral reflux and renal dysplasia: a syndrome. J Urol. 1982; 128(5): 994-7.
20.*** Casal AJ. Válvulas uretrales posteriores y otras anomalías uretrales. En: Campbell-Walsh, editor. Urology. Panamericana; 2007.
21. Ansari MS, Gulia A, Srivastava A, Kapoor R. Risk factors for progression to end-stage renal disease in children with posterior urethral valves. J Pediatr Urol. 2010; 6(3): 261-4.
22. Holmes N, Harrison MR, Baskin LS. Fetal surgery for posterior urethral valves: long-term postnatal outcomes. Pediatrics. 2001; 108(1): E7.
23. Essentials of pediatric radiology. A multimodality approach. 1ª ed. Cambridge; 2010.
24. Lebowitz RL, Olbing H, Parkkulainen KV, Smellie JM, Tamminen-Mobius TE. International system of radiographic grading of vesicoureteric reflux. International Reflux Study in Children. Pediatr Radiol. 1985; 15(2): 105-9.
25. Espino Hernández MM, Loris Pablo C. Reflujo vesicoureteral primario. Protocolos diagnósticos terapéuticos de la AEP 2008. Nefrología.
26. Areses Trapote R, Escribano Subías J, Fraga Rodríguez GM, Gracia Romero J, Loris Pablo C, Valenciano Fuente B. GPC Reflujo vésico-ureteral. Asociación Española de Nefrología Pediátrica; 2009 (GuíaSalud). Disponible en: http://www.guiasalud.es/egpc/reflujo/completa/apartado01/introduccion.html
27. Mori R, Fitzgerald A, Williams C, Tullus K, Verrier-Jones K, Lakhanpaul M. Antibiotic prophylaxis for children at risk of developing urinary tract infection: a systematic review. Acta Paediatr. 2009; 98(11): 1781-6.
28.*** Boston children Hospital 2013Available from: URL: http://www.childrenshospital.
org/vurcalculator/.
Bibliografía recomendada
– Lupton EW, Testa HJ, O’Reilly PH, Gosling JA, Dixon JS, Lawson RS, et al. Diuresis renography and morphology in upper urinary tract obstruction. Br J Urol. 1979; 51(1): 10-4.
Artículo original que describe las curvas de eliminación del renograma diurético descritas por O´Reilly.
– Essentials of paediatric urology. second ed. Informa Healthcare; 2008.
Libro clásico de la urología pediátrica que expone de manera sencilla y didáctica sus principales patologías.
– Parente HA, Angulo Madero JM, Romero Ruiz RM, Rivas VS, Lain FA, Fanjul GM. Medium-term results of the endourological management with balloon dilatation of the ureteropelvic junction stenosis in infants. Actas Urol Esp. 2009; 33(4): 422-8.
Este artículo refleja la la experiencia del Hospital Gregorio Marañón en el tratamiento endourológico de la estenosis pielo-ureteral.
– Casal AJ. Válvulas uretrales posteriores y otras anomalías uretrales. En: Campbell-Walsh, editor. Urology. Panamericana; 2007.
Compendio de urología, referencia en su campo, traducido al castellano. Cuenta con un tomo dedicado exclusivamente a la urología pediátrica.
– Boston children Hospital 2013. Available from: URL: http://www.childrenshospital.
org/vurcalculator/.
Página del Boston´s Children Hospital que permite la estimación de la efectividad del tratamiento endoscópico tras la cumplimentación de una serie de parámetros.
| Caso clínico | |
|
Presentamos el caso clínico de un RN varón con diagnóstico prenatal de hidronefrosis bilateral en la semana 20 de gestación, con un DAP máximo de 10 mm que en ecografías sucesivas ha ido paulatinamente disminuyendo, sin otros hallazgos ecográficos de interés. No constan antecedentes personales ni familiares reseñables. Nace por parto espontáneo, vaginal, en la semana 38 de gestación, con un Apgar 8/9 y un peso de 3.450 g. En la ecografía postnatal, se aprecia un riñón derecho de 54 mm, con buena diferenciación córtico-medular y un riñón izquierdo de 64 mm, con una cortical y diferenciación córtico-medular preservadas, con ureterohidronefrosis izquierda. La pelvis renal mide 15 mm, presentando un uréter mínimamente prominente a nivel distal (3 mm). Con el fin de descartar RVU, se solicita una CUMS, en la que se observa una vejiga de paredes finas sin defectos de repleción, sin RVU y con una uretra de características normales. El renograma diurético MAG-3 descarta obstrucción y muestra una FRD mantenida, lo que nos permite seguir al paciente en consultas. Durante este tiempo, el paciente se mantiene clínicamente asintomático. Las ecografías muestran en alguna ocasión un aumento de la dilatación piélica, pero que no se correlaciona con cambios en el MAG-3, los cuales mantienen un patrón no obstructivo, desapareciendo la hidronefrosis en las siguientes ecografías. Por otra parte, la dilatación ureteral ha ido disminuyendo hasta no ser perceptible. A los 4 años de edad, acude a revisión, aportando una ecografía en la que se aprecia una importante hidronefrosis izquierda que ha aumentado con respecto al estudio previo, midiendo la pelvis renal 46 milímetros de DAP. Así mismo, en la ecografía Doppler se visualizan unos vasos de gran calibre cruzando la pelvis renal. Ante estos hallazgos se decide solicitar un renograma diurético, en el que se observa una FRD del riñón izquierdo del 47% sin prácticamente respuesta a la administración del diurético, por lo que se interviene al paciente con el diagnóstico de estenosis pieloureteral secundaria a vasos polares.

Figura 6. Resultados del renograma diurético administrando furosemida en el minuto 20.
|
|
 |
| El Rincón del Residente |
D. Álvarez Demanuel*, M.X. Lemos Bouzas*, M.M. Portugués de la Red**
*MIR 3 de Pediatría. **Médico Adjunto de Pediatría. Complexo Hospilatario Universitario de Vigo
El Rincón del Residente es una apuesta arriesgada de Pediatría Integral. No hemos querido hacer una sección por residentes para residentes. Yendo más allá, hemos querido hacer una sección por residentes para todo aquel que pueda estar interesado. Tiene la intención de ser un espacio para publicaciones hechas por residentes sobre casos clínicos, imágenes y revisión bibliográfica. ¡Envíanos tu caso! Normas de publicación en www.sepeap.org |
Pediatr Integral 2013; XVII(6): 441-446
Neonato de 20 días, sin antecedentes perinatales de interés, que consulta por irritabilidad, eritrodermia generalizada y descamación con signo de Nikolski positivo. Asocia costras melicéricas en región peribucal y conjuntivitis purulenta. No evidencia de signos clínicos ni analíticos de afectación sistémica.

Figura 1.

Figura 2.

Figura 3.
 |
| El Rincón del Residente |
D. Gómez Andrés
MIR. Hospital Universitario La Paz. Trastornos del Desarrollo y Maduración Neurológica. IdiPaz-UAM
| Las revisiones de pediatría que te pueden interesar publicadas en las revistas internacionales más importantes. |
Pediatría General y Extrahospitalaria
★★★★Pediatric pharmacogenomics: an overview. Arch Dis Child. 2013; 98: 232-7. PMID: 23196740
En la pediatría actual, como en la medicina en general, nos manejamos con fármacos con una eficacia que oscila entre el 25 y el 80% con un riesgo importante de efectos adversos. El advenimiento de las técnicas genéticas ha desarrollado la farmacogenética y la farmacogenómica. Este artículo intenta resumir la metodología de estas nuevas disciplinas junto a las peculiaridades necesarias para su aplicación en las edades pediátricas. Termina destacando los avances conseguidos por estas disciplinas en los últimos años.
★★★Effect of intestinal microbial ecology on the developing brain. JAMA Pediatr. 2013; 167: 374-9. PMID: 23400224
Trabajo que pretende resumir las pruebas existentes sobre un tema provocador de la influencia del microbioma en el neurodesarrollo. Debido al papel de la flora intestinal en el control del metabolismo de las vitaminas, de los ácidos grasos y de las toxinas, junto a su rol regulador en el sistema inmunológico y los cambios que ocasiona en el sistema nervioso entérico, se han realizado estudios en animales que han visto como cambios en esta flora producen cambios en el comportamiento y en la expresión de proteínas en el sistema nervioso en desarrollo. También, estudios en humanos han detectado importantes cambios en la flora de los pacientes con autismo. Ello ha planteado importantes preguntas respecto al uso de antibióticos en etapas precoces de la vida, los mecanismos de los beneficios de la leche materna o el potencial papel de los probióticos.
Medicina de la Adolescencia
★★★★★Adolescence extended: implications of new brain research on medicine and policy. Acta Paediatr. 2013; 102: 226-32. PMID: 23176160
La adolescencia es una época de cambios, especialmente a nivel cognitivo, psicológico o social. Esas transiciones se traducen en cambios conductuales muy importantes cuyo substrato biológico es poco conocido. Este artículo estudia los cambios que ocurren en el cerebro adolescente y cómo se relacionan con los cambios conductuales. Además, plantea las implicaciones que estos nuevos datos podrían tener en política sanitaria y en la legislación en general.
Digestivo
★★★★★Mewling and puking: infantile gastroesophageal reflux in 21st century. J Paediatr Child Health. 2013; 49: 259-63. PMID: 23253052
Esencial artículo sobre el reflujo gastroesofágico. Es conciso y claro. Desde la fisiopatología de la enfermedad, explica y clasifica los síntomas y razona los distintos abordajes terapéuticos.
★★★★★Current options for management of biliary atresia. Pediatric Transplantation. 2013; 17: 95-8. PMID: 23347466
La atresia de vías biliares extrahepáticas continúa siendo una patología con una importante morbimortalidad. Los autores revisan la clasificación de Ohi, cuyos tipos se asocian al pronóstico, y la controversia respecto a los resultados de las distintas opciones terapéuticas: la portoenterostomía de Kasai y el trasplante hepático.
Endocrinología
★★★★★Short stature in childhood – challenges and choices. N Engl J Med. 2013; 368:1220-8. PMID: 23534561
Excelente revisión sobre la talla baja. Los autores estudian el abordaje diagnóstico con hincapié en la interpretación de los resultados del eje de la GH para terminar analizando las distintas opciones terapéuticas.
★★★★★Debate: idiopathic short stature should be treated with growth hormone. J Paediatr Child Health. 2013; 49: 165-9. PMID: 22582941
Artículo escrito en forma de debate que discute sobre el uso de la hormona de crecimiento recombinante en la talla baja idiopática. Los argumentos a favor son la dificultad para diagnosticar el déficit de GH, la variabilidad de cuadros clínicos que se agrupan bajo el concepto de “talla baja idiopática” y las consecuencias negativas psicosociales o sobre la calidad de vida que tiene la talla baja en un grupo de pacientes junto a la seguridad y la supuesta coste-efectividad del tratamiento. Los argumentos en contra residen en que los cambios psicológicos no son tan importantes como tradicionalmente se han asumido, que el tratamiento no ha demostrado mejorar esos supuestos problemas psicológicos y que los problemas sociales no deberían tratarse con hormonas, que en sentido estricto no es un tratamiento y que el uso de recursos en este tratamientos podría ser poco ético.
Hematología
★★★★Nuclear medicine and multimodality imaging of pediatric neuroblastoma. Pediatr Radiol. 2013; 43: 418-27. PMID: 23151727
El neuroblastoma es el tumor sólido pediátrico más frecuente después de los intracraneales. En ocasiones, su localización es complicada y, en otras, la detección de metástasis es muy importante para decidir el abordaje diagnóstico. Tras discutir las ventajas y desventajas de las diferentes técnicas, los autores concluyen que la gammagrafía sigue siendo la prueba de elección ya que el PET con flourodeoxiglucosa no ha demostrado ventajas. Sin embargo, el uso de otras moléculas con isótopos están consiguiendo resultados prometedores. Además, insisten en la combinación de pruebas de imagen con pruebas nucleares como mejor opción diagnóstica.
★★★★HThrombotic thrombocytopenic purpura in children. Curr Opin Pediatr. 2013; 25: 216-24. PMID: 23422353
Buena revisión sobre este tipo de anemia microangiopática producida por la deficiencia de ADAMTS13. Los autores resumen la patogénesis y las pruebas diagnósticas para esta enfermedad, tanto en su forma congénita como adquirida. Terminan con los distintos abordajes terapéuticos disponibles para su tratamiento.
Infectología
★★★★Congenital cytomegalovirus infection. New prospects for prevention and therapy. Pediatr Clin N Am. 2013; 60: 335-49. PMID: 23481104
Tras revisar la epidemiología de la infección por CMV, los autores se centran en las distintas formas de presentación clínica y el protocolo diagnóstico a seguir en caso de datos de sospecha clínica para terminar discutiendo los beneficios del tratamiento con ganciclovir y los avances en el desarrollo de una vacuna.
Neonatología
★★★★★A pattern-based approach to bowel obstruction in the newborn. Pediatr Radiol. 2013; 43: 318-29. PMID: 23233046
Los vómitos en el neonato son una situación clínica relativamente frecuente, representando la forma de presentación de patologías que van desde lo banal y transitorio hasta problemas quirúrgicos que requieren una atención urgente. Junto a los datos clínicos, la prueba complementaria principal es la radiografía de abdomen, una imagen radiológica que los pediatras estamos menos acostumbrados a valorar. Este artículo proporciona una serie de patrones a detectar que simplifican la interpretación de la radiografía y, desde esos patrones, construye un algoritmo que permite dirigir la toma de decisiones respecto al uso de ecografías y de pruebas con contraste.
Neumología
★★★★★Microbes and mucosal immune responses in asthma. Lancet. 2013; 381: 861-73. PMID: 23428115
Concienzuda revisión sobre el papel de las infecciones y de la microflora pulmonar en el desarrollo de la hiperreactividad bronquial y del asma. Los autores describen con detalle la compleja interacción entre la maduración del sistema inmunológico y las infecciones virales en la infancia.
★★★★Long-term pulmonary outcomes of patients with bronchopulmonary dysplasia. Semin Perinatol. 2013; 37: 132-7. PMID: 23582968
Sencilla pero interesante revisión sobre la displasia broncopulmonar centrada en la evolución a largo plazo. Los pacientes con displasia broncopulmonar continúan teniendo una morbilidad respiratoria importante que mejora a lo largo de la infancia, pero con el doble de riesgo de asma a los 11 años. Su función pulmonar muestra un disminución del volumen pulmonar, una disfunción de la vías aéreas pequeñas, a la hipertensión pulmonar en uno de cada seis e hiperreactividad bronquial en uno de cada 4 (más asociada a daño estructural que a inflamación). Su tolerancia al ejercicio es similar pero existen cambios importantes en la manera de regular la ventilación. Los cambios estructurales persisten en el TC de alta resolución hasta la edad adulta, aunque la mayoría de los datos proceden de la era pre-surfactante.
Neurología
★★★★★Pharmacologic treatment of pediatric headaches: a meta-analysis. JAMA Pediatr. 2013; 167: 250-8. PMID: 23358935
El tratamiento prolongado para la cefalea en pediatría es limitado. En el caso de la migraña episódica, existe una evidencia limitada para la trazodona y el topiramato con escasos estudios a favor de la clonidina, la flunaricina, pizotifén, propanol o valproico. Sólo existe un único ensayo de calidad suficiente para las cefaleas crónicas diarias con fluoxetina con resultados negativos.
★★★★Torticollis. J Child Neurol. 2013; 28: 365-78. PMID: 23271760
Magnífico artículo sobre la tortícolis que orienta el abordaje de esta patología en dos grupos diagnósticos: la tortícolis no paroxística y la tortícolis paroxística. En cada una de las causas, describe cuidadosamente la forma de presentación clínica, la epidemiología, las pruebas complementarias y el pronóstico.
Psiquiatría
★★★★★Treatment of anxiety and depression in the preschool period. J Am Acad Child Adolesc Psychiatry. 2013; 52: 346-58. PMID: 23582866
La ansiedad y la depresión son patologías frecuentes en los pacientes preescolares. Distintos abordajes psicoterapéuticos específicos para esta edad basados en estrategias cognitivo-conductuales se han evaluado en pequeños ensayos clínicos demostrando eficacia. En cambio, existen pocos datos respecto a la eficacia y la seguridad de los tratamientos farmacológicos.
 |
| El Rincón del Residente |
D. Gómez Andrés
MIR. Hospital Universitario La Paz. Trastornos del Desarrollo y Maduración Neurológica. IdiPaz-UAM
| Esta nueva sección pretende dar a conocer aquellas tecnologías nuevas para la difícil (o imposible) tarea de enfrentarse a un ordenador para obtener información útil (es decir, de alta calidad, actualizada y completa pero no excesiva). |
La generalización en el uso de móviles “inteligentes” y de las tabletas nos ha hecho familiarizarnos con el concepto de “app”. Con esa abreviatura, nos referimos a las aplicaciones que podemos instalar en el móvil. En nuestro trabajo estas herramientas son bastante útiles y, por ello, hemos decidido dedicarles un espacio en Pediatría Integral a aquellas que son especialmente interesantes por su calidad y por su precio (gratis, claro).
Una de las mejores apps médicas es “Calculate by QxMD”, una de las calculadoras más potentes para el uso clínico habitual. Lo peor es que su uso en Pediatría es algo engorroso al tener muchas de las fórmulas incluidas en las especialidades generales. Los enlaces para su descarga son: http://goo.gl/g9BNoq en Apple y http://goo.gl/vKtem3 en Android.
Otra app excelente es “Micromedex Drug Information”, un vademécum virtual de medicamentos que es bastante útil para encontrar dosis pediátricas de medicaciones con las que uno no suela tener contacto habitual. Los enlaces para su descarga son: http://goo.gl/3ZfLX1 en Android y http://goo.gl/Q6ZsCG en Apple.
 |
| Crítica de libros |
Carlos Marina
Pediatra y Médico Puericultor del Estado

ENFERMEDAD INFLAMATORIA INTESTINAL EN PEDIATRÍA
Dr. César Sánchez Sánchez
Hospital General Universitario Gregorio Marañón
(Madrid). Gastroenterología, Hepatología y Nutrición Pediátrica. Servicio de Pediatría
Madrid: Ergon; 2013
El interés que genera entre los Pediatras en general y no digamos entre los Gastroenterólogos Pediátricos de manera especial, tanto el diagnóstico lo más precoz posible y el tratamiento más actual de esta peculiar patología del Aparato Digestivo en el niño y adolescente, justifica plenamente el encomiable esfuerzo realizado por el Dr. César Sánchez Sánchez, como Editor y Coordinador de 80 Autores, representando a la élite Gastroenterológica Pediátrica de toda España, junto con la puntual colaboración profesional de una distinguida invitada de Cali (Colombia). El resultado: un libro enormemente atractivo, configurado, dado su denso y completo contenido, como auténtico y actualizado Tratado sobre Enfermedad Inflamatoria Intestinal en Pediatría.
La labor del Pediatra de Atención Primaria –el primero en enfrentarse con esta patología– se va a centrar en valorar lo más acertadamente posible la sintomatología clínica de la colitis ulcerosa y de la enfermedad de Crohn, y sus variantes, tanto en el niño como en el adolescente; su curso intermitente, en brotes, sus peculiaridades etiopatogénicas, fenotípicas y epidemiológicas, sin olvidar la actitud terapéutica, diferente a la del adulto; y todo ello con elevados costes sanitarios e importantes repercusiones psicosociales tanto en pacientes como en el entorno familiar.
La imprescindible derivación del enfermo al experto gastroenterólogo infantil da paso a la importancia de libros, como el que se comenta, convertido en auténtica “guía” y “puesta al día” diagnóstica y terapéutica para el estudioso y preocupado pediatra en su trabajo clínico con estos pacientes.
Nos encontramos ante un proceso patológico crónico que, por tanto, va a tener gran impacto sobre el propio enfermo como sobre todos los que le rodean: padres, cuidadores, compañeros y educadores fundamentalmente. Va a ser misión del pediatra, siempre bajo la dirección científica del gastroenterólogo pediátrico, el saber comunicar y explicar qué está ocurriendo, alentando siempre la esperanza a pesar del curso más o menos tórpido del proceso, estimulando el cumplimiento de las pruebas diagnósticas necesarias, así como del tratamiento a seguir a largo plazo, contribuyendo así al mejor pronóstico y la consecución de una buena calidad de vida para el paciente.
La labor del pediatra, eminentemente clínica, habrá de saber valorar el más interesante marcador sensible de inflamación persistente del tracto intestinal: el retraso del crecimiento y del desarrollo puberal del niño o adolescente afectados. Este hecho, detectado por el pediatra, va a ser motivo de alerta de sospecha diagnóstica inicial de enfermedad inflamatoria intestinal en cualquiera de sus variantes, hasta tal punto que la necesaria promoción del crecimiento y desarrollo solo vendrá dada cuando se obtenga la curación histológica del proceso causante.
La atenta y puntual lectura de cada capítulo de este interesante libro va a ayudar sobremanera a aclarar dudas y a ilustrar sobre todas las novedades, tanto diagnósticas como terapéuticas surgidas en el riguroso estudio de la Enfermedad Inflamatoria Intestinal en Pediatría. Aprenderemos, así, a combatir el círculo vicioso iniciado por la inflamación y deterioro de la mucosa intestinal, y seguido por la anorexia, malnutrición y malabsorción con esteatorrea, para terminar conduciendo al hipocrecimiento e intensificación de la malnutrición. El detallado conocimiento del tratamiento antiinflamatorio precoz necesario, preferiblemente mediante nutrición enteral específica, fármacos y, excepcionalmente, cirugía, terminarán por destacar el carácter multidisciplinar de la patología considerada.
Libro, pues, recomendado como de alto interés pediátrico y de auténtica referencia para todo lo relacionado hoy en día con la Enfermedad Inflamatoria Intestinal en Pediatría. La impecable presentación conseguida por la Editorial Ergon realza el extraordinario contenido científico de la obra aquí comentada, cuyo éxito aseguramos.
 |
| Noticias |
Ángeles Cansino Campuzano
Presidenta del Comité Organizador
Después de casi veinte años, en Octubre de 2013 la ciudad de Las Palmas de Gran Canaria volverá a ser la anfitriona del XXVII Congreso Nacional de la Sociedad Española de Pediatría Extrahospitalaria y de Atención Primaria (SEPEAP).
Las Palmas de Gran Canaria es una ciudad abierta y cosmopolita con un hermoso balcón al océano Atlántico, la playa de Las Canteras en la que se encuentra ubicada la sede del congreso. Nuestra ciudad brinda a los congresistas, además de sol y playa, un acervo cultural que tiene su máximo exponente en el casco antiguo situado en el barrio de Vegueta-Triana.
En estos momentos difíciles de recortes sanitarios y medidas organizativas desafortunadas, los pediatras de Atención Primaria continuamos siendo punto de referencia para las familias y nos enfrentamos a un incremento de problemas psico-sociales. Las sociedades científicas tenemos la obligación de recordar a nuestras autoridades sanitarias el beneficio de mantener este modelo asistencial.
Nos gustaría que el congreso fuera el marco adecuado para discutir estos y otros problemas de la actualidad pediátrica. Para ello hemos diseñado un Programa Científico con temas variados, tanto desde la perspectiva biológica como psico-social, algunos controvertidos; y hemos aumentado el número de talleres. Todo ello con la ilusión de cumplir con sus expectativas y contribuir a mejorar la atención a nuestros niños y niñas.
El reto de organizar un congreso nacional lo afrontamos con mucha ilusión y esperamos que un gran número de compañeros se animen a volar hasta nuestro archipiélago canario. Será para nosotros un honor recibirles en nuestra ciudad.
Ángeles Cansino Campuzano
Presidenta del Comité Organizador

Junta Directiva de la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria
Presidente: J.L. Bonal Villanova
Vicepresidente: V. Martínez Suárez
Secretario: J.C. Silva Rico
Tesorero: L. Sánchez Santos
Vocales: M.E. Benítez Rabagliati
C. Coronel Rodríguez
C. Ferrández Gomáriz
J. García Pérez
A.M. Rodríguez Fernández
Vocales de la Sociedad Española de Pediatría Extrahospitalaria
y Atención Primaria en las Sociedades Regionales de la AEP
Andalucía Occidental y Extremadura: J. García Palomeque
Andalucía Oriental: V. Bolivar Galiano
Aragón, La Rioja y Soria: M.Á. Learte Álvarez
Asturias, Cantabria y Castilla-León: J. Pellegrini Belinchón
Canarias (Secc. Las Palmas): Á. Cansino Campuzano
Canarias (Secc. Tenerife): A. Hernández Hernández
Castilla-La Mancha: J.L. Grau Olivé
Cataluña: J. de la Flor i Brú
Galicia: M. Sampedro Campos
Madrid: P. Ruiz Lázaro
Navarra: R. Pèlach Pàniker
Sureste-Murcia: A. Iofrio de Arce
Valencia: F. García-Sala Viguer
id

Junta Directiva de la Sociedad Canaria de Pediatría Extrahospitalaria
Presidenta: Á. Cansino Campuzano
Vicepresidenta: M.E. Benítez Rabagliati
Secretario: M. Castillo de Vera
Tesorera: N. Acosta Fernández
Vocales: R. Ariza Oviedo
A. Machín Jiménez
H. Zerpa Falcón
G. Rodríguez Pérez
B. Montoro González
Comité Organizador
Presidenta: Á. Cansino Campuzano
Vicepresidenta: M.E. Benítez Rabagliati
Secretario: M. Castillo de Vera
Tesorera: N. Acosta Fernández
Vocales: A. Pérez Pérez
H. Zerpa Falcón
G. Rodríguez Pérez
A. Machín Jiménez
Comité Científico
Presidente: V. Pérez Candela
Vocales: M.D. Estévez González
O. Afonso Rodríguez
M.E. Angulo Moreno
Programa científico
JUEVES 17 DE OCTUBRE DE 2013
15:00 h ENTREGA DE DOCUMENTACIÓN
17:00-18:30 h COMUNICACIONES ORALES-
PRESENTACIÓN DE POSTERS
18:30-20:00 h MESA REDONDA PROFESIONAL
Aspectos legales en la atención al niño y al adolescente
Moderador: F. Malmierca Sánchez (Salamanca)
Ponentes: E.J. Sanz Álvarez (Tenerife)
E. Cortés Cros (Las Palmas)
20:00 h INAUGURACIÓN OFICIAL
21:30 h COCKTAIL
VIERNES 18 DE OCTUBRE DE 2013
09:00-10:30 h SEMINARIOS
Transexualidad en pediatría
Moderadora: M.I. Hidalgo Vicario (Madrid)
Ponentes: I. Miguel Mitre (Tenerife)
M.J. Hinojosa Pareja (Las Palmas)
Lactancia materna
Moderadora: G. Rodríguez Pérez (Las Palmas)
Ponentes: E. Fernández Pulido (Salamanca)
M.Á. Velasco Mateos (Salamanca)
Insomnio infantil. ¿Podemos hacer algo?
Moderador: G. Pin Arboledas (Valencia)
Ponentes: T. de la Calle Cabrera (Salamanca)
C. Ferrández Gomáriz (Tenerife)
10:30-11:15 h Presentación del consenso nacional del uso de la melatonina en niños y adolescentes con dificultad para iniciar el sueño
Moderadora: C. Ferrández Gomáriz (Tenerife)
Ponentes: G. Pin Arboledas (Valencia)
M.I. Hidalgo Vicario (Madrid)
11:15-11:30 h Descanso
11:30-12:30 h SIMPOSIOS INDUSTRIA
NESTLÉ
Nutrición y crecimiento en los 1.000 primeros días
– Efectos de los probióticos en la nutrición infantil temprana
Ponente: V. Martínez Suárez (Gijón)
– Estrategias nutricionales para la prevención de las alergias en los 1.000 primeros días
Ponente: E. Román Riechmann
(Madrid)
– Los 1.000 primeros días: la aportación de la nutrición
Ponente: J. Dorca Fornas (Barcelona)
SANOFI PASTEUR
¿Qué hemos aprendido hasta hoy en la vacunación frente a tos ferina, rotavirus y varicela?
Ponentes: J. Arístegui Fernández (Bilbao)
F. Álvarez García (Oviedo)
L. Ortigosa Castillo
(Santa Cruz de Tenerife)
STIEFEL/GSK
Manejo práctico de las patologías dermatológicas más prevalentes en pediatría
Ponente: J.L. López Estebaranz (Madrid)
SHIRE
Futuros avances en el TDAH
Moderadora: M.E. Benítez (Las Palmas)
– Diagnóstico y manejo del TDAH
Ponente: A. Figueroa
(Las Palmas de Gran Canaria)
– Nuevos tratamientos del TDAH
Ponente: P. Rodríguez
(Santa Cruz de Tenerife)
12:30-13:30 h CONFERENCIA EXTRAORDINARIA NESTLÉ
Educación en la infancia
Ponente: F. Santana Santos (Las Palmas)
15:30-17:00 h MESA REDONDA PLENARIA
Medicina deportiva en el niño y el adolescente
Moderadora: M.N. Acosta Fernández (Las Palmas)
Ponentes: D. Medina Leal (Barcelona)
A. Ramos Gordillo (Las Palmas)
17:00-18:30 h MESAS REDONDAS SIMULTÁNEAS
Enfermedades inmunoprevenibles emergentes, ¿qué está pasando?
Moderador: V. Martínez Suárez (Oviedo)
– Sarampión
Ponente: L. Ortigosa del Castillo (Tenerife)
– Tos ferina
Ponente: A. Montesdeoca Melián
(Tenerife)
Coordinación interinstitucional ante el maltrato infantil
Moderadora: M.E. García Almeida (Las Palmas)
Ponentes: M.J. Meilán Ramos (Las Palmas)
T. Martín Rodríguez (Las Palmas)
18:30-20:00 h TALLERES SIMULTÁNEOS
1. Acceso vascular. Vía intraósea
Moderadora: M.E. Benítez Rabagliati
(Las Palmas)
Ponente: E. Civantos Fuentes (Tenerife)
2. Fondo de ojo en pediatría. Uso del retinógrafo
Moderador: N. Cáceres Alemán (Las Palmas)
Ponentes: M. García González (Las Palmas)
L. Baeta Bayón (Las Palmas)
3. ¿Qué puede hacer el pediatra de Atención Primaria con el ecógrafo?
Moderadora: A. Pérez Pérez (Las Palmas)
Ponentes: M.I. Osiniri Kippes (Figueres)
F. Philipps Fuente (Las Palmas)
A. Ramos Díaz (Las Palmas)
4. Guía de supervivencia en radiología para el pediatra de Atención Primaria
Moderador: A. Machín Jiménez (Las Palmas)
Ponente: V. Pérez Candela (Las Palmas)
5. Atención inicial al trauma pediátrico
Moderador: M. Sampedro Campos (Ourense)
Ponentes: L. Alonso Jiménez (Cádiz)
A. Gálvez Esquinas (Las Palmas)
6. Atención al niño viajero internacional. Casos prácticos
Moderador: M. Castillo de Vera (Las Palmas)
Ponentes: O. Afonso Rodríguez (Las Palmas)
M. Mateos Durán (Tenerife)
7. Taller de comunicación
Moderador: A. Iofrio de Arce (Murcia)
Ponente: M.L. Arroba Basanta (Madrid)
8. Control del asma infantil en atención primaria. Técnicas de inhalación. Uso del espirómetro
Moderador: J. Martín Ruano (Salamanca)
Ponentes: J. Pellegrini Belinchón (Salamanca) C. Ortega Casanova (Salamanca)
9. Exploración neurológica del recién nacido y el lactante
Moderador: C. Coronel Rodríguez (Sevilla)
Ponentes: J. Santos Borbujo (Salamanca)
I. Ruiz-Ayucar de la Vega
(Salamanca)
10. Redes sociales
Moderador: J.C. Silva Rico (Valladolid)
Ponente: D. Pérez Solís (Avilés)
11. Inteligencia emocional para pediatras
Moderadora: A.M. Rodríguez Fernández (Murcia)
Ponente: P. Ruiz Lázaro (Madrid)
12. Defensa personal para pediatras
Moderador: L. Sánchez Santos
(Santiago de Compostela)
Ponente: M. Sánchez Sánchez (Vigo)
09:00 a 14:00 h 13. Simulación médica avanzada
Expertos: L. Sánchez Santos
(Santiago de Compostela)
J.A. Iglesias Vázquez (La Coruña)
A. Casal Sánchez (Pontevedra)
J. Couceiro Gianzo (Pontevedra)
A. Rodríguez Núñez (La Coruña)
SÁBADO 19 DE OCTUBRE DE 2013
09:00-10:15 h CONTROVERSIAS
Alimentos saludables: fast-food vs dieta mediterránea
Moderadora: A. Pérez Pérez (Las Palmas)
Ponentes: V. Martínez Suárez (Oviedo)
L. Serra Majem (Las Palmas
Vacunación contra la gripe estacional: universal vs grupos de riesgo
Moderadora: Á. Cansino Campuzano (Las Palmas)
Ponentes:: P.A. Piedra (EE.UU.)
J. Arístegui Fernández (Bilbao)
10:15-11:45 h MESA REDONDA PLENARIA
Violencia ascendente. Nuevas morbilidades en pediatría
Moderador: J. García Pérez (Madrid)
– Violencia ?lio-paternal
Ponente: J. García Pérez (Madrid)
– Nuevas adicciones y patologías asociadas en Pediatría
Ponente: P. Ruiz Lázaro (Madrid)
– Procedimientos sancionadores a menores
Ponente: E. Calatayud Pérez (Granada)
11:45-12:45 h SIMPOSIOS INDUSTRIA
NOVARTIS
¿Qué hay de nuevo frente a la meningitis?
Moderador: L. Ortigosa Del Castillo (Tenerife)
Ponente: F. Martinón-Torres
(Santiago de Compostela)
12.45-13.30 h ENCUENTRO CON EXPERTOS
Indicadores de calidad de la asistencia de pediatría de Atención Primaria en europa: el proyecto cosi
Moderador: L. Sánchez Santos
(Santiago de Compostela)
Ponente: G. Huss
13:30-14:30 h ASAMBLEA DE SOCIOS
14:30-16:00 h ALMUERZO DE TRABAJO
16:00-17:30 h MESAS REDONDAS SIMULTÁNEAS
Ginecología de la adolescencia
Moderadora: C. Rosa Rodríguez Fernández-Oliva
(Tenerife)
– Patología ginecológica en la adolescencia
Ponente: M. Prieto Martínez
(Las Palmas de Gran Canaria)
– Anticoncepción y prevención de Enfermedades de transmisión sexual en la adolescencia
Ponente : M.Á. Nieto Naya (Las Palmas)
Seguimiento del prematuro desde Atención Primaria
Moderador: F. García-Sala Viguer (Valencia)
Ponentes: O. González Calderón (Salamanca)
T. Carbajosa Herrero (Salamanca)
17:30-19:00 h TALLERES SIMULTÁNEOS
(Repetición)
21:30 h COCKTAIL Y CENA DE CLAUSURA