|
| Temas de FC |
A. Hervás Zúñiga*, N. Balmaña**, M. Salgado**
*Jefe de Psiquiatría infantil y juvenil del Hospital Universitario Mutua Terrassa. Barcelona, Directora de IGAIN (Instituto Global de Atención Integral al Neurodesarrollo).
**Psicóloga. Hospital Universitario Mutua Terrassa. Barcelona
| Resumen
Los trastornos del espectro autista (TEA) comprenden un grupo heterogéneo de trastornos, tanto en su etiología como en su presentación clínica, que se inician en la infancia y duran toda la vida, teniendo en común la afectación en la comunicación social y la presencia de patrones repetitivos y restrictivos de la conducta. La prevalencia de TEA es mayor en chicos, 23,6 por 1.000, que en chicas, 5,3 por 1.000 en población de EE.UU. de 8 años. La detección precoz del TEA es fundamental, ya que está íntimamente ligada a la evolución clínica. Es el rol fundamental de los profesionales de la Atención Primaria el detectar signos precoces de TEA, mediante el seguimiento del desarrollo del niño, el conocimiento de los signos de alerta específicos y el uso de instrumentos de cribaje. No existe ninguna prueba biológica que diagnostique TEA y el diagnóstico es eminentemente clínico. La detección precoz de TEA y la instauración de un programa de tratamiento temprano, en todos los entornos en los que vive el niño, mejora el pronóstico de los síntomas autistas, las habilidades cognitivas y la adaptación funcional a su entorno. |
| Abstract
Autistic Spectrum Disorders (ASD) are a heterogeneous group of disorders according to their aetiology and clinical presentation that are chronic and last all life. They are characterized by impairments in social communication and restricted and repetitive patterns of behaviours. |
Palabras clave: Autismo; Trastornos del espectro autista; Trastornos generalizados del desarrollo
Key words: Autism; Autism spectrum disorders; Generalized developmental disorders
Pediatr Integral 2017; XXI (2): 92-108
Los trastornos del espectro autista (TEA)
Introducción y concepto
El TEA es un trastorno del neurodesarrollo de origen neurobiológico e inicio en la infancia, que afecta el desarrollo de la comunicación social, como de la conducta, con la presencia de comportamientos e intereses repetitivos y restringidos. Presenta una evolución crónica, con diferentes grados de afectación, adaptación funcional y funcionamiento en el área del lenguaje y desarrollo intelectual, según el caso y momento evolutivo.
Es un trastorno complejo y altamente heterogéneo, tanto en lo referente a la etiología como en la manifestación y evolución de los síntomas en las diferentes etapas del desarrollo, en su expresión y presentación según el sexo, edad o comorbilidades coexistentes.
Definición. Criterios diagnósticos
La conceptualización, definición y criterios diagnósticos de TEA se han ido modificando, complementando y ajustando a lo largo de las últimas décadas, teniendo en cuenta los resultados de las investigaciones, y el DSM5 incluye una denominación genérica de TEA y elimina las subcategorías del DSM IV-TR adquiriendo un concepto dimensional del autismo.
Con la publicación del DSM5 (APA, 2014) en el 2013(1), la clasificación y criterios en el campo del autismo quedaron modificados notablemente comparados con las clasificaciones previas (DSM-IV-TR). En el DSM5, los diferentes trastornos del espectro autista incluidos en el DSM IV-TR (trastorno autista, síndrome de Asperger y trastorno generalizado del desarrollo no especificado, entre otros) desaparecen para quedar todos englobados en una única nomenclatura de trastornos del espectro del autismo (TEA) (Tabla I).
Parte del diagnóstico del DSM5 incluye la adición de grados de severidad (en 3 grados) tanto para los síntomas de la comunicación social como de comportamientos restringidos y repetitivos: grado 3 “necesita ayuda muy notable”; grado 2 “necesita ayuda notable”; y grado 1 “necesita ayuda” (Tabla II).
Con la nueva clasificación del DSM 5(1), se pasa de una aproximación categorial del autismo a una conceptualización con perspectiva dimensional. El concepto del autismo como un espectro de trastornos de diferente severidad y una conceptualización más dimensional, no es una observación actual, sino que tiene su origen prácticamente en los orígenes de la definición del autismo. Por otra parte, estudios recientes de TEA han encontrado que, existe una tendencia con la edad a la mejora de sus síntomas y mejor adaptación funcional, aun tratándose de un trastorno crónico y que el retraso de inicio de lenguaje no es una diferencia significativa en la adaptación funcional en la evolución a la edad adulta. Entre otros factores, han sido relevantes en los cambios de los criterios diagnósticos y en la eliminación de las diferentes subcategorías incluidas en los trastornos generalizados del desarrollo del DSM IV-TR, apoyando una denominación genérica de TEA para expresar el concepto dimensional de autismo.
Con el DSM 5, la variabilidad fenotípica del cuadro queda reflejada a través de sus especificadores y modificadores que acompañarán al diagnóstico(1). Los especificadores hacen referencia a si el trastorno está o no asociado a una afección médica o genética (como sería el caso del X-frágil o trastorno de Rett), o a un factor ambiental conocido o a otro trastorno del desarrollo neurológico (epilepsia…), mental o del comportamiento. Los modificadores describen factores relacionados con la mayor o menor gravedad del cuadro clínico, en referencia a si el niño presenta o no: déficit intelectual, deterioro de lenguaje, posibles trastornos comórbidos y, por último, la presencia de catatonía.
Con la nueva clasificación del DSM5, los criterios de inclusión son más específicos y estrictos, incluyendo por ejemplo las alteraciones sensoriales (hipo o hipersensibilidad) dentro de la dimensión de patrones de comportamiento, intereses y actividades restringidas y repetitivas. Ello reduce la posibilidad de falsos positivos, pero también el TEA del DSM5 es menos sensible a detectar e incluir cuadros clínicos menos graves, como sería el grupo que presentaba alteraciones en la dimensión socioemocional y de la comunicación pragmática, sin presentar síntomas en el área de las conductas repetitivas que anteriormente se incluían en el DSM IV-TR. Este grupo en concreto, dentro de la nueva clasificación del DSM5, quedaría probablemente incluido en el trastorno de la comunicación social, que recoge las alteraciones y dificultades en el uso pragmático de la comunicación, sin presencia de conductas repetitivas, ni alteraciones sensoriales. Categoría diagnóstica, por el contrario, no exenta de críticas.
Epidemiología
Los estudios recientes de incidencia y prevalencia de TEA reflejan un incremento paulatino, posiblemente relacionado a cambios de criterios diagnósticos, de la definición de casos, y de un incremento de reconocimiento del TEA por los profesionales.
Quedan lejos las primeras estimaciones de la prevalencia de TEA, que lo situaba y consideraba como un trastorno raro que afectaba a 4-5/10.000, para pasar a estimaciones más actuales, de 1 cada 68 niños de 8 años, según el “Centers for Disease Control and Prevention” (CDC) en EE.UU. en su “Morbidity and Mortality Weekly Report (MMWR)”, basadas en datos del 2012(2). Resultados más recientes del CDC en EE.UU., encuentran que el TEA tiene una prevalencia del 2,24% en el 2014 (1/45), otros trastornos del desarrollo (OTD) del 3,57% y discapacidad intelectual (DI) del 1,10%. En una encuesta del CDC anterior, en el 2011-2013, los datos eran: 1,25% TEA, 4,84% OTD y 1,27% DI, respectivamente. Este incremento del diagnóstico e identificación del TEA en los datos del 2014 coincide, entre otras razones, con un cambio metodológico, como es el cambio de cuestionario para hacerlo más sensible a la detección de casos de TEA(3,4).
Análisis recientes sobre el estudio de prevalencia de TEA del CDC americano del 2012, aparte de mostrar un incremento en la prevalencia de valoraciones anteriores, presenta otros datos interesantes, como una estimación significativamente mayor entre los niños de 8 años (23,6 por 1.000) en comparación con las niñas de la misma edad años (5,3 por 1.000). La estimación de prevalencia de los TEA era significativamente mayor entre los blancos no-hispanos en comparación con los niños negros no-hispanos y los hispanos. También, se observaban diferencias de estimación según la zona. El 82% de los chicos identificados con TEA presentaban diagnósticos o adaptaciones educacionales con anterioridad, no encontrándose diferencias por sexo o color. El porcentaje de edad en el que recibían una evaluación completa era de 36 meses, sin diferencias en cuanto al sexo, pero si era superior en la población de niños no hispánicos blancos (45%), comparado con la población negra no–hispana (40%) e hispanos (39%). Los resultados relacionados con el incremento de prevalencia eran interpretados como una mejor detección y evaluación de los TEA por el sistema, tanto educacional como de salud. Las diferencias de prevalencia en TEA según raza/etnia, especialmente para el grupo de hispanos, y las diferencias encontradas en la edad de recibir una evaluación completa, parecían poder explicarse por la falta de posibilidades de algunos niños de tener acceso a los servicios, tanto de atención como de intervención(2).
Más del 62% de la población con TEA tiene una capacidad intelectual dentro de la normalidad, con un CI mayor o igual a 70, de los que un 38% tiene un CI mayor o igual a 85. Es decir, el TEA ocurre mayormente en niños, que en la primera infancia no presentan alteraciones evolutivas muy marcadas y que están educados en educación ordinaria. La discapacidad intelectual asociada a TEA es más prevalente proporcionalmente en chicas que en chicos.
Signos precoces de TEA
La detección precoz sigue siendo un aspecto fundamental en el abordaje del autismo, ya que la iniciación de un tratamiento precoz está íntimamente ligada a su pronóstico.
Los estudios de investigación en poblaciones de riesgo, como son los hermanos de los niños con autismo, estaban basados en los resultados de estudios que demostraban un incremento indiscutible de la incidencia y prevalencia de TEA o de síntomas de autismo en hermanos de personas con TEA y tenían principalmente, el objetivo de establecer estudios longitudinales para conocer el desarrollo de síntomas tempranos o signos precoces de autismo. Estos estudios se basaron en que: 1) los padres de niños con autismo, aunque recibían el diagnóstico entre los 3-4 años referían observar signos de anormalidades pronto en su desarrollo, entre los 12-18 meses, e incluso antes del año, según describían los padres mirando retrospectivamente; y 2) la intervención del autismo en estadios precoces se relaciona con un mejor pronóstico.
Para estudiar la emergencia temprana del autismo, los primeros estudios de investigación se concentraron en diseños retrospectivos, videos grabados en casa, registros de historias clínicas y recuerdos de los padres. Los estudios que se basaron en videos grabados por los padres de niños que posteriormente recibieron un diagnóstico de autismo encontraron que, muchos de estos niños manifestaban signos de desviaciones en el desarrollo social y comunicativo, incluso antes de los 12 meses. Estudios retrospectivos de niños con autismo utilizando vídeos previos al diagnóstico señalan que, frecuentemente el comportamiento social es normal a los 4-6 meses y que, entre los 9-12 meses, puede ocurrir una pérdida de competencias sociales, como la mirada ocular, las vocalizaciones, etc. A los 12 meses, se encontraba disminución del contacto ocultar, no reconocer su nombre, no señalar para pedir y no mostrar objetos a los adultos. Sin embargo, estos estudios estaban sujetos a importantes sesgos como son, el influenciado por el recuerdo de los padres y la dificultad de recordar la secuencia temporal de la emergencia de síntomas. Estas limitaciones estimularon la implementación de estudios longitudinales en poblaciones de riesgo de TEA. Los estudios longitudinales en hermanos de niños diagnosticados con TEA, han demostrado una variabilidad importante en el desarrollo de síntomas o signos precoces relacionados con TEA. Algunos hermanos de niños con autismo que luego desarrollaban ellos mismos TEA, no presentaban disminución de contacto ocular o respuesta al nombre o sonrisa social antes de los 12 meses, mientras que en otros casos, se podían presentar estas alteraciones de una manera sutil y no claramente identificables por métodos observacionales. Alteraciones motoras y en la esfera sensorial han sido las alteraciones más claramente detectadas en algunos bebés, que posteriormente desarrollaban TEA durante el primer año de vida, siempre en estudios de poblaciones de riesgo. Signos precoces de alteraciones en el desarrollo social y comunicativo, en general, han sido menos observados en el primer año de vida y aparecen generalmente en el segundo año de vida. Estos estudios longitudinales en poblaciones de riesgo, revelan la variabilidad en el desarrollo de los primeros síntomas o signos de TEA y reflejan la necesidad de monitorizar durante los primeros tres años del desarrollo y en múltiples fases a aquellos niños con alto índice de riesgo de desarrollar TEA. Esto explica las limitaciones y baja sensibilidad que observamos con los instrumentos de cribaje actuales de TEA realizados en un único punto del tiempo. Se podrían destacar dos patrones de síntomas a los 18 meses predictivos de TEA: 1) reducido o alterado contacto ocular, combinado con una disminución de gestos comunicativos y una disminución de dar u ofrecer objetos a una persona para compartirlos; y 2) contacto ocular intacto, es decir, presentando las sutilidades comunicativas, con la emergencia de conductas repetitivas y disminución de dar objetos a una persona para compartir o pedir. Estos dos factores predictivos, independientemente uno de otro, se relacionaban con un incremento de 3 veces el riesgo de desarrollar TEA a los 36 meses, pero el primer factor predictivo se asociaba adicionalmente a un mayor riesgo de tener otros retrasos evolutivos asociados al TEA. Lo que sugiere que, aquellos que presentan una discapacidad intelectual asociada al autismo presentan una emergencia de síntomas relacionados con el TEA más temprana. Por lo tanto, lo que la investigación demuestra es que, puede haber diferentes patrones de desarrollo de síntomas, en periodos diferentes del desarrollo con diferentes procesos(5,21).
Signos precoces en el primer año de la vida
Los estudios que se han realizado sobre signos precoces de autismo en el primer año de la vida, también en poblaciones de riesgo de hermanos con niños con autismo, han sido contradictorios y difíciles de interpretar. Algunos estudios marcaron un camino en la investigación por su importancia, como es el estudio realizado por Jones & Klin (2013), utilizando tecnología eye-tracking en el que, compararon 25 bebés con desarrollo típico y 10 bebés con alto riesgo que después desarrollaron TEA y, quienes entre los 2-6 meses mostraron una disminución de la mirada del bebé a los ojos y un incremento a la boca de una mujer grabada en un vídeo que era la prueba experimental(6). Elsabbag, et al. 2013, también estudiando esta edad, encontraron que los bebés que fueron diagnosticados de TEA a los 36 meses, entre los 7-14 meses mostraron dificultades en la flexibilidad de la atención hacia determinados estímulos(7); y Chawarska, et al. 2013, encontraron que los bebés que posteriormente desarrollaban TEA, a los 6 meses presentaban menos atención a caras utilizando también eye tracking(8). Otros estudios longitudinales en hermanos de niños con TEA, no han encontrado alteraciones del desarrollo social y comunicativo en el primer año de vida, pero, en algunos casos, han encontrado alteraciones motoras y en la esfera sensorial en aquellos bebés hermanos de niños con autismo, que posteriormente desarrollaran TEA(9,21). Quizás no sea un hecho altamente sorprendente que, aspectos evolutivos no claramente relacionados con aspectos diagnósticos de TEA, sean los primeros signos observables, ya que el cerebro se desarrolla de una manera jerárquica, de tal manera que circuitos neuronales relacionados con los sistemas motores y sensoriales se establecen antes postnatalmente que circuitos relacionados con alto nivel de funcionamiento, como es el lenguaje, cognición y habilidades sociales. Este desarrollo del cerebro botton-up implica que, perturbaciones en el circuito básico sensorial-motor pueden ejercer efectos en cascada en el desarrollo de circuitos de alto nivel de desarrollo. Son hipótesis que esperan investigación para ser confirmadas.
Marcadores neurobiológicos tempranos
Estudios recientes han avanzado en el conocimiento de la relación existente entre signos tempranos de TEA con marcadores biológicos, como son: el volumen cerebral y la neuroimagen funcional. Incremento del volumen cerebral en los primeros años de la vida, incluso observable antes de los 12 meses, tanto de la substancia gris como blanca, en especial en lóbulo temporal y frontal y en áreas subcorticales, como la amígdala, ha sido observado en niños posteriormente diagnosticados de TEA. La medida cruda del incremento del tamaño cerebral, es decir, un incremento del perímetro craneal en edades tempranas, se ha asociado a niños con TEA. Esta asociación, por el contrario, está actualmente en debate, debido a estudios recientes que encontraron sesgos por el uso de tablas de crecimiento y perímetro craneal anticuadas para las normas poblacionales. En la dirección de un incremento de tamaño de, al menos, algunas áreas cerebrales, estudios utilizando neuroimagen encontraron agrandamiento de la amígdala en edades precoces relacionado con alteraciones de la atención conjunta y con la severidad de las alteraciones de la comunicación social a los 4-5 años. Otros estudios longitudinales realizados en grupos de alto riesgo, encontraron que un desarrollo aberrante de las conexiones de la substancia blanca entre los 6-24 meses precedía al desarrollo de TEA a los 24 meses, estudios que también encontraron respuestas atípicas neuronales utilizando potenciales evocados a los 6-10 meses en bebés que luego desarrollaban TEA. Estudios menos seleccionados en poblaciones generales que enviaban a bebés para diagnóstico de TEA, también encontraron una menor correlación entre el hemisferio cerebral izquierdo y derecho en áreas relevantes para la comunicación social, utilizando resonancia magnética cerebral funcional(21,22).
Signos precoces de TEA relacionados con la capacidad intelectual
Los signos precoces y la presentación del autismo difieren si el TEA va acompañado de discapacidad intelectual. En estos casos, los signos propios del autismo se acompañan de los propios de la discapacidad, con retraso evolutivo generalizado en su psicomotricidad, comunicación, curiosidad, control de esfínteres y, en general, en su capacidad de adaptación funcional. Podemos decir que, en estos casos, los signos precoces de TEA aparecen más temprano. En aquellos que tienen una capacidad cognitiva dentro de la normalidad, los primeros signos que se identifican tienen una cualidad “más autista”. Es en la guardería, por lo general, que en aquellos TEA de buena capacidad intelectual y buen desarrollo de lenguaje expresivo se identifican los problemas de sociabilidad y comunicación pragmática, las dificultades de adaptarse a las normas, comprender un nuevo entorno alejado de sus referentes adultos y dificultades de incorporarse al juego con sus iguales(21).
Detección y diagnóstico de TEA en edades tempranas: instrumentos de cribado
Cuando hablamos de detección de TEA, se pueden establecer distintos niveles. En un primer nivel, estaría la vigilancia del desarrollo mientras que, en un segundo nivel, estaría la detección específica de TEA, pasando a un tercer nivel, donde situamos ya la valoración diagnóstica específica por parte de un servicio especializado.
Debemos diferenciar el concepto de “cribado”, que consiste en la utilización de un instrumento estandarizado sencillo para identificar la población en riesgo de alteraciones en el desarrollo de “vigilancia del desarrollo”, que consiste en acciones múltiples flexibles longitudinales realizadas a cada niño en cada visita de revisión, para monitorizar el desarrollo e identificar cualquier desviación del desarrollo que pueda causar preocupación.
Primer nivel: vigilancia evolutiva de rutina
Programa del niño sano: debe incluir una combinación de información obtenida por los profesionales de Atención Primaria, que incluya: las preocupaciones de los padres sobre el desarrollo de sus hijos, la utilización de escalas y pruebas sobre el desarrollo general de los niños y la observación por los profesionales de las desviaciones que ocurren en el desarrollo. La AAP (Asociación Americana de Pediatría 2016) recomienda que, todos los niños en edades precoces deberían ser reconocidos por los equipos de Pediatría a los 9, 18 y entre los 24-30 meses para identificar retrasos evolutivos. Reconocimientos adicionales pueden ser necesarios, si los bebés pertenecen a grupos de alto riesgo, como aquellos con prematuridad o bajo peso al nacer, o niños adoptados. También, la AAP recomienda que todos los niños deben ser reconocidos a los 18 y 24 meses, específicamente para signos relacionados con TEA. Grupos de riesgo, como hermanos de niños con TEA o grupos con prematuridad o bajo peso al nacer, pueden requerir cribajes adicionales. El reconocimiento de la evolución del desarrollo de los niños debería incluir protocolos específicos de cribaje conjuntamente con juicio clínico. Un estudio de observación del uso de instrumentos para la detección de TEA en Pediatría destacó que, un 39% de los casos que presentaban signos de TEA no fueron reconocidos por los expertos durante los reconocimientos evolutivos(10). En el futuro habrá que realizar estudios de investigación rigurosos sobre la fiabilidad de utilizar marcadores biológicos, como el eye-tracking en la detección temprana del autismo. Podemos decir que, las diferentes asociaciones de profesionales no están de acuerdo si el uso de un cribaje específico para el autismo debe ser universal o no. Mientras “The American Academy of Pediatrics” recomienda realizar un cribaje para TEA a todos los niños entre 18 y 24 meses en adición a la supervisión del desarrollo y monitorización, “The US Preventive Service Task Force (USPSTF)” 2016 encontró que era inadecuado el realizar un cribaje específico para TEA en aquellos niños en edades precoces que los padres no habían mostrado preocupación sobre el desarrollo de sus hijos, sin tener clara evidencia directa de los beneficios reportados a las familias con esta práctica(11,12). “The American Academy of Neurology y Child Neurology Society” 2016 recomienda vigilancia de rutina del desarrollo en todos los niños identificados como de riesgo y cribaje para autismo con uno de estos dos cuestionarios MCHAT o el Autism Screening Questionnaire(13).
Screening para vigilancia del desarrollo que tienen evidencia de fiabilidad
Existen instrumentos de cribaje del desarrollo en edades precoces, algunos de los cuales se han traducido y validado al habla hispana:
a) Cuestionarios rellenados por padres: son rápidos y fáciles de rellenar. No exigen gran tiempo de los profesionales de Atención Primaria.
• Ages and Stages Questionnaire (ASQ-3) (Bricker & Squires, 2009). Uno de los instrumentos que, además de haber demostrado una buena validez en los estudios realizados, es de fácil administración, lo que hace recomendable su uso. Consiste en 21 cuestionarios correspondientes a edades comprendidas entre 1 y 66 meses, que evalúan aspectos generales del desarrollo. Existe una versión en castellano, validada en población latina en EE.UU. y en población pediátrica de nivel socioeconómico medio-alto en Chile. Ambos estudios validan los cuestionarios de edades 8-9, 18 y 30 meses, mostrando el estudio en la población pediátrica chilena una baja sensibilidad (27,8-50%), pero alta especificidad (92-93,2%) (Tabla III).
• The Parents Evaluation of the Developmental Status (PEDS) (Glascoe, 1998). También es un cuestionario completado por padres de niños entre 0-8 años. Consiste en una pregunta general que los padres deben completar sobre sus preocupaciones sobre el aprendizaje, desarrollo y conducta de sus hijos, seguido de 8 preguntas para extraer la información sobre las preocupaciones de los padres en cada área. La “PEDS Interpretation Form” incluye un algoritmo para decidir la respuesta del profesional ante los resultados del test (Tabla III).
b) Escalas de desarrollo mixtas de aplicación por profesionales e información recogida de padres: se han utilizado generalmente como las medidas gold standard de alteraciones del desarrollo en un primer nivel de cribaje. Traducidas al castellano, pero con la limitación de falta de estudios normativos de su adaptación a la población española. Son costosas en tiempo y requieren formación para su uso, lo que limita su aplicabilidad clínica.
• Bayley Scales of Infant and Toddler Development, Third edition (2005). Aplicada a niños entre 1-42 meses. Existe una versión traducida al castellano en EE.UU., pero no adaptada a la población española. Exige entrenamiento y es costosa en tiempo en su aplicación, unos 90 minutos.
• Batelle Developmental Inventory Screening Test (BDIST) (Newborg, et al. 2005). Consiste en 96 ítems extraídos del BDI-II aplicados en 10-30 minutos, dependiendo de la edad del niño. Existe la limitación de que los estudios de validez se han realizado con la escala total, lo que limita su fiabilidad. Requiere entrenamiento.
• La escala Denver-IIse puede utilizar desde el nacimiento hasta los 6 años. Tiene 125 ítems y lleva unos 30 minutos de administración. Requiere entrenamiento. Ampliamente utilizada, ha sido cuestionada por sus escasos estudios de fiabilidad y algunos estudios realizados han demostrado una buena sensibilidad, pero escasa especificidad, entre 26-43%(13,16).
Dentro de nuestro país, han sido ampliamente utilizadas la Escala Observacional del Desarrollo de Secadas (Secadas, 2011) y la Escala Haizea-Llevant (Fernández & Álvarez, 1989), escalas sencillas y rápidas en su utilización.
Segundo nivel: vigilancia específica para TEA
Cribaje específico para TEA aplicado en la población general. La AAP ha recomendado que todos los niños entre los 18-24 meses deberían tener un cribaje con un instrumento específico para autismo, además de la vigilancia durante las visitas. Estas recomendaciones han sido cuestionadas por la necesidad existente de más información sobre el impacto de la detección e intervención temprana(11). Sensibilidad, se refiere a la proporción de niños correctamente identificados como “de riesgo” y, especificidad, a la proporción de niños correctamente identificados como “no riesgo” por el instrumento de cribaje. “The positive predictive value” (PPV) de TEA de un instrumento de cribaje es la proporción de niños que dieron positivo en el cribaje y que recibieron un diagnóstico posterior de TEA, dividido por el número total de casos que dieron positivo en el cribaje. “The negative predictive value” (NPV) es la proporción de niños que dieron negativo en el cribaje y que no recibieron un diagnóstico posterior de TEA, dividido por el número total de casos que no dieron positivo en el cribaje. Hay que distinguir entre nivel 1 y 2 de cribaje. El nivel 1 se aplica a todos los niños, independiente del status de riesgo (cribaje universal). Por el contrario, el nivel 2 se realiza a los niños identificados como de riesgo, identificados por el nivel 1 de detección o por pertenecer a grupos de riesgo.
Instrumentos de cribaje específico para TEA
1. Modified Checklist for Autism in Toddlers (MCHAT)(17). CHAT fue el primer instrumento de screening para TEA en población general; sin embargo, obtuvo una escasa sensibilidad del 18%, por lo que no se recomendó su uso.
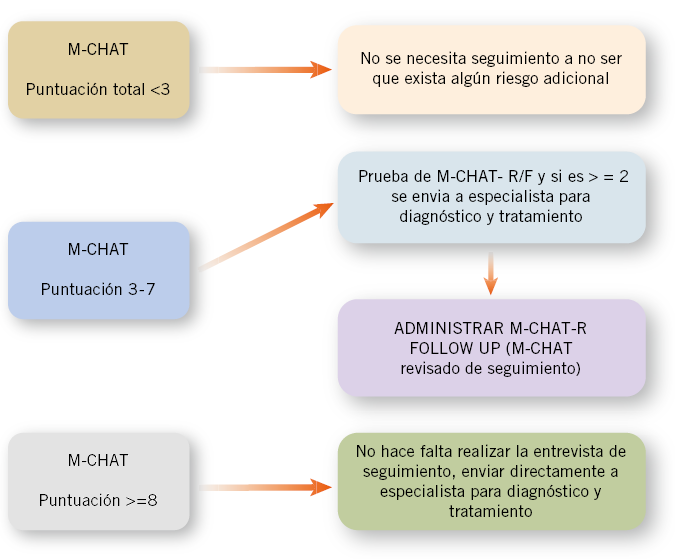
Una mejor adaptación fue el M-CHAT, que se ha utilizado como un instrumento de cribaje de nivel 1. El M-CHAT tiene 23 ítems, y combinado con una entrevista de seguimiento (M-CHATF) ha tenido un PPV de 0,57-0,65 en grupos de población general, resultando menos fiable en grupos de niños con menor edad con una PPV de 0,28 entre 16-23 meses. El alto número de falsos positivos encontrados se debe a niños que presentan desviaciones del desarrollo que no presentarán problemas posteriores o a niños con otras alteraciones del desarrollo que no sea el autismo(14). La validación realizada en España de este instrumento encontró una PPV de 0,19, este bajo índice podría relacionarse a la baja detección de TEA en edades precoces en el estudio(15). La nueva versión del M-CHAT, el M-CHAT-R con seguimiento (M-CHAT- R/F) ha conseguido mejoras en aspectos de fiabilidad de la escala. El cuestionario M-CHAT se ha reducido a 20 ítems, eliminando 3 ítems (juego social de cu-cu, jugar con juguetes y deambular sin propósito) y se mejoró la formulación y descripción de las preguntas. Se ha desarrollo un algoritmo con 3 niveles de riesgo (Fig. 1).
Figura 1. Algoritmo recomendado basado en M.CHAT R/F, screening en dos fases. Fuente: Robins DL, Casagrande K, Barton M, et al. Validation of Modified. Checklist for Autism in Toddlers, Revised With Follow-up (M-CHAT-R/F). Pediatrics. January 2014; 133: 1.
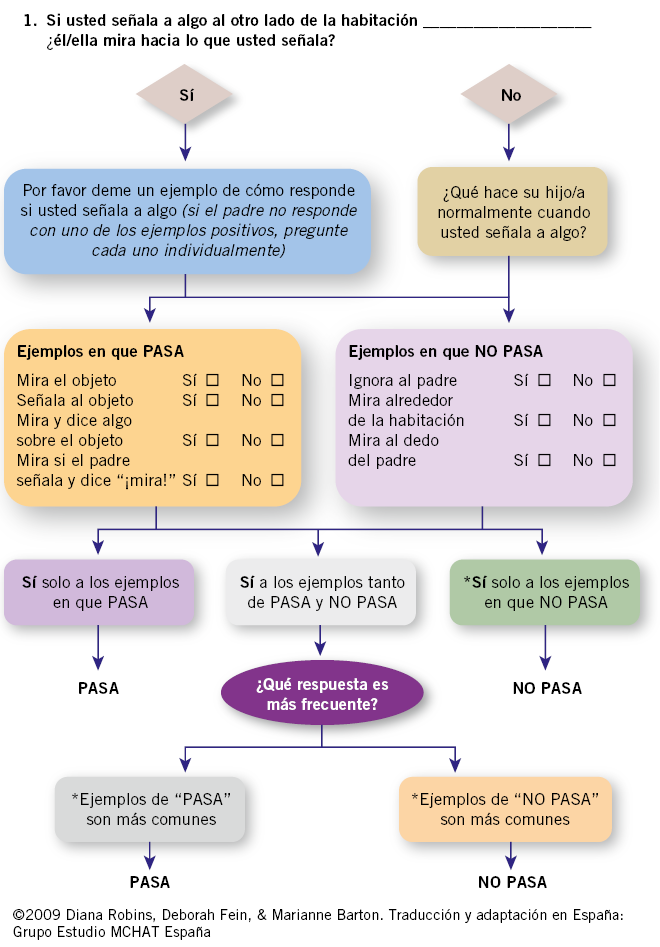
Esta revisión ha mejorado la detección a 67 de 45 por 10.000 niños. El M-CHAT es un cuestionario completado por los padres de niños entre 18-24 meses, diseñado para identificar niños en riesgo de autismo en la población general. El M-CHAT-R con seguimiento (M-CHAT- R/F) se introdujo para mejorar la sensibilidad del M-CHAT, mientras se mantenía la especificidad. El M-CHAT- R/F es un cuestionario que consta de dos etapas. En un primer estadio, los padres deben completar 20 preguntas sí/no. Las preguntas 2, 5 y 12 “sí” indican riesgo y las otras preguntas “no” indican riesgo. En una segunda fase, el profesional pregunta sobre los ítems del cuestionario que no se ha pasado (Fig. 2).
Figura 2. Ejemplo de pregunta en el M-CHAT R/F. Fuente: Robins DL, Casagrande K, Barton M, et al. Validation of the Modified Checklist for Autism in Toddlers, Revised With Follow-up (M-CHAT-R/F). Pediatrics. January 2014; 133: 1.
Se suman con una puntuación total y se categoriza el M-CHAT-R. Se considera un screening positivo si da más de 3 en puntuación total o da positivo para más de 2 ítems considerados críticos. El 54% de los niños clasificados de riesgo por el M-CHAT R/F desarrollaron TEA y un 98% de los positivos en las dos fases del screening, desarrollaron problemas o preocupaciones con su desarrollo(16) (Fig. 3).
Figura 3. A) Curva ROC para el screening M-CHAT R/F. B) Tabla de sensibilidad y especificidad del M-CHAT R/F para cada puntuación total. Fuente: Robins D.L., Casagrande K. Barton M. et al. Validation of the Modified Checklist for Autism in Toddlers, Revised With Follow-up (M-CHAT-R/F). Pediatrics. January 2014, 133, 1(16).
2. Pervasive Developmental Disorder Screening Test–II (PDDST-II) (Siegel B, 2004). Comprende preguntas sobre el desarrollo del niño en los primeros 48 meses de vida. Está basada en información de padres y tiene 3 versiones para 3 diferentes estadios de las consultas. Etapa 1: cribaje en Atención Primaria; evalúa si hay algún retraso en el desarrollo (Stage 1-PCS 22 ítems). Etapa 2: para diferenciarlo de otros trastornos del desarrollo (Stage 2-DCS14). Etapa 3: para diferenciar los diferentes trastornos existentes en TEA (Stage 3-ACSS 12 ítems)(13,22) (Tabla III).
3. ESAT (Early screening for autistic traits questionnaire) (Dietz, et al. 2006). Es un cuestionario con 14 ítems, diseñado para identificar niños en riesgo de TEA a los 14-15 meses, en combinación con supervisión especifica del desarrollo. Se realiza en dos fases, primero una versión corta de 4 ítems, que se pasa en una visita pediátrica y a los que dan positivo se les pasa la de 14 ítems ESAT por un profesional, incorporando información de padres. Se ha realizado un estudio en Holanda de 31.724 niños en la comunidad. Ha demostrado escasa sensibilidad en niños pequeños, PPV del ESAT es de 0,25 a los 14-15 meses(17).
4. Screening Tool for Autism in Two-Year-Olds (Stone, 2008). Utilizado en grupos clínicos de edad de 2 años, enviados para la sospecha de TEA, la sensibilidad era de 92% y la especificidad del 85%. Existe evidencia preliminar de su utilidad en edades entre 14-23 meses, pero requiere estudios posteriores. El STAT es más complejo de administrar que el M-CHAT-R, pero está disponible un entrenamiento informatizado que mejora la efectividad de su utilización(17).
Instrumentos de cribaje que evalúan aspectos varios del desarrollo en menores de 24 meses
Communication and Symbolic Behavior Scales (CSBS) checklis y el Communication and Symbolic Behavior Scales Developmental Profile (CSBS DP) Infant/Toddler Checklist (Wetherby and Prizant, 2001). La CSBS es un screening completado por los padres de niños hasta los 24 meses, sobre las habilidades comunicativas y simbólicas. Tiene 24 ítems en 3 dimensiones: comunicación social y emociones, lenguaje expresivo y receptivo y conductas simbólicas. Es fácil de pasar, dura 5 minutos y la corrección 2 minutos. Tiene un buen valor predictivo positivo de 0,75. Posteriormente, el CSBS-DP añade: al checklist rellenado por los padres, un cuestionario de seguimiento que los padres deben rellenar (CQ) de 4 páginas y un ejemplo de conducta. Aplicado en una población comunitaria entre 6-24 meses, identificó un 93% de los niños que a los 3 años recibían un diagnóstico de TEA. El PPV fue de 0,75 para TEA y para todos los que tenían retrasos del desarrollo, la PPV era más alta. Es decir, estos estudios demostraban la utilidad de utilizar instrumentos de cribado más amplios de alteraciones del desarrollo y, posteriormente, los que resultaban positivos, deberían ser enviados para diagnóstico de TEA. Actualmente, se está estudiando la efectividad del PEDS y ASQ para la detección de TEA.
Instrumentos de cribaje específicos para TEA en niños de mayor edad
Aquellos niños con TEA de capacidad intelectual dentro de la normalidad manifiestan sus dificultades al iniciar el primer ciclo de educación primaria, incluso en educación secundaria, donde las demandas sociales y escolares (planificación, trabajos) aumentan.
• El test infantil del síndrome de Asperger (CAST) (Scott FJ, Baron-Cohen S, Bolton P & Brayne C, 2002). Ha demostrado ser útil en la identificación temprana de niños, de edades comprendidas entre los cuatro y los once años, cuyos comportamientos sugieren un alto riesgo de presencia de TEA de alto funcionamiento. Consta de 37 ítems y cada pregunta puede proporcionar 0 a 1 puntos, pero hay seis preguntas que no puntúan. Una puntuación total de 15 o superior sería indicativa de la presencia de comportamientos que justifican una valoración diagnóstica por parte de un profesional especializado. Una puntuación de 15 o más detecta el 87,5% de los niños con TEA de alto funcionamiento, con un valor del CAST predictivo de TEA del 0,64 y una especificidad del 0,98. Por encima de la puntuación 17, mejora el valor predictivo a 0,86(18).
• Para edades mayores, se puede utilizar el SCQ (Social Communication Questionnaire) (Michael Rutter, Anthony Bailey i Catherine Lord, 2003). Es un cuestionario rellenado por los padres o cuidadores para niños, adolescentes y adultos entre 4 y 40 años. Está basado en las preguntas del ADI-R. Existe una versión basada en información actual y otra de información recogida a lo largo de toda la vida. Se obtiene una puntuación total con un punto de corte de 15. Es fácil de utilizar, lleva menos de 15 minutos y los estudios realizados en poblaciones clínicas demuestran una sensibilidad del 85% y una especificidad del 75%.
• Social Responsiveness Scale (SRS) (Constantino JN, 2005). Tiene 65 ítems para ser completado por padres o profesores y se aplica en edades entre 4 y 18 años. Es más sensible a alteraciones más sutiles de TEA(13,22).
Tercer nivel: valoración diagnóstica de TEA
Una vez que un niño ha sido detectado, debe ser remitido para una apropiada evaluación. El diagnóstico debe realizarse por un equipo multidisciplinario de profesionales especializados en TEA, de una manera rápida y efectiva, evitando cualquier retraso diagnóstico y en la intervención terapéutica.
Los aspectos fundamentales incluidos en una evaluación diagnóstica de TEA, son los siguientes:
• Evaluación médica y neurológica amplia: identificar alteraciones en el desarrollo o regresiones evolutivas a cualquier edad, identificar cualquier encefalopatía, crisis epilépticas, problemas con el sueño o la comida y pica, por la posible exposición al plomo.
• Historia familiar: estudios en familias han demostrado que la probabilidad de aparición de autismo se incrementa en hermanos de niños autistas, por lo que es una población de riesgo que necesitará una supervisión en su desarrollo.
• Examen físico y neurológico:
- Perímetro cefálico: existe un incremento del perímetro cefálico a partir de los 6 meses de edad, pero en un 80% de los casos, posteriormente, se normaliza. Un 20% siguen con incremento del perímetro cefálico (megalencefalia o macrocefalia, sobre todo, por incremento de la substancia blanca cerebral), incremento relacionado con la severidad del autismo.
- Examen general: dada la alta prevalencia de autismo en la esclerosis tuberosa, se debería realizar un examen usando una lámpara de Wood y un examen del estado mental: evaluación de las interacciones sociales, del juego, del lenguaje, de la función comunicativa y de su conducta. A cualquier edad, debe explorarse la comprensión social, el reconocimiento de sus propias emociones y la empatía o el reconocimiento y comprensión de las emociones de las otras personas.
- Examen motor: se ha encontrado hipotonía (25%), espasticidad (menos del 5%), apraxia de un miembro en (un 30% de los niños autistas con CI normal y en un 75% de los autistas con discapacidad intelectual) y estereotipias motoras (en un 60% en los niños con autismo y CI bajo).
- Audiometría:todo niño con retraso en el desarrollo, especialmente los que tengan retrasos en las áreas sociales y del lenguaje, deberían ser sometidos a una audiometría.
• Pruebas de laboratorio:
- Estudios metabólicos: están indicados cuando existe una historial de: letargia, vómitos cíclicos, crisis epilépticas tempranas, rasgos dismórficos o toscos y/o retraso mental.
- Estudios genéticos: cariotipo y análisis de ADN para el X frágil está indicado como protocolo de rutina en casos de sospecha de TEA, pero, actualmente, estudio del ADN microarrays y, en el futuro, estudios de secuenciación exómica o de todo el genoma, deberían realizarse, sobre todo en aquellos casos acompañados de: discapacidad intelectual, alteraciones morfológicas asociadas o/y cuadros de regresión o atipicidad en la presentación. Los padres de niños con autismo deben recibir consejo genético por expertos en TEA, ya que el riesgo de tener un segundo hijo con TEA se incrementa. Test genéticos ayudarán a aconsejar a la familia si la variante genética relacionada con la causa del autismo es heredada o producida de novo, es decir que dependiendo de las variantes genéticas encontradas en las familias, el riesgo de recurrencia en hermanos puede estar muy incrementado o ser igual que en poblaciones generales.
- Pruebas electrofisiológicas: 1) las indicaciones para EEG incluyen: evidencia de crisis clínicas, historia de regresión (pérdida clínicamente significativa en la función social o comunicativa) y situaciones donde hay un alto índice de sospecha clínica de que la epilepsia pueda estar presente. 2) La prevalencia de epilepsia en niños preescolares con autismo se ha estimado entre un 7 y un 14% y la prevalencia acumulada en adultos está entre el 20 y el 35%. Los picos de aparición de crisis ocurren en la primera infancia y en la adolescencia.
- Neuroimagen: el autismo no se considera una indicación para una exploración de neuroimagen, incluso en niños con macrocefalia. La presencia de rasgos neurológicos no explicados por el diagnóstico de autismo (examen motor asimétrico, disfunción en los pares craneales, severos dolores de cabeza), puede ser una indicación para realizar una exploración de neuroimagen.
Pruebas diagnósticas específicas para autismo
El diagnóstico del autismo requiere una aproximación multidisciplinaria. La evaluación debe incluir información de los padres, la observación del niño, de la interacción con él y del juicio clínico. Existen instrumentos clínicos diagnósticos con demostrada fiabilidad en el diagnóstico de TEA, especialmente el ADI-R (autism diagnostic interview-revised) o el ADOS (autism diagnostic observational schedule), disponible en castellano y recientemente actualizado al ADOS2. El ADI-R y ADOS2 son considerados instrumentos clave en la evaluación clínica y de investigación del TEA. El ADI-R es una entrevista con los padres o cuidadores de niños, adolescentes y adultos con TEA, incluye un algoritmo diagnóstico con referencia principalmente a los 4-5 años y otro algoritmo de la edad actual. Es válido para niños con edades mayores de 2 años; aunque, actualmente, se está desarrollando un algoritmo para niños con edades mentales mayores de 12 meses. El ADOS2 es una entrevista semiestructurada para niños, adolescentes y adultos con TEA. Mediante el juego, conversación, imágenes y libros, el entrevistador va provocando “conductas autistas” que va puntuando con el fin de obtener algoritmos diagnósticos que clasifican los casos en: normalidad, autismo o trastorno del espectro autista. El ADOS tiene 5 módulos de aplicación y algoritmos diagnósticos clasificados según edad y nivel de lenguaje. Dichas herramientas deben ser utilizadas por profesionales entrenados en su uso, requieren tiempo para su aplicación. El ADOS2 incluye la incorporación de un nuevo módulo T para niños pequeños con edad cronológica o no-verbal mayor de 12 meses(22).
Recurrencia de TEA en hermanos y estabilidad diagnóstica
En familias que tiene un hijo con TEA, 1 de cada 5 de los hermanos posteriores recibirá un diagnóstico similar y si tiene 2 o más hermanos con TEA, el riesgo de otro hermano con TEA se incrementa a 1 de cada 3.
Estudios recientes en EE.UU., reflejan un alto índice de alteraciones evolutivas en los primeros años de la vida del niño. Un 17% de los niños tenían alteraciones del desarrollo o de la conducta (motora, lenguaje, conducta, socioemocional) y un 20-25% riesgo psicosocial. En familias que tienen un hijo con TEA, 1 de cada 5 de los hermanos posteriores recibirá un diagnóstico similar y si tiene 2 o más hermanos con TEA, el riesgo de otro hermano con TEA se incrementa a 1 de cada 3. De aquellos hermanos que no reciben un diagnóstico de TEA, 1 de cada 5 presentarán elevados síntomas de TEA subclínicos para un diagnóstico y/o alteraciones en su desarrollo evolutivo de lenguaje, cognición o desarrollo motor fino y/o grueso(21,25).
En estudios realizados en poblaciones de riesgo, como son los hermanos de niños con TEA, la estabilidad diagnóstica en los primeros años de la vida es muy alta, con un mantenimiento del 93% en aquellos niños que reciben un diagnóstico de TEA a los 18 meses y del 82% para aquellos diagnosticados a los 24 meses. Sin embargo, también existían aquellos que reciben un diagnóstico de TEA a los 36 meses y que no presentaban signos evidentes de TEA en edades más precoces y un 63% que no cumplían criterios a los 18 meses y un 41% a los 24 meses. Estos estudios indican que grupos de alto riesgo para TEA requieren control y observación evolutiva hasta los 36 meses e incluso más tarde(26).
Por el contrario, en algunos casos, la presencia de alteraciones evolutivas precoces en hermanos de niños con TEA, no predijo que desarrollaran más tarde TEA. El estudio realizado por Georgiades, 2013, encontró que un 20% de los hermanos con elevados signos de autismo a los 12 meses, presentaban: alteraciones en la comunicación social, déficits cognitivos y problemas internalizantes a los 3 años, pero no cumplían criterios suficientes para un diagnóstico de TEA(9). Por lo tanto, existe la necesidad de desarrollar programas de cribado adaptados a la investigación realizada recientemente, que refleja una variabilidad en las rutas del desarrollo para TEA y, por otra parte, ensayos clínicos aleatorizados que estudien si la intervención precoz en estas primeras alteraciones evolutivas o signos precoces relacionados con autismo disminuyen la incidencia posterior del TEA a los 3 años de vida o posteriormente.
Etiología del TEA
En la etiología del TEA, poco a poco van conociéndose los diferentes mecanismos etiológicos. Actualmente, la evidencia indica que no existe un autismo, sino que los TEA son diferentes trastornos, de etiologías múltiples, que tienen fenotipos similares. Sabemos que la etiología genética es la más sustentada y que existen diferentes mecanismos genéticos en TEA, que conducirán a fenotipos similares.
Variaciones genéticas normalmente distribuidas en la población con múltiples genes involucrados, mutaciones genéticas de novo o bien heredadas y alteraciones cromosómicas han sido encontradas en TEA. La epigenética ADN y replegamientos de la cromatina, está relacionada con factores ambientales u otros factores genéticos que alteran la expresión genética y que los estudios actuales indican implicados de una manera relevante en el TEA. Diferentes mecanismos parecen estar relacionados con el TEA, asociado o no a discapacidad intelectual. Los TEA con capacidad intelectual dentro de la normalidad se relacionan con causas genéticas con cientos de genes, con polimorfismos distribuidos normalmente en la población y que infieren efectos aditivos de riesgo. Los TEA asociados a discapacidad intelectual se asocian a mutaciones genéticas de novo o heredadas o a alteraciones cromosómicas. Factores ambientales, todavía en gran parte desconocidos, como: alteraciones perinatales, exposición a tóxicos o medicamentos durante el embarazo, etc., interaccionan con factores genéticos en el desarrollo del TEA.
Un 10% de los casos de TEA se asocian a causas sindrómicas, de causas monogénicas identificadas, como es el caso de: frágil X, fenilcetonuria, tuberoesclerosis, síndrome de Rett, etc. Un 5%, se asocian a alteraciones cromosómicas raras, como es el caso de la heredada duplicación maternal 15q11-q13, trisomía 21, síndrome de Turner (45X), 47XYY, 47XXY, etc. Otro 5%, se asocian a variaciones en el número de copias de partes del genoma, que se repiten más o menos veces, comúnmente denominados copy number variants (CNV), particularmente aquellos CNV que son raros o poco frecuentes en la población: 16p11-2, duplicación 7q 11-23, 22q 11-2, 15q 13-3, etc. Otro 5% asociados a variaciones genéticas penetrantes y poco frecuentes en la población (SHANK, etc.).
El otro 75% de las causas sigue siendo, en principio, de causas multifactoriales desconocidas, con factores ambientales modulando la expresión genética y factores como la edad paterna, que podrían asociarse a un incremento de mutaciones genéticas. El riesgo genético de recurrencia una vez que se tiene un hijo con TEA, podría variar según las diferentes etiologías genéticas implicadas y ser menor en aquellos casos en que surgen de novo variaciones genéticas (no heredadas de los padres) en el hijo afectado.
Tratamiento
Intervención temprana
La detección temprana y la consecuente implementación de un programa de intervención precoz continúa siendo la opción por excelencia, al relacionarse con una mejor evolución clínica del niño.
Un mayor conocimiento acerca de las desviaciones del desarrollo normalizado de signos relacionados con TEA, ha permitido iniciar intervenciones en edades muy tempranas, incluso antes del año. Cada vez más, son las publicaciones que presentan resultados prometedores, con datos de seguimiento en algunos años posteriores, de la implementación de intervenciones tempranas intensivas e integrales, específicamente diseñadas para niños con TEA. Las variables comunes de dichas intervenciones actuales con mejores resultados son: el enfoque naturalista, el empoderar a los padres y personas significativas y el estar diseñadas teniendo en cuenta tanto las teorías del desarrollo interpersonal, como la implementación de las técnicas y estrategias de la modificación de conducta, sobre todo, para el manejo de aspectos de conducta del niño con TEA.
La intervención va dirigida a cambiar el foco de atención preferente de los niños con signos precoces de TEA (detectados a partir del año y antes de los 36 meses), por el funcionamiento de los objetos hacia una motivación preferencial por el mundo social. El programa de intervención debe incorporar objetivos basados en los hitos del desarrollo esperable de un niño “típico”. La intervención en estas edades tempranas gira alrededor de rutinas sociales centradas en todo momento en la motivación e intereses del propio niño, teniendo como finalidad, estimular y trabajar las áreas del neurodesarrollo más afectadas en los niños con TEA, que son: la imitación, la comunicación y el lenguaje, la iniciación y motivación social, el desarrollo de las habilidades motoras, cognitivas, así como de juego, siendo el centro de toda la intervención, la interacción con un adulto. Se da especial importancia a ser capaces de generar oportunidades de interacción social en las que sea el propio niño con señales de TEA, el que inicie la interacción espontáneamente. Para ello, el peso recae en que el adulto sea suficientemente sensible, habilidoso y creativo para ser motivante. Mediante la imitación e iniciación de todo tipo de acciones, movimientos y actividades en interacción con otra persona, se busca estimular las estructuras cerebrales relacionadas con el seguimiento de la mirada, la atención conjunta, la percepción facial, el reconocimiento de emociones y la imitación, entre otras. Otros de los factores relevantes en el enfoque de dichas intervenciones es el importante papel que se otorga en empoderar a los padres. De modo que se diseñan programas estructurados que se llevan a cabo con los padres, para que trabajen los déficits en comunicación e interacción de sus hijos. Avances tecnológicos, por ejemplo, grabaciones con móvil, comienzan a utilizarse en la implantación de intervenciones en espacios naturales para que puedan ser evaluadas y recibir un feedback por parte del terapeuta, para mejorar la competencia del manejo de los padres.
Como resumen, cualquier tipo de intervención debe cumplir los siguientes requisitos:
a. Inicio lo más temprano posible, incluso antes de los 3 años. En estas edades, cuando la sospecha está presente, pero el diagnóstico puede aún no ser claro, es preciso hacer un seguimiento periódico de su evolución e iniciar la intervención adecuada lo más precozmente posible y que incida en los síntomas más relevantes de cada niño hasta confirmar o descartar el diagnóstico.
b. A todas las edades, la intervención debe ser compartida y coordinada entre los padres, la escuela y el terapeuta responsable del niño. Padres y profesionales deben conocer las dificultades específicas de los TEA y aplicar las estrategias adecuadas a cada niño en concreto.
c. Debe realizarse, siempre que sea posible, dentro de los entornos naturales del niño.
d. La intervención debe ser intensiva. Debe incluir las horas que el niño está en la escuela y las que pasa con su familia. Las pautas y estrategias que se deben utilizar han de estar previamente consensuadas entre familia, escuela y terapeuta y deben ser diseñadas específicamente para cada niño en concreto.
e. En el proceso diagnóstico y en el diseño de la intervención, hay que contar con un equipo multidisciplinar y tener la oportunidad de contar con la colaboración de otras especialidades médicas, si se considera oportuno(19,23).
Existen diferentes prioridades de la intervención en función del momento evolutivo y de las capacidades de cada niño
1. En niños pequeños, es imprescindible hacer una intervención estructurada y predecible para el niño, teniendo siempre en cuenta sus posibilidades intelectuales. La estructura debe adaptarse, en la medida de lo posible, en casa y en la escuela. La utilización de estructura con apoyos visuales y recompensas sencillas facilita a cualquier niño pequeño la comprensión de lo que se espera de él. El método TEACCH (Treatment and Education of Autistic and Related Communications Handicapped Children, Schopler 1988), proporciona muchos ejemplos prácticos y sencillos de poner en práctica la estructura para favorecer el juego, los aprendizajes y la autonomía. En niños con poca capacidad comunicativa verbal es aconsejable la introducción de métodos alternativos de comunicación cuando sea el momento adecuado [p. ej., The Picture Exchange Communication System (PECS)].
2. A lo largo de la Educación Primaria y según la evolución de cada niño, hay que ir decidiendo el futuro de su escolarización. Para los niños con capacidad intelectual normal o superior, la ubicación recomendada es la escuela ordinaria. La intervención adecuada irá dirigida a facilitar la comprensión del entorno, a su integración en grupo, a adecuar su conducta a las exigencias sociales y a mejorar dificultades específicas de aprendizaje o lenguaje, en caso de que se considere necesario.
3. Durante la Educación Secundaria, en general, hay que priorizar la mejora de sus competencias sociales, en sesiones individuales o de grupo, la ampliación de sus intereses, el control de su impulsividad y mejorar su nivel de autonomía para acercarse al máximo a la adquirida por los compañeros de su misma edad. En esta etapa, suele hacerse más evidentes las posibles comorbilidades, especialmente con problemas de ansiedad u otros problemas emocionales. La ansiedad, en pacientes con capacidad intelectual normal o superior, es debida frecuentemente al inicio de la autoconciencia de sus propias dificultades y de los frecuentes fracasos, a pesar de sus esfuerzos por mejorar, aunque no siempre sean adecuados. Los episodios de acoso son muy frecuentes en esta etapa y, además de ser fuente de ansiedad, pueden, si no se controlan, desembocar en patologías más graves con el paso del tiempo.
4. La adolescencia siempre es una etapa conflictiva y en las personas con diagnóstico de TEA, las dificultades se añaden a las que ya vienen soportando a lo largo de su vida. Su conducta, afectividad y capacidad de socialización vendrá determinada, en gran parte, por su experiencia vital durante las etapas previas. El objetivo de iniciar una intervención en grupo con chicos con características similares en la etapa anterior, es favorecer el establecimiento de un grupo de referencia con el que compartir intereses a nivel social, poner en práctica el nivel de autonomía que cada uno de ellos ha sido capaz de alcanzar y adecuar la responsabilidad que exige su edad y su condición concreta.
La mayoría de personas diagnosticadas de TEA precisan, durante toda la vida, una supervisión o intervención terapéutica.
Tratamiento farmacológico
en los TEA
No existen, en la actualidad, fármacos de probada efectividad para los síntomas nucleares propios del TEA. Existen dos fármacos aprobados por la FDA para su uso en TEA que son: la risperidona y el aripiprazol para su uso en la irritabilidad, impulsividad e hiperactividad asociada a TEA.
Los tratamientos farmacológicos utilizados podemos dividirlos en aquellos para los síntomas específicos del TEA y aquellos utilizados para las comorbilidades asociadas.
Principios generales del tratamiento
La mayoría de los niños con autismo o no necesitan o no se benefician del tratamiento con fármacos y los tratamientos psicosociales de base conductual, generalizados e individualizados son los tratamientos de elección.
Como principio general básico en cualquier población infantil y adolescente, está instaurar siempre el tratamiento tanto farmacológico como psicosocial en estrecha colaboración con los padres. Una guía importante en esta población tan vulnerable es evitar ingresos hospitalarios y soluciones crónicas para problemas agudos tan frecuentes en personas con autismo ante cambios, situaciones nuevas o inesperadas. Siempre, ante un empeoramiento brusco de conducta, debemos evaluar la existencia de una comorbilidad asociada, para lo cual el realizar un diagnóstico por un profesional experto en el tema resulta ser esencial. Como guía inalterable en una población tan vulnerable a los efectos secundarios de los fármacos, es comenzar siempre exclusivamente con un fármaco e incrementar despacio, siempre con el propósito de evitar efectos secundarios y retirar el fármaco si estos son severos. Siempre el profesional debe controlar muy cercanamente posibles efectos secundarios y facilitar a los padres un rápido acceso a los profesionales en caso de que surjan imprevistos con la medicación. Como norma, el profesional debe intentar maximizar y esperar la efectividad de un fármaco, antes de realizar cambios, evitando plurifarmacología. Muchas veces, la plurifarmacoterapia enmascara efectos secundarios de otro fármaco, por lo que la retirada de fármacos puede producir reacciones no esperadas. Los padres deberán tener una amplia información de los efectos esperados con el tratamiento farmacológico, de cuáles son los efectos secundarios más frecuentes y ser anticipados de los efectos secundarios por los cuales deberían parar el fármaco. Es importante evitar comenzar tratamientos farmacológicos durante periodos de cambio en la vida de estos niños o situaciones muy estresantes escolares o en situaciones relacionadas con comorbilidades médicas que requieren un tratamiento o respuesta diferente al farmacológico.
Tratamiento para los síntomas específicos de autismo/TEA
Actualmente, los únicos fármacos que tienen indicación por la FDA Americana (Food and Drug Administration)en personas con TEA son: la risperidona (2006) y el aripiprazol (2009), ambos utilizados para las comorbilidades frecuentemente asociadas al autismo, sin que exista evidencia de mejora en los síntomas específicos del TEA. Sin embargo, la investigación está abriendo nuevas posibilidades terapéuticas. Estudios de genética están identificando proteínas implicadas en la trasmisión cerebral disfuncional en las personas con TEA, favoreciendo el diseño de estudios con tratamientos noveles, mediante ensayos clínicos aleatorizados en poblaciones diana.
Oxitocina: es la medicación más ampliamente estudiada y más prometedora para síntomas específicos de autismo, especialmente en el área de la sociabilidad. Es un neuropéptido producido en el hipotálamo y que en estudios de animales ha demostrado su implicación en la conducta y vinculación maternal hacia el bebé, además de en procesos relacionados con la memoria. Estudios de investigación, han relacionado polimorfismos genéticos del receptor de la oxitocina con autismo, y estudios de neuroimagen han asociado tratamiento con oxitocina intranasal con mejoras en la conectividad cerebral. El uso de oxitocina intranasal se ha asociado a una mejora en la cognición social, contacto ocular y reconocimiento de expresiones faciales. La oxitocina tiene la limitación de que se utiliza intranasalmente y que tiene una vida media muy corta en sangre; por lo que, actualmente, no es una opción terapéutica recomendable.
Estudios de genética han señalado alteraciones en diferentes proteínas implicadas en la trasmisión sináptica, que han guiado la realización de diferentes ensayos clínicos con diferentes sustancias. Es el caso de IGF-1 (insulin-like growth factor 1), que actúa en la maduración de las espinas dendríticas regulando la formación sináptica y que en ensayos clínicos se ha asociado a una mejora de la conducta prosocial y a una disminución de las conductas estereotipadas.
Otros fármacos que se están experimentando en autismo, son los implicados en el metabolismo del glutamato, sustancia relacionada con una mejora en la trasmisión sináptica.
La memantina es un antagonista del receptor NMDA, y el antibiótico D-cycloserina un agonista del receptor de NMDA, ambos han demostrado en ensayos clínicos alguna eficacia en la mejora de la cognición social, lenguaje y reducción de las conductas estereotipadas.
Alteraciones en el sistema excitatorio-inhibitorio de trasmisión sináptica, han sido implicadas en autismo y el sistema Gabaérgico, también se ha implicado en la patogénesis del TEA. El Arbaclofen, agonista del receptor GABA (b), se ha relacionado con mejoras en la sociabilidad en algunos estudios en humanos. El clonazepan que actúa en los receptores GABA (a), también se ha utilizado en autismo, aunque sin evidencia definitiva de mejora. Con la excepción de la oxitocina, en la que existen varios estudios actuales señalando su promesa terapéutica, en el resto de fármacos las evidencias encontradas son todavía preliminares.
Tratamiento para las comorbilidades asociadas al autismo
• Antipsicóticos atípicos: solo existe evidencia alta de eficacia en el tratamiento del TEA (específicamente de la comorbilidad asociada al TEA) para dos fármacos: el aripiprazol y la risperidona, mejorando: irritabilidad, agitación, labilidad emocional, hiperactividad y conducta estereotipada evaluada por la escala de autismo ABC. Los efectos secundarios más frecuentes asociados a estos fármacos son: sedación, ganancia de peso y efectos extrapiramidales, como el temblor e hipersalivación. El incremento de la prolactina, sobre todo en edad adolescente, necesita ser monitorizado. Ambos son antipsicóticos atípicos, que actúan preferencialmente en receptores dopaminérgicos y serotonérgicos, pero que, también, tienen efectos en receptores histamínicos, adrenérgicos y colinérgicos. Se han utilizado otros antipsicóticos atípicos con alguna evidencia de efectividad, pero limitada, como es el caso de la olanzapina, que se ha asociado a importante ganancia de peso y efectos metabólicos en niños que desaconsejan su uso.
La quetiapina, que por su efecto sedativo se utiliza en casos de trastornos de conducta con insomnio resistentes al tratamiento. En casos muy graves, la clozapina ha demostrado alguna evidencia de efectividad. Los antipsicóticos atípicos están indicados en casos de severa agresividad hacia otras personas o hacia ellos mismos, irritabilidad e impulsividad muy marcada. La olanzapina, quetiapina y clozapina no tienen indicación en el TEA por la FDA.
• Fármacos estimulantes utilizados en el tratamiento del TDAH: existe moderada evidencia de eficacia para el tratamiento con metilfenidato en la comorbilidad del TEA con TDAH. El DSM-5 reconoce esta comorbilidad por primera vez. Existen varios ensayos clínicos aleatorizados que han demostrado su eficacia en el autismo asociado a hiperactividad, impulsividad, inatención y agresividad. Sin embargo, su eficacia y tolerabilidad en TEA asociado a TDAH es menor que cuando el TDAH se presenta sin estar asociado al autismo. Siempre que se utilice el metilfenidato es necesario comenzar con dosis muy bajas y muy lentamente, descartando efectos secundarios de: irritabilidad, agitación, disforia, labilidad emocional, conductas compulsivas y empeoramiento de conductas estereotipadas que, en muchas ocasiones, exigen la retirada del fármaco. Derivados anfetamínicos se utilizan de una manera similar al metilfenidato en personas con autismo.
• Fármacos no estimulantes utilizados en el tratamiento del TDAH: atomoxetina, fármaco no estimulante que actúa como inhibidor de la recaptación de la noradrenalina, también tiene moderada evidencia de mejora en los síntomas del TDAH y ansiedad asociadas al autismo y, en un 21% de los casos de autismo, mejoraron los síntomas en comparación con el 9% de los que mejoraron con placebo. Los efectos secundarios más frecuentes son los asociados a un incremento de la irritabilidad. Fenómenos de activación que incluyen alteraciones del humor: irritabilidad, labilidad del humor, agresividad, hiperactividad, incremento de energía, disminución de la necesidad de dormir e impulsividad, se han encontrado asociados al uso de ISRS (inhibidores selectivos de la recaptación de serotonina), a otros antidepresivos y a la atomoxetina.
Guanfacina y clonidina, ambos también, fármacos no estimulantes utilizados en el tratamiento del TDAH y que actúan como agonistas de los receptores alfa2 adrenérgicos, tienen evidencia de mejora en los problemas de hiperactividad, impulsividad y atención asociados al autismo, pero no se encontró mejora en los casos que existía irritabilidad y agresión asociada. En general, su uso es bastante seguro, pero es recomendable el control de tensión arterial y se ha de evitar en aquellos que tengan antecedentes de cardiopatías. Sedación, es un efecto secundario ocasional, cuando se administran los fármacos durante el día.
• Fármacos inhibidores selectivos de la recaptación de serotonina (ISRS): no existen todavía estudios randomizados, doble ciego estudiando la efectividad de los ISRS en personas con TEA asociado a depresión o ansiedad. Existen varios estudios que no han encontrado evidencia de mejora en las conductas repetitivas propias del autismo. Casi un 50% de los pacientes con autismo tratados con ISRS, presentan fenómenos de activación que exigen la retirada del fármaco. Los ISRS más recomendados son aquellos que tienen una vida media más corta, como es el caso de la sertralina y el citalopran, pero existen estudios realizados con la fluoxetina con buena tolerancia y efectividad. Fluoxetina y fluvoxamina tienen también evidencia de efectividad en TOC (trastorno obsesivo compulsivo) asociado a TEA en adultos. No existen estudios de la utilización de los ISRS en la población de adultos con TEA comórbido con ansiedad.
• Fármacos utilizados en las alteraciones del sueño: La melatonina es considerada como la hormona del sueño y se utiliza en TEA para mejorar el inicio del sueño y disminuir los despertares nocturnos. Se ha asociado el autismo a una disminución de la secreción de melatonina al atardecer. Produce pocos efectos secundarios excepto sedación diurna en algunos casos. Otros fármacos utilizados en el insomnio en personas con autismo son: clonidina, antihistamínicos y trazodona.
• Fármacos utilizados en agresión y agitación: problemas de conducta se asocian con frecuencia al autismo. Las dificultades de expresión verbal, la rigidez y las conductas estereotipadas propias del trastorno, las dificultades de autorregulación emocional e impulsividad frecuentemente asociadas, incrementan el riesgo de conductas agresivas y agitación ante situaciones nuevas, imprevistos o situaciones no comprendidas por las personas con autismo. Fármacos, como: clonidina, guanfacina, antipsicóticos atípicos, propanolol, dyvalproex, lithium, oxcarbazepine y clonazepam son posibilidades terapéuticas en estos casos(20).
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 5th ed. Washington DC: American Psychiatric Publishing; 2013.
2.** Christensen DL, Baio J, Braun KV, et al., 2016. Prevalence and Characteristics of Autism Spectrum Disorder Among Children Aged 8 Years – Autism and Developmental Disabilities Monitoring Network, 11 Sites, United States, 2012. MMWR. Surveill Summaries, 6(No. SS-3) (No. SS-3): 1-23.
3.** Estimated Prevalence of Autism and Other Developmental Disabilities Following Questionnaire Changes in the 2014 National Health Interview Survey.
4.** USA National Health Statistics Report 2015. Number 87, November 13.
5.*** Daniels AM, Halladay AK, Shih A, Elder LM, Dawson G. Approaches to enhancing the early detection of autism spectrum disorders: a systematic review of the literature. J Am Acad Child Adolesc Psychiatry. 2014; 53(2): 141-52.
6.** Jones W& Klin A. Attention to eyes es present but indecline in 2-6 month old infants later daignose with autism. Nature. 2013; 504: 427-31.
7.** Elsabbagh M, Fernandes J, Jane Webb S, et al. Disengagement of visual attention in infancy es associated with emerging autism in toddlerhood. Biol Psychiatry. 2013; 74: 189-94.
8.** Chawarska K, Macari S, Shic F. Decreased spontaneous attention to social scenes in 6 month old infants later diagnosed with autism spectrum disorders. Biol Psychiatry. 2013; 74: 195-203.
9.** Georgiades S, Szatmari P, Zwaigenbaum L, et al. A prospective study of autistic like traits in unaffected siblings of probands with autism spectrum disorders. JAMA psychiatry. 2013; 70: 42-8.
10.** Gabrielsen TP, Farley M, Speer L, et al. Identifying Autism in a Brief Observation. Pediatrics. 2015; 135(2): 330-38.
11.*** Siu AL, and the US Preventive Services Task Force. Screening for Autism Spectrum Disorder in Young Children. US Preventive Services Task Force Recommendation Statement. (USPSTF). JAMA. 2016; 315(7): 691-6.
12.** Al- Qabandi M, Gorter JW, Rosenbaum P. Early autism detection: are we ready for routine screening? Pediatrics. 2011; 128(1).
13.*** Alcantud F, Alonso Y & Rico D. Herramientas de cribado para la detección de retrasos o trastornos del desarrollo. Una revisión sistematica de la literatura. Revista Española de Discapacidad. 2015; 3(2): 7-26.
14.*** Robins DL, Fein D, Barton ML & Green JA. The Modified Checklist for Autism in Toddlers: An initial study investigating the early detection of autism and pervasive developmental disorders. Journal of Autism and Developmental Disorders. 2001; 31(2): 131-44.
15.** Canal-Bedia R, Garci´a-Primo P, Marti´n-Cilleros MV, et al. Modified checklist for autism in toddlers: Cross-cultural adaptation and validation in Spain. J Autism Dev Disord. 2011; 41: 1342-51.
16. Robins DL, Casagrande K, Barton M, et al. Validation of the Modified Checklist for Autism in Toddlers, Revised With Follow-up (M-CHAT-R/F). Pediatrics. 2014; 133: 1.
17. Dietz C, Swinkels S, van Daalen E, van Engeland H, Buitelaar JK. Screening for autistic spectrum disorder in children aged 14-15 months. II: Population screening with the Early Screening of Autistic Traits Questionnaire (ESAT). Design and general findings. J Autism Dev Disord. 2006; 36(6):713-22.
18. Scott FJ, Baron-Cohen S, Bolton P, Brayne C. The CAST (Childhood Asperger Syndrome Test). Preliminary development of a UK screen for mainstream primary-school-age children. Autism. 2002; 6(1): 9-31.
19.** Green J, Charman T, McConachie H, et al. PACT Consortium. Parent-mediated communication-focused treatment in children with autism (PACT): a randomised controlled trial. The Lancet. 2010; 375(9732): 2152-60.
20.** Hervas A. Psicofarmacología del TEA. En: César Soutullo. Coordinador. Guía Esencial de Psicofarmacología del niño y del adolescente. 2ª Edición. Editorial Médica Panamericana, Madrid, 2017.
21. Hervás A, Maristany M, Salgado M, Sánchez Santos L. Los trastornos del espectro autista. Pediatr Integral. 2012; XVI(10): 780-94.
Bibliografía recomendada
– Zwaigenbaum L, Bauman ML, Stone WL, et al. Early Identification of Autism Spectrum Disorder: Recommendations for Practice and Research. Pediatrics. 2015; 136(Suppl 1): S10-S40.
Excelente revisión de un panel de clínicos e investigadores resumiendo la actualización de la evidencia en marcadores tempranos de TEA en 8 conclusiones.
– Zwaigenbaum L, Bauman ML, Fein D, et al. Early Screening of Autism Spectrum Disorder: Recommendations for Practice and Research. Pediatrics. 2015; 136(Suppl 1): S41-S59.
Excelente revisión de un panel de clínicos e investigadores, resumiendo la actualización de la evidencia sobre los diferentes instrumentos de screening para utilizar en poblaciones generales y en consultas de Atención Primaria resumidos en 8 conclusiones.
– Zwaigenbaum L, Bauman ML, Choueiri R, et al. Early Intervention for Children With Autism Spectrum Disorder Under 3 Years of Age. Pediatrics. 2015; 136(Suppl 1): S60-S81.
Excelente revisión de los tratamientos con alguna evidencia en ensayos clínicos de efectividad para niños menores de 3 años.
– British Columbia Ministry of Health Planning. Standards and Guidelines for the Assessment and Diagnosis of young Children with Autism Spectrum Disorders in British Columbia; 2003.
Una excelente guía sobre la progresión de aparición de síntomas de autismo en las primeras edades.
– Ozonoff S, Young GS, Carter A, et al. Recurrence risk for autism spectrum disorders: A Baby Siblings Research Consortium study. Pediatrics. 2011; 128: e488-95.
Excelente estudio prospectivo longitudinal por un consortium internacional, realizado en poblaciones de riesgo para TEA, como son los hermanos de niños con autismo, seguidos hasta los 3 años y clasificados en aquellos que recibían un diagnóstico de TEA y los que no lo recibían.
– Ozonoff S, Young GS, Landa RJ, et al Diagnostic stability in young children at risk for autism spectrum disorder: a baby siblings research consortium study. Journal of Child Psychology and Psychiatry. 2015; 56(9): 988-98.
Excelente estudio prospectivo longitudinal por un consortium internacional, realizado en poblaciones de riesgo para TEA, como son los hermanos de niños con autismo, seguidos hasta los 3 años y que establece la alta estabilidad diagnóstica en primeras edades, cuando se recibe un diagnóstico de TEA.
– Dealhunty C. Development delays and autism. Screening and surveillance. Clevelance Clinical Journal of Medicine. 2015; 82(Suppl 1): 29-32.
Excelente revisión de los instrumentos de screening utilizados en TEA.
| Caso clínico |
|
Edad: 2 años y 10 meses. Constelación familiar: núcleo familiar formado por padre, madre y Marc. Escolarización: no ha ido a guardería. En un mes inicia escolarización ordinaria, cursando P3. Motivo de consulta: valoración diagnóstica y orientación terapéutica. Antecedentes obstétricos y antecedentes familiares: embarazo: sin complicaciones. Parto: natural y sin complicaciones. Apgar: 10/10. Peso al nacimiento: 3.205 g. Antecedentes familiares: no relevantes. Antecedentes personales: no relevantes. Anamnesis Las primeras preocupaciones surgieron en el ámbito familiar, cuando tenía unos 14 meses de edad. Observaron una baja respuesta al nombre y baja iniciativa por comunicarse (ni con gestos ni con palabras). La familia consultó con el pediatra, que les derivó al equipo de atención precoz de su zona. Empezaron sesiones semanales con psicología, con la presencia de la madre. Los padres refieren no tener ninguna evaluación estandarizada ni hipótesis diagnósticas. Los padres refieren un desarrollo psicomotor dentro de la normalidad (se mantuvo sentado a los 7 meses de edad, gateo a los 9 meses y marcha autónoma a los 13 meses). Control de esfínteres diurno a los 2 años y 6 meses, aunque en la actualidad, continúan las dificultades con el control intestinal diurno, ya que pide que le pongan el pañal y si no, hace retención de esfínteres. Sueño correcto. Alimentación basada en alimentos triturados y algún sólido (galleta, pan, manzana, patatas). Las primeras palabras aparecieron sobre los 18 meses y la aparición de frases cortas (con la presencia de un verbo) las sitúan sobre los 2 años y medio. Su lenguaje actual está basado en frases cortas de 2-3 palabras. Utiliza el lenguaje para hacer demandas o buscar ayuda. Poco uso del lenguaje para compartir, para expresar emociones, para informar. Su lenguaje tiene tendencia a ser repetitivo y presenta ecolalias demoradas (repite anuncios de la televisión y frases de adultos con la misma entonación original). Los padres le describen como un niño poco expresivo con la cara y con las manos: o ríe o llora, pero no ven expresiones más sutiles con la cara. Si se le insiste, dice adiós con la mano. No recuerdan ningún gesto espontáneo. Cuando está muy contento, sí se acerca a los padres, pero solo lo hace de forma ocasional. Puede llevar objetos que le gustan a los padres, pero, también, es de forma ocasional. Presenta un juego repetitivo con los objetos (hacer subir y bajar un coche por la rampa, montar y desmontar torres), aunque sí es variado (coches, torres, construcciones, puzles, pelota, trenes…). Sobre los 2 años apareció el juego simbólico. La familia explica que era un juego enseñado, pero que, poco a poco, fue añadiendo acciones nuevas (juego de médicos, cocinitas, profesores…). Este tipo de juego, no aparece cuando juega solo, solamente cuando los padres le incitan. Sobre los 18 meses apareció aleteo de brazos, cuando estaba muy contento. Ahora lo continúa haciendo, pero cede rápido. Presencia de hipersensibilidades auditivas (motos, petardos, taladros), táctiles (arena, pintura, agua en la cara) con un alto grado de interferencia en el ámbito familiar y escolar. En el parque, no muestra mucho interés por los otros niños. En algunos momentos, sí le llama la atención cómo se tiran los otros por el tobogán o en los columpios y puede querer tirarse detrás de ellos. Aun así, pierde rápido el interés. Si un niño le dice algo en el parque, la mayoría de las veces no responde. Con niños más conocidos, puede ponerse a jugar a su lado, pero, raramente, comparten un juego a no ser que el adulto intervenga. Exploración del estado mental y físico Buen estado general. Disminución del contacto ocular utilizado en las interacciones. Disminución de los acercamientos sociales (solamente busca el adulto para pedir objetos o pedir ayuda). Baja respuesta social (no responde a la mayoría de las preguntas que se le realizan). Poco uso de gestos (señala en una ocasión para pedir; en las otras dos ocasiones en las que el adulto no le entiende, llora). Poca expresividad facial. Explora los objetos de la sala. Tiende a usarlos de un modo repetitivo. Se asusta con los juguetes con música alta. Muestra en una ocasión un objeto a la madre. No busca compartir juegos con ellos. Facies sin rasgos dismórficos. Exploraciones complementarias PEA: normales. EEG: sin presencia de anormalidades evidentes. RM cerebral: normal. Cariotipo: 46XY. DNA microarray: no anormalidades evidentes. Búsqueda de cromosoma X frágil: negativa. Hemograma y bioquímica de rutina: normales. Exploración psicopatológica 1. WPPSI-III (escala de inteligencia de Wechsler para niños 1ª etapa 2,6- 3,11). • Cociente inteligencia total (CIT) = 89. • Lenguaje general (LG) = 80. • Escala verbal (CIV) = 78. • Escala manipulativa (CIM) = 100. • CI- media poblacional = 100 ± 20. 2. Escala de adaptación funcional: escala adaptativa de Vineland. Resultados por áreas: • Comunicación PT: 78. • Hábitos vida diaria PT: 68. • Socialización PT: 69. • Conducta desadaptativa: signicativo. 3. Entrevista con el niño diagnosticado de TEA: ADOS (autismo diagnóstico observacional): algoritmo diagnóstico. 4. Entrevista diagnóstica con la familia: Autism Diagnostic Interview (ADI-R). Algoritmo diagnóstico. • Alteraciones cualitativas en la interacción social recíproca. - A.1. Incapacidad para utilizar conductas no verbales en la regulación de la interacción social. - A.2. Incapacidad para desarrollar relaciones con sus iguales. - A.3. Falta de goce o placer compartido. - A.4. Falta de reciprocidad socio-emocional. - Puntuación total A: 12 (punto de corte 10). Significativo. • Alteraciones cualitativas de la comunicación. - B.1. Falta o retraso del lenguaje hablado e incapacidad para compensar esta falta mediante gestos. - B.2. Incapacidad relativa para iniciar o sostener un intercambio conversacional. - B.3. Habla estereotipada, repetitiva e idiosincrásica. - B.4. Falta de juego imaginativo o juego social imitativo espontáneo y variado. - Puntuación total B (verbal): 10 (punto de corte 8). Significativo. - Puntuación total B (no verbal): 9 (punto de corte 7). Significativo. • Patrones de conducta restringidos, repetitivos, estereotipados. - C.1. Preocupación absorbente o patrón de intereses circunscrito. - C.2. Adhesión aparentemente compulsiva a rutinas o rituales no funcionales. - C.3. Manierismos de manos y dedos. - C.4. Preocupaciones con partes de objetos o elementos no funcionales de los materiales. - Puntuación total C: 4 (punto de corte 3). Significativo. • Alteraciones en el desarrollo evidentes a los 36 meses o antes. Puntuación total 4 (punto de corte 1). Significativo. Orientación diagnóstica Con toda la información recogida a la familia, los resultados de las pruebas estandarizadas y la observación realizada a lo largo de las sesiones, se concluye que Marc cumple criterios para el diagnóstico de un trastorno del espectro del autismo según criterios DSM5. • Requiere un apoyo significativo en los déficits de comunicación social. • Requiere un apoyo significativo en las conductas repetitivas. • No presenta una discapacidad intelectual. • Sin retraso en la adquisición del lenguaje. • Un lenguaje actual basado en frases de 2-3 palabras. Presenta un déficit en el lenguaje respecto a su edad cronológica y respecto a su edad cognitiva no verbal. • Sin comorbilidad médica. • Sin comorbilidad psiquiátrica. • Sin regresión a lo largo de su desarrollo. Recomendaciones Se recomienda a la familia, iniciar un tratamiento de base cognitivo-conductual con modelo basado en la interacción social aplicado, generalizado mediante la formación de padres y en el ámbito de la escuela con la que se trabajen todas las áreas del desarrollo afectadas de forma intensiva, partiendo de situaciones de juego y siguiendo la iniciativa del propio niño. Se establecerán 14 objetivos de tratamiento con 4 pasos progresivos para conseguir cada objetivo en los que se enseñarán las pautas a los padres y ámbito escolar. Se establecerán registros semanales de frecuencia de consecución de objetivos. Asimismo, se recomienda que en el entorno escolar, se establezcan objetivos de trabajos concretos y medibles de: las áreas de comunicación receptiva, comunicación expresiva, imitación, juego con iguales, motricidad fina y motricidad gruesa y hábitos de autonomía. En el ámbito escolar, resultará imprescindible la coordinación interna de todos los profesionales que trabajan con Marc, así como la coordinación con la familia y los profesionales externos al ámbito escolar.
|