 |
| Temas de FC |
J. Sánchez de Toledo Codina, C. Sábado Álvarez
Servicio de Oncología y Hematología Pediátricas. Hospital Materno Infantil Vall d’Hebron. Universitat Autònoma de Barcelona
| Resumen
Los linfomas son la tercera neoplasia más frecuente en la edad pediátrica, por detrás únicamente de las leucemias y de los tumores del sistema nervioso central. En el año 2014, se comunicaron al Registro Español de Tumores Infantiles, 128 nuevos casos de linfomas. A diferencia de lo que ocurre en la edad adulta, donde la mayoría de los linfomas son de histología nodular, indolentes y de fenotipo B, los linfomas pediátricos son predominantemente difusos, de alto grado de malignidad y con una distribución casi equivalente entre los fenotipos B y T. Cabe distinguir, separadamente, el linfoma de Hodgkin (LH) del resto de linfomas no Hodgkin (LNH), la mayoría de los cuales pertenece, en la población infantil, a uno de los cuatro grupos siguientes: linfoma de Burkitt (LB), linfoma difuso de células grandes B (LDCGB), linfoma linfoblástico (LL) y linfoma anaplásico de células grandes (LACG). Los avances en la clasificación de los linfomas –que pasó de ser una clasificación puramente morfológica a la utilización de la inmunohistoquímica y, actualmente, empieza a utilizarse la biología molecular– han contribuido a la gran mejoría en el pronóstico de este grupo de enfermedades, que han pasado de ser invariablemente mortales a presentar globalmente supervivencias por encima del 80%. |
| Abstract
Lymphomas are the third most common neoplasia in children after leukaemia and central nervous system tumours. The Registro Español de Tumores Infantiles registered 128 new cases of lymphoma during the year 2014. In contrast with what happens in the adult, where most lymphomas are of nodular histology, indolent and of B phenotype, childhood lymphomas are mainly diffuse, of high grade of malignancy and with an equal distribution between B and T phenotypes. Hodgkin’s lymphoma can be separately distinguished from the rest of non-Hodgkin’s lymphomas which, during childhood, can be distributed among the following four clinical entities: Burkitt’s Lymphoma, Diffuse Large B-cell Lymphoma, Lymphoblastic Lymphoma and Anaplastic Large Cell Lymphoma. Progress in the classification of lymphomas –that has evolved from a purely morphologic system to the use of immunohistochemical and currently molecular biology tools- has contributed to the improvement in the prognosis of lymphomas that has changed from being a group of diseases with dismal prognosis to a highly curable one with mean survivals above 80%. |
Palabras clave: Linfoma de Hodgkin; Linfoma no Hodgkin; Cáncer pediátrico
Key words: Hodgkin’s Lymphoma; Non-Hodgkin’s Lymphoma; Cancer in childhood
Pediatr Integral 2016; XX (6): 390-400
Linfomas de Hodgkin y no Hodgkin
Introducción
Los linfomas son el conjunto de enfermedades neoplásicas de los linfocitos. Se diferencian de las leucemias en que el proceso oncogénico ocurre en las fases extramedulares del desarrollo linfocitario. El origen de los diferentes linfomas dependerá de la estirpe y de la etapa en la que el linfocito inicie su proceso de malignización.
Los linfocitos son unas células únicas en el organismo, porque deben alterar su estructura genética para poder formar los receptores antigénicos específicos, T o B. Los linfocitos B, en la fase del desarrollo madurativo que ocurre en el centro germinal de los ganglios linfáticos y del timo, presentan, al entrar en contacto con un antígeno, un fenómeno conocido como hipermutación somática, que consiste en una exacerbada mutagénesis en la región variable del gen de las inmunoglobulinas, cuyo objetivo es lograr la especificidad antigénica. En una fase posterior de su proceso madurativo, para poder sintetizar IgM, el linfocito B necesita realizar nuevos reordenamientos en el gen de las inmunoglobulinas, conocidos como recombinación de cambio de clase (class-switch recombination). Todos estos procesos, necesarios para lograr una adecuada respuesta inmune adaptativa, conllevan un riesgo mayor de mutaciones equivocadas, alguna de ellas, al fin, potencialmente oncogénica(1).
Linfoma de Hodgkin
Introducción
El LH presenta dos picos de incidencia, siendo la neoplasia más frecuente entre los 15 y los 19 años de edad, y volviendo a aumentar su frecuencia en el anciano.
El LH representa el 7% de las neoplasias en la edad pediátrica y el 1% de la mortalidad debida a cáncer infantil. Es excepcional en el lactante y su incidencia va aumentando durante la infancia hasta ser la neoplasia más frecuente entre los 15 y los 19 años de edad. La incidencia del LH presenta variaciones según la región geográfica, el nivel socioeconómico y el estado inmunológico del paciente(2). En los países desarrollados, se observan dos picos de incidencia, el primero en la adolescencia o al inicio de la edad adulta, y el segundo en ancianos; sin embargo, en los países en vías de desarrollo, el primer pico de incidencia se adelanta a la edad infantil. El 80% de los casos de LH en menores de 5 años de edad, se da en varones, a los 12 años de edad la proporción niño/niña se iguala y, a partir de los 15 años de edad, la proporción se invierte, el 80% de los casos se da en niñas(3).
Patología
La Clasificación de 2008 de los Tumores de los Tejidos Linfoides y Hematopoyéticos de la Organización Mundial de la Salud (OMS)(4) reconoce dos tipos de LH clínica y biológicamente distintos(5): el LH clásico y el LH nodular, de predominio linfocítico (LHnPL) (Tabla I).
El LH se caracteriza histológicamente por la escasa presencia de células malignas en el tumor (<1%) y la abundancia de células reactivas no malignas acompañantes, como: linfocitos, eosinófilos, neutrófilos, histiocitos y células plasmáticas. En el caso del LH clásico, las células malignas se denominan células de Hodgkin cuando son mononucleares, células de Reed-Sternberg cuando son multinucleares o, en conjunto, células de Hodgkin Reed-Sternberg (HRS). En el caso del LHnPL, se denominan células histiocíticas y linfocíticas (HL) o células en palomitas de maíz. Actualmente, la evidencia señala que la célula causante del LH es un linfocito B(6).
La asociación del virus de Epstein Barr (VEB) con el LH se conoce desde hace tiempo, pero el papel que juega el virus en el desarrollo del tumor sigue sin comprenderse. El genoma del virus se encuentra en un 25-50% de las células de HRS. Normalmente, todas las células de un paciente están infectadas por la misma cepa del virus y, en caso de recaída, se aísla de nuevo la misma cepa de VEB que estaba presente al principio de la enfermedad. Las células infectadas expresan los antígenos del VEB según el patrón de infección latente tipo II; es decir, expresan la proteína latente de membrana (LMP) tipo 1 y 2A y el antígeno nuclear 1, pero no el antígeno nuclear 2, ni el antígeno del cápside, ni el antígeno precoz. El porcentaje de casos que expresan la LMP tipo 1 depende del subtipo histológico, desde casi el 100% de los casos de LH clásico subtipo depleción linfocítica asociado a infección por VIH, hasta una presencia casi nula en el LHnPL(7).
Clínica
El LH se presenta clínicamente como una tumoración ganglionar no dolorosa en la región cervical, supraclavicular o mediastínica; en ocasiones, acompañada de síntomas sistémicos, como son: fiebre, pérdida de peso y sudoración nocturna.
La forma de presentación clínica típica del LH sería la de una niña de 12 años de edad que desarrolla una adenopatía grande, no dolorosa en la región cervical, supraclavicular o axilar acompañada o no de síntomas sistémicos y de masa mediastínica(8) (Fig. 1).
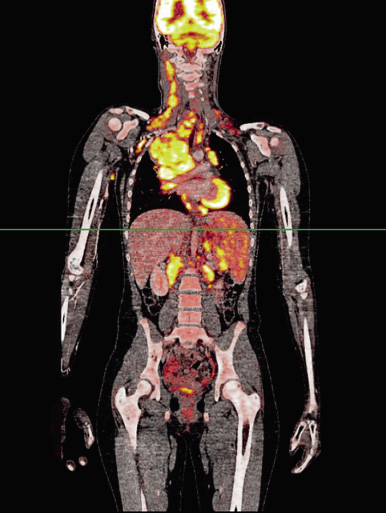
Figura 1. Linfoma de Hodgkin estadio IIIA. Reconstrucción coronal de una 18F Glucosa PET/CT, realizada como estudio inicial en niña de 13 años de edad. Hiperseñal indicativa de actividad metabólica patológica en las regiones cervical y supraclavicular del lado derecho, mediastino, hilios pulmonares, hepático y esplénico y del propio bazo. Captación fisiológica cerebral, miocárdica y vesical. Foco captante en cara interna del brazo derecho atribuida a adenopatía de localización atípica. La biopsia de una adenopatía cervical mostró linfoma de Hodgkin clásico variante escleronodular. Se clasificó como estadio IIIA.
Menos del 3% de las adenopatías en el LH son infradiafragmáticas. La masa mediastínica está presente en el 75% de los casos, y en el 30% es “bulky” (masiva); es decir, con un volumen superior a los 200 mL. En estos casos, puede ir acompañada de: tos, disnea, estridor, disfagia y síndrome de vena cava superior. Los síntomas sistémicos tienen valor pronóstico e implican cambios en las decisiones terapéuticas. Se denominan síntomas B y son: fiebre, sudoración nocturna y pérdida de peso. El prurito y el dolor desencadenado por la ingesta de alcohol, aunque característicos, no se consideran síntomas B. No son excepcionales los fenómenos autoinmunes: anemia hemolítica, trombocitopenia y neutropenia.
El LHnPL supone menos del 10% de los casos de LH, se presenta clínicamente, mayoritariamente en varones y con formas localizadas de la enfermedad.
Diagnóstico diferencial
El diagnóstico diferencial del LH abarca todas las causas de adenopatías, sean infecciosas, autoinmunes o malignas, y la velocidad del proceso diagnóstico debe adaptarse a las características clínicas de la adenopatía y de los signos y síntomas acompañantes.
El diagnóstico diferencial del LH comprende cualquier clase de adenopatía, sea maligna o de otra etiología. Las causas más frecuentes de infiltración maligna adenopática son los LNH, las leucemias y las metástasis de tumores sólidos. Las causas no neoplásicas de aumento de tamaño de los ganglios linfáticos incluyen las enfermedades reumáticas (lupus eritematoso sistémico) o infecciosas (VEB, toxoplasma, micobacterias, Bartonella). La presencia de signos o síntomas acompañantes puede ayudar a diferenciar algunas de estas entidades. Una adenopatía supraclavicular o látero-cervical baja siempre es sospechosa de neoplasia y el proceso diagnóstico debe acelerarse. Ante la ausencia de otras alteraciones clínicas, se puede adoptar una conducta expectante durante unos días. En el caso de persistencia de la adenopatía, el primer escalón diagnóstico consiste en la realización de un hemograma con fórmula leucocitaria y determinación de reactantes de fase aguda, serologías víricas, PPD y una radiografía de tórax. Si todo ello es normal y la adenopatía permanece estable, se puede prolongar la observación durante 2 o 3 semanas adicionales.
El diagnóstico diferencial de la masa mediastínica dependerá de la forma y localización; por ejemplo, en el mediastino anterior, la hiperplasia tímica puede persistir hasta los 10 años de edad.
Evaluación diagnóstica
La punción aspiración con aguja fina (PAAF) puede ser el primer paso en el proceso diagnóstico, pero no es suficiente para diagnosticar el LH. Ante la sospecha clínica, se precisa el examen histológico de una adenopatía completa, para poder valorar su arquitectura. El PET (tomografía por emisión de positrones) y la resonancia magnética (RM) de cuerpo entero están revolucionando el estudio de extensión del LH y, lo que es más importante, la toma de decisiones durante el tratamiento de los LH.
La anamnesis debe recoger datos sobre síntomas previos, infecciones pasadas, vacunaciones y antecedentes familiares de cáncer o inmunodeficiencias.
El examen físico debe incluir la valoración del estado general, el peso y la talla, cambios en la piel, presencia de adenopatías –anotando su localización y tamaño–, visceromegalias y signos de obstrucción vascular (síndromes de vena cava superior o inferior) o dificultad respiratoria. La exploración física meticulosa del aparato cardiorrespiratorio y de la región del anillo de Waldeyer es muy importante.
Los exámenes complementarios incluirán una analítica básica y una radiografía de tórax. La velocidad de sedimentación globular, la linfopenia, la cupremia, los receptores solubles de IL y otros marcadores sanguíneos se relacionan con la agresividad de la enfermedad.
Para el diagnóstico de certeza del LH, la PAAF no es suficiente, porque la escasez de células malignas aumenta las probabilidades de que el material obtenido dé un resultado falsamente negativo. La biopsia de una adenopatía completa facilitará el trabajo del patólogo, que debe diferenciar con certeza el LH clásico del LH nodular de predominio linfocítico, puesto que el tratamiento es completamente distinto y permitirá obtener material suficiente para los cada vez más necesarios estudios moleculares.
Para la biopsia, se debe escoger la adenopatía más accesible. En caso de masa mediastínica voluminosa acompañada de síntomas de compromiso respiratorio o cardio-circulatorio, se debe posponer la biopsia e iniciar tratamiento empírico con corticoides hasta poder llevar a cabo una sedación con seguridad(9).
El diagnóstico se completa con el estudio de extensión de la enfermedad, que nos permitirá clasificarla según los estadios de Ann-Arbor modificados por Cotswolds (Tabla II).
Los estudios de imagen clásicos, morfológicos, como son la radiología simple, el TAC o la RM, están siendo sustituidos por estudios funcionales, como la Tomografía por Emisión de Positrones (PET) o las técnicas especiales de RM(10).
La afectación de la médula ósea (MO) en el LH ocurre de forma nodular o parcheada, por lo que, a menudo, la biopsia o el aspirado de MO son negativos; mientras que las modernas exploraciones de imagen, como el PET o la RM de cuerpo entero, demuestran la afectación. La tendencia moderna consiste en evitar las dolorosas punciones óseas y substituirlas por pruebas de imagen.
Tratamiento
Actualmente, sobreviven más del 90% de los pacientes diagnosticados de LH. El objetivo de los nuevos protocolos terapéuticos es la disminución de los efectos secundarios sin comprometer las tasas de curación.
Los excelentes resultados en cuanto a supervivencia del LH son un logro alcanzado en los años 80 del siglo pasado; sin embargo, los efectos secundarios, incluyendo la elevada incidencia de segundas neoplasias en los supervivientes del LH, han sido una amarga lección. Los protocolos modernos intentan mantener la misma tasa de curación, pero disminuyendo la intensidad del tratamiento, especialmente evitando la radioterapia (RT) en los pacientes de mejor pronóstico.
La mayoría de países europeos participa en los estudios EuroNet PHL. Actualmente, se está poniendo en marcha el estudio EuroNet PHL-C2 que consiste, a grandes rasgos, en obviar la RT en aquellos pacientes que muestran una buena respuesta tras dos ciclos de quimioterapia (QT) tipo OEPA (Oncovin [Vincristina], Etopósido [VP16], Prednisona y Adriamicina [Doxorrubicina]). La respuesta se valora según criterios morfológicos (RM o TAC) y funcionales (PET/CT). Los pacientes se estratifican en 3 niveles de riesgo. El nivel de riesgo viene determinado por el estadio según la clasificación de Ann-Arbor, la presencia de síntomas B, la presencia de enfermedad masiva (>200 mL) y, por último, una VSG superior a 30 mm la 1ª hora. Los pacientes con nivel de riesgo 1 reciben únicamente dos ciclos de QT, los de nivel 2 reciben 4 ciclos y los del nivel más alto, seis. Los dos primeros ciclos son siempre OEPA para los 3 niveles de riesgo. Los pacientes con niveles de riesgo 2 y 3 reciben, respectivamente, 2 o 4 ciclos extras de QT. El ensayo pretende demostrar que se pueden mantener los excelentes resultados de supervivencia de los estudios previos reduciendo todavía más el número de pacientes que reciba RT. Para ello, se randomizará a los pacientes de más alto riesgo entre una QT más intensificada, ciclos llamados DECOPDAC-21, y los ciclos ya utilizados en el estudio anterior, COPDAC-28. Los pacientes que sean randomizados al brazo nuevo del estudio recibirán los ciclos DECOPDAC, que contienen los mismos fármacos (Ciclofosfamida [pero una dosis mayor], Oncovin [Vincristina], Prednisona y Dacarbazina) que los ciclos COPDAC clásicos, y, además, se añade Doxorrubicina (Adriamicina) y Etopósido (VP16). Además, estos ciclos experimentales se administrarán cada 21 días (intensificados), mientras que el brazo clásico seguirá recibiendo los ciclos de QT cada 28 días.
El protocolo EuroNet-PHL-LP se basa en la observación de que los pacientes con LHnPL tienen mejor pronóstico que los pacientes afectos de la forma clásica de la enfermedad. Los pacientes con estadios IA completamente resecados pueden curarse sin precisar más tratamiento. Los pacientes con estadios IA no completamente resecados o IIA reciben tres ciclos de QT sin RT y los pacientes con estadios más avanzados se tratan con el mismo protocolo que el LH clásico.
La recaída del LH puede ser rescatada en muchos casos. El factor más importante que marca el pronóstico del paciente en recaída es el tiempo transcurrido desde el final del tratamiento. Dependiendo de este factor de riesgo y del tratamiento previo recibido, se puede intentar un rescate con posibilidades razonables de éxito con QT de segunda línea más RT o con trasplante de médula ósea (TMO) autólogo(11) con acondicionamientos con intensidad reducida o estándar(12) o con inmunoterapia con anticuerpos monoclonales anti CD30.
Efectos tardíos
Las segundas neoplasias, especialmente el cáncer de mama, son la mayor causa de morbi-mortalidad entre los supervivientes de LH pediátrico.
Los supervivientes de LH infantil presentan una morbi-mortalidad superior a la población general. Este aumento en la frecuencia de problemas de salud persiste durante décadas, probablemente durante el resto de sus vidas(13). La incidencia acumulada a los 30 años de desarrollar una segunda neoplasia invasiva es del 26% en las mujeres, principalmente a costa del carcinoma de mama, seguido de la neoplasia de tiroides, ambos relacionados con la RT. Estudios recientes de asociación en el genoma completo han identificado genes que aumentan la susceptibilidad a desarrollar cáncer de mama después de haber recibido tratamiento por LH(14).
Ante una enfermedad con un índice de curación tan alto y que se presenta en individuos tan jóvenes, los efectos secundarios tardíos y su repercusión en la calidad de vida de los supervivientes son motivo de gran preocupación. El síndrome de fatiga crónica, de etiología difícil de discernir, junto con alteraciones endocrinológicas, inmunológicas y cardiopulmonares, son los responsables principales de la pérdida de calidad de vida de estos pacientes.
Linfomas no Hodgkin
La clasificación de los LNH ha ido cambiando a lo largo del tiempo, a medida en que se disponía de mejores herramientas: citomorfología en un principio, inmunohistoquímica y citogenética a continuación y, actualmente, biología molecular. Actualmente, la Clasificación de 2008 de la OMS (Tabla III) es ampliamente utilizada y permite alcanzar un amplio consenso entre los expertos de todas las nacionalidades.
Se trata de un grupo heterogéneo de enfermedades que incluye a todos los linfomas excepto el LH. La clasificación de los LNH ha cambiado a lo largo del tiempo, debido a los avances en la histopatología, inmunología, citogenética y biología molecular. A su vez, el estudio y clasificación de los LNH ha permitido avanzar en el conocimiento del desarrollo normal del linfocito. Históricamente, la clasificación de los LNH se basaba en el aspecto cito-morfológico de las células malignas y existía solapamiento clínico entre las distintas entidades y la terminología utilizada por patólogos y clínicos era, en ocasiones, distinta, dificultando el entendimiento entre clínicos y patólogos o entre especialistas de ambos lados del Atlántico. Las clasificaciones posteriores, incluyendo criterios inmuno-histoquímicos, permitieron mejorar la correspondencia entre las entidades definidas por los patólogos, los estadios de desarrollo de los linfocitos normales y las enfermedades que presentan los pacientes; uniformaron la terminología y facilitaron el desarrollo de protocolos terapéuticos colaborativos cada vez más eficaces. Los avances de la biología molecular, ocurridos en los últimos años, están empezando a permitir subclasificar en grupos de riesgo a los pacientes pediátricos afectos de LNH, pero, a diferencia de lo que ocurre con las leucemias, todavía no han sido capaces de caracterizar molecularmente a los distintos tipos de LNH.
Los resultados del tratamiento de los LNH pediátricos son uno de los éxitos más importantes de la Medicina, y son un fruto de la colaboración de grupos internacionales de especialistas desde la segunda mitad del siglo XX. La comparación de resultados obtenidos en aquellos primeros ensayos clínicos, permitió observar que los linfomas torácicos respondían a tratamientos que combinaban hasta 10 fármacos distintos administrados en bloques, seguidos de tratamientos de baja intensidad por vía oral llamados de mantenimiento, que se debían mantener durante años, mientras que los LNH abdominales respondían mejor a tratamientos simples, tipo CHOP (Ciclofosfamida, Hidroxidaunorrubicina [Doxorrubicina o Adriamicina], Oncovin (Vincristina) y Prednisona), pero administrados intensivamente, en breves periodos de tiempo. Esos hallazgos fueron confirmados posteriormente, cuando se pudo diferenciar ambos tipos de linfoma, los LL, de localización torácica y casi siempre originados en precursores de linfocitos T por una parte, frente a los LB, abdominales y cuyo origen es un linfocito B más maduro, en la etapa de centro germinal. Las curvas de supervivencia mejoraban estudio tras estudio, hasta que en los años 90 se alcanzó el plateau. A partir de entonces, las mejoras de los resultados han sido más dependientes de hallazgos concretos como, por ejemplo, el descubrimiento del imatinib en el tratamiento de la Leucemia Mieloide Crónica. Actualmente, se está viviendo una nueva revolución debida a las herramientas de la biología molecular, la secuenciación del genoma de las células neoplásicas y la avalancha de nuevas dianas terapéuticas; de tal forma que, en ocasiones, existen más nuevas dianas que pacientes, obligando a un gran esfuerzo en el cambio del diseño de los ensayos clínicos para poder probar más fármacos con menos pacientes. Existe una gran preocupación en la comunidad hematooncológica pediátrica, porque el tiempo que transcurre desde que se descubre un nuevo fármaco hasta que se ensaya en niños es demasiado largo. Por eso, en el seno de la Sociedad Internacional de Oncología Pediátrica (SIOP), se han creado distintos organismos. como son: la Innovative Therapies for Children with Cancer (ITCC) o el Cancer Drug Development Forum (CDDF), para acelerar el proceso y ejercer presiones sobre las autoridades sanitarias europeas, para que adapten la legislación y disminuyan las trabas burocráticas que dificultan que los laboratorios farmacéuticos ensayen los nuevos tratamientos también en los niños.
Biología molecular
Las alteraciones genéticas moleculares de los LNH pediátricos son ubicuas, pero, a diferencia de lo que ocurre en el caso de los LNH en el adulto o en el de las leucemias infantiles, actualmente, todavía no se pueden utilizar para definir los distintos subtipos de linfomas.
Las alteraciones genéticas moleculares de los LNH pediátricos nos permiten entrever los mecanismos patogénicos, hacer un pronóstico evolutivo y descubrir nuevas dianas terapéuticas.
La mayoría de los LNH pediátricos presentan translocaciones cromosómicas que producen proteínas de fusión que alteran los mecanismos de control del crecimiento y la maduración celulares, favoreciendo la oncogénesis.
El 50-70% de los LL presentan un cariotipo anormal que afecta al gen de los receptores de células T. No se ha demostrado que dichas alteraciones sirvan para diferenciar subgrupos con distintas características clínicas.
Virtualmente, todos los casos de LB presentan sobreexpresión del oncogen MYC, casi siempre debida a translocaciones del oncogen con un gen de inmunoglobulinas, en el 80% de los casos, el gen de las cadenas pesadas, la característica translocación t(8;14).
Los LDCGB presentan de forma recurrente translocaciones que afectan a alguno de los genes BCL6, BCL2 y/o MYC. Los estudios de perfiles de expresión genética (gene expression profiling) han permitido distinguir dos tipos de LDCGB que coinciden con distintos estados madurativos del linfocito B, el subtipo de célula B activada (ABC) y el de centro germinal (GCB), el primero con peor pronóstico en la población adulta. Sin embargo, en niños, el valor pronóstico se pierde, probablemente por la rareza del subtipo ABC.
La OMS distingue dos tipos de LACG, ALK+ y ALK-. El 95% de los LACG pediátricos son ALK positivos y presentan mejor pronóstico que en la población adulta.
Incidencia y epidemiología
La incidencia de LNH aumenta constantemente a lo largo de toda la vida del individuo. El único factor etiológico favorecedor del desarrollo de un LNH conocido, actualmente, es la inmunodeficiencia, primaria o adquirida.
Los LNH son más frecuentes que los LH por debajo de los 10 años y ambos tipos de linfoma son muy poco frecuentes en menores de 4 años de edad. Entre los 15 y los 19 años de edad, la incidencia de LH aumenta hasta doblar la de LNH. La distribución entre los dos sexos muestra un predominio en los varones, sobre todo en edades inferiores a los 10 años de edad, cuando la incidencia en niños triplica a la de las niñas. Durante la infancia, la incidencia de los distintos tipos de LNH varía. El LB es más frecuente entre los 5 y los 15 años de edad; la incidencia de LL es constante a lo largo de toda la infancia, y la incidencia de los linfomas de células grandes, LDCGB y LACG, aumenta constantemente con la edad.
La frecuencia de los LNH también varía con la localización geográfica. Existe en África, en la región de las grandes lluvias, donde la malaria es endémica, una elevada incidencia de un subtipo de LB llamado endémico, con características clínicas y biológicas específicas y distintas del LB esporádico que se da en el resto del mundo.
La etiología de los LNH es prácticamente desconocida. Se ha asociado una mayor incidencia de LNH con el uso de pesticidas en el hogar, aunque sin poder especificarse ningún producto concreto. Los estudios epidemiológicos desarrollados hasta el momento actual, no han conseguido demostrar una asociación consistente entre el desarrollo de LNH y ningún factor medioambiental. La fenitoína puede causar un pseudolinfoma que desaparece al suspender el uso del fármaco. La inmunodeficiencia, primaria o adquirida, es claramente un factor de riesgo para el desarrollo de LNH. La asociación entre el VEB y los LNH fue observada por Denis-Burkitt cuando describió el linfoma que lleva su nombre mientras estudiaba la malaria en África. Se ha demostrado que el VEB es capaz de transformar in vitro a los linfocitos B en líneas celulares inmortales. El papel del VEB es incluso más claro y definitivo en el desarrollo de los síndromes linfoproliferativos asociados a inmunodeficiencia, por ejemplo, tras trasplante de órganos. El papel que juega el VEB en los LNH de los individuos inmunocompetentes es más difícil de entender. Se encuentra el genoma del virus en el 10-20% de los casos de LB norteamericanos o europeos.
Clínica
Los LNH en la infancia pueden debutar clínicamente en forma de emergencia médica, como son: síndrome de la vena cava superior, compresión de la vía aérea, síndrome de lisis tumoral, insuficiencia respiratoria o cardíaca por derrames masivos, insuficiencia renal por afectación renal directa o de la vía urinaria, síndromes de compresión medular, etc.
Los LNH en niños son enfermedades muy agresivas. Pueden debutar con cuadros clínicos extremadamente graves, como son: síndrome de la vena cava superior, compresión de la vía aérea, síndrome de lisis tumoral, insuficiencia respiratoria o cardíaca por derrames masivos, insuficiencia renal por afectación renal directa o de la vía urinaria, síndromes de compresión medular, etc. En los casos menos graves, la forma de presentación clínica dependerá de la localización (Tabla IV).
Linfoma linfoblástico
La mayoría de los LL son causados por células de estirpe T y se presentan como masa mediastínica acompañada de derrame pleural o pericárdico.
La mayoría de los niños afectos de LL de precursores T se presentan con una masa adenopática de crecimiento rápido en la región cervical o mediastínica. No es extraño que se acompañe de síntomas de compresión de la vía respiratoria o de la vena cava. Los derrames, pleurales o pericárdicos, son frecuentes y pueden contribuir a la clínica de descompensación respiratoria o cardiovascular. En contraste, los pacientes con LL de precursores B desarrollan formas localizadas de la enfermedad, con afectación de los ganglios periféricos, de los huesos y de la piel. La forma de afectación cutánea suele ser en forma de placas poco pigmentadas en la región del cuero cabelludo, en contraste con los linfomas de células grandes en los cuales la afectación cutánea va acompañada con mayor frecuencia de signos inflamatorios locales y tiende a aparecer en la región torácica y axilar.
Linfoma de Burkitt
El LB esporádico se presenta como una masa abdominal, causante de un cuadro de abdomen agudo, invaginación intestinal u ocupación abdominal masiva, o bien en forma de masa adenopática en la región parafaríngea.
El LB esporádico se presenta, en la mayoría de los casos, como una masa abdominal en un niño de entre 5 y 10 años de edad, localizada en la pared del intestino en la región ileocecal, simulando la forma de presentación de la apendicitis aguda o la invaginación intestinal. En estos casos, si la resección quirúrgica puede ser completa, supone la curación de la práctica totalidad de estos pacientes con muy poca QT adyuvante. En ocasiones, la afectación abdominal es difusa y masiva, afectando al mesenterio, el peritoneo, los riñones y ovarios y, a menudo, acompañada de ascitis. Es poco frecuente la afectación testicular. Una quinta parte de los pacientes debutan con pancitopenia debida a infiltración medular masiva. Por convenio, cuando la infiltración blástica de la MO supera el 25%, el paciente pasa a ser diagnosticado de LAL.
El LB también afecta con frecuencia la región parafaríngea y paranasal. A diferencia con la forma endémica, la afectación mandibular no es frecuente. Otros lugares menos habituales de presentación del LB son: la piel, el SNC y el hueso. Las masas mediastínicas son muy poco frecuentes en el LB.
Linfoma difuso de células grandes B
El LDCGB tiene tendencia a afectar la piel y el hueso. La variante mediastínica primaria es característica de mujeres jóvenes.
La forma de presentación clínica del LDCGB es más heterogénea, comparada con el LB. Predominan los pacientes con afectación extranodal, cutánea y ósea. La afectación del SNC y de la MO es menos frecuente. El linfoma de células grandes mediastínico primario se presenta como una masa mediastínica con tendencia a invadir localmente las estructuras vecinas, como pulmón y pericardio. Es frecuente la afectación renal.
Linfoma anaplásico de células grandes
El LACG se presenta en dos formas clínicas, una cutánea exclusiva, ALK negativa y de evolución benigna; y otra forma invasiva o sistémica, ALK positiva, que requiere tratamiento QT agresivo.
El LACG suele afectar a la piel con mayor frecuencia que cualquier otro linfoma de la infancia; también, puede extenderse al hueso, partes blandas y ganglios periféricos (Fig. 2).
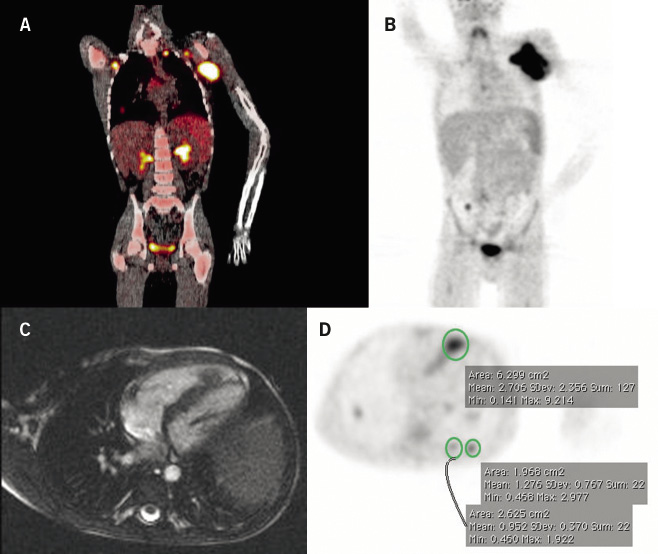
Figura 2. Linfoma anaplásico de células grandes. A y B. PET/CT inicial. Varón, 8 años de edad. Gran masa ganglionar y cutánea en axila izquierda. Pequeñas captaciones patológicas en axila derecha, lóbulo inferior de pulmón derecho, región apical pulmonar y subclavicular izquierdas. Captación fisiológica en laringe, pelvis renales, uréter derecho, médula ósea en múltiples huesos y vejiga. C y D. RNM y PET, recaída 1 mes después de finalizado el tratamiento: nódulo linfomatoso en tabique interventricular cardíaco y múltiples nódulos en ambos pulmones..
A menudo, se acompaña de síntomas y signos sistémicos, como: fiebre, cansancio y anorexia. El 70% de los pacientes debutan con enfermedad diseminada. No es excepcional la afectación del SNC y de la MO.
La forma cutánea exclusiva del LACG es prácticamente una entidad distinta, sus células son ALK negativas y la enfermedad tiene tendencia a la curación espontánea. Si no se demuestra afectación extracutánea, una actitud conservadora es aconsejable. La papulomatosis linfomatoide (PL) es una entidad benigna, autoinvolutiva, que a menudo es difícil de distinguir de la forma cutánea exclusiva del LACG. No requiere tratamiento y las lesiones papulares características, rojizo-marronosas y de menos de 2 cm de diámetro, aparecen y desaparecen en el plazo de entre 3 y 8 semanas (Fig. 3).
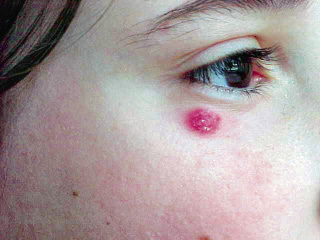
Figura 3. Papulomatosis linfomatoide: paciente de 13 años de edad. Quinto año de seguimiento. Las lesiones aparecen y desaparecen espontáneamente sin dejar cicatriz. Únicamente las lesiones iniciales, grandes y úlcero-necróticas, dejaron secuelas cicatriciales en las piernas. La papulomatosis linfomatoide, entidad exclusivamente cutánea y de curso clínico benigno, no debe confundirse con el LACG ALK negativo que es histológicamente muy parecido.
Estadio y valoración de la respuesta al tratamiento
Tras treinta años de vigencia, la clasificación de Saint Jude o de Murphy ha sido substituida por una nueva clasificación consensuada por un panel de expertos internacional.
A diferencia de lo que ocurre con los linfomas del adulto, donde se utiliza la clasificación de Ann Arbor, en los linfomas pediátricos se ha usado desde los años 80 la clasificación de St. Jude o de Murphy (Tabla V), para clasificar los LNH según la extensión de la enfermedad (Tabla V).
En junio de 2015, se ha publicado el nuevo International Pediatric Non-Hodgkin Lymphoma Staging System (IPNHLSS), bajo la dirección del Dr. Rosolen(15), y los International Pediatric Non-Hodgkin Lymphoma Response Criteria(16) (IPNHLRC). La nueva clasificación incluye la afectación extranodal, por ejemplo: piel, hueso y tejidos blandos, que los LNH pediátricos presentan con mayor frecuencia que sus equivalentes en el adulto. La nueva IPNHLSS también recoge información sobre el método empleado para detectar la presencia de enfermedad en LCR y MO: sea morfológico (clásico anatomopatológico), inmunofenotípico (citometría de flujo), citogenético (FISH o similares) o molecular (PCR) y las nuevas técnicas de imagen, morfológicas (RM con protocolos de adquisición de imagen que permiten el análisis funcional de los tejidos) y metabólicas (PET).
El tratamiento actual de los linfomas pediátricos se basa en combinaciones de quimioterapia que se han ido definiendo a lo largo de décadas, mediante protocolos colaborativos internacionales, liderados en Estados Unidos por el Children Oncology Group (COG) y, en Europa, por el grupo alemán BFM y el francés, principalmente en el seno de la Sociedad Internacional de Oncología Pediátrica (SIOP).
Tratamiento
El tratamiento de los LNH pediátricos se basa en la poliquimioterapia administrada en un centro de oncología pediátrica multidisciplinar y con experiencia, y en el contexto de un protocolo internacional.
A principios de los años 70, los LNH eran prácticamente incurables y se empezó a tratarlos con QT similar a la utilizada en las leucemias. Desde entonces hasta la actualidad, los resultados han ido mejorando hasta conseguirse supervivencias libres de eventos del 80-95% en los casos localizados y del 70-85% en los casos más avanzados o diseminados(17) (Tabla VI).
• Linfoma de Burkitt: el tratamiento del LB muestra uno de los aumentos más notables de supervivencia, superior al 90%, basándose en regímenes relativamente sencillos y baratos, consistentes en bloques de quimioterapia tipo COMP (Ciclofosfamida, Oncovin [Vincristina], Metotrexate y Prednisona), administrados lo más rápidamente para conseguir una alta relación entre la dosis administrada y el tiempo transcurrido (dosis intensidad). Recientemente, un ensayo clínico internacional ha demostrado que la adición de rituximab, un anticuerpo monoclonal anti-CD20, en los pacientes de alto riesgo (definidos como estadios avanzados o presencia de niveles de LDH elevados en el momento del diagnóstico), mejora su pronóstico. Como consecuencia, se ha cerrado la rama sin rituximab y, actualmente, es práctica habitual utilizar el anticuerpo en este subgrupo de pacientes.
• Linfoma difuso de células grandes B: los LDCGB pediátricos se tratan con los mismos protocolos que los LB con resultados similares.
• Linfoma linfoblástico: los LL, preT, en la mayoría de los casos, se han venido tratando históricamente con protocolos derivados de las leucemias y los resultados son excelentes. La RT, como profilaxis de la recaída en el SNC, ha sido eliminada de la mayoría de los protocolos y existe evidencia de que también las dosis altas de metotrexate podrían evitarse en algunos pacientes. La tendencia actual es conseguir marcadores biológicos que permitan distinguir el pequeño subgrupo de pacientes con alto riesgo de fracaso. En el LL, ningún dato clínico ni analítico, ni siquiera el estadio de extensión, repercute en los resultados del tratamiento.
• Linfoma anaplásico de células grandes: el tratamiento del LACG deriva de los protocolos alemanes BFM y se consiguen buenos resultados, con supervivencias globales alrededor del 90% y supervivencias libres de evento del 74%. Los pacientes que recaen pueden ser rescatados con estrategias muy distintas. Dosis semanales de monoterapia con Vinblastina han demostrado eficacia en los pacientes con menos factores de riesgo. En los casos refractarios o de muy alto riesgo, Brentuximab-vendotin, un anticuerpo anti-CD30 combinado con un quimioterápico antimicrotúbulo ha conseguido tasas de respuesta del 86% y parece que la consolidación con TMO alogénico es efectiva en estos pacientes. Los inhibidores de ALK como el crizotinib o ceritinib también son efectivos en los casos refractarios.
Función del pediatra de Atención Primaria
La función del pediatra de Atención Primaria es muy importante, porque es el primer y el último eslabón en la cadena de cuidados del niño con linfoma. Será quién detecte el primer síntoma de la enfermedad y será quien acompañe al niño desde el día que acabe la quimioterapia hasta la edad adulta, afrontando los efectos secundarios del tratamiento recibido.
La presencia de una adenopatía aumentada de tamaño en un niño previamente sano es un acontecimiento frecuente que, normalmente, no indica la presencia de una enfermedad maligna. Será el pediatra de Atención Primaria quien deberá valorar, mediante la anamnesis, la exploración física y un primer escalón de exámenes complementarios, si la actitud más adecuada es la observación o es necesario iniciar el proceso diagnóstico para descartar enfermedades de mayor gravedad.
Así mismo, el pediatra de Atención Primaria será quien dará soporte a la familia y al paciente durante los periodos de alta hospitalaria, principalmente en el caso de pacientes que habiten lejos del Hospital. Debemos mejorar la comunicación entre el oncólogo y el pediatra de Atención Primaria.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Weinstein HJ, Hudson MM, Link MP. Pediatric Lymphomas. Berlin Heidelberg New York. Springer-Verlag; 2007.
Excelente libro que recoge de forma amena todas las particularidades de los linfomas. Viaje a través de la epidemiología, etiología, clínica, tratamiento y efectos secundarios.
2.** Kaatsch P. Epidemiology of childhood cancer. Cancer Treatment Reviews. 2010; 36: 277-85.
Buena revisión de la epidemiología del cáncer infantil.
3.*** Pizzo PA, Poplack DG. Principles and Practice of Pediatric Oncology, 7th Edition. Philadelphia: Lippincott Williams & Wilkins. 2015.
Libro de referencia mundial en Oncología Pediátrica. Realizado por autores prestigiosos.
4.*** Swerdlow SH, Campo E, Harris NL, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Geneva. 2008.
La clasificación por excelencia de los linfomas. Abundante información sobre biología molecular. Es la referencia.
5.** Campo E, Swerdlow SH, Harris NL, et al. The 2008 WHO classification of lymphoid neoplasms and beyond: evolving concepts and practical applications. Blood. 2011; 117: 5019-32.
Revisión e interpretación de la clasificación de los linfomas, Hodgkin y no Hodgkin.
6.** Steidl C, Connors JM, Gascoyne RD. Molecular Pathogenesis of Hodgkin’s Lymphoma: Increasing Evidence of the Importance of the Microenvironment. J Clin Oncol. 2011; 29: 1812-26.
Interesante hipótesis, el microambiente puede tener un papel más importante del que se pensaba.
7.*** Cader FZ, Kearns P, Young L, et al. The contribution of the Epstein-Barr virus to the pathogenesis of childhood lymphomas. Cader FZ, Kearns P, Young L, Murray P, Vockerodt M. Cancer Treatment Reviews. 2010; 36: 348-53.
El virus de Epstein Barr sigue siendo un misterio. Revisión actualizada del papel que juega en los linfomas.
8.** Sánchez de Toledo J. Linfomas. Linfoma de Hodgkin y Linfoma no Hodgkin. Pediatr Integral. 2012; XVI: 463-74.
Revisión sintetizada de los linfomas en la infancia.
9.** Garey CL, Laituri CA, Valusek PA, et al. Management of Anterior Mediastinal Masses in Children. Eur J Pediatr Surg. 2011; 21: 310-13.
10.** Abramson SJ, Price AP. Imaging of Pediatric Lymphomas. Radiol Clin N Am. 2008; 46: 313-38.
Excelente artículo sobre las técnicas de imagen en los linfomas. Las imágenes son de gran calidad y muy didácticas.
11.** Colpo A, Hochberg E, Chen YB. Current Status of Autologous Stem Cell Transplantation in Relapsed and Refractory Hodgkin’s Lymphoma. The Oncologist. 2012; 17: 80-90.
Revisión muy actualizada sobre el TMO en el linfoma de Hodgkin.
12.** Greaves PJ, Gribben JG. Demonstration of Durable Graft Versus Lymphoma Effects in Hodgkin’s Lymphoma. J Clin Oncol. 2011; 29: 952-3.
Este trabajo demuestra que el efecto injerto contra linfoma es algo más que una hipótesis atractiva.
13.*** Castellino SM, Geiger AM, Mertens AC, et al. Morbidity and mortality in long-term survivors of Hodgkin lymphoma: a report from the Childhood Cancer Survivor Study. Blood. 2011; 117: 1806-16.
La importancia de este trabajo radica en el elevado número de individuos y el prolongado periodo de tiempo en que se ha hecho el seguimiento.
14.** Ma YP, van Leeuwen FE, Cooke R, et al. FGFR2 genotype and risk of radiation-associated breast cancer in Hodgkin lymphoma. Blood. 2012; 119: 1029-31.
Interesante trabajo que señala que no todas las pacientes presentan el mismo riesgo de desarrollar cáncer de mama después de recibir radioterapia.
15.*** Rosolen A, Perkins SL, Pinkerton CR, et al. Revised International Pediatric Non-Hodgkin Lymphoma Staging System. J Clin Oncol. 2015; 33: 2112-18.
Artículo de referencia obligada. Consenso internacional sobra la nueva clasificación de los LNH pediátricos.
16.*** Sandlund JT, Guillerman RP, Perkins SL, et al. International Pediatric Non-Hodgkin Lymphoma Response Criteria. J Clin Oncol. 2015; 33: 2106-11.
Artículo de referencia obligada. Nuevos criterios para valorar la respuesta al tratamiento de los LNH pediátricos.
17.*** Cairo MS, Pinkerton R. Childhood, adolescent and young adult non-Hodgkin lymphoma: state of the science. Br J Haematol. 2016; 173, 507-30.
Resumen del 5º Simposium Internacional sobre Linfomas no Hodgkin del Niño, Adolescente y Adulto Joven que tuvo lugar en Varese, Italia en octubre de 2015. Novedades sobre linfomas.
| Caso clínico |
|
Niña de 13 años de edad que consultó tres semanas antes a su pediatra, por la aparición de una tumoración en la fosa supraesternal. En aquel momento, la niña explicaba astenia y una pérdida de peso de 4 kg, aunque coincidiendo con una dieta de adelgazamiento en los últimos dos meses. También, relataba sudoración nocturna en las últimas semanas. No había presentado fiebre ni otra sintomatología acompañante. En la exploración física, destacaba únicamente una obesidad moderada que hacía difícil la palpación de la región cervical. Se solicitó una analítica general, una ecografía cervical y una radiografía de tórax. Los resultados de estas pruebas se obtuvieron unos días más tarde. Mientras tanto, la tumoración supraesternal había dejado de ser palpable. En la analítica, destacaba una hemoglobina de 8,4 g/L (VN: 12-16 g/L), fórmula leucocitaria y plaquetas normales, PCR: 12,3 mg/dL (VN: 0,03-0,5 mg/dL) y VSG 91 mm 1ª hora (VN < 15 mm 1ª hora). La ecografía no mostró ningún hallazgo destacable y la radiografía de tórax es la que aparece en la figura 4. La exploración física en el momento del ingreso mostraba un buen estado general, obesidad moderada con piel clara y traslúcida con abundante circulación venosa visible, especialmente en el tronco superior. Acantosis nigricans en el cuello. Edema en el tercio superior del tronco. No se palpaban masas ni adenomegalias. ACR normal sin signos de dificultad respiratoria ni ruidos añadidos. Abdomen globuloso, normal. La analítica de urgencias no mostraba cambios respecto a la anterior. En el inicio del estudio de la paciente, se realizó una RNM (Fig. 5). La RM mostró una voluminosa masa en la unión cervicotorácica, que se extendía desde la región supraesternal hasta el mediastino anterior con un diámetro craneocaudal máximo de 8,8 cm y que condicionaba una ligera compresión de vena cava superior y una obliteración del tronco venoso innominado izquierdo. La biopsia, realizada una semana más tarde, confirmó que se trataba de un linfoma, pero no un LH, sino una variante poco frecuente de linfomas B llamado linfoma de la zona gris, con características comunes a los linfomas difusos de células grandes B y los LH clásicos. Se inició tratamiento específico.
Figura 4.
Figura 5. |