|
| Temas de FC |
A. Fierro Urturi
Pediatra en Centro de Salud Pisuerga. Arroyo de la Encomienda. Valladolid
| Resumen
El síndrome purpúrico o púrpura son lesiones producidas por la extravasación de hematíes a la piel y/o mucosas como consecuencia de trastornos de la hemostasia. Tiene como causa subyacente una gran variedad de enfermedades. |
| Abstract
Purpura are injuries caused by the extravasation of blood cells into the skin and/ or mucous membranes due to hemostasis disorders. They are caused by many diseases. |
Palabras clave: Púrpura; PTI; Púrpura trombocitopénica inmune; Trombocitopenia inmune primaria; Infancia
Key words: Purpura; ITP; Immune thrombocytopenic purpura; Primary immune thrombocitopenia; Children
Pediatr Integral 2016; XX (5): 331-345
Púrpuras. Tromboctopenia inmune primaria
Púrpuras
Introducción
El síndrome purpúrico o púrpura se produce por la extravasación de células sanguíneas a las capas superficiales de la piel y/o mucosas como consecuencia de la alteración de alguno de los componentes de la hemostasia: plaquetas, factores de la coagulación o lesiones de la pared vascular.
Las lesiones purpúricas se caracterizan por ser lesiones bien delimitadas y no desaparecer a la vitropresión. Presentan una coloración variable según la profundidad: rojo (más superficiales) o azulado (más profundas), y según el tiempo de evolución (desde rojo violáceo en lesiones recientes hasta verde-amarillento en lesiones más evolucionadas).
Según su tamaño, se clasifican en: petequias ((≤2 mm), púrpura (>2mm) o equimosis (si son mayores a 1 cm).
Atendiendo al tacto, diferenciaremos entre: púrpuras palpables, producidas por lesión vascular (vasculitis), y púrpuras no palpables.
Clasificación etiopatogénica de las lesiones purpúricas
En la etiopatogenia del síndrome purpúrico, están involucrados distintos componentes de la hemostasia. Según el nivel de afectación, se clasifican en:
• Diátesis hemorrágica de origen plaquetario o púrpuras plaquetarias.
• Púrpuras vasculares o angiopáticas.
• Diátesis hemorrágicas de origen plasmático o alteraciones de la coagulación.
En la tabla I, se expone la clasificación etiopatogénica de la púrpura, según el componente de la hemostasia alterado(1-7).
Diátesis hemorrágica de origen plaquetario o púrpuras plaquetarias
Se producen como consecuencia de una alteración en el número de plaquetas (púrpuras trombopénicas o trombocitopénicas) o de una alteración de su función (púrpuras trombopáticas o plaquetopatías).
1. Púrpuras trombopénicas o plaquetopenias. Se produce una disminución aislada del recuento plaquetario. Son las más frecuentes en la infancia.
Clásicamente, se ha definido trombocitopenia como una cifra de plaquetas inferior a 150 x 109/L. Sin embargo, en la actualidad, se ha propuesto disminuir este límite hasta 100 x 109/L, debido a que unas cifras de plaquetas entre 100 y 150 x 109/L se encuentran con frecuencia en personas sanas, prematuros y en embarazadas, sin que tenga ninguna repercusión clínica.
La trombocitopenia puede ser atribuida a diferentes causas:
a. Por un defecto de la producción medular, que puede ser de origen congénito o adquirido.
b. Por aumento de la destrucción plaquetaria, producido por mecanismo inmune o no inmune.
c. Por alteración de la distribución plaquetar, con secuestro de plaquetas en un bazo, aumentado de tamaño o en otros órganos.
En laboratorio, encontraremos, además de la trombocitopenia, un tiempo de hemorragia/tiempo de obturación (TO) alargado, siendo el tiempo de tromboplastina parcial (TTPa) y el tiempo de protrombina (TP) normales.
2. Púrpuras trombopáticas o plaquetopatías. Son cuadros más infrecuentes, debidos a alteraciones de la función plaquetaria.
En estos casos, el tiempo de hemorragia/tiempo de obturación está alargado, con un número de plaquetas normal o discretamente disminuido. El tiempo de tromboplastina parcial (TTPa) y el tiempo de protrombina (TP) están en límites normales.
Púrpuras vasculares o angiopáticas
Son síndromes clínicos producidos por alteraciones estructurales y/o funcionales de la pared vascular y sus tejidos de sostén.
Estas pueden ser hereditarias o adquiridas. La mayoría de las vasculitis en la infancia son “reactivas” y secundarias a procesos infecciosos/infamatorios.
Se caracterizan por presentar el hemograma, plaquetas y pruebas de coagulación normales.
Diátesis hemorrágicas de origen plasmático o alteraciones de la coagulación
Se producen como consecuencia del fallo en la hemostasia secundaria.
En laboratorio, encontramos un número de plaquetas dentro de los límites normales. Estarán alterados aquellos estudios que evalúen la vía en las que participe el factor alterado (excepto en el déficit de factor XIII).
Las causas más frecuentes de púrpura son: los traumatismos, las infecciones, la púrpura de Schönlein-Henoch y la trombocitopenia inmune primaria.
Diagnóstico de sospecha de un trastorno de la hemostasia/coagulación
El exantema petequial o purpúrico constituye un reto diagnóstico, ya que puede ser el resultado de enfermedades graves, que precisan un diagnóstico y tratamiento urgentes. Es frecuente ver en la consulta de Atención Primaria, niños con contusiones, equimosis o hematomas sin herida en los miembros inferiores, debido a su alto nivel de actividad física. Sin embargo, estas manifestaciones hemorrágicas pueden ser también el primer signo de una enfermedad sistémica o de un maltrato.
Ante un niño con estas lesiones, se realizará siempre una valoración sistemática y rigurosa que determinará qué pacientes precisan pruebas complementarias.
Los datos claves para la valoración de un paciente con sospecha de un trastorno en la hemostasia, vienen dados por: la anamnesis, la exploración clínica y las pruebas de laboratorio(1-7) (Tabla II).
La fiebre es un dato fundamental, constituye un primer signo de alerta. Su ausencia nos hará dudar de la etiología infecciosa, aunque no la excluye. No siempre indica enfermedad grave, pero hay pocas enfermedades exantemáticas graves que no la presenten.
La etiología más frecuente de los cuadros febriles con exantema petequial en pacientes sin afectación del estado general ni otros síntomas o signos de alerta suelen ser cuadros víricos, benignos y autolimitados, en los que, en determinados casos, podría no hacerse ninguna prueba complementaria. Las lesiones son petequias puntiformes, que pueden estar aisladas o agrupadas (p. ej., en guante y calcetín), se localizan por encima de la línea intermamilar y son estables.
Son signos y síntomas de alerta sugestivos de sepsis: la afectación del estado general, irritabilidad, somnolencia, hipotensión, tiempo de relleno capilar > 2 segundos, dificultad o alteración de la respiración y cianosis. Las lesiones hemorragias equimóticas rápidamente progresivas con distribución generalizada y rigidez de cuello, deben de sugerir la posibilidad de enfermedad meningocócica invasiva (EMI).
Las lesiones micropetequiales localizadas en tercio superior del tronco, cara y cuello, por aumento de la presión intravascular en el territorio de la vena cava superior, pueden ser originadas por esfuerzos tras vómitos intensos, accesos de tos o incluso rabietas.
Se debe sospechar la posibilidad de malos tratos ante un exantema petequial y/o equimótico, que aparece en regiones no prominentes con diferentes grados evolutivos y en diferentes localizaciones de forma repetida. Las pruebas analíticas descartarán otros procesos.
A nivel práctico, una vez identificada la lesión hemorrágica, clasificarla en función de si es palpable (vasculitis) o no palpable, nos irá aproximando hacia ciertas patologías.
Es importante, en el diagnóstico de sospecha de una enfermedad hemorrágica, discernir si se trata de una alteración de las plaquetas, vasos sanguíneos o una coagulopatía:
• En las trombopatías y vasculopatías, las lesiones hemorrágicas se manifiestan como petequias y púrpuras superficiales (pequeñas y múltiples), epistaxis, gingivorragias y menorragias. El volumen de sangrado es pequeño, siendo los hematomas infrecuentes. Tras cortes superficiales, el sangrado es profuso y prolongado. En cortes profundos y extracciones dentales, la hemorragia se inicia inmediatamente, controlándose con presión local. Las hemorragias espontáneas son superficiales, pequeñas y de localización múltiple. La historia familiar de sangrado es rara.
• En las coagulopatías, las hemorragias son profundas, con: hemartros, equimosis grandes y aisladas. Las petequias son raras. El volumen de sangrado es moderado o importante. Tras abrasiones y cortes superficiales, el sangrado es mínimo. En las extracciones o cortes profundos, la hemorragia se inicia a las 3-5 horas, no controlándose con presión local. Las hemorragias espontáneas son una o varias (hematomas profundos extensos o hemartros). Es frecuente la historia familiar de sangrado (Algoritmo 1).
El estudio de laboratorio se iniciará con unos exámenes complementarios elementales: hemograma, bioquímica, recuento plaquetario y pruebas de coagulación, que están alteradas en los déficit graves en el 90-95%, pero pueden ser normales en déficit leves.
En las trombopenias, se debe repetir el recuento y comprobar la cifra real de plaquetas en la extensión de sangre periférica, sobre todo, si no hay síntomas acompañantes, ya que puede deberse a una agregación plaquetaria (pseudotrombocitopenia) producida por un fenómeno de aglutinación de las plaquetas al ponerse en contacto con el EDTA.
Se debe valorar el Volumen Plaquetario Medio (VPM), ya que algunas enfermedades cursan con plaquetas grandes (VPM aumentado), como: en las trombopenias por “consumo periférico” (médula ósea regenerativa) y en el síndrome de Bernard-Soulier, o plaquetas de tamaño pequeño (VPM disminuido o normal), cuando la producción plaquetaria está disminuida en la médula ósea (hiporregenerativa) y en el síndrome de Wiskott-Aldrich.
Los niños prematuros tienen un TP, TTP prolongados y una reducción de las proteínas anticoagulantes (proteína C, S y AT-III); en ellos, se considera normal la cifra de plaquetas entre 100.000 y 150.000/mm3.
Según la alteración de las pruebas básicas de coagulación, nos orientará el diagnóstico:
• Tiempo de protrombina (TP): se alarga por alteraciones en factores vitamina K dependientes (II, VII, IX, X), factor V y fibrinógeno.
• Tiempo de tromboplastina parcial (TTPa): se alarga en las alteraciones de los factores VIII, IX, XI, XII, precalicreína y quininógeno de alto peso molecular.
• Tiempo de trombina: se alarga cuando existen alteraciones del fibrinógeno, hiperfibrinólisis o heparina.
Púrpura trombocitopénica inmune (PTI)
Introducción
La púrpura trombocitopénica es uno de los trastornos hematológicos más frecuentes en la población infantil y la adolescencia. Se estima una incidencia anual entre 1,9 y 6,4/100.000 niños por año, con una mayor prevalencia entre los 2-8 años de edad. A pesar de considerarse un trastorno hematológico benigno, en el 30% de los niños, la enfermedad tiene un curso prolongado, y entre el 5-10%, desarrolla una enfermedad refractaria grave. A diferencia del adulto, en el niño es frecuente el antecedente de un proceso infeccioso vírico o una inmunización con vacunas vivas unas semanas antes, teniendo la enfermedad una mayor tendencia a la remisión espontánea. Los síntomas y signos clínicos son muy variables, siendo el principal problema, el riesgo aumentado de hemorragia. No hay ningún parámetro clínico ni biológico que permita establecer el diagnóstico con certeza y, por tanto, su diagnóstico es siempre por exclusión. El objetivo del tratamiento es prevenir las hemorragias graves y conseguir una adecuada calidad de vida con la mínima toxicidad asociada a la terapia. Muchos expertos consideran que los niños con PTI sin sangrado no requieren tratamiento, independientemente del número de plaquetas, aunque precisan un control y seguimiento estrecho.
Recientemente, se han publicado diferentes guías basadas en la evidencia en PTI para ayudar a los profesionales sanitarios en el diagnóstico y tratamiento de estos pacientes.
Definiciones básicas y terminología
Las definiciones básicas y criterios de respuesta para esta enfermedad han sido consensuados por un grupo internacional de trabajo (IWG-ITP) integrado por expertos europeos y americanos, para niños y adultos, publicado en el año 2009. Algunas definiciones básicas se han adaptado a los resultados de la experiencia clínica de años posteriores, con los nuevos fármacos aparecidos para el tratamiento de esta enfermedad.
Se ha optado por cambiar la nomenclatura clásica (púrpura trombocitopénica idiopática), con el fin de aclarar el mecanismo patogénico de la enfermedad. Los términos “púrpura” e “idiopática” se consideran inadecuados para definir la enfermedad, ya que el sangrado cutáneo o mucoso está ausente o es mínimo en algunos pacientes.
Por otra parte, hoy en día, la patogenia de la enfermedad se considera que es autoinmune. Por ello, actualmente, se recomienda la denominación de trombocitopenia inmune primaria. Se mantiene el acrónimo Immune Thrombocytopenia (ITP) y PTI en castellano, por su significado histórico y su uso consolidado en el lenguaje médico cotidiano(8-13).
Definiciones básicas de la trombocitopenia inmune primaria y secundaria
PTI primaria
Definición y concepto: Trombocitopenia Inmune Primaria (acrónimo PTI) es una patología autoinmune caracterizada por una disminución de la cifra de plaquetas por debajo de 100 x 109/L, en ausencia de causa desencadenante conocida.
PTI secundaria
PTI que se presenta asociada a otras causas, que incluyen enfermedades autoinmunes, enfermedades virales y algunos fármacos.
Clasificación diagnóstica de la PTI según el tiempo de evolución
• PTI de reciente diagnóstico: < 3 meses de evolución.
• PTI persistente: 3-12 meses desde el diagnóstico.
• PTI crónica: PTI con más de 12 meses de evolución.
Nomenclatura para definir los criterios de respuesta
• Respuesta completa (RC): recuento plaquetario >100 x 109/L, determinado en dos ocasiones, separadas, al menos, siete días, y ausencia de hemorragia.
• Respuesta (R): recuento plaquetario ≥30 x 109/L e incremento en más de dos veces la cifra basal, determinado en dos ocasiones, separadas, al menos, siete días, y ausencia de hemorragia.
• No respuesta (NR): recuento plaquetario <30 x 109/L o incremento inferior a dos veces la cifra basal o presencia de síntomas hemorrágicos. La cifra de plaquetas debe ser determinada en dos ocasiones, separadas, al menos, un día.
• Pérdida de respuesta completa: recuento plaquetario <100 x 109/L, determinado en dos ocasiones, separadas, al menos, un día y/o presencia de hemorragia (si RC previa).
• Pérdida de respuesta: recuento de plaquetas <30 x 109/L o menos de dos veces del valor basal o hemorragia (si R previa). La cifra de plaquetas debe ser determinada en dos ocasiones, separadas, al menos, un día.
• Duración de la respuesta: tiempo transcurrido entre la RC o R y la pérdida de la RC o R.
• Corticodependencia: necesidad de dosis repetidas o mantenidas de glucocorticoides para mantener un recuento plaquetario ≥30 x 109/L y/o evitar la hemorragia.
• PTI severa: pacientes con hemorragia clínicamente relevante, definida como la hemorragia que en su presentación indica la necesidad de tratamiento, o bien, la aparición de un nuevo episodio hemorrágico que precisa tratamientos adicionales y/o incremento de la dosis del tratamiento actual.
• PTI refractaria: consideramos PTI refractaria a la PTI que no ha respondido al tratamiento de tercera línea.
Fisiopatología
La patogenia se basa en una destrucción acelerada y en una producción inadecuada de plaquetas mediada por autoanticuerpos y linfocitos T citotóxicos.
La PTI es un trastorno autoinmune adquirido producido por una desregulación de la inmunidad celular y humoral de causa no aclarada. Esto da lugar a la activación de linfocitos T citotóxicos y a la producción de autoanticuerpos que se unen a las glicoproteínas de la membrana plaquetar, (GP) IIb/IIIa o GP Ib/IX, formando complejos anticuerpo-antígeno plaquetares que son fagocitados y destruidos por los macrófagos tisulares del hígado y bazo. El defecto subyacente que lleva a este proceso se desconoce, y es probable que tanto factores genéticos como ambientales estén involucrados. En el 50-60% de los casos de PTI infantil, existe el antecedente de enfermedad viral reciente, desarrollando entre 1 y 4 semanas después, autoanticuerpos dirigidos contra la superficie plaquetaria.
Diversas líneas de investigación, han demostrado que la trombocitopenia en la PTI no tiene un origen exclusivamente periférico. Los megacariocitos, que también expresan GP IIb/IIIa y GP Ib/IX, sufren un proceso de apoptosis que desemboca en inhibición de la trombopoyesis. Además, se ha observado que la respuesta megacariocítica de la médula ósea está disminuida en los pacientes con PTI, y que la administración de un análogo de la trombopoyetina (TPO) aumenta los niveles plaquetarios en estos pacientes.
Pacientes con PTI pueden desarrollar anticuerpos adicionales en otros tejidos u órganos; siendo el más común, la glándula tiroides. Alrededor del 40% de los pacientes tienen anticuerpos detectables dirigidos hacia el tejido tiroideo y, casi un cuarto de los pacientes, pueden desarrollar hipertiroidismo o hipotiroidismo sintomático o subclínico.
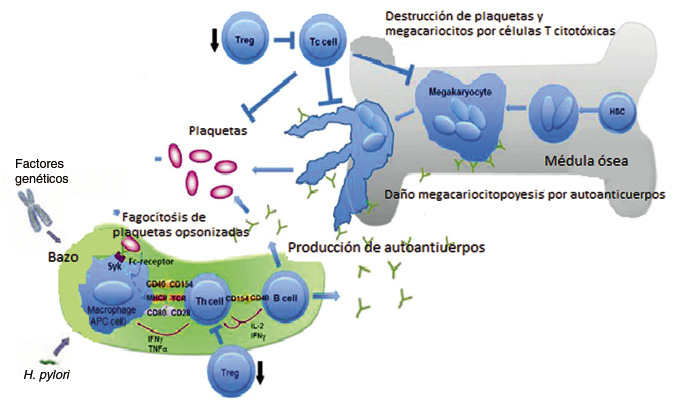
El papel de las infecciones, tales como H. pylori, no ha sido completamente aclarado, pero se ha demostrado reactividad cruzada entre los antígenos bacterianos y las glicoproteínas de las plaquetas(9) (Fig. 1).
Figura 1. Representación de la fisiopatología de la PTI. Células T reguladoras (Treg), Células Th colaboradoras (Th cell), Células T citotóxicas (Tc cell), interleukina (IL-2), Interferón (IFN).
Manifestaciones clínicas
Los síntomas y signos clínicos son muy variables, siendo el principal problema, el riesgo aumentado de hemorragia.
La trombocitopenia inmune infantil suele cursar de forma leve y autolimitada, sin embargo, el 30% de los niños afectados tendrá un curso prolongado y el 5%-10% desarrollará la enfermedad refractaria crónica grave. La mayoría de los niños que la padecen están previamente sanos, presentando un cuadro clínico brusco de aparición de lesiones purpúricas en piel, con: petequias, púrpura y equimosis. Puede asociarse sangrado de mucosas con: epistaxis, gingivorragia, metrorragias o sangrado digestivo leve. No siempre hay correlación exacta entre la cifra de plaquetas y las manifestaciones hemorrágicas, aunque estas son más frecuentes por debajo de 20 x 109/L. En pacientes con recuento de plaquetas por encima de 50 x 109/L, el diagnóstico de la PTI es incidental, debido a que no suelen presentan sintomatología hemorrágica. Entre 30 y 50 x 109/L, tienen petequias y equimosis al mínimo trauma; en contraste, los enfermos con cifras de plaquetas de 10 a 30 x 109/L, son quienes presentan hemorragias espontáneas. Los pacientes que presentan sangrado con repercusión clínica significativa son escasos (3%). Las hemorragias a nivel visceral o articular son excepcionales. La complicación más grave es la hemorragia intracraneal (HIC), que acontece en el 0,1-0,5% de los casos. No es posible predecir qué niños desarrollarán HIC.
Existen unos factores de riesgo de hemorragia grave: traumatismo craneal, politraumatismo previo, tratamiento con antiagregantes hasta 7-10 días antes, hematuria y coexistencia de diátesis hemorrágica (vasculitis y coagulopatías). Se debe tener, también, precaución en casos de varicela asociada a PTI.
Se considera sangrado activo, la presencia de: epistaxis que precisa taponamiento, gingivorragia importante, hematuria, hemorragia digestiva macroscópica, menorragia y cualquier hemorragia con riesgo razonable de precisar trasfusión de hematíes.
Diagnóstico
El diagnóstico de PTI se realiza por exclusión de otras causas de trombocitopenia. La evaluación básica inicial debe incluir: una historia clínica detallada, exploración física y hemograma completo con extensión de sangre periférica.
En todos los pacientes con trombocitopenia, se debe realizar una historia clínica detallada y una exploración física completa, que permitan descartar otras enfermedades hematológicas o situaciones que, de forma secundaria, puedan ocasionar trombocitopenia (Tabla II).
El examen físico de la PTI habitualmente es normal y, únicamente, se suelen constatar lesiones purpúricas. Si la hemorragia afecta a otros órganos, la exploración mostrará la alteración específica de los órganos y sistemas afectados. La presencia de adenopatías o hepatoesplenomegalia sugiere otros diagnósticos, como leucemias o cáncer linfático. Se debe descartar la existencia de signos dismórficos que sugieran trombocitopenias congénitas, incluyendo anomalías óseas e hipoacusias.
Los estudios básicos recomendados para un diagnóstico y seguimiento adecuados se describen en la tabla III.
Se debe realizar un hemograma completo con reticulocitos y metabolismo del hierro. La PTI cursa sin alteraciones cuantitativas o cualitativas en los eritrocitos o leucocitos. No obstante, puede encontrarse anemia y ferropenia en proporción a la cantidad y duración de la hemorragia. Si hay anemia, el estudio debe completarse con la determinación de reticulocitos y metabolismo del hierro. Los contadores hematológicos suelen detectar un volumen plaquetario normal o ligeramente aumentado, pero sin llegar a los valores que se encuentran en las trombocitopenias megatrombocíticas hereditarias, y un aumento en la amplitud de su curva de distribución.
La fracción de plaquetas inmaduras (IPF) se correlaciona directamente con la actividad megacariocítica y varios estudios insinúan que el IPF podría ser equivalente al recuento de reticulocitos en el estudio de las anemias. Existe un autoanalizador de cuarta generación (XE-2100) que puede medir de forma simple y automatizada el IPF. Su determinación puede ser útil para diferenciar, de una manera sencilla y rápida, si una trombocitopenia se debe a un problema en la producción (IPF bajo) o si las plaquetas se destruyen periféricamente (IPF alto). Así, la anemia aplásica, la postquimioterapia, las leucemias agudas o los síndromes mielodisplásicos cursan característicamente con IPF bajos y, sin embargo, en la PTI, la CID, las microangiopatías trombóticas o los estados con hiperesplenismo cursan con IPF altos.
El frotis de sangre periférica es esencial en el algoritmo diagnóstico de la PTI, porque permite confirmar la trombocitopenia y descartar otras causas de trombocitopenia, tales como: el satelitismo plaquetario, la pseudotrombocitopenia por EDTA o los procesos microangiopáticos. En pacientes con PTI, la extensión de sangre periférica muestra unas plaquetas de tamaño normal o aumentado. Paradójicamente, la inspección de los hematíes y los leucocitos, más que la morfología de las plaquetas, es de mayor utilidad para descartar causas de trombocitopenia diferentes a la PTI. Así, por ejemplo, los síndromes mielodisplásicos o leucemias agudas pueden debutar, ocasionalmente, como una trombocitopenia aislada, pero, en un examen de sangre periférica realizado con detenimiento, se puede encontrar, en muchas ocasiones, alteraciones morfológicas en las otras series hematopoyéticas o la presencia de células de aspecto blástico.
La dosi?cación de inmunoglobulinas (Ig, se sebe determinar, a ser posible, antes de su indicación terapéutica, para descartar una de?ciencia de IgA o un estado de inmunode?ciencia
Aunque la exploración rutinaria de la presencia de Helicobacter pylori es objeto de controversia, las actuales recomendaciones aconsejan su determinación en adultos. Un reciente metaanálisis demuestra una fuerte relación de la infección por Helicobacter pylori con la PTI y otras citopenias. Además, se demuestra la relación entre erradicación de la infección y la corrección de las alteraciones hematológicas. En niños, se aconseja su determinación en áreas de alta prevalencia o sospecha clínica. La determinación mediante el test de aliento con urea marcada con un isótopo de carbono, es la técnica de elección. También, puede determinarse el antígeno H. pylori en heces.
El estudio de anticuerpos antiplaquetas es de escasa utilidad en PTI. La determinación de anticuerpos antiplaquetarios específicos tiene baja sensibilidad en PTI (49-66%) y, además, puede ser positiva tanto en PTI como en trombocitopenias no inmunes.
En los adolescentes con PTI de nueva aparición, se debe descartar un lupus eritematoso diseminado (LED) mediante anticuerpos antinucleares. En las poblaciones de riesgo, debe analizarse el VIH, sobre todo en adolescentes sexualmente activos.
El estudio de médula ósea no es necesario en casos típicos para establecer el diagnóstico de PTI. La médula ósea en pacientes con PTI suele ser hipercelular y es muy característico el aumento del número y tamaño de los megacariocitos.
Se realizará un medulograma en pacientes con sospecha de PTI y uno de los siguientes criterios:
• Mayores de 60 años.
• Niños con clínica atípica (dolores óseos, fiebre, adenopatías, hepatoesplenomegalia).
• Presencia de anemia en ausencia de sangrado y/o leucopenia.
• Alteraciones en el frotis sugerentes de SMD (síndrome mielodisplásico), leucemia, mielofibrosis o mieloptisis.
• Paciente refractario.
• Previo a la esplenectomía u otros tratamientos de segunda línea.
• En niños, tampoco se debe realizar, aunque fracase el tratamiento con inmunoglobulinas.
La decisión entre aspirado y biopsia debe hacerse según la sospecha clínica. Por ejemplo, si la sospecha es de leucemia o SMD, podría valer con un aspirado; si sospechamos anemia aplásica, mielofibrosis o mieloptisis, estaría indicada la biopsia medular(10-16).
Tratamiento
El objetivo del tratamiento es prevenir las hemorragias graves y conseguir una adecuada calidad de vida con la mínima toxicidad asociada a la terapia.
Las recomendaciones son una síntesis del documento de consenso publicado en 2011 por la Sociedad Española de Hematología y Oncología Pediátrica y de las recomendaciones de las guías americanas de PTI de 2011.
Las recomendaciones actuales sobre la decisión de tratar o no tratar a los niños con PTI se basan en la consideración de múltiples factores. Las que consideran exclusivamente las cifras de plaquetas son muy controvertidas, puesto que no siempre hay correlación exacta entre la cifra de plaquetas y las manifestaciones hemorrágicas, aunque estas son más frecuentes por debajo de 20 x 109/L.
Actualmente, las decisiones terapéuticas están sustentadas en las manifestaciones hemorrágicas del paciente y, en determinadas ocasiones, en la cifra de plaquetas, debiéndose tener en cuenta: los posibles efectos secundarios de los fármacos, la actividad, estilo de vida del paciente, sus condiciones psicosociales y las comorbilidades asociadas. El curso autolimitado de la PTI en niños y el bajo riesgo de complicaciones hemorrágicas graves a largo plazo apoyan estas líneas de actuación. En niños, aunque el riesgo traumático es superior, sobre todo en preescolares y adolescentes con intensa actividad física, la menor comorbilidad con respecto al adulto facilita el manejo de la enfermedad.
En la tabla IV, se describen los grados de severidad del sangrado y conducta a seguir en niños con PTI, siguiendo las recomendaciones del Consenso internacional para el manejo de PTI en niños(10).
El ingreso hospitalario debe realizarse en aquellos niños que presenten: hemorragia mucosa o sangrado activo, factores de riesgo hemorrágicos, un recuento plaquetar igual o inferior a 20 x 109/L o necesidad de tratamiento con inmunoglobulina humana. Debe tenerse en cuenta: las circunstancias psicosociales de los pacientes y sus familias, capacidad y facilidad para comprender, asimilar y cumplir las indicaciones médicas, la angustia familiar, así como la residencia alejada de un centro sanitario.
Los tratamientos tradicionales para la PTI han consistido predominantemente en la supresión y/o modulación inmunitarias. Sin embargo, el conocimiento actual de la incapacidad de una producción adecuada de plaquetas ha llevado al desarrollo de nuevos tratamientos, cuya diana es el receptor de trombopoyetina, que promueve la diferenciación y maduración de megacariocitos y la generación de plaquetas. Estos nuevos recursos terapéuticos se consolidan como tratamiento de elección para los pacientes con PTI crónica refractaria o sin posibilidad de esplenectomía, permitiendo reducir la toxicidad asociada al tratamiento con inmunosupresores a largo plazo. Sin embargo, no está bien definida la incidencia de respuestas de estos agentes en niños, ni la calidad de la misma(10-15).
Tratamiento de primera línea
Los glucocorticoides a altas dosis en pauta corta y las inmunoglobulinas intravenosas son el tratamiento de primera línea. Los tratamientos de segunda línea y los posteriores deben controlarse en centros especializados.
Como tratamiento de primera línea de la PTI se recomienda:
• Prednisona vía oral o metilprednisolona iv, en 3 dosis: 4 mg/kg/día (dosis máxima 180 mg/día) durante 4 días, 2 mg/kg durante 3 días y suspender. Se propone esta posología por haberse mostrado eficaz y posibilitar un descenso rápido y con menos efectos adversos asociados al tratamiento esteroideo.
• Inmunoglobulinas intravenosas a altas dosis: 0,8-1 g/kg, 1 sola dosis. Inducen un ascenso más rápido del recuento plaquetario. Son hemoderivados y su administración no está exenta de efectos adversos (náuseas, vómitos, cefalea, anafilaxia en pacientes con déficit de Ig A, hemolisis aloinmune y meningitis aséptica) y transmisión de enfermedades infecciosas (hepatitis C).
Hay que valorar siempre, el conjunto de los datos clínicos y biológicos para un adecuado enfoque terapéutico. Los pacientes pueden clasificarse en diversos grupos. En el algoritmo 2, se expone la opción de tratamiento más adecuada en función de las manifestaciones clínicas, recuento de plaquetas y factores de riesgo hemorrágico.
Tratamiento de segunda y tercera línea
En los pacientes que recaen o que no responden adecuadamente a los tratamientos de primera línea, se debe pasar al siguiente escalón terapéutico, con el objetivo de reducir la toxicidad de tratamientos inmunosupresores a largo plazo.
El objetivo principal del tratamiento en la PTI crónica no es curar la enfermedad, sino prevenir los episodios hemorrágicos, debiendo basar las decisiones terapéuticas en los síntomas más que en el número de plaquetas. Estas decisiones deben ser individualizadas y en colaboración con el paciente y la familia. La mayoría de los pacientes con PTI persistente o crónica no requiere tratamiento, especialmente si el sangrado es escaso o no está presente. Se debe procurar que el paciente lleve una vida lo más cercana a la normalidad y con los mínimos efectos adversos derivados del tratamiento.
• En el tratamiento de segunda línea, las posibilidades a considerar son:
1. Dexametasona: 0,6 mg/kg/día (máx. 40 mg) vía oral en una dosis durante cuatro días cada mes.
2. Bolus de glucocorticoides (metilprednisolona): 30 mg/kg/día durante 3 días, en perfusión iv de dos horas.
3. Inmunoglobulina anti-D: 50-75 µg/kg en dosis única intravenosa, perfundida en 1 hora. Indicada exclusivamente en pacientes Rh positivos. Es un hemoderivado y, con frecuencia, desencadena hemólisis importantes, por lo que debe monitorizarse al enfermo hemoglobina, reticulocitos y bilirrubina indirecta. Presenta el riesgo de transmisión de enfermedades infecciosas (hepatitis C).
• Tratamiento de tercera línea:
1. Esplenectomía: aunque tradicionalmente considerada como tratamiento de segunda línea, los grupos de consenso actual la incluyen en el siguiente escalón, considerándose como el tratamiento más efectivo de entre ellos. Está indicada en:
- PTI de diagnóstico reciente o persistente con clínica hemorrágica de riesgo vital, que no responde a los tratamientos previamente instaurados.
- PTI crónica con urgencia hemorrágica o una cifra de plaquetas persistentemente inferior a 30 x 109/L. Valorar en mayores de 5 años sintomáticos refractarios a tratamientos previos, que presentan interferencia con su vida normal con más de dos años de evolución.
Aunque no existen criterios definidos, se recomienda esperar, al menos, 12 meses tras el diagnóstico inicial, debiendo realizar siempre previamente un aspirado medular y un estudio que demuestre que el bazo es el principal lugar de captación de plaquetas. Es efectiva en el 60-80% de los casos, con una elevación inmediata de la cifra de plaquetas, pero tiene un 1-2% de riesgo de ocasionar septicemia por organismos encapsulados, especialmente en niños menores de dos años y, más frecuente, durante el primer año, pero que persiste durante toda la vida.
Medidas de prevención del aumento del riesgo infeccioso:
- Demorar la esplenectomía hasta después de los 5-6 años de vida.
- Comprobar que existe un adecuado entorno familiar (vivienda, hábitos…).
- Vacunación previa a la intervención frente a: neumococo, meningococo y H. influenzae, y, posteriormente, con la siguiente frecuencia: neumococo (cada 5-10 años), meningococo (cada dos años), H. influenzae y gripe (anual).
- Si es posible, realizarla por vía laparoscópica.
- Profilaxis antibiótica con penicilina oral durante los 2-5 primeros años tras la esplenectomía.
- Tratamiento antibiótico empírico urgente ante la sospecha de sepsis o fiebre sin foco con cobertura para neumococo, H. Influenzae y meningococo.
2. Tratamientos farmacológicos: los tratamientos que a continuación se relacionan, deberán emplearse únicamente ante pacientes refractarios a los tratamientos previos (10-15% de los casos) o que tienen contraindicación para la esplenectomía, y que presentan trombocitopenia (<30 x 109/L) persistente o crónica de más de dos años de evolución acompañada de clínica hemorrágica activa o factores de riesgo de sangrado que desaconsejan la simple observación del paciente. Aunque las opciones terapéuticas son variadas, ofrecen escasas tasas de respuesta y no exentas de efectos secundarios. Por otra parte, la ausencia de estudios controlados no permite ofrecer unas recomendaciones claras sobre la opción más adecuada, debiendo ser, en todo caso, el tratamiento individualizado. El empleo de estas medicaciones exige una monitorización en centros especializados.
- Rituximab (anti-CD20): su uso en niños se apoya únicamente en estudios no aleatorizados en casos seleccionados, por lo que su solicitud debe realizarse mediante el procedimiento de “uso compasivo”. La tasa de respuestas es del 30-60%, aunque la experiencia en adultos sugiere que su combinación con altas dosis de dexametasona puede mejorar las tasas de respuesta de la monoterapia. Como efectos adversos produce: problemas inmunoalérgicos, riesgo infeccioso por depleción prolongada de linfocitos B y posible leucoencefalopatía multifocal progresiva.
- Agentes trombopoyéticos (Rituximab y eltrombopag): están aún en fase de investigación en niños; si bien, parece que se convertirán en tratamiento de elección por su eficacia y seguridad. Aunque parecen ofrecer resultados esperanzadores, exigen un tratamiento continuado, ya que exclusivamente estimulan la trombopoyesis sin provocar la remisión de la enfermedad, y suponen un aumento del riesgo trombótico. Debe vigilarse durante su tratamiento la función hepática.
El primero de ellos se administra por vía subcutánea con periodicidad semanal, mientras que el segundo, es de administración oral diaria.
- Otros tratamientos en monoterapia o en combinación: azatioprima, ciclosporina, danazol, ciclofosfamida, vincristina, etc.
Tratamiento de las Urgencias con riesgo vital y situaciones de especial riesgo
En situaciones de riesgo vital con hemorragias del sistema nervioso central (SNC) u otras hemorragias que comprometan la vida del paciente, se pueden considerar también, las siguientes opciones, preferentemente de forma combinada:
• La transfusión de plaquetas (a doble o triple dosis de la habitual) para mantener recuentos >50 x 109/L, puede ser una opción a valorar en pacientes no esplenectomizados en situaciones excepcionales.
• Metilprednisolona: bolus de 30 mg/kg/día, en perfusión iv, máximo 1 g/día durante tres días.
• Inmunoglobulinas iv a dosis de 1 g/kg/día durante dos días o gammaglobulina anti-D a dosis de 75 mcg/kg, en dosis única (exclusivamente en pacientes Rh positivos que no hayan sido esplenectomizados).
• La esplenectomía de urgencia y el uso de factor VIIa recombinante pueden ser opciones a considerar ante hemorragias de riesgo vital o previamente a realizar una craneotomía.
- En situaciones con riesgo especial, TCE, politraumatizados y cirugía urgente.
Administrar inmnoglobulinas iv: 0,8-1 g/kg si plaquetas <50 x 109/L y plaquetas si recuento <10 x 109/L.
- En casos de cirugía programada, se debe valorar el riesgo hemorrágico según intervención. Se aconseja la administración de IgIV 0,8-1 g/kg, si el recuento de plaquetas es inferior a 50 x 109/L.
- En la esplenectomia programada, se debe administrar IgIV 0,8-1 g/kg si el recuento es inferior a 20 x 109/L, y efectuar pinzamiento precoz de la arteria esplénica.
PTI durante el embarazo. Manejo del neonato
Los recuentos plaquetarios o la clínica hemorrágica de la madre no se correlacionan con el desarrollo de trombocitopenia neonatal; por tanto, y ante la imposibilidad de predecir la trombocitopenia en el recién nacido, deben evitarse los procedimientos invasivos, tales como: la obtención de muestras de sangre del cuero cabelludo, la cordocentesis y los partos instrumentados.
Los mayores descensos de plaquetas en los niños se observan a las primeras 48 horas de vida, por lo que deben efectuarse hemogramas seriados durante los primeros siete días de vida. En los neonatos con clínica hemorrágica o cifras de plaquetas <20 x 109/L, la administración de una única dosis de IgIV (1 g/kg) produce una rápida respuesta.
Se recomienda realizar una ecografía transcraneal en todo neonato con una plaquetopenia grave para excluir tempranamente sangrado asintomático deL SNC.
Evolución y seguimiento
El seguimiento debe individualizarse. En pacientes sin tratamiento activo, se recomienda un hemograma cada 3-6 meses, y programas de educación para que consulten en caso de hemorragia, cirugía o procedimiento invasivo y gestación.
Recomendaciones generales para pacientes con PTI
Los síntomas derivados de la PTI junto con la ansiedad o el miedo a las hemorragias condicionan un gran impacto en la calidad de vida de los pacientes con PTI. Además, hay que sumar los efectos secundarios de los tratamientos. Los niños con PTI pueden verse aislados si existen restricciones en su estilo de vida y, en adultos, se puede afectar notablemente su productividad laboral.
Con los tratamientos actuales para la enfermedad y la toma de precauciones, la PTI es ampliamente manejable (Tabla V).
Calidad de vida en el paciente con PTI
La trombopenia inmune primaria (PTI) es una patología muy heterogénea en cuanto a su forma de presentación y a sus manifestaciones clínicas, y que incide de forma muy diversa en la calidad de vida (CV) de los individuos que la padecen. Los principales factores implicados en dicha calidad de vida son:
• Factores relacionados con la enfermedad: episodios hemorrágicos, recuento plaquetario, astenia, ingresos/visitas hospitalarias, edad, duración de la PTI (aguda vs crónica), limitación de la actividad física, efectos psíquicos (miedo).
• Factores relacionados con el tratamiento: administración del tratamiento, eficacia del tratamiento, efectos psíquicos/físicos del tratamiento, complicaciones infecciosas, hiperglucemia, riesgo tromboembolismo, esplenectomía, vía de administración.
Para la valoración de la CV en PTI se han empleado dos tipos de escalas, unas específicas para PTI y otras generales de salud que se han aplicado a este tipo de pacientes. Hay dos herramientas pediátricas de investigación cualitativa que valoran la calidad de vida: The Kids ITP Tools (KIT) y el ITP-quality of life. Evalúan aspectos psicológicos, emocionales y de salud física relacionados con la calidad de vida de los pacientes con PTI. La Kids ITP Tools está compuesta por 3 cuestionarios validados: Child self-report, con preguntas dirigidas al niño; parent proxy report cuestionario, realizado a los padres sobre la calidad de vida del niño; y el parent impact report, que evalúa el impacto que tiene la enfermedad del hijo en sus padres.
Funciones del pediatra de Atención Primaria
El diagnóstico diferencial de los cuadros purpúricos durante la infancia incluye múltiples procesos de etiopatogenia muy diversa, entre los cuales se puede encontrar patología de gravedad, como: neoplasias, infecciones severas o malos tratos. Desde el punto de vista de la Atención Primaria, interesa incidir, especialmente, en el diagnóstico diferencial que plantea, partiendo de la anamnesis y de la exploración física, así como en la adecuada gestión y derivación del caso.
En el seguimiento y control evolutivo de los pacientes diagnosticados de PTI, el pediatra de Atención Primaria debe:
• Favorecer la adherencia terapéutica de estos pacientes y monitorizar los efectos adversos de los tratamientos empleados, colaborando en la realización de controles analíticos periódicos.
• Se debe tener precaución y administrar, solo en caso necesario, fármacos que puedan alterar la agregación plaquetaria (antihistamínicos, antiinflamatorios no esteroideos) prescribiendo como analgésico/antitérmico preferentemente paracetamol.
• Asegurar el cumplimiento del calendario vacunal de estos pacientes, prestando especial atención a la vacunación frente al neumococo, meningococo, H. influenzae, varicela, triple vírica y gripe. Realizar la vacunación preventiva y de recuerdo recomendada si se realiza una esplenectomía.
• Si se viaja al extranjero, asegurar que las inmunizaciones están actualizadas.
• Explicar cómo se monitorizan los signos y síntomas de niveles bajos de plaquetas.
• Clarificar cuándo es necesario buscar ayuda médica.
• Animar a los pacientes a unirse a grupos de apoyo.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** Vieria RL. Rash-Petechiae and purpura. En: Fleisher GR, Ludwig S (eds). Text-book of Pediatric Emergency Medicine. 6th revised editon. Chapter 65. Lippincott Willians & Wilkins; 2010. p. 532-9.
2.** Scott Nelson JP, Montgomery RR. Enfermedades de las plaquetas y de los vasos sanguíneos. En: Kliegman RM, Behrman RE, Jennon HB, Stanton BF eds. Tratado de Pediatría Nelson 18ª ed. Cap. 484. p. 2081-9.
3.*** Amigo Bello MC. Fisiopatología y trastornos de la coagulación. Pediatría integral. 2008; XII: 469-80.
4.*** Menéndez Suso JJ, Lodoso Torrecilla B, Plaza López de Sabando D. Púrpura en urgencias. Decisiones en urgencias pediátricas. Ergon; 2010. p. 606-13.
5. *** García Hernández B, González Martínez B. Trastornos de la hemostasia y la coagulación. En: García –Sicilia López J (ed). Manual práctico de Pediatría en Atención Primaria. 2ª edición Madrid. Publimed., 2013. p. 843-53.
6. *** Asenjo Torner E, Cela de Julián E. Petequias. Púrpuras. Hematomas. En: Míguez Navarro MC (ed). Síntomas y signos guía en Urgencias Pediátricas. Madrid: Ediciones Ergon; 2016. p. 534-39.
7. *** Ares Álvarez J, Plaza Almeida J, García Suárez A. Exantemas purpúrico-petequiales. Guía de Algoritmos en Pediatría de Atención Primaria. AEPap. Lúa Ediciones. 2016.
8.*** Rodeghiero F, Stasi R, Gernsheimer T, et al. Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura of adults and children: report from an international working group. Blood. 2009; 113: 2386-93.
9.** Stasi R. Immune thrombocytopenia: pathophysiologic and clinical update. SemnThromb Hemost. 2012; 38: 454-62.
10. *** Provan D, Stasi R, Newland AC, et al. International consensus report on the investigation and management of primary immune thrombocytopenia. Blood. 2010; 115: 168-86.
11.*** Neunert C, Lim W, Crowther M, et al. The American Society of Hematology 2011 evidence-based practice guideline for immune thrombocytopenia. Blood. 2011; 117: 4190-207.
12.*** Neunert CE, Buchanan GR, Imbach P, et al. Bleeding manifestations and management of children with persistent and chronic immune thrombocytopenia: data from the Intercontinental Cooperative ITP Study Group (ICIS). Blood. 2013; 121: 4457-62.
13.*** Monteagudo E, Fernández-Delgado R, Sastre A, et al., en representación del Grupo de Trabajo de la PTI de la Sociedad Española de Hematología y Oncología Pediátricas. Protocolo de estudio y tratamiento de la trombocitopenia inmune primaria (PTI-2010). An Pediatr (Barc). 2011; 74: 414.e1-e8.
14.*** Sanz MA, Vicente V, Fernández A, et al. Diagnóstico, tratamiento y seguimiento de la trombocitopenia inmune primaria. Conferencia de consenso. Med Clin. 2012; 138: 261.e17.
15.*** Aguilar Franco C, Aguilera Sanz C, Alberca I, et al., en representación de la Sociedad Castellano-Leonesa de Hematología y Hemoterapia. Guía de práctica clínica para la PTI en Castilla y León. Documento de Consenso. Madrid: You & US. S.A. 2014.
Bibliografía recomendada
– García Hernández B, González Martínez B. Trastornos de la hemostasia y la coagulación. En: García –Sicilia López J (ed). Manual práctico de Pediatría en Atención Primaria. 2ª edición Madrid. Publimed., 2013. p. 843-53.
Manual práctico de ayuda en el manejo básico de las principales patologías pediátricas en Atención Primaria.
– Ares Álvarez J, Plaza Almeida J, García Suárez A. Exantemas purpúrico-petequiales. Guía de Algoritmos en Pediatría de Atención Primaria. AEPap. Lúa Ediciones. 2016.
Instrumento de ayuda en la toma de decisiones para el pediatra de Atención Primaria.
– Asenjo Torner E, Cela de Julián E. Petequias. Púrpuras. Hematomas. En: Míguez Navarro MC (ed). Síntomas y signos guía en Urgencias Pediátricas. Madrid: Ediciones Ergon; 2016. p. 534-39.
Herramienta práctica en las Urgencias y centros de Atención Primaria.
– Aguilar Franco C, Aguilera Sanz C, Alberca I, et al., en representación de la Sociedad Castellano-Leonesa de Hematología y Hemoterapia. Guía de práctica clínica para la PTI en Castilla y León. Documento de Consenso. Madrid: You & US. S.A. 2014.
Guía de práctica clínica para el diagnóstico, tratamiento y seguimiento de la Trombocitopenia Inmune Primaria (PTI) en Castilla y León.
– Monteagudo E, Fernández-Delgado R, Sastre A, et al., en representación del Grupo de Trabajo de la PTI de la Sociedad Española de Hematología y Oncología Pediátricas. Protocolo de estudio y tratamiento de la trombocitopenia inmune primaria (PTI-2010). An Pediatr (Barc). 2011; 74: 414.e1-e8.
Documento de referencia del Grupo de Trabajo de la PTI de la Sociedad Española de Hematología y Oncología pediátricas, sobre las recomendaciones protocolizadas para el diagnóstico y tratamiento de la enfermedad.
– Sanz MA, Vicente V, Fernández A, et al. Diagnóstico, tratamiento y seguimiento de la trombocitopenia inmune primaria. Conferencia de consenso. Med Clin. 2012; 138: 261.e17.
Guía que trata de actualizar y adaptar a España las recomendaciones de los documentos de consenso internacional.
| Caso clínico |
|
Niña de 6 años que acude a su pediatra por presentar, desde hace 24 horas, lesiones purpúricas en cara, tronco y extremidades. Refieren los padres que previamente se encontraba bien, no presentando fiebre ni otros síntomas sugestivos de enfermedad. Unos días antes había presentado leve epistaxis que se había resuelto con medidas de presión local. Tampoco refieren antecedentes traumáticos previos. Hace una semana presentó fiebre asociada a exantema en cara y tronco que se resolvió en 48 horas sin tratamiento. Es derivada a su Hospital de referencia para su valoración. Antecedentes personales y familiares Única hija de un matrimonio sano sin antecedentes de consanguinidad. Embarazo, parto y periodo neonatal normales. Crecimiento y desarrollo normal. Calendario vacunal completo. No presenta antecedentes personales de interés. Tampoco refieren antecedentes familiares de enfermedades hematológicas, malformaciones, sordera, alteraciones óseas o articulares. Exploración física al ingreso Presenta aceptable estado general, coloración normal de piel y mucosas, petequias y alguna lesión purpúrica en cara, tronco y extremidades. No signos de hemorragia en otra localización. No se palpan adenopatías. Auscultación cardiopulmonar normal. Abdomen normal, no se palpan masas ni hepatoesplenomegalia. Genitales normales. Faringe normal. Otoscopia normal. Exploración articular y neurológica normal. Peso y talla en percentil: 25-50. Temperatura: 36,8°C axilar. Tensión arterial: 11/6. Exámenes complementarios A su llegada al hospital, se inicia estudio analítico, mostrando una plaquetopenia de 14.000 µ/L con serie roja y leucocitos normales. Se decide ingreso para completar estudio, decidiendo, como actitud terapéutica, la observación con estrecha vigilancia clínica y del recuento de plaquetas. Se realiza frotis de sangre periférica, que muestra plaquetas escasas, alguna de tamaño grande, no apreciándose fórmulas inmaduras. Se solicitan, asimismo: bioquímica, hemostasia y sedimento de orina, que resultan normales, serología de virus IgG, positiva a parvovirus B19, Hepatitis B, C, CMV y VIH negativas. Test de Coombs directo: negativo. Pruebas de coagulación: normal, tiempo de hemorragia: normal. Inmunoglobulinas: normales. Evolución Con el diagnóstico de trombocitopenia inmune primaria post-infecciosa se observa evolución. A las 24 horas del ingreso, aumentan las lesiones hemorrágicas cutáneas haciéndose más extensas y grandes, presentando gingivorragia y hematuria en orina. El contaje plaquetario realizado en ese momento es de 7.000 µ/L, por lo que se decide tratamiento con inmunoglobulina iv, 0,8 g por kg de peso. A las 24 horas, no se evidencia signos de sangrado en mucosas, con un contaje plaquetar de 20.000 µ/L. Se mantiene estable durante los siguientes días de su ingreso, siendo dada de alta a los 7 días con una cifra de plaquetas de 70.000 µ/L. Se dan indicaciones de vigilancia domiciliaria ante el inicio de nuevos signos de sangrado, limitando su actividad física y evitando fármacos que alteren la función plaquetaria. Se realiza seguimiento periódico en su Centro de Salud y en el servicio de Hematología del Hospital durante los siguientes meses, no presentando nuevos síntomas de sangrado y con ascenso progresivo del número de plaquetas, siendo a los 6 meses de 120.000 µ/L.
|