 |
| Regreso a las bases |
D. Yeste, A. Carrascosa
Hospital Universitari Vall d’Hebron de Barcelona. Servicio de Endocrinología Pediátrica. Universidad Autónoma de Barcelona
Pediatr Integral 2015; XIX (6): 436.e1-436.e9
Valoración e interpretación de la masa ósea en la infancia y adolescencia
Introducción
El crecimiento y la mineralización del esqueleto óseo son procesos que se inician durante el desarrollo fetal y continúan a ritmos diferentes durante la infancia y adolescencia hasta la tercera década de la vida, momento en que se alcanza el pico máximo de masa ósea. A partir de entonces la masa ósea se mantiene constante hasta la quinta-sexta décadas, edad en la que comienza a declinar progresivamente. El capital óseo con el que se llega a la edad adulta es por tanto un factor condicionante del potencial desarrollo de osteoporosis que se acompaña con la edad. Factores genéticos, nutricionales, hormonales y estilos de vida desempeñan un papel determinante de la mineralización del esqueleto. En consecuencia, las patologías crónicas que afecten a estos factores durante la infancia y adolescencia pueden ser condicionantes de una deficiente o insuficiente mineralización ósea en estas edades de la vida y ser responsables de estados de osteopenia que incrementen el riesgo de desarrollar patología osteoporótica en edades tempranas o tardías de la vida. Por consiguiente, es del máximo interés que todas las poblaciones pediátricas, tanto normales como con patología, lleguen a la tercera década de la vida con un nivel óptimo de masa ósea para prevenir el ulterior desarrollo de la osteoporosis(1,2) (Fig. 1).
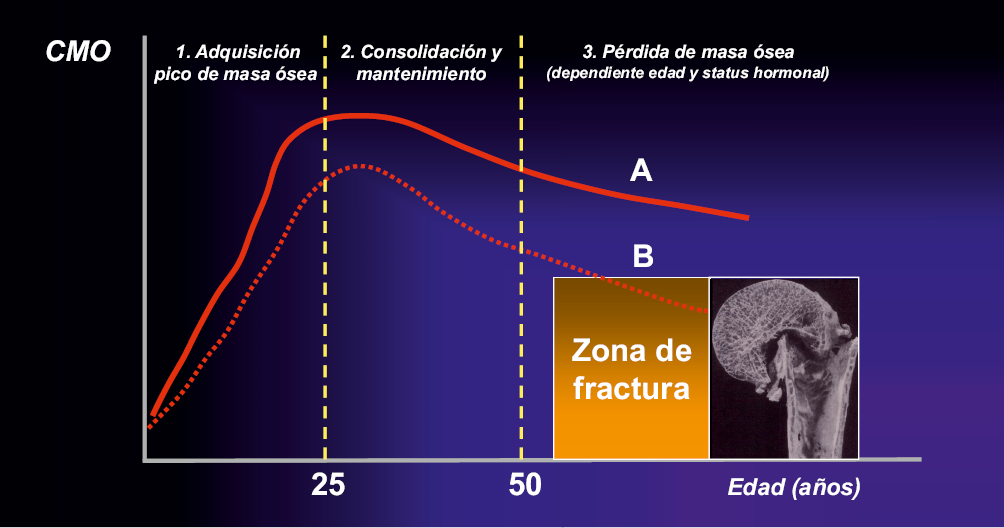
Figura 1. Evolución de la masa ósea desde el nacimiento a la edad adulta. A. Población normal. B. Población con osteopenia iniciada en la infancia y/o adolescencia.
Crecimiento y mineralización del tejido óseo
El hueso es un tejido conjuntivo que posee la característica de tener una matriz extracelular mineralizada, convirtiéndose en una estructura apta para el soporte del organismo. Es un tejido metabólicamente muy activo, sometido a un proceso constante de aposición y resorción. Alberga en su interior la médula ósea hematopoyética y es reservorio de importantes iones que pueden ser almacenados y liberados de forma controlada. Se desarrolla a partir de moldes cartilaginosos y su volumen aumenta progresivamente durante los periodos embrionario, fetal y postnatal, estando totalmente formado al finalizar la pubertad, coincidiendo con el momento en que se alcanza la talla adulta.
El proceso de osificación se desarrolla de dos modos diferentes: la osificación endocondral, a partir del cartílago de crecimiento (huesos largos) y la osificación intramembranosa a partir de estructuras mesenquimales (huesos planos). El crecimiento en grosor se realiza a partir de la capa de osteoblastos del periostio del hueso previamente formado. Macroscópicamente se distinguen dos formas de hueso: el hueso cortical, más compacto y resistente que se localiza en la periferia del hueso, y el hueso trabecular dispuesto en forma de láminas, menos compacto, pero metabólicamente más activo, localizándose en el interior del hueso en contacto con la médula ósea.
Las células óseas provienen de dos estirpes. Los preosteoblastos, los osteoblastos y los osteocitos son de origen mesenquimal y los osteoclastos de origen hematopoyético. Los osteocitos son las células maduras localizadas en el interior de la matriz ósea, están interconectadas a través de sus prolongaciones citoplasmáticas y desempeñan un importante papel en la regulación del intercambio de minerales, así como en la integración y respuesta a estímulos físicos y químicos procedentes de los tejidos adyacentes. Constituyen más del 90% del total de células del hueso. Los osteoblastos son responsables de la síntesis de la matriz ósea y regulan la actividad de los osteoclastos a través de la síntesis de citocinas y factores de crecimiento. Los osteoclastos son grandes células multinucleadas provenientes de los monocitos y encargadas de la resorción de la matriz ósea. Osteoblastos y osteoclastos se acoplan en unidades funcionales de resorción y neoformación ósea denominadas de remodelado óseo.
La matriz ósea está formada por un componente orgánico y otro inorgánico. El componente orgánico está constituido en un 90% por fibras de colágeno tipo I, y en el 10% restante, por proteoglucanos y otras proteínas no colágenas. El componente inorgánico está integrado por sales de hidroxiapatita depositadas entre las fibras de colágeno, carbonato cálcico, magnesio, sodio y potasio. El componente orgánico representa un 25% del peso óseo, el componente inorgánico un 70% y el restante 5% corresponde al agua. El depósito, en concentraciones adecuadas, de estas sales minerales en la matriz junto a la orientación anatómica de las fibras de colágeno mineralizadas, confiere al hueso las características de rigidez y elasticidad que le permiten ser soporte del organismo y resistir las cargas y fuerzas de tracción a las que constantemente están sometidas las estructuras óseas. Una mineralización insuficiente y la desestructuración de la arquitectura ósea pueden ser el origen de la aparición de fracturas osteoporóticas.
El hueso es un tejido metabólicamente muy activo, estando sometido a un proceso continuo de neoformación. Durante la infancia y la adolescencia hasta la adquisición de la talla adulta concurren dos fenómenos: formación de nuevo hueso a partir del cartílago de crecimiento (osificación endocondral) y resorción-neoformación de la matriz extracelular previamente sintetizada (acción de osteoblastos y osteoclastos). Ambos fenómenos se combinan y acoplan teniendo como resultado la adquisición la masa ósea (Fig. 2). Durante la edad adulta la masa ósea se mantiene y durante las últimas décadas de la vida disminuye la neoformación ósea, el balance se negativiza y conlleva una disminución progresiva de la masa ósea.

Figura 2. Actividad de remodelado óseo. Acoplamiento de la actividad de los osteoclastos y osteoblastos. Resorción y neoformación ósea.
La cantidad total de calcio depositada en el esqueleto de un recién nacido se incrementa desde unos 22 g (8 g/kg de peso) hasta unos 1.300 g (19 g/kg de peso) en el adulto. Las cifras correspondientes de fósforo pasan de 17 g en el recién nacido (5,8 g/kg de peso) a 700 g (10 g/kg de peso) en el adulto. Se estima aproximadamente que entre un 7,5% y un 10% del volumen óseo total del organismo adulto es renovado anualmente(3).
Masa ósea. Concepto de osteopenia y de osteoporosis
El término de masa ósea define la cantidad total de tejido óseo del organismo y depende del volumen del esqueleto y de la cantidad de células y matriz extracelular mineralizada, en él albergadas. En condiciones fisiológicas, la cantidad total de sales minerales depositadas en la matriz por unidad de volumen es relativamente constante; sin embargo, en situaciones patológicas la cantidad de sales minerales puede ser superior (osteopetrosis) o inferior (raquitismo/osteomalacia).
La osteoporosis se define como una situación en la que existe una pérdida global de masa ósea. La celularidad y los componentes orgánico e inorgánico de la matriz están disminuidos. La disminución de la matriz extracelular puede ser homogénea y afectar por igual al componente orgánico e inorgánico, o puede afectar más al componente mineral que al componente orgánico. La osteoporosis puede ser uniforme en todo el hueso o afectar más a unas partes que a otras del mismo hueso. El resultado final siempre es la pérdida de la arquitectura normal del hueso e implica una disminución de su resistencia y elasticidad, teniendo como consecuencia la posible aparición de fracturas patológicas.
Osteopenia y osteoporosis son dos términos que definen grados diferentes de pérdida de la masa ósea. El desarrollo de métodos no invasivos para cuantificar la masa ósea ha permitido valorar el contenido mineral óseo en diversas regiones anatómicas y definir los conceptos de osteopenia y de osteoporosis y su relación con la aparición de fracturas, en la edad adulta. Según los criterios de la Organización Mundial de la Salud, los valores de densidad mineral ósea (DMO) comprendidos entre -1 y -2,5 desviaciones estándar (DE) de los valores de la media correspondientes a una población adulta de similar edad y sexo definen el concepto de osteopenia. Cuando estos valores son inferiores a -2,5 DE definen el concepto de osteoporosis; con estos valores ya existe un riesgo franco para la aparición de fracturas óseas, pero no significa que todos los sujetos que los tengan las vayan a presentar necesariamente.
A diferencia de lo que ocurre en la población adulta, en la que ya se ha alcanzado el pico de masa ósea, y los criterios de osteopenia y osteoporosis reflejan el riesgo para la aparición de fracturas patológicas, ya que las posibilidades de recuperación son limitadas, en la infancia y la adolescencia, la masa ósea se está adquiriendo y valores bajos de masa ósea pueden recuperarse con la terapia adecuada en muchas ocasiones. Por esta razón, los conceptos de osteopenia y osteoporosis no pueden tener el mismo significado que en la edad adulta y, en general, se prefiere hablar de valores bajos de masa ósea en relación con los de una población de similar edad, sexo y estadio puberal, categorizando estos valores en forma de valor z-score. En Pediatría y por debajo de los 20 años de edad, se recomienda utilizar el concepto de “densidad mineral baja o disminuida para la edad cronológica” cuando los valores de z-score son inferiores a -2.
La osteopenia/osteoporosis se clasifica en dos tipos: primaria y secundaria. La primaria se refiere a aquellas situaciones en las que la pérdida de masa ósea está relacionada con procesos fisiológicos, como la menopausia y el envejecimiento. La secundaria se refiere a situaciones clínicas de etiología bien definida: trastornos nutricionales, hormonales y de la estructura de la matriz ósea. La osteopenia/osteoporosis primaria es propia del adulto y puede prevenirse durante la infancia y adolescencia logrando un pico óptimo de masa ósea. La osteopenia/osteoporosis secundaria puede presentarse en cualquier edad. Cuando ocurre durante la infancia y adolescencia (“densidad mineral baja para la edad cronológica”), la consecución de un pico de masa ósea adecuado puede verse seriamente afectada(4,5).
Factores reguladores de la masa ósea
Muchos son los factores que regulan la adquisición de la masa ósea: la carga genética, la nutrición, los estilos de vida, la actividad física, diferentes hormonas, múltiples factores locales de crecimiento y algunas citocinas (Fig. 3).

Figura 3. Factores reguladores de la masa ósea.
Durante la infancia y la adolescencia favorecen el anabolismo óseo y la adquisición del pico de masa ósea. Durante la edad adulta contribuyen al equilibrio entre resorción y neoformación óseas y favorecen el mantenimiento de la masa ósea(3,5).
Factores genéticos
Diversos estudios han evaluado que los factores genéticos pueden explicar entre un 60-80% de la variabilidad de la masa ósea en la población normal. Los hijos tienden a tener una masa ósea similar a la de sus padres. Esta aseveración ha sido comprobada en varios estudios realizados en gemelos y en parejas de madres e hijas y de padres e hijos. Los gemelos monocigóticos tienen una densidad mineral ósea más concordante que los gemelos dicigóticos. Así mismo, también se ha comprobado que los familiares de personas con osteoporosis tienen valores de densidad mineral ósea inferiores a los de la población normal. Aceptándose que la regulación de la masa ósea es un proceso poligénico, en el curso de estos últimos años una parte importante de la investigación sobre marcadores genéticos se ha centrado en el estudio de genes de receptores hormonales, genes de hormonas, genes de factores de crecimiento, genes de factores de transcripción y genes de proteínas de la matriz del hueso.
Actividad física
La actividad física es un determinante mayor de la masa ósea. Regula la síntesis del componente orgánico de la matriz ósea, el depósito de sales minerales, la orientación espacial de las fibrillas de colágeno mineralizadas y la orientación espacial de la arquitectura ósea. Sus efectos van en el sentido de optimizar la fuerza y la resistencia del hueso frente a los micro y macrotraumatismos a los que está continuamente sometido. Los niños y adolescentes con actividad física apreciable tienen valores mayores de densidad mineral ósea que aquellos que tienen una actividad sedentaria. Las atletas de élite, corredoras y gimnastas, incluso a pesar de presentar cierto grado de hipogonadismo, tienen valores de densidad mineral ósea superiores a los individuos sedentarios. Estudios controlados en adolescentes con diversos grados de actividad física, han mostrado que el ejercicio prolongado estimula la aposición de masa ósea.
Estilos de vida
El consumo excesivo de alcohol y el hábito de fumar también ha sido relacionado con valores de densidad mineral ósea bajos y con una mayor incidencia de fracturas óseas.
Factores hormonales y factores locales de crecimiento
La parathormona tiene un efecto dual sobre el metabolismo óseo. Concentraciones séricas fisiológicas estimulan el anabolismo óseo; por contra, concentraciones séricas elevadas favorecen el catabolismo óseo. A nivel renal estimula la actividad 1-a-hidroxilasa, y la síntesis del metabolito activo de la vitamina D, el calcitriol 1,25-(OH)2D, favoreciendo indirectamente la absorción intestinal de calcio. La calcitonina inhibe la acción de los osteoclastos y por este motivo ha sido utilizada para el tratamiento de la osteoporosis. La hormona de crecimiento regula junto con la nutrición la síntesis del factor de crecimiento IGF-I con importantes efectos anabólicos sobre el cartílago de crecimiento y el hueso. En este sentido, los niños y adolescentes afectos de deficiencia de hormona de crecimiento presentan una masa ósea disminuida. Los esteroides gonadales (estradiol y andrógenos) son agentes reguladores del crecimiento y de la mineralización ósea y a través de las influencias que la nutrición tiene sobre su secreción, esta última también regula estos procesos. Su presencia es necesaria para realizar el brote de crecimiento puberal y para la adecuada mineralización del cartílago de crecimiento y del hueso. Situaciones clínicas de hipogonadismo en ambos sexos condicionan una disminución de la masa ósea. Las hormonas tiroideas estimulan la mineralización del cartílago de crecimiento y regulan la actividad de remodelado óseo; en situación de hipertiroidismo se observa disminución de masa ósea. Los glucocorticoides a dosis suprafisiológicas inhiben tanto el crecimiento como la mineralización del hueso. Sin embargo, a dosis fisiológicas o dosis discretamente superiores, como las administradas en la hiperplasia suprarrenal congénita, no tienen repercusiones negativas importantes sobre la masa ósea, aunque sí sobre el crecimiento.
La leptina, hormona sintetizada por los adipocitos y que informa al hipotálamo de las reservas energéticas, ha sido considerada también como un posible mediador que estimularía el gonadostato. Más recientemente, un efecto de la leptina sobre el metabolismo óseo ha sido también sugerido. Finalmente, existen múltiples factores locales de crecimiento y citocinas que regulan también el metabolismo óseo.
Factores nutricionales
La nutrición regula el proceso de adquisición y mantenimiento de la masa ósea a través de diversos mecanismos:
• Aporta nutrientes energéticos y plásticos necesarios para la multiplicación celular y la síntesis de la matriz del cartílago y del hueso.
• Aporta vitaminas que regulan la formación de esta matriz.
• Aporta sales minerales de calcio, fósforo y magnesio que se depositan en la matriz.
• Condiciona la síntesis de hormonas y factores locales de crecimiento que regulan globalmente, tanto el proceso de crecimiento en longitud de los huesos como el de su mineralización: hormona de crecimiento, IGF-I y esteroides gonadales.
La malnutrición condiciona una situación de hipogonadismo hipogonadotropo. Cuando se produce antes de la pubertad, condiciona un retraso en la aparición del desarrollo puberal; cuando se produce durante el desarrollo puberal, condiciona un paro en el desarrollo de la pubertad, y cuando se produce en la adolescencia o en el adulto condiciona una abolición de la función gonadal normal, manifestándose mediante una amenorrea en las mujeres y un hipogonadismo en los varones. No son completamente conocidos los mecanismos a través de los cuales el estado nutricional puede regular la secreción de gonadotrofinas.
Calcio y mineralización ósea
El calcio es el quinto elemento del organismo en abundancia. Un 99,4% está depositado en el esqueleto óseo, un 0,5% en los tejidos blandos y el 0,4% restante en el líquido extracelular, fundamentalmente en el plasma. La cantidad total de calcio depositada en el esqueleto óseo pasa de 30 g en el recién nacido a 1.300 g en el adulto, manteniéndose estable desde entonces hasta las últimas décadas de la vida, momento en que existe una pérdida relacionada con la disminución fisiológica de la masa ósea. El balance cálcico es netamente positivo durante la infancia y adolescencia, es neutro durante la edad adulta y está relacionado con el proceso de adquisición y mantenimiento de la masa ósea.
El depósito de calcio en el hueso depende de la cantidad total de calcio presente en la alimentación, de su tasa de absorción intestinal y de su eliminación urinaria. La cantidad total de calcio en la dieta puede variar desde 300 a 2.000 mg/día según el tipo de dieta realizada. La absorción intestinal de calcio varía según la edad. Durante los dos primeros años de la vida, período de tiempo en el cual la aposición de calcio en el esqueleto es máxima, la capacidad intestinal de absorción de calcio se estima que puede llegar hasta un 40% del total ingerido. Esta cantidad puede aumentar hasta un 70% cuando la fuente de calcio es la leche materna. Durante la infancia y hasta el inicio del desarrollo puberal, esta puede ser hasta un 27%, para incrementarse durante el desarrollo puberal hasta un 30% y disminuir posteriormente en la edad adulta desde un 20% en los adultos jóvenes (hasta los 30 años de edad) hasta un 4-8% en edades posteriores. Un 90% de la absorción intestinal de calcio se realiza en el intestino delgado y solo un 10% en el intestino grueso. La absorción intestinal de calcio se realiza en el yeyuno y en el íleon y depende de la biodisponibilidad del calcio y de la vitamina D. La vitamina D regula la calbindina, proteína transportadora de calcio. La biodisponibilidad del calcio depende de los compuestos químicos de los que forma parte y de la presencia de otros factores presentes en la dieta (fibra, oxalatos, fitatos).
En situaciones clínicas de bajo aporte de calcio, su absorción intestinal puede incluso incrementarse por encima de los niveles antes comentados, siempre que los niveles plasmáticos de 1,25-(OH)2D sean adecuados, con objeto de permitir una aposición ósea correcta, aunque aportes inferiores a 450 mg/día han mostrado ser claramente insuficientes para mantener un adecuado ritmo de incremento de la masa ósea. Por contra, situaciones de aporte excesivo de calcio no comportan un incremento lineal de la absorción intestinal del mismo, existiendo incluso unos valores a partir de los que ya no se incrementa la absorción intestinal de calcio.
Una cuestión debatida durante estos últimos años es la relación existente entre aporte de calcio en la dieta y masa ósea. Se acepta que existe un umbral fisiológico para la absorción de calcio dependiente de la edad y en íntima relación con las necesidades de calcio para lograr un ritmo normal de adquisición de masa ósea. Aunque este umbral puede ser forzado con la suplementación de calcio, no se conocen los efectos a largo término de este hecho, siendo necesarios estudios prospectivos que indiquen:
• Qué épocas de la vida son más sensibles a esta suplementación: infancia, niñez, desarrollo puberal, adolescencia o adulto joven.
• Cuáles son las necesidades óptimas para cada época.
• Si los cambios inducidos en la masa ósea son permanentes o desaparecen al suprimir la suplementación.
• Si esta suplementación resulta en un pico de masa ósea superior.
• Si este pico de masa ósea es beneficioso o no para evitar la aparición de fracturas osteoporóticas.
Responder a todas estas cuestiones es difícil y requiere estudios a muy largo término. Mientras tanto, parece útil seguir las recomendaciones de aporte de calcio sugeridas en diversas reuniones de consenso y por diferentes sociedades médicas y lograr que todos los niños y adolescentes tengan niveles óptimos de vitamina D.
Las recomendaciones actuales de aporte de calcio en la dieta fueron revisadas a finales de 2010, por el Food and Nutrition Board del Instituto de Medicina de la Academia Americana de Ciencias y varían entre los 200 mg para los lactantes a 1.300 mg para los adolescentes. Las principales fuentes alimentarias de calcio las constituyen: los productos lácteos, el pan, los huevos y los cítricos.
En resumen, teniendo en cuenta la variabilidad en la absorción intestinal de calcio según las diferentes edades e incluso la capacidad de incrementarse en situaciones de aporte cálcico restringido, y que la vitamina D es el mayor agente responsable de la absorción intestinal de calcio, parece razonable recomendar que si el aporte de vitamina D es suficiente, no son necesarios aportes superiores de calcio a los recomendados, para adquirir y mantener la masa ósea. Aportes más elevados de calcio podrían condicionar una hipercalciuria y el riesgo relativo de nefrocalcinosis, particularmente si se asocian a dosis superiores a las recomendadas de vitamina D, tal como se ha observado en la intoxicación por vitamina D. La suplementación de calcio solo estaría indicada cuando las ingestas son inferiores a las recomendadas, particularmente durante los períodos de máxima acreción de masa ósea: los primeros años de vida y el desarrollo puberal. La suplementación de calcio en las poblaciones con trastornos de la absorción intestinal y con necesidades fisiológicas aumentadas (prematuridad, embarazo y lactancia durante la adolescencia), siempre tendrá como objeto no sobrepasar las recomendaciones anteriormente comentadas.
Fósforo y mineralización ósea
El fósforo es el sexto elemento del organismo en cantidad. Un 85% está unido al calcio en la matriz del esqueleto en forma de cristales de hidroxiapatita. Un 14% forma parte de los tejidos blandos y un 1% está en el espacio extracelular. Las concentraciones plasmáticas de fósforo inorgánico se mantienen entre 4 y 7 mg/dl y no tienen el papel trascendental de las de calcio iónico. El balance de fósforo durante la infancia y adolescencia es netamente positivo, estimándose en unos 90-100 mg/día, para permitir que los depósitos óseos pasen de 17 g en el recién nacido a 700 g en el adulto. Aproximadamente, la cantidad de fósforo depositada en el esqueleto óseo representa la mitad de la de calcio. La presencia de fósforo en los alimentos es universal y una dieta variada cubre las necesidades diarias, sin que se hayan descrito situaciones clínicas carenciales.
Vitamina D y mineralización ósea
Los precursores de vitamina D (colecalciferol, ergocalciferol) no poseen por sí mismas, a dosis fisiológicas, actividad biológica. De forma similar, a las formas principales circulantes de la hormona 25(OH)D, no se les conoce una actividad específica. Estas últimas moléculas y los metabolitos precursores de vitamina D son consideradas las principales formas de almacenamiento y depósito de vitamina D en el organismo y precisan su conversión a calcitriol 1,25-(OH)2D para ejercer sus efectos biológicos sobre sus tres órganos diana tradicionales: el intestino, el hueso y el riñón. A nivel intestinal, el calcitriol incrementa la absorción de calcio y fósforo procedentes de la dieta, adaptando este proceso a las fluctuaciones de su aporte alimentario. Incrementa los niveles intracelulares de las proteínas transportadoras de calcio (calbindina) y la expresión de canales selectivos para la absorción del calcio en el enterocito. En el tejido óseo, el 1,25-(OH)2D es un agente esencial del desarrollo, crecimiento y mineralización del tejido óseo y regula la actividad de remodelado óseo. Sus mecanismos reguladores no son completamente conocidos, aunque diversos estudios de base experimental ponen de manifiesto que posiblemente el papel principal de la vitamina D en el tejido óseo sea el de proveer los minerales necesarios para promover la mineralización del tejido osteoide. En el riñón, el 1,25-(OH)2D, además de regular su propia síntesis, incrementa la eficiencia de la reabsorción de calcio y fósforo en el túbulo distal a través de la expresión y regulación de transportadores de calcio (calbindina D28k, calbindina D9k) y de canales epiteliales de calcio (TRPV5 y TRPV6). Un interés particular durante los últimos años ha sido dado al receptor de la vitamina D, en relación con la adquisición de la masa ósea, y en este sentido, diversos trabajos han asociado la presencia de ciertos polimorfismos de este receptor con la masa ósea(5,6).
Métodos para valorar la masa ósea y el metabolismo del hueso
Métodos no invasivos
Las técnicas no invasivas han contribuido a conocer los patrones normales del proceso de adquisición de la masa ósea durante la infancia y adolescencia y a detectar poblaciones pediátricas de riesgo. La densitometría fotónica simple, la densitometría fotónica dual, la densitometría radiológica de doble energía, la tomografía axial computerizada, la medición del espesor de las corticales de las falanges de los huesos de la mano y los ultrasonidos son las más utilizadas. En todas, menos en los ultrasonidos, existe un grado mayor o menor de radiación del paciente. De entre todas, la densitometría radiológica de doble energía (DEXA) es la más adecuada para la cuantificación de la masa ósea en Pediatría, por su alto índice de reproductibilidad (99%), su escaso error de precisión (1%), el limitado tiempo que se precisa para su realización (3-5 minutos) y su mínima dosis de radiación (0,02% de límite anual establecido para la población).
La masa ósea evaluada mediante densitometría dual de rayos X y expresada como DMO (gramos de hidroxiapatita/cm2), se puede evaluar en la región lumbar, femoral y en todo el esqueleto. Se incrementa progresivamente desde el nacimiento hasta la edad de 20-25 años, siendo los primeros años de la vida y el desarrollo puberal los períodos de máximo crecimiento en longitud del esqueleto y de máximo incremento en la DMO.
Los ultrasonidos son una técnica no invasiva y exenta de radiaciones, que también se ha utilizado para cuantificar la masa ósea. Las falanges de extremidades superiores y el calcáneo son las dos regiones anatómicas valoradas. Los datos disponibles hoy día indican que mientras los datos obtenidos en el calcáneo pueden ser representativos de la masa ósea, del riesgo de osteoporosis y de las fracturas osteoporóticas, los datos obtenidos en las falanges de las extremidades superiores están en curso de validación.
Marcadores bioquímicos
Los marcadores bioquímicos del metabolismo óseo son moléculas sintetizadas por los osteoblastos y osteoclastos o moléculas procedentes de la reabsorción de la matriz ósea. Pueden cuantificarse en plasma y en orina y se clasifican en dos grupos: marcadores de neoformación ósea y marcadores de resorción ósea.
Los marcadores de neoformación ósea son moléculas sintetizadas por los osteoblastos, siendo la osteocalcina y la fosfatasa alcalina (FA) los mejor caracterizados, los más utilizados en clínica y los que mejor relación tienen con los valores de densidad mineral ósea. Los marcadores de resorción ósea son moléculas sintetizadas por los osteoclastos (fosfatasa ácida tartratorresistente) o moléculas que proceden de la degradación de la matriz ósea en el curso de su resorción (hidroxiprolina, piridinolinas, péptidos derivados de la degradación de moléculas precursoras del colágeno: telopéptido carboxiterminal y telopéptido aminoterminal). La deoxipiridinolina cuantificada en orina y el telopéptido carboxiterminal del colágeno tipo I (ICTP) son los marcadores más específicos, más utilizados en clínica y los que mejor relación guardan con los valores de densidad mineral ósea.
Patrones de mineralización ósea normal en la infancia y adolescencia evaluados mediante DEXA
La DEXA ha contribuido a conocer los patrones normales de adquisición de la masa ósea durante la infancia y la adolescencia y a detectar poblaciones pediátricas de riesgo. Nosotros hemos estudiado la evolución de la masa ósea durante la infancia y la adolescencia a nivel de la columna lumbar (L2-L4) en un estudio transversal realizado en 256 niños y 215 niñas de edades comprendidas entre los tres meses y los 21 años y hemos establecido el patrón de adquisición de masa ósea en nuestra población (Figs. 4 y 5). Mediante esta técnica, se cuantifica la cantidad total de mineral (CMO) depositado en tres cuerpos vertebrales (L2-L4) y se divide por el área proyectada de los tres cuerpos vertebrales. Los resultados se expresan como gramos de hidroxiapatita/cm2y representa la densidad mineral ósea (DMO).

Figura 4. Valores de densidad mineral ósea (gramos de hidroxiapatita/cm2) y (gramos de hidroxiapatita/cm3) a nivel de columna vertebral (L2-L4) en nuestra población en función de la edad y sexo.

Figura 5. Evolución de la densidad mineral ósea (gramos de hidroxiapatita/cm2) en la infancia y adolescencia (media ± 1 DE).
La masa ósea se incrementa progresivamente desde el nacimiento hasta la edad de 20-25 años, con ritmos diferentes según el período considerado. Desde el nacimiento hasta la edad de 3 años, el incremento representa aproximadamente un 30% del incremento total, desde los 3 años hasta el inicio del desarrollo puberal se incrementa un 20%, durante el desarrollo puberal se incrementa otro 30-40% y desde la finalización del crecimiento hasta la edad de 21 años se incrementa otro 15-20%. Estos datos indican que los primeros años de la vida y el desarrollo puberal son los períodos de máximo crecimiento en longitud del esqueleto y de máximo incremento en la DMO, que la mineralización del esqueleto se prolonga más allá de la finalización del crecimiento en longitud y se continúa durante la adolescencia tardía hasta los 25 años de edad, y que en estas épocas de la vida son las de mayor riesgo para no alcanzar una masa ósea adecuada, si en ellas inciden procesos patológicos que condicionen un menor ritmo de ganancia y/o pérdida de masa ósea(7-9)(Fig. 6).

Figura 6. Incrementos anuales de densidad mineral ósea (gramos de hidroxiapatita/cm2) en la infancia y adolescencia. Los tres primeros años de la vida y la adolescencia son las etapas de mayor depósito de sales minerales en el esqueleto en desarrollo.
Poblaciones pediátricas con riesgo de masa ósea disminuida
Cuatro grandes grupos de enfermedades pueden interferir con el proceso de adquisición de masa ósea en la infancia y adolescencia: enfermedades estructurales (osteogénesis imperfecta), nefropatías, trastornos nutricionales (síndromes de malabsorción intestinal, situaciones de malnutrición crónica y situaciones de carencia de vitamina D o anomalías en su mecanismo de acción) y endocrinopatías, siendo, con mucho, estos dos últimos los más frecuentes (Tabla I).
El pediatra de asistencia primaria tiene una gran responsabilidad en la identificación de estas poblaciones pediátricas con riesgo de adquisición de una masa ósea disminuida y también en la adopción de todas aquellas medidas tanto preventivas como terapéuticas dirigidas a promover una salud ósea óptima durante la infancia y adolescencia y que eviten la aparición de la osteoporosis en edades tempranas de la vida(10).
Bibliografía
1. Carrascosa A, Gussinyé M, Yeste D, Del Rio L, Audi L. Bone mass acquisition during infancy, childhood and adolescence. Acta Paediatr 1995; suppl. 411: 18-23.
2. Davies JH, Evans BA, Gregory JW. Bone mass acquisition in healthy children. Arch Dis Child. 2005; 90: 373-78.
3. Carrascosa A, Gussinyé M, Yeste D. En Tratado de endocrinología de la infancia y de la adolescencia. 2ª Edición. Argente J, Carrascosa A, Gracia R, Rodríguez F editores. Capítulo 54. “Masa ósea, osteopenia y osteoporosis”, págs. 1353-82. Ediciones Doyma S.L. Barcelona. 2000.
4. Van Kuijk C. Pediatric bone densitometry. Radiol Clin North Am. 2010; 48: 623-27.
5. Yeste D, Carrascosa A. Osteopenia/osteoporosis de origen nutricional. Rev Esp Ped. 2003; 59: 99-105.
6. Carrascosa A, Ballabriga A. Masa ósea y nutrición. En: Nutrición en la Infancia y Adolescencia; Ballabriga A, Carrascosa A (editores). Ergón, Madrid 2006, págs. 919-49.
7. Del Río L, Carrascosa A, Pons F, Gussinyé M, Yeste D, Domenec FM. Bone mineral density of the lumbar spine in caucasian mediterranean spanish children and adolescents. Changes related to age, sex and puberty. Pediatr Res. 1994; 35: 362-66.
8. Yeste D, Del Río L, Carrascosa A. En Tratado de endocrinología de la infancia y de la adolescencia. 2ª Edición. Argente J, Carrascosa A, Gracia R, Rodriguez F, editores. Capítulo 58. “Valores de contenido mineral óseo, densidad mineral ósea (DMO) y densidad mineral ósea volumétrica en niños y adolescentes en la columna lumbar y en el fémur”, págs. 1501-13. Ediciones Doyma S.L. Barcelona. 2000.
9. Shaw NJ. Osteoporosis in paediatrics. Arch Dis Child Educ Pract Ed. 2007; 92: 169-75.
10. Sopher AB, Fennoy I, Oberfield SE. An update on childhood bone health: mineral accrual, assessment and treatment. Curr Opin Endocrinol Diabetes Obes. 2015; 22: 35-40.

