|
| Temas de FC |
A. Hernández Hdez. *, C. Coronel Rodríguez**, M. Monge Zamorano***, C. Quintana Herrera****
*Pediatra del Centro de Salud de Tacoronte y Adjunto de guardias del Hospital Universitario de Canarias, Tenerife. **Centro de Salud Amante Laffón (Sevilla) y Vocal Nacional de la SEPEAP. *** Pediatra del Centro de Salud de Tacoronte y Colaboradora del Servicio de Nefrología del Hospital Universitario de Nuestra Señora de la Candelaria, Tenerife. **** Pediatra del Centro de Salud de Tacoronte, Tenerife
| Resumen
La microbiota constituye un complejo ecosistema que establece una relación mutualista con el hospedador. Está compuesta por más de 1.000 especies bacterianas diferentes, con un número de células aproximado de 1014 UFC (100 billones), sobrepasando a las células del cuerpo humano en una proporción de 10 a 1, o sea, el 90% de nuestras células en número, no en masa, son microbios. Cubren una superficie intestinal aproximada de 300 m2, pueden llegar a pesar entre 600-1.500 g, similar al peso de nuestro corazón o cerebro, formando un microbioma con más de 600.000 genes, esto es, 20 veces superior a los genes del hospedador humano, que están en torno a los 25.000-30.000. |
| Abstract
The microbiota is a complex ecosystem which establishes a mutualistic relationship with the host. It is composed of over 1000 different bacterial species, with an approximate number of cells 1014 UFC (100 billion), surpassing the human body cells at a ratio of 10-1, i.e, 90% of our cells in number, no in mass, are microbes. They cover an intestinal surface of 300 m2, can weigh between 600-1500 gm similar to the weight of our heart or brain, forming the microbiome with over 600.000 genes, that is, 20 times higher than the genes of the human host, which are around the 25,000-30,000. |
Palabras clave: Microbiota; Metagenoma; Prebióticos; Probióticos y simbióticos
Key words: Microbiota; Metagenome; Prebiotics; Probiotics and symbiotics
Pediatr Integral 2015; XIX (5): 337-354
Microbiota, Probióticos, Prebióticos y Simbióticos
Flora gastrointestinal
Adquisición, colonización y adaptación de la flora intestinal
Se adquiere desde el momento del nacimiento, en el canal del parto, pero principalmente por la lactancia materna; es estable desde los 2-3 años y susceptible de modificarse mediante cambios dietéticos mantenidos en el tiempo.
Desde el origen del hombre, hace más de 200.000 años, este ha convivido permanentemente en íntima asociación con las comunidades microbianas. Este ecosistema incluye a numerosos microrganismos necesarios para el mantenimiento de la homeostasis intestinal. La mayoría promueve efectos beneficiosos para la salud, pero también contiene otros considerados como potencialmente patógenos por su capacidad de invadir al hospedador.
El recién nacido presenta el intestino estéril y comienza a colonizarse en el parto. Clásicamente, se ha considerado que la principal fuente natural de bacterias era la microflora intestinal y vaginal de la madre durante el tránsito por el canal del parto. Según dicha hipótesis, la composición inicial de la microbiota intestinal estaría determinada fundamentalmente por el tipo de nacimiento (vaginal o mediante cesárea), por la alimentación del recién nacido e incluso por el contacto íntimo que se establece entre la madre y el niño. Estudios recientes demuestran que la microflora vaginal de la madre no se relaciona estrechamente con la microflora fecal del recién nacido y la leche materna se ha mostrado como el principal factor en la iniciación, desarrollo y composición de la microflora del niño, ya que es una fuente continua de bacterias comensales y mutualistas para el intestino del lactante, llegando a contener más de 104 UFC/ml, entre los que se encuentran: estreptococos, enterococos, estafilococos y bacterias lácticas (lactobacillus: L. acidophilus, L. casei, L. fermentum, L. gasseri, L. johnsonii, L. paracasei, L. plantarum, L. reuteri, L. rhamnosus, L. salivarius, etc.). La aplicación de técnicas moleculares a la investigación, como las basadas en el estudio del gen 16S rRNA y su ampliación mediante la reacción en cadena de polimerasa (PCR), han permitido demostrar que, únicamente, una cuarta parte de los neonatos adquieren lactobacillus maternos vaginales en el momento del nacimiento, y que incluso en tales casos, esos lactobacillus no llegan a colonizar de forma permanente el intestino del lactante, ya que son reemplazados rápidamente por otros lactobacillus asociados a la leche materna(2).
Por otra parte, se ha demostrado la presencia de bacterias en muestras de líquido amniótico y en sangre del cordón umbilical, procedentes del intestino materno en neonatos sanos, nacidos tanto por parto vaginal como por cesárea. Estos hallazgos sugieren que existe un flujo de ciertas bacterias desde el intestino de la mujer sana al intestino del feto vía transplacentaria y entero-mamaria, en los que las células dendríticas tienen un papel importante(3).
Después del nacimiento, diversos géneros de bacterias aerobias o anaerobias facultativas, como enterobacterias, E. coli, estreptococos y estafilococos, consumen el oxígeno del ambiente intestinal y progresivamente se establecen las bacterias anaerobias, como: bacteroides, clostridium, ruminococcus, bifidobacterium, a partir de los 10 días, son detectables los lactobacillus. En pocos días, el número de bacterias alcanzan de 108 a 1010 UFC/g de heces. En determinadas circunstancias, como en los partos por cesárea, la colonización tiene lugar a partir del medio ambiente, quirófano, material médico, contacto con la madre, etc., retrasándose la adquisición de la flora intestinal permanente.
El conocimiento de la composición de la flora intestinal del recién nacido pretérmino es muy escaso. Su principal característica es el bajo número de especies bacterianas, fundamentalmente son enterobacterias, y el establecimiento de flora anaerobia es más tardío. A diferencia de lo que ocurre en el recién nacido a término, en el pretérmino, la forma de parto influye poco en el tipo de colonización.
El tipo de alimentación determina, en gran parte, el establecimiento de la flora microbiana. En los niños amamantados, predominan las bifidobacterias (longum, breve e infanctis), suponen el 90%, y en menor concentración lactobacillus (acidophilus, gasseri, johnsonii), con pocos bacteroides, coliformes y clostridios; mientras que, en los lactantes alimentados con leche adaptada, predominan los bacteroides, enterococos, coliformes y clostridios, y en menor proporción bifidobacterias, con una flora más diversa y similar a la de los adultos.
La lactancia materna constituye un factor clave en el desarrollo de la microbiota intestinal del recién nacido, ya que la leche materna proporciona un aporte continuo de bacterias durante la lactancia. Es posible que se trate de la principal fuente de bacterias para el recién nacido, dado que el lactante ingiere unos 800 ml de leche/día, por lo que recibe entre 105-107 bacterias/diarias. Por otra parte, aporta moléculas de anticuerpos específicas y moléculas de la inmunidad inmediata, que de alguna forma neutralizan parte de estas bacterias. Además, el elevado contenido de oligosacáridos, más de 200, con predominio de los galactooligosacáridos (GOS), en concentraciones de 15-23 g/l en el calostro o de 12-14 g/l en la leche materna, favorece la selección y el crecimiento de una flora bifógena en el colón del niño. El rol de estas bacterias es fundamental en la inducción de la inmunidad adaptativa. Con el inicio del destete y la introducción de la alimentación complementaria, la ingesta de leche materna se va reduciendo hasta su completa sustitución. Ello produce cambios en la composición de la microbiota intestinal del niño, desapareciendo las diferencias entre la de los niños amamantados y los alimentados con fórmula, al incorporarse a la alimentación del adulto entre los 10-18 meses, donde predominan más bifidobacterias spp que bacteroides spp, altos niveles de enterobacterias y enterococos y bajos de lactobacillus spp. Se considera que las bacterias dominantes en la flora de los niños de 2 años son similares a la del adulto(4). Esta es más o menos estable para cada individuo, dado que el sistema inmune reconoce y tolera a las especies bacterianas adquiridas en la primera etapa de la infancia.
La flora bacteriana, aunque es relativamente estable, puede variar de un individuo a otro, o incluso en el mismo individuo por diferentes circunstancias: tipo de dieta, estrés, infecciones, ingestión de antibióticos, que pueden producir cambios transitorios. El propio envejecimiento origina una inmunosenescencia, con agotamiento de células T y cambios en la flora intestinal, consistente en un incremento de anaerobios facultativos, a la vez que disminuyen las bacterias beneficiosas como lactobacillus y bifidobacterias.
Poblaciones de diferentes países presentan diferente composición de la microflora intestinal en función de la dieta ingerida. La microbiota de las poblaciones occidentales, que ingieren más cantidad de grasa y proteínas de origen animal y un bajo contenido de fibra, parece contener mayores niveles de bacteroides y clostridium (filo firmicutes), y menor de bacterias lácticas que la microbiota de las poblaciones orientales. La alimentación propia de las poblaciones rurales africanas (niños de Boupan en Burkina Faso) u otras de Malwii o amerindios, con dietas ricas en polisacáridos y proteínas vegetales no digeribles, favorece que predomine el género de bacterias prevotella(filo bacteroidetes), con una alta representación de genes que codifican la a-amilasa. Esto hace pensar que determinadas dietas, seguidas a largo plazo, permitan también modular los enterotipos intestinales que pudiesen mejorar la salud(5).
Composición de la flora intestinal
Los estudios mediante técnicas moleculares de secuenciación genética han hecho posible desentrañar la composición de la microbiota y su microbioma, identificando tres enterotipos predominantes: Bacteroides, Prevotella y Ruminococcus, aunque hay otros comensales menos numerosos, pero de importante trascendencia.
La composición de la microbiota intestinal era poco conocida, dado que los métodos tradicionales de cultivos in vitrode muestras biológicas de heces son de poca utilidad. Se calcula, que el 80% de las especies no pueden cultivarse, debido a que la gran mayoría son anaerobias estrictas y requieren condiciones físicas y nutricionales concretas. Dichas técnicas no aportaban información sobre la diversidad bacteriana y los recuentos podían dar resultados falsos, si las bacterias tienden a unirse y formar agregados. Otros métodos estudian alguna de las actividades enzimáticas de origen bacteriano, pero estas no son específicas de los microorganismos de un determinado grupo y, además, existe una gran variabilidad metabólica entre especies e incluso entre distintas cepas de una misma especie. Sin embargo, este era, hasta hace poco tiempo, el único método disponible para intentar desentrañar las características de la compleja población microbiológica que constituye el microbioma.
Los datos obtenidos con los análisis de ADN bacteriano (metodología molecular basada en la secuenciación del gen 16S rRNA y rDNA) han ampliado de forma notable el conocimiento, aportando datos sobre la composición de las comunidades de bacterias del intestino humano, contribuyendo también a revelar sus propiedades funcionales.
Existen dos proyectos a escala mundial que están marcando la dirección en esta nueva vía de conocimiento: el Metagenomics of the Human Intestinal Tract (MetaHIT) en Europa y el Human Microbiome Project (HMP) en Estados Unidos. Estos proyectos nos permiten definir el microbioma, como: la totalidad de bacterias, su información genética y las formas en que interactúan entre ellas mismas y con el hospedador humano. Descubren que solo un pequeño número de especies son compartidas por todas las personas, clasificando a los individuos según tres enterotipos, identificados por la variación en la cantidad de cada uno de los tres géneros predominantes a nivel colónico: enterotipo 1 Bacteroides; enterotipo 2 Prevotella; enterotipo 3 Ruminococcus(6) (Tabla I).
Las bacterias constituyen la mayor parte de la flora en el colon y hasta el 60% de la masa seca de las heces. La microflora está formada por más de un millar de especies, pero es probable que el 99% de las bacterias provengan de unas 30 o 40 especies, los hongos, protozoos y arqueas, también forman parte de la flora intestinal, pero es poco conocida su actividad. En su inmensa mayoría, son anaerobias, aunque en el ciego coexisten con otras bacterias aerobias. Solo una pequeña proporción de los filos de bacterias detectados en la biosfera, 9 de los 70 conocidos, han evolucionado en asociación con el intestino humano y uno de arqueas de entre los 13 descubiertos. Los cuatro filos dominantes en el intestino humano por orden numérico son: Firmicutes, Bacteroidetes, Actinobacteria y Proteobacteria. La mayoría de las bacterias pertenecen a los géneros Bacteroides, Clostridium, Fusobacterium, Eubacterium, Ruminococcus, Peptococcus, Peptostreptococcus y Bifidobacterium. Otros géneros, tales como Escherichia y Lactobacillus, están presentes en menor medida. La especie de los géneros Bacteroides constituye aproximadamente el 30% de todas las bacterias del intestino, lo que sugiere que este género es especialmente importante en el funcionamiento del huésped. Los géneros actualmente conocidos de hongos de la flora intestinal incluyen: Cándidas, Saccharomyces, Aspergillus y Penicillium. Las arqueas constituyen otra gran clase de la flora intestinal, que es importante en el metabolismo fermentativo y producen metano.
Cabe destacar que hay microorganismos que, pese a pertenecer a los filos menos abundantes en el tracto gastrointestinal humano, pueden tener una gran influencia en el mantenimiento de la salud y en el desarrollo de la enfermedad. Por ejemplo: las proteobacterias, entre las que se encuentran patógenos implicados como agentes etiológicos en el desarrollo de la colitis ulcerosa; la E. coli como etiología de muchas sepsis; Bacteroides, como causa de abscesos; los enterococos, que pueden originar endocarditis bacteriana; y los clostridium histolyticum, causantes de la gangrena gaseosa. Otro ejemplo, en este caso de microorganismos considerados probióticos, son las bifidobacterias, un género de bacterias Gram positivas anaerobias estrictas, pertenecientes a los Actinomycetes, que constituyen tan solo del 3 al 5% de la microbiota presente en el colon. Los lactobacilos, un género de microorganismos anaerobios facultativos pertenecientes al filo Firmicutes, con una amplia presencia en productos alimentarios fermentados, considerados probióticos, que presentan unos niveles bajos en el colon o en heces, pero que, sin embargo, son predominantes en el estómago y especialmente en el intestino delgado, pudiendo constituir hasta el 50% de la microbiota del íleon adulto(7).
Distribución espacial de la flora intestinal
Podemos considerar que, a partir del esófago, prácticamente aséptico, la microflora presenta un gradiente creciente en cantidad y variedad, siendo escasa en el estómago, para irse incrementando a partir del intestino delgado y máxima en el colon, donde desempeñan sus principales funciones.
La distribución de la microflora no es homogénea a lo largo del tubo digestivo, sino que la colonización y persistencia de determinadas poblaciones bacterianas en diferentes tramos del intestino, va a depender de un equilibrio entre los mecanismos defensivos de este (la saliva con la lisozima, ácido gástrico, secreción de inmunoglobulinas (IgA), sales biliares, secreciones proteolíticas pancreáticas, el propio moco intestinal que actúa a modo de barrera mucosa, la tolerancia inmunológica del huésped, etc.) y la capacidad de estas bacterias de sobrevivir a dichas condiciones extremas, de tal forma que el control del crecimiento bacteriano nunca es absoluto, estableciéndose diferentes nichos a lo largo del mismo. El número y el tipo de bacterias son variables a lo largo del intestino, no existiendo prácticamente en el esófago y son máximas en el colon.
En la boca, encontramos multitud de bacterias, protozoos y levaduras, con discutible papel mutualista de muchos de ellos. Algunos causan caries y otros problemas dentales, debido a que producen ácido que ataca el esmalte dental.
El esófago no presenta colonización permanente, se trata de una cavidad virtual por la que la comida se abre paso a su través y arrastra a los posibles microorganismos que pudieran establecerse en él.
En el estómago de personas no infectadas por el H. Pylori, encontramos una alta diversidad de microflora: estreptococos, actinomicetos (bifidobacterias), prevotella, gemella, que también predominan en la orofaringe, por lo general, en tránsito y no colonizadores. En los individuos colonizados por H. Pylori, esta bacteria constituye el 90% de la microbiota gástrica y el resto queda muy reducido a algunos lactobacillus. El estómago y duodeno albergan un número reducido de microorganismos que se adhieren a la superficie mucosa o están de paso, separados por una capa de moco en concentraciones de 103-104 UFC/ml. La mucosa gástrica favorece la digestión mediante la secreción de ácido clorhídrico y enzimas digestivas. El ácido clorhídrico estomacal hace que el pH alcance niveles muy bajos, cercanos a uno. Muy pocos microorganismos sobreviven a estas duras condiciones, por lo que constituye una de las defensas más eficaces frente a patógenos potenciales.
El número de bacterias aumenta a medida que nos acercamos al colon, desde 104 UFC/ml en el yeyuno a 107/ml en el extremo del íleon, donde se encuentran algunos aerobios obligados y un predominio de anaerobios Gram negativos, frente a Gram positivos como los lactobacillus (filo firmicutes, género ruminococcus), pudiendo constituir hasta el 50% de la microbiota del íleon. La elevada motilidad del intestino delgado, con un tiempo de tránsito de 4 a 6 horas, dificulta la adhesión y el crecimiento microbiano. Además, se vierten al mismo, las sales biliares y las enzimas digestivas, y los microorganismos han de competir por los azúcares fácilmente absorbibles con el hospedador. La presencia del gen de la hidrolasa de las sales biliares es considerada un marcador de adaptación microbiano al tracto gastrointestinal, al suponérsele un papel en la tolerancia ácida y a la bilis(8).
En el colon, el tránsito es lento, el tiempo de residencia de más de 50 horas permite una intensa interacción lumen-mucosa. El epitelio tiene una superficie plana con invaginaciones que forman criptas. El pH es más ácido (5,5-5,9) en el ciego y colon proximal y más neutro (6,5-5,9) en las porciones más distales, frente al pH ácido del estómago y porciones iniciales del intestino delgado. Los microorganismos disponen de nutrientes: carbohidratos complejos de la dieta que no han podido digerirse, fibra, restos desprendidos de la mucosidad intestinal, células muertas procedentes de la renovación del epitelio y compuestos obtenidos a partir de las actividades metabólicas de otros miembros de la microbiota, lo que facilita la posibilidad de proliferar degradando dichos sustratos, a pesar de una osmolaridad relativa elevada y un nivel de oxígeno variable en la mucosa, aun siendo el lumen principalmente anóxico. Además de una enorme densidad de bacterias en el colon, 1011-1014UFC/g, hay una gran variedad, más de 1.000 especies, predominando mayoritariamente los anaerobios estrictos (90%), como: firmicutes, Fc. ecolibacterium, eubacterium rectale, rosebacteria spp y bacteroides, y el 10% restante está formado por los actinobacterius (bifidobacterium) y las proteobacterias (eschericias). En su conjunto, dan lugar a un ecosistema extraordinariamente maduro y resistente a la inducción de cambios desde el exterior, lo que se denomina homeostasis intestinal o “equilibrio de Nash”. Sin embargo, las variaciones significativas, como exposición a antibióticos, infecciones entéricas o cambios dietéticos prolongados en el tiempo, pueden conducir a un desequilibrio, que se traduzca en un nuevo estado de equilibrio, con una composición distinta a la original. Esto es lo que se pretende conseguir, en su caso, con la ingesta de prebióticos o probióticos, o con trasplantes fecales(9).
Funciones de la microbiota intestinal
Función metabólica, de barrera intestinal y de modulación inmunológica.
Cada día se descubren nuevas funciones de la microbiota intestinal y su influencia en la fisiología del hospedador. Una de las más conocidas es la metabólica, pero otras funciones no menos importantes son: la de formar parte de la barrera intestinal, evitando la anidación y penetración de patógenos, y la de modular el sistema inmuntario(10). También, interviene en la angiogénesis intestinal, incluso en la interacción entre el sistema nervioso central y el entérico.
La importancia de la microbiota para el hospedador se ha evidenciado al comprobarse que animales con intestinos estériles, libres de bacterias, pueden sobrevivir, pero necesitan unos mayores requerimientos energéticos, hasta el 30% más de calorías, y mayor variedad de nutrientes. Suelen tener menor peso corporal y de órganos vitales (cerebro, corazón, pulmones, hígado, riñones) que los controles criados en condiciones normales. Además, presentan una pared intestinal atrófica, con alteraciones de la motilidad intestinal, bajo gasto cardiaco, baja temperatura corporal y metabolismo reducido, con cifras elevadas de colesterol en sangre. Ello indica, que la presencia de bacterias es fundamental para el adecuado aprovechamiento nutricional. Por otra parte, estos animales sin microbiota, presentan un sistema inmunitario con bajos niveles de inmunoglobulinas plasmáticas, ganglios atróficos y menor nivel de linfocitos en la mucosa intestinal, con una mayor susceptibilidad a sufrir infecciones; prueba de que, para un adecuado desarrollo del sistema inmunitario es necesario la presencia de microflora actuando sobres estructuras inmunocompetentes(11).
Antes de comentar cada una de estas funciones, metabólica, de barrera, e inmunorreguladora, recordamos las estructuras anatomo-histológicas implicadas y la disposición de la microflora.
Recuerdo anatomo-histológico de la barrera intestinal y la disposición de la microflora intestinal
La microflora intestinal flota, en su mayor parte, en las heces, y una porción de la misma se adhiere al moco que recubre el epitelio intestinal. Este está formado por enterocitos y células califormes en las vellosidades, y por células madre, células de Paneth y células M en la base de las mismas y en las criptas. Este epitelio descansa, por su membrana basal, sobre la lámina propia, infiltrada por células dendríticas y por GALT (tejido linfoide asociado a la mucosa intestinal).
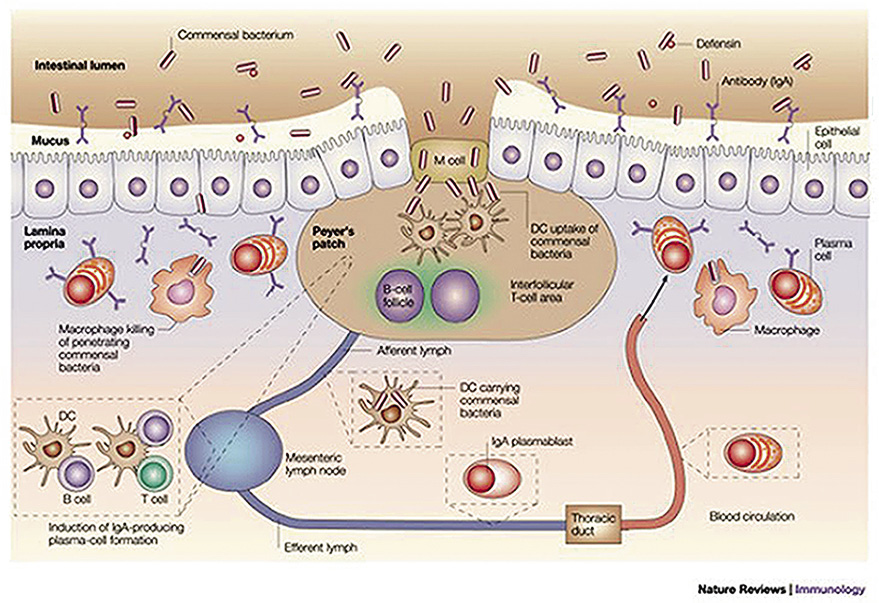
La microbiota, en su mayoría, está en la luz intestinal y ha de interactuar con la mucosa intestinal, que está formada básicamente por epitelio, con su membrana basal y lámina propia, rodeado a su vez por una capa de mucus, donde quedan atrapadas la mayoría de las bacterias intestinales, constituyendo una compleja estructura fisicoquímica que actúa a modo de barrera intestinal (Fig. 1).
Figura 1. Esquema tridimensional del corte intestinal con las diferentes células.
El epitelio intestinal está formado por diversos tipos celulares especializados. El epitelio del intestino delgado forma vellosidades que alternan con criptas, mientras que el epitelio del intestino grueso es plano con invaginaciones o criptas. El epitelio está en renovación constante durante toda la vida a partir de células madre localizadas en las criptas a media altura. Las células absortivas o enterocitos y las caliciformes (secretoras de mucus) migran hacia la parte superior de las vellosidades, mientras que las enteroendocrinas (que participan en la regulación de la función intestinal), las células de Paneth (que secretan sustancias antimicrobianas y hormonas) y las células M (células epiteliales modificadas que participan en la presentación de antígenos) están localizadas en la base de las vellosidades y sobre folículos linfoides asociados a las placas de Peyer.
La barrera está constituida por el epitelio de enterocitos, fuertemente cohesionados por los las uniones estrechas (tight junctions), uniones adherentes y los desmosomas, así como con mecanismos de contracción del citoesqueleto de actomiosina. El epitelio descansa sobre la membrana basal, que lo separa de la lámina propia. Esta se localiza bajo la membrana basal y está constituida por tejido conectivo laxo que contiene capilares y presenta una gran concentración de células del sistema inmunitario e inmunoglobulinas.
El GALT o tejido linfoide asociado a mucosas del tracto gastrointestinal (Gut Associated Lymphoid Tissue) se localiza a este nivel; es, sin duda, el mayor órgano del sistema inmune del cuerpo, al contener la mayor fuente de células inmunocompetentes del mismo. Contiene más de 106 linfocitos por gramo de tejido y aproximadamente el 60% del total de inmunoglobulinas producidas diariamente (40-60 mg/kg/día), que son secretadas al tracto gastrointestinal. En el GALT pueden distinguirse dos componentes:
• El GALT organizado, constituido por folículos linfoides aislados, folículos linfoides asociados o placas de Peyer y ganglios linfáticos mesentéricos.
• El GALT difuso, integrado por poblaciones de linfocitos dispersos a lo largo del epitelio, linfocitos intraepiteliales y de la lámina propia del intestino.
En la lámina propia, hay un enorme número de células B, la mayoría se acaban diferenciando en células plasmáticas secretoras de IgA. Las células dendríticas son células mieloides derivadas de los monocitos, de carácter fagocítico, consideradas fagocitos profesionales, que se extienden por todo el organismo cerca de las superficies en contacto con el medio externo y también en estado inmaduro en la sangre. En el intestino, se localizan en la lámina propia y proyectan prolongaciones, como si de periscopios se tratara, entre los enterocitos para sondear antígenos y bacterias del lumen (Fig. 1 y 2).
Figura 2. Recuerdo anatómico funcional de la microbiota-mucus-epitelio-GALT.Nature Reviews/Immunology.
La luz del tubo está en contacto con una capa de mucus constituida por glicolípidos y glicoproteínas grandes y altamente glicosiladas, llamadas mucinas. En los humanos, existen 18 tipos de mucinas, siendo MUC2 la predominante, tanto en el intestino delgado como en el grueso. El mucus actúa como una separación física entre el lumen y el epitelio, y sirve de marco para el desarrollo de interacciones bacteria-bacteria y bacteria-hospedador, además de ser un lubricante para la motilidad intestinal. El mucus es también un importante mecanismo de defensa al proteger a la mucosa de daños y facilitar la reparación de lesiones. El grosor y la viscosidad del mucus aumentan a medida que nos desplazamos de las zonas proximales a las distales del tracto intestinal. Comprende dos subcapas, una en contacto con la luz, más gruesa e hidrosoluble, menos viscosa y fluida, que puede ser alcanzada por bacterias cocoides, como bacteroides y clostridium, que no pueden penetrar en la otra capa de mayor viscosidad, al reabsorberse su contenido acuoso, en forma de gel insoluble, fuertemente adherida a los carbohidratos de superficie de las células epiteliales, de grosor menor y más constante, libre de microorganismos en los individuos sanos. Como se verá más adelante, los microorganismos considerados probióticos (algunos bifidobacterium y lactobacilos) podrían actuar a nivel de esta capa de mucus promoviendo la secreción de este, como mecanismo de mejora de la función barrera y exclusión de patógenos(12).
La mayoría de la flora comensal vive en el interior de las heces, siendo sus concentraciones máximas en la superficie cerca del moco, otras, como las Enterobacteriaceae y Verucomicriaceae, estarían en la frontera entre las heces y el moco; por último, el grupo de los Bifidobacteriaceae se localizarían por fuera de este moco, o lo que es lo mismo, más próximas a la superficie epitelial(9).
La función metabólica
La flora comensal degrada los restos carbonados y proteicos no digeridos en el intestino delgado, dando lugar a ácidos grasos de cadena corta y a otros que modifican el pH intestinal, favoreciendo la absorción de oligoelementos. Además, contribuye a regular el metabolismo del colesterol y constituye un aporte de energía extra para el organismo, al tiempo que sintetiza vitaminas y metaboliza sustancias tóxicas.
El resto de nutrientes no digeridos en el intestino delgado, en su mayoría carbohidratos de origen vegetal (almidón, celulosa, hemicelulosa, inulina, oligosacáridos que escapan a la digestión, azúcares y alcoholes no absorbidos), cuando alcanzan el colon proximal, constituyen el sustrato para la proliferación microbiana y su fermentación, gracias a las diferentes capacidades enzimáticas de estos microorganismos (diversas glucosidasas), dando lugar a la formación de ácidos grasos de cadena corta (AGCC): ácido acético, propiónico y butírico, que juegan un importante papel fisiológico como veremos. Otras sustancias producidas son etanol y ácido láctico. Todos ellos contribuyen a acidificar el colon proximal y el ciego (pH 5,5-5,9), favorecen la absorción de otros oliogoelementos, como el hierro, calcio y magnesio, y mejoran la biodisponibilidad del zinc, cobre y fósforo. También, se generan gases, como el dióxido de carbono, metano e hidrógeno, que pueden ser expulsados en el aire espirado y, en su mayoría, por las heces, al igual que, al menos, el 10% de los AGCC originados por las bacterias.
El butirato es utilizado como fuente de energía por el colonocito, también contribuye a su trofismo, regulando su diferenciación celular y disminuyendo el riesgo de cáncer de colon induciendo la apoptosis tumoral. El acetato y el propionato llegan sin modificarse al hígado. El acetato se utiliza para la síntesis de colesterol y la lipogénesis en el hígado. El propionato actúa como inhibidor competitivo del transporte del acetato hacia el interior de los hepatocitos. Esto explica que animales de experimentación alimentados con determinados hidratos de carbono, reduzcan los niveles de colesterol sérico y hepático. El acetato y el propionato también intervienen en el metabolismo hepático de la glucosa, reduciendo la glucosa postprandial y la respuesta insulínica.
En el colon izquierdo, donde el pH es más neutro (6,5-6,9), con crecimientos bacterianos más lentos, predomina una actividad proteolítica. Aquí, los restos proteicos no digeridos llegan en cantidades de 5-20 g/día, junto con las proteínas procedentes del moco, de bacterias lisadas o de enterocitos muertos, que se degradan originando AGCC y ácidos grasos de cadena ramificada, como el isobutirato, metilbutirato o isovalerato. Además, estas bacterias que degradan los restos proteicos pueden originar metabolitos potencialmente perjudiciales para la salud como determinadas aminas heterocíclicas, indoles y fenoles(13).
Por otra parte, la microflora del colon tiene un protagonismo importante en la producción de vitaminas, como la biotina, riboflavina, ácido pantoténico, piridoxina, cianocobalamina y vitamina K. En este proceso, participan bacterias Gram positivas y Gram negativas.
Función de barrera defensiva frente a patógenos
La desarrolla la flora comensal compitiendo por los nutrientes, mejorando el propio trofismo del epitelio intestinal, reforzando uniones estrechas, estimulando producción de moco y de antibacterianos, y por exclusión competitiva gracias a complejos mecanismos de adherencia preferencial de comensales sobre patógenos.
La microbiota ejerce un potente efecto defensivo frente a la colonización de patógenos y oportunistas, reforzando la función de barrera intestinal constituida por los enterocitos y el propio mucus que los rodea, mediante varios mecanismos (Fig. 3). El más elemental es la competencia por los nutrientes; de ahí, que haya diferentes nichos ecológicos en las diferentes partes del intestino según las necesidades nutricionales. Esto constituye la base para el uso de prebióticos que favorezcan el desarrollo selectivo de flora probiótica beneficiosa frente a patógenos. Otros mecanismos más complejos e inespecíficos son:
Figura 3. Funciones comunes de la flora comensal y probióticos.
• La producción de sustancias antimicrobianas (ácidos orgánicos, peróxido de hidrógeno, etanol, ácido láctico) o bien la excreción de sustancias antibióticas naturales (bacteriocinas, toxinas antimicrobianas de tipo proteico producidas tanto por los Gram negativos, colicinas y microcinas, como por los Gram positivos, antibióticos como la nisina).
• Estimular la secreción del mucus por las células califormes, lo que inhibe la unión de enteropatógenos al epitelio intestinal. También, se ha visto que la microbiota y algunos probióticos (B. bifidum) producen glicosidasas que degradan los carbohidratos asociados a las mucinas intestinales y, por lo tanto, pueden destruir los receptores de mucus donde se iban a fijar patógenos.
• Incrementar la secreción por parte del enterocito de péptidos antimicrobianos como las beta-defensinas.
• Favorecer la estabilidad de las uniones estrechas, disminuyendo la permeabilidad epitelial a patógenos y sus productos a través de los receptores TLR2 (Toll-Like receptors) de los enterocitos, al ser estimulados por ciertas bacterias comensales, aumentan la expresión de los complejos laterales de unión (ocludina, las caudinas y zónula ocludens-1), como se ha comprobado en modelos murinos de colitis inducida.
• Promover la homeostasis intestinal de renovación y proliferación de enterocitos a través de rutas de señalización específicas, proteínas bacterianas que son capaces de estimular la fosforilación del EGF (Epidermal Growth Factors), promoviendo la supervivencia celular al inactivar vías proapoptóticas y estimular la proliferación celular(14).
• Lo que se ha llamado “la exclusión competitiva”, quizás uno de los principales mecanismos, que hace referencia a la capacidad de la flora comensal de adherirse a los mismos sitios de unión que los patógenos en el mucus y en el epitelio intestinal, bien impidiendo su unión o bien desplazándolos del mismo. Los mecanismos de adherencia de las bacterias al epitelio y al moco intestinal son propios de cada cepa y un rasgo ideal para favorecer la colonización y el mantenimiento de la flora comensal desplazando a la flora patógena.
El lumen del intestino está recubierto por carbohidratos, la fracción polisacárida de las mucinas y el glicocálix de las células del epitelio intestinal, que son sitios potenciales de unión para las adhesinas bacterianas. En el proceso de adhesión, concurren interacciones inespecíficas, como las hidrofóbicas y electrostáticas, propiciadas por la naturaleza físico-química de las superficies bacteria-mucus-epitelio, e interacciones específicas, del tipo ligando-receptor, mediante polisacáridos extracelulares, proteínas y/o ácidos lipoteicoicos de la superficie bacteriana, que le confieren esa capacidad específica de adherencia.
Los factores no proteicos de la superficie bacteriana que median en la adhesión inespecífica de bacterias son:
• Los ácidos lipoteicoicos, que confieren hidrofobicidad a la superficie bacteriana.
• Los exopolisacáridos, que participan en la interacción inespecífica con superficies bióticas y abióticas al contribuir a determinar alguna de las propiedades físico-químicas de estas superficies que interactúan. Están directamente implicados en la adherencia, pues son responsables de enmascarar a otras adhesinas de superficie. Por ejemplo, el L. Rhamnosus GG, al que se muta la capacidad de producir la biosíntesis de estos exopolisacáridos, aumenta considerablemente su adherencia al mucus y a células epiteliales, así como su capacidad de formación de biofilms al quedar expuestas otras adhesinas de superficie, tipo fimbria, anteriormente enmascaradas por los exopolisacáridos(15).
Las adhesinas son un factor de virulencia en los patógenos y sirven para adherirse al epitelio e invadir los diferentes órganos de forma más específica. Los comensales comparten algunos de estos mecanismos de adherencia, que pueden clasificarse según la diana de unión, su localización en la superficie bacteriana o forma de anclaje. Se han descrito multitud de adhesinas bacterianas de la flora comensal y de los probióticos, algunas de las cuales nombramos a continuación por su relevancia en la actividad de estos últimos:
- Adhesinas del mucus, como la mucus binding protein (Mub).
- Adhesina específica de la manosa tipo lectina (Msa).
- La Spac, que confiere al L. rhamnosus GG el pilo con gran capacidad de adherencia al mucus y epitelio, responsable también de la inmunomodulación.
- Proteínas de la capa de superficie (S-Layer), que forman una especie de envoltorio poroso que rodea y se ancla en la pared bacteriana constituyendo un escudo defensivo, incluso puede considerarse como factor de virulencia para los patógenos, y sirve para adherirse a las células epiteliales y proteínas de la matriz extracelular, si quedase expuesta (colágeno y fibronectina), posibilitando a algunos lactobacillus (L. acidophilus) adherirse a las mismas para prevenir la invasión de bacterias patógenas. Además, pueden interactuar con receptores de las células dendríticas modulando la producción de interleuquinas y, por lo tanto, forman parte de los mecanismos de comunicación bacteria-célula epitelial-sistema inmunológico.
- Proteínas moonlighting (proteínas pluriempleadas), se trata de proteínas citoplasmáticas con expresión en superficie y función diferente a la del citoplasma. Aquí, desempeñan función de virulencia y adherencia, tanto a mucinas como a células epiteliales, como es el caso del L. Johnsonii. Algunas de estas adhesinas, además, pueden desempeñar funciones de chaperonas (son proteínas encargadas de la reestructuración espacial de otras proteínas para dotarlas de una actividad determinada).
Función de inmunomodulación
La microflora actúa modulando la respuesta tolerogénica de homeostasis intestinal Th2, frente a la proinflamatoria Th1, mediante un complejo mecanismo de señales intercelulares, en las que las bacterias, células epiteliales, células dendríticas y del sistema inmunológico actúan coordinadamente con el objetivo de eliminar patógenos, permitir la supervivencia de comensales y la tolerancia a los alimentos.
La mucosa intestinal es la mayor interfase entre el sistema inmunitario (SI) y el medio externo. La microbiota desempeña un papel importante en el desarrollo y maduración del tejido linfoide asociado a la mucosa intestinal GALT (Gut Associated Lymphoid Tisue). Esto se evidencia, porque los recién nacidos y animales criados en condiciones de asepsia total presentan un sistema inmunitario, tanto celular como humeral, poco desarrollado(11).
El sistema inmunitario en mamíferos dispone de mecanismos innatos y adaptativos para proteger al individuo de patógenos ambientales. Los mecanismos innatos funcionan independientemente de exposiciones previas a agentes infecciosos y lo constituyen las barreras mecánicas (piel y epitelio de las mucosas) y los componentes celulares, principalmente macrófagos y neutrófilos. Los macrófagos representan el 10-20% de todas las células mononucleares de la lámina propia, por lo que el intestino constituye el mayor reservorio humano. Estas células despliegan una potente actividad fagocítica y bactericida y son los principales elementos funcionales del SI innato. A la barrera física que supone el epitelio (formado por enterocitos y colonocitos con sus uniones estrechas laterales y el borde en cepillo), se suma la producción de moco por parte de las células caliciformes (que dificulta la adherencia de microorganismos al quedar atrapados en él, eliminándose por el peristaltismo) y la incorporación a la luz intestinal de lisozimas, enzimas hidrolíticas con actividad bactericida, y un amplio espectro de péptidos con actividad antimicrobiana (más de 500), producidos por las células de Paneth, que funcionan abriendo poros en las paredes de las bacterias.
La inmunidad adaptativa se desarrolla en tejidos linfoides asociados a la mucosa intestinal o GALT, requiere de contacto previo con el agente invasor y pone en marcha una respuesta mediante la activación de linfocitos T, linfocitos B, células plasmáticas, formación de IgA y otros elementos moleculares de activación e inhibición de las diferentes células (interleuquinas, citoquinas y otros). Ambos mecanismos actúan de manera coordinada y conducen finalmente a la instauración de la memoria inmunológica (linfocitos T y B de memoria).
Existe un nexo de unión, interacción o comunicación entre el sistema innato, la microbiota intestinal y el sistema adaptativo, de tal forma que se ponga en marcha una respuesta rápida y eficaz ante la presencia de patógenos u otros antígenos nocivos, con la finalidad de eliminarlos, así como una supresión o cese de esta actividad, una vez desaparezca dicho peligro, y también una actividad tolerogénica ante la presencia de flora comensal y alimentos. Este equilibrio es fundamental en la supervivencia de la propia flora del hospedador y en la modulación inmunológica; la alteración del mismo conduce a enfermedades autoinmunes y a enfermedad inflamatoria crónica, como la enfermedad inflamatoria intestinal, la enfermedad celíaca y otras alergias alimentarias.
En este nexo de unión, se involucran diferentes células:
• Células M, son células epiteliales modificadas del epitelio intestinal, que se encuentran sobre zonas que recubren nódulos linfoides y placas de Peyer. Captan por endocitosis partículas antigénicas solubles, incluso microorganismos íntegros, desde la luz intestinal. En su citoplasma, se procesan y después se presentan a los linfocitos intraepiteliales, mediante el complejo mayor de histocompatibilidad tipo I (CMH I). Estos atraviesan la membrana basal hasta los nódulos linfoides y desencadenan la respuesta inmune.
• Los macrófagos y las células dendríticas (CD) se consideran las células profesionales presentadoras de antígenos (CPAs) más potentes que existen. Se encargan de reconocer antígenos del lumen intestinal (patógenos, comensales, alimentos), procesarlos, devolverlos a la superficie y, mediante el CMH II, presentarlos a los linfocitos del SI adaptativo para originar básicamente una respuesta proinflamatoria, orientada a la eliminación de patógenos u otros agentes nocivos, o una respuesta tolerógenica ante bacterias comensales u otras moléculas que son reconocidas como propias. Ello es posible mediante la interacción de diferentes moléculas o productos bacterianos denominados, genéricamente, patrones moleculares asociados a patógenos (PAMPs), que son reconocidos por unos receptores celulares reconocedores de dichos patrones (PRRs patterm recognistion receptor) localizados tanto a nivel de la superficie de la membrana extracelular, Toll-like receptors (TLR), como intracelulares a nivel citoplasmático (nucleotide-binding oligomerization domain/caspese recruiment domain NOD/CARD: (dominios de oligomerización ligados a nucleótidos/dominios de reclutamiento de caspese), así como los genes tipo helicasa inducibles por ácido retinoico (RIG-like helicasa).
Los PRRs tienen una amplia expresión tanto en células del SI innato (monocitos, macrógafos tisulares, células dendríticas, células epiteliales, enterocitos y células endoteliales), como del sistema adaptativo (linfocitos T y B). Como consecuencia de la interacción PAMPs y PRRs, se produce la activación de señales intracelulares que involucran la disociación del complejo formado por el factor nuclear kappa (NF-kB) y su proteína reguladora, el inhibidor de kB (I kB), que conducen a la expresión de distintos mediadores proinflamatorios (INFa, IL1b, IL6, IL8, IL12), que generan quimiotaxis, fagocitosis, producción de especies reactivas de oxígeno y polarización de la respuesta Th1/Th2 hacia Th1 (proinflamatoria) por influencia principalmente de IL12. En resumen, la interacción PMPs y PRRs culmina con la producción de citoquinas inflamatorias, quimioquinas o interferón.
Las células del sistema adaptativo que van a responder son diferentes poblaciones de linfocitos que comentamos a modo de recordatorio en la tabla II(16).
Los receptores Toll-like (TLR), del alemán coloquial “toll”, raro/extravagante, son receptores transmembrana de señalización. Todos los TLR’s comparten la misma estructura: un gran dominio extracelular, que consiste en repeticiones ricas en leucina (LRR’s) y una secuencia franqueadora rica en cisteína, un dominio transmembrana y una porción citoplasmática similar al receptor de IL-1 llamado TIR (Toll/IL-1Receptor). El dominio extracelular tiene la capacidad de unión al ligando, mediante las LRR’s, siendo las responsables del reconocimiento de los diferentes PAMP’s, y el dominio TIR media la señal intracelular en presencia de ligandos. Los dominios extracelulares son más variables que los citoplasmáticos entre diferentes TLRs, reflejando la diferencia entre sus ligandos. Sin embargo, estos receptores no tienen tanta diversidad como los receptores de los linfocitos T, ni como los anticuerpos, porque se codifican en genes somáticos no recombinados. Después de unirse a su ligando (PAMPs), algunos TLRs en su porción citoplasmática forman homodímeros, en unos casos y, en otros, heterodímeros, para su activación. Los correspondientes PAMPs para los TLRs comprenden diferentes moléculas de tipo lipo-polisacáridos de superficie (LPS) de las bacterias Gram negativas, lipoproteínas, di y tri-aciladas, peptidoglicanos, ácido lipoteicoico de las bacterias Gram positivas, zymosan de la pared celular de hongos, ARN de doble cadena generado durante la replicación de virus ARN, flagelina (monómero del flagelo de algunas especies de bacterias), regiones ricas en guanina–uracilo (GU) del ARN de una sola cadena y regiones de bajo grado de metilación del ADN bacteriano y viral(17).
Estos PAMPs son típicos de los patógenos, por lo que sirven para diferenciar los patógenos de las células del huésped. No están distribuidos clonalmente y no tienen la especificidad de los receptores del sistema adaptativo. Son habitualmente estructuras invariantes de clases enteras de patógenos; por ejemplo, todas las bacterias Gram negativas tienen LPS y, así, el PRRs de LPS puede detectar la presencia virtualmente de cualquier infección bacteriana por Gram negativos.
En resumen, la interacción de las células dendríticas con antígenos de diferente origen conduce a su maduración y a la liberación de citoquinas, que promueven la conversión de las células T-auxiliadoras indiferenciadas (Th0) en una respuesta madura balanceada de células T-auxiliadoras (Th1, Th2 y Th3/Tr1), un componente importante en la prevención de enfermedad. La polarización de la respuesta Th1/Th2 depende del patrón de citoquinas a que sea expuesta la célula Th0; este patrón está condicionado por el tipo de antígeno procesado por las células presentadoras de antígenos. La respuesta Th1, cuyo patrón de citoquinas está integrado por el factor de necrosis tumoral alfa (TNF-a), interferón gamma (INF-g) y las interleuquinas IL-1, IL-2, IL-6, IL-8, IL-12, IL-15, IL-16, IL-18, IL-25 e IL-27, va dirigida fundamentalmente contra patógenos intracelulares (clásicamente bacterias y virus); mientras que la Th2, con un patrón de citoquinas constituido por IL-3, IL-4, IL-5, IL-9, IL-10, IL-11 e IL-13, va dirigida contra patógenos extracelulares.
El antígeno interactúa con una célula presentadora del antígeno, que a su vez lo presenta a una célula Th0 (CD4) nativa. Cuando se trata de un organismo patógeno, se produce una inflamación local por los efectos inducidos por los patógenos en los receptores específicos de membrana, TLR. Tras capturar el antígeno, las células dendríticas experimentan una maduración y producen interleucina 2 (IL-2), que favorece la diferenciación de las células CD4 nativas a Th1, productoras de interferón gamma INFg y más inflamación, y también hacia células de Th2, que liberan IL-4 e IL-5, promotoras de la respuesta local de inmunoglobulina IgA. La discriminación entre señales de peligro y señales normales depende de la naturaleza de los PAMPs. Las células dendríticas actúan como un seleccionador entre la respuesta inmunitaria o de tolerancia y la naturaleza determina esta respuesta mediante la promoción de cualquiera de las células efectoras Th1 o Th2 o células T reguladoras y sus citosinas relacionadas (IL-10, etc.).
Si las células dendríticas capturan antígenos alimentarios o gérmenes de la microflora intestinal en ausencia de inflamación, se liberan prostaglandina E2 y factor transformador de crecimiento beta (TGFb), promotores de la maduración parcial desde las células dendríticas que presentan el antígeno a células T CD4, que se diferencian a células T reguladoras (Treg), productoras de IL-10, y células Th3, que producen TGFb. El resultado final es la producción local de IgA, la tolerancia sistémica y la homeostasis inmunológica total(18).
La presencia de IgA en el tracto gastrointestinal es necesaria para la regulación de la comunidad de bacterias que allí residen y su adecuada distribución en cada uno de los segmentos intestinales. En ratones, la ausencia de IgA conduce a una expansión anormal de bacterias anaerobias en todos los segmentos del intestino delgado, mientras que su restablecimiento produce un regreso de estas bacterias a los segmentos del intestino grueso, donde habitualmente viven, y una restitución de la microbiota normal del intestino delgado. Evidentemente, la IgA no es el único factor involucrado en el mantenimiento de las proporciones adecuadas de comensales y la exclusión de patógenos en el tracto digestivo, pero las evidencias se inclinan hacia un rol preponderante de esta inmunoglobulina en dichas funciones, incluido el hecho de su casi exclusivo predominio en el intestino y la existencia de múltiples vías para su generación. La existencia de IgA en las secreciones del intestino depende del efecto que sobre el SI tiene la presencia de determinados tipos de microorganismos y, a su vez, las cantidades, poblaciones y distribución de estos depende, en gran medida, de que se secrete esta inmunoglobulina. Estos hechos parecen tener implicaciones importantes en el proceso de desarrollo de tolerancia a los comensales y de una adecuada respuesta inmune contra los patógenos.
El descenso en la incidencia de la estimulación microbiana por cepas infecciosas, como resultado de la mejora de las condiciones higiénicas, la baja incidencia de enfermedad infecciosa (dado la mejora del nivel socioeconómico y la medicación antibacteriana) y la menor carga bacteriana de la dieta humana (por la mejora del proceso industrial y de la conservación), puede haber modificado de forma considerable el componente microbiano de nuestro tracto digestivo y podría ser la base del incremento notable de las enfermedades autoinmunes y de las alergias.
Hay pruebas que demuestran que los microorganismos probióticos inducen preferentemente células Th3/Treg y parecen inducir una respuesta antiinflamatoria, principalmente a través de una interacción con TLR9. Actualmente, existe una mejor comprensión de cómo los microorganismos comensales/probióticos pueden crear un estado de tolerancia general mediada por la acción de los TLR sobre las CD. Es evidente que la señalización de TLR9 es esencial para mediar el efecto antiinflamatorio de los probióticos; sin embargo, diferentes estudios han implicado a otros TLR, como los TLR3 y TLR7, en la tolerancia inducida por bacterias comensales/probióticas. Después de la activación por microorganismos comensales/probióticos, las CD inician una respuesta apropiada, como es la diferenciación de Th0 a Treg, que tiene un efecto inhibidor sobre la respuesta inflamatoria de Th1, Th2 y Th17. Los TLR en las CD también están implicados en la generación de la respuesta inmunitaria protectora contra los agentes patógenos inductores de citoquinas proinflamatorias como la IL12. Aunque hay evidencia sustancial de estudios in vitro y en animales que demuestran el potencial de los probióticos y una capacidad cepa-específica inmunomoduladora, los resultados de los ensayos de intervención humana han sido mucho menos convincentes.
La posibilidad de actuar sobre la población bacteriana del tracto digestivo parece muy atractiva para la prevención de enfermedades, como la atopia; de ahí, el interés creciente por el estudio de los probióticos y su papel en el tratamiento y la prevención de diversas patologías(19).
Probióticos
Concepto
Microorganismos vivos que, cuando se administran en cantidad adecuada, confiere beneficio para la salud al huésped con indicaciones precisas, seguridad y eficacia demostrada.
En 1908, el premio Nobel Elie Metchnikoff publica el libro “Prolongation of life”, en el que se postula que las bacterias lácticas del yogurt confieren beneficios para la salud capaces de promover la longevidad mediante la supresión de las bacterias proteolíticas, tipo Clostridium, productoras de sustancias tóxicas (fenoles, indoles, amoníaco, etc.), favoreciendo el desarrollo de otros microbios útiles de los yogures. Estos eran los responsables de la longevidad de los campesinos búlgaros y que denominó “bulgaris Bacillus”. No fue hasta 1989 cuando Roy Fuller redefinió a los probióticos como: “aquellos suplementos alimenticios integrados por microorganismos vivos que afectan beneficiosamente al hospedador que los consume mejorando su equilibrio microbiano intestinal”.
Actualmente, se acepta la definición de probiótico formulada en 2001 y revisada en 2006 por la FAO/OMS(19): “Microorganismos vivos, que cuando se administran en cantidad adecuada, confiere beneficio para la salud al huésped”. Dicha definición ha de adaptarse a los nuevos conocimientos, pues varios científicos han demostrado que algunos microorganismos inactivos, incluso sus componentes celulares, pueden ejercer un efecto beneficioso para la salud.
Los probióticos, para ser considerados como tales, han de cumplir una serie de condiciones que se especifican en la tabla III, aunque no se exige que se satisfagan todos los requisitos, sino que, al menos, tengan efecto beneficioso para la salud.
En principio, cualquier componente de la microbiota comensal podría ser candidato a convertirse en probiótico, pero los más utilizados en Pediatría pertenecen a los dos grupos microbianos: lactobacillus y bifidobacterias, considerados GRAS (Generally Regarded As Safe) y QPS (Qualified Presumption of Safety)por la FDA de EE.UU. y la EFSA de Europa. Pero también, se han utilizado con este fin, bacterias que pertenecen a otros géneros, como: E. Coli y Bacillus cereus, así como levaduras, principalmente: Saccharomyces cerevisiae y boulardii (Tabla IV).
Mecanismos de acción de los probióticos
Son de tres tipos: mejora de la barrera intestinal defensiva, modulación inmunológica y mejora de la eficiencia metabólica.
El propósito del uso de los probióticos es aportar resultados beneficiosos para la salud. Son prácticamente los mismos que los beneficios que aporta la flora comensal, ampliamente comentados, y que se resumen en la tabla V.
Hemos de tener en cuenta que los efectos descritos solo se pueden atribuir a la cepa o cepas estudiadas, y no a la especie o a todo el grupo de bacterias ácido lácticas y otros probióticos. Por lo tanto, cada probiótico no presenta todas las acciones apuntadas sino que pueden mostrar una o varias, de tal forma que unas cepas pueden complementar la acción de otras; de ahí, que se haya documentado el posible efecto sinérgico, esto es, que la combinación de diferentes probióticos podría ser superior al obtenido por cada uno individualmente(20).
Dosis de probióticos
Son muy variables, dependiendo de la cepa y de las indicaciones, oscilan entre 106-1011 UFC/dosis.
Es importante definir la dosis terapéutica, esto es, la dosis en la que se alcanzan los efectos beneficiosos para la salud, tanto en la prevención como en el tratamiento de los diferentes procesos patológicos. Sin embargo, la dosis de probióticos necesaria varía enormemente según la cepa y el producto. Habitualmente, puede oscilar en un rango entre un millón y 10 mil millones (106-1010) de UFC/dosis; han de llegar viables ≥ 106y de ≥ 108 UFC/dosis al intestino delgado y colon, respectivamente. Pero se ha demostrado, para algunos, su eficacia a niveles más bajos, mientras otros requieren cantidades mayores. Por ejemplo, el B. infantis ha mostrado ser eficaz para aliviar los síntomas del síndrome de intestino irritable a dosis de 100 mil millones (1011) UFC/dosis, mientras hay estudios con el VSL#3R que han utilizado de 300-400 mil millones (3-4 1011) de UFC tres veces al día. En resumen, no es posible establecer una dosis general para probióticos, la dosificación ha de basarse en estudios realizados en humanos, que muestren un beneficio para la salud en patologías específicas(19).
Normativa reguladora
Han de seguir las normas explicitadas en el reglamento de la Unión Europea sobre las declaraciones nutricionales y de propiedades saludables (1924/2006/CE).
No hay normas universalmente establecidas y/o aplicadas para el contenido y las declaraciones en la etiqueta de los productos. Sin embargo, en 2007 entró en vigor el reglamento de la Unión Europea sobre las declaraciones nutricionales y de propiedades saludables (1924/2006/CE). Uno de los principales cambios introducidos por el nuevo reglamento es que, los fabricantes de probióticos deben presentar todas las declaraciones de propiedades saludables a la Comisión Europea, para que la EFSA evalúe su base científica antes de aceptarlos o rechazarlos. Desde el 2010, las declaraciones sobre productos probióticos se han acreditado mediante este proceso y deberían ofrecer al consumidor información fiable sobre los posibles efectos beneficiosos para la salud de dichos productos.
Los criterios mínimos que se exigen para que un producto, desde un punto de vista científico, se considere probiótico son:
• Debe estar especificado por género y cepa. La investigación sobre determinadas cepas específicas de probióticos no se puede aplicar a cualquier producto comercializado como probiótico.
• Ha de contener bacterias vivas en el producto.
• Administrarse en dosis adecuada hasta el final de la vida útil (con variabilidad mínima de un lote a otro).
• Haber demostrado ser eficaz en estudios controlados en humanos.
• Ser inocuo para el uso para el cual está destinado.
Una cepa probiótica se indentifica por un género, especie y designación alfanumérica. La comunidad científica ha acordado una nomenclatura para microorganismos, por ejemplo, Género, Lactobacillus; Especie, casei, rahmnosus; Designación de la cepa, GG, DN-114001.
La comercialización y nombres comerciales no están regulados y las compañías pueden ponerle el nombre que quieran a sus productos probióticos (por ejemplo, LGG).
Otros aspectos a tener en cuenta son:
• La documentación de los efectos sobre la salud debe realizarse considerando la cepa específica que se vende en el producto.
• Los estudios y artículos que avalen los efectos de una cepa específica no son aval de efectos similares en cepas no estudiadas.
• Los efectos observados por una cepa, a dosis determinada, no evidencia dichos efectos a dosis más bajas.
• Los posibles efectos beneficiosos con un vehículo/matriz pueden no reproducirse al utilizar otro diferente, que puede alterar entre otras la viabilidad de la cepa(19).
Prebióticos
Ingredientes fermentados selectivamente que dan lugar a cambios específicos en la composición y/o actividad de la flora gastrointestinal, confiriendo así beneficios a la salud del huésped.
Concepto
Los prebióticos son sustancias de la dieta (polisacáridos no almidón, oligosacáridos no digeribles por enzimas humanas) que estimulan selectivamente el crecimiento o la actividad de una o de un número limitado de bacterias en el colon y beneficia la salud del huésped. Según esta definición, los prebióticos han de presentar las siguientes características(21):
• Resistencia a la digestión en el intestino delgado, es decir, han de superar casi sin daños y en cantidad adecuada los procesos digestivos que se producen en la primera sección del tubo digestivo.
• Fermentación parcial por bacterias en el intestino grueso; esto es, son sustrato fermentable nutricional para la microflora intestinal, con el fin de estimular selectivamente el crecimiento y/o metabolismo de una o unas pocas especies bacterianas.
• Deberían cambiar positivamente la flora bacteriana aumentando las bacterias acidófilas fermentativas (bifidobacterias, lactobacillus), disminuyendo las bacterias putrefactivas y, finalmente, deberían incluir efectos sistémicos o locales en el intestino que sean positivos para la salud humana.
Composición química
Se trata de oligasacáridos que, a nivel nutritivo, se comportan como fibra alimentaria soluble no digerible.
Se consideran prebióticos a los oligosacáridos (OS) que contienen entre 3-30 moléculas de monosacáridos unidos por enlaces glusídicos tipo β. Estos oligosacáridos a nivel nutritivo se comportan como fibra alimentaria soluble no digerible.
Existen diferentes tipos y fuentes naturales de OS:
• Fructo OS (FOS) y la inulina. Las fuentes naturales de los mismos son: achicoria, cebolla, ajo, alcachofa, yacon, puerro, espárragos, etc. Se obtienen a partir del disacárido sacarosa usando la actividad transfructosilación del enzima β-fructofuranosidasa. Los FOS así formados contienen entre 3-4 unidades de fructosa unidas con enlaces β(2-1) con residuo terminal D-glucosa.
• Galacto OS (GOS). Las fuentes naturales son la leche, incluida la humana, y los a GOS de las legumbres. Los GOS se producen por la acción de la β-galactosidasa con actividad de transgalactosilación. Las uniones glicosídicas entre dos unidades de galactosa son, principalmente, uniones tipo β(1-4) o tipo β(1-6), utilizándose como sustrato la lactosa.
• Xilo OS (XOS). Se encuentra en la fruta, verduras, miel y leche.
• Isomalto OS (IMOS). Se encuentra en la soja y miel.
• Lactulosa. Se obtiene por isomerización alcalina de la lactosa de la leche de vaca. Se trata de un disacárido de síntesis formado por galactosa-fructosa, aceptado y utilizado como prebiótico, además de medicamento para el tratamiento del estreñimiento en la encefalopatía hepática.
• Los oligosacáridos de la leche materna. En la leche materna se encuentran diferentes OS con función prebiótica. La lactosa, el principal carbohidrato y su precursor, por adición de monosacáridos (galactosa y N-acetilglucosamina) en unión β-glucosídica originan los β-galactooligosacáridos (β-GOS). Sobre estos oligosacáridos primarios se incorpora fucosa, que genera OS neutros (fucosilados) o ácido siálico (ácido acetilmuramínico) que produce OS ácidos (sialilados). Los OS de la leche materna (β-GOS) y el ácido siálico aparecen en concentraciones de 2,2-2,4 g/dl en el calostro y disminuyen en la leche madura. El 60%-70% son OS fucosilados (GOS y ácido siálico), la leche materna carece de FOS. Constituyen aproximadamente el 10% del total de hidratos de carbono de la leche materna y el otro 90% restante está formado por la lactosa que también ejerce efecto prebiótico.
En las fórmulas infantiles, se utilizan como prebióticos los GOS y FOS, aparte del ácido siálico, en una proporción de 90:10, 90% del GOS de cadena corta y 10% de FOS de cadena larga, generalmente. Esta combinación favorece el desarrollo de flora intestinal semejante a la que se encuentra en lactantes alimentados con leche materna, con predominio de bifidobacterias y lactobacillus(22).
Efectos de los prebióticos
Son los mismos que los debidos a efectos probióticos por su estimulación y algunos más específicos debido a su efecto laxante.
Los prebióticos afectan a las bacterias intestinales aumentando el número de bacterias anaerobias beneficiosas y disminuyendo la población de microorganismos potencialmente patógenos. Se supone que el aumento de bifidobacterias colónicas beneficia a la salud humana, al producir los efectos propios de los probióticos ya reseñados en la tabla V, a los que se añaden algunos más específicos, como son:
• Aumentan el número de bifidobacterias en el colon.
• Incrementan la absorción de Ca, Fe y Mg.
• Aumentan el peso fecal.
• Acortan el tiempo de tránsito gastrointestinal.
• Posiblemente, reducen los niveles séricos de lípidos.
Simbióticos
Cuando utilizamos probióticos y prebióticos de forma conjunta, estamos empleando un simbiótico.
En 1995, Gibson y Roberfroid definieron el simbiótico como: “una mezcla de probióticos y prebióticos que afecta beneficiosamente al huésped, mediante la mejora de la supervivencia y la implantación de suplementos microbianos vivos de la dieta en el tracto gastrointestinal, a partir de la estimulación selectiva del crecimiento y/o la activación del metabolismo de una o un número limitado de bacterias que promueven la salud y, por tanto, mejoran el bienestar del anfitrión”.
Cuando utilizamos probióticos y prebióticos de forma conjunta estamos empleando un simbiótico. Por tanto, los simbióticos pueden ser definidos como: preparaciones farmacéuticas o alimentarias que contienen una o más especies de probióticos e ingredientes prebióticos. Utilizando la correlación entre la actividad de los microorganismos y la metabolización por parte de estos, de los prebióticos, se favorece el desarrollo/actividad de los componentes probióticos, potenciando sus propiedades saludables y generando un efecto sinérgico. Esto implica que, un producto solo puede ser denominado simbiótico si ha demostrado inducir un efecto beneficioso superior al que se obtiene con la suma de los generados separadamente por sus integrantes. Suplementariamente, se espera que esta mejora se acompañe de un aumento cuantitativo de los componentes probióticos o de las actividades saludables.
La administración simultánea de probióticos y un sustrato que puedan metabolizar, proporciona a las cepas administradas mayores oportunidades para la colonización y supervivencia en el colon del hospedador, al aumentar o prolongar sus efectos beneficiosos. Los simbióticos son la mejor estrategia para la integración del probiótico en el ecosistema, ya que aumentan la persistencia (vida útil del producto) y, por otra parte, proporcionan un sustrato específico para la flora bacteriana residente.
Teóricamente, los simbióticos tienen un mayor efecto beneficioso sobre la flora intestinal que los probióticos y los prebióticos en forma aislada. Esto se debe a que reducen el pH, promueven el crecimiento de bifidobacterias y de la acción protectora mediante la inhibición de microorganismos potencialmente patógenos, favorecen la estabilización del entorno intestinal y aumentan la liberación de ácidos grasos de cadena corta(21).
Nutracéuticos
Los prebióticos, los probióticos y los simbióticos comercializados como agentes bioterapéuticos pueden ser catalogados como productos nutracéuticos.
Son productos de origen natural con propiedades biológicas activas, beneficiosas para la salud y con una capacidad preventiva y/o terapéutica definida. Cuando hablamos de nutracéuticos, nos referimos a una medicina biológica y a una categoría muy amplia de productos, que deben cumplir los siguientes criterios:
• Ser de origen natural.
• Ser aislados y purificados por métodos no desnaturalizantes.
• Aportar efectos beneficiosos para la salud.
• Mejorar una o más funciones fisiológicas.
• Actuar de forma preventiva y/o curativa.
• Mejorar la calidad de vida.
• Cumplir todas las normas de desarrollo y validación, siguiendo criterios científicos equiparables a cualquier otro medicamento en cuanto a reproducibilidad, calidad, seguridad y eficacia demostrada en estudios en animales de experimentación y en humanos.
Según los conceptos desarrollados, podemos concluir que los prebióticos, los probióticos y los simbióticos comercializados como agentes bioterapéuticos pueden ser catalogados como productos nutracéuticos.
La complementación probiótica y prebiótica en la infancia a largo plazo es atractiva, y abre caminos de investigación novedosos. En el mercado español, existen diversas fórmulas lácteas a las que se ha añadido uno o varios probióticos y/o prebióticos, para intentar asemejarlas aún más a la leche materna y lograr beneficios saludables a largo plazo en forma profiláctica o preventiva; es decir, se suministran probióticos y prebióticos en niños sanos para mantenerlos sanos.
Posibilidades terapéuticas de probióticos y prebióticos
Son muchas y a diario se publican otras nuevas, pero han de basarse en la evidencia científica probada y específica.
En la tabla VI, se resumen algunas de las condiciones clínicas para las cuales se ha mostrado algún grado de evidencia, con estudios clínicos bien diseñados y con poder estadístico suficiente, de que la administración oral de una cepa probiótica específica o prebiótico puede ser eficaz y beneficiosa para la salud o como tratamiento.
El nivel de evidencia puede variar entre diferentes indicaciones, las dosis recomendadas son las que han sido demostradas como útiles en los ensayos.
La lista reflejada en la tabla VI es una adaptación de la que aparece en la Guía Práctica de la Organización Mundial de Gastroenterología: probióticos y prebióticos de octubre de 2011(19), que puede ser incompleta dado el flujo constante de estudios publicados. En la misma guía, además, se especifican otras patologías donde se han usado probióticos y/o prebióticos, tanto en niños como en adultos, que no reseñamos aquí porque se sale de la extensión de este artículo.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. O’Hara AM and Shanahan F. The gut flora as a forgotten organ. EMBO Rep. 2006; 7(7): 688-93.
Interesante artículo de revisión que repasa la importancia de comprender las interacciones bioquímico-inmunológicas de la microbiota, “el órgano olvidado dentro de otro órgano”, y su relación con ciertos estados patológicos y las posibilidades terapéuticas de los “bichos medicamento” o farmabiótica.
2. Martin R, Jiménez E, Heilig H, et al. Isolation of bifidobacteria from breast milk and assessment of the bifidobacterial population by PCR-denaturing gradient gel electrophoresis and quantitative real-time PCR. Appl Environ Microbiol. 2009; 75: 965-9.
El objetivo de este trabajo fue determinar si la leche materna contiene bifidobacterias y si pueden ser transmitidas al intestino del bebé a través de la lactancia materna. Se tomaron muestras de leche y heces en la primera semana de vida. Se objetivó un rango entre 40 y 10.000 copias de genes por secuenciación 16S rRNA por ml de leche del ADN de bifidobacterias, evaluados por PCR-electroforesis en gradiente de gel desnaturalizante (PCR-DGGE), y sus niveles se estimaron cuantitativamente en tiempo real PCR (qRTi-PCR), concluyendo que la leche humana es la principal fuente de bifidobacterias para el intestino del bebé.
3.** Jiménez E, Marín ML, Martín R, et al. Is meconium from healthy newborns actually sterile? Res Microbiol. 2008; 159: 187-93.
Es un interesante estudio experimental que evidencia la posibilidad de que el colon de los recién nacidos sea colonizado por vía enteroplacentaria desde antes del nacimiento, al encontrarse bacterias comensales en la sangre del cordón umbilical y en el líquido amniótico en crías de ratones obtenidas por cesárea. Por otra parte, bacterias de la leche materna, marcadas genéticamente y administradas a las ratas durante el embarazo, se detectan en el meconio de las crías obtenidas por cesárea realizada un día antes de la fecha de parto, en contraste no pudieron ser aisladas en el grupo control.
4. Guarner F and Malagelada J. Gut flora in health and disease. The Lancet. 2003; 361: 512-9.
5. Wu GD, Chen J, Hoffmann C, Bittinger K, Chen Y-Y, Keilbaugh SA, Bewtra M, Knights D, Walters WA, Knight R, Sinha R, Gilroy E, Gupta K, Baldassano R, Nessel L, Li H, Bushman FD, Lewis JD. Linking Long-Term Dietary Patterns with Gut Microbial Enterotypes. Science. 2011; 334 (6052): 105-8.
En este artículo, se comprueba la asociación entre determinados enterotipos intestinales: bacteroides y prevotella, y la dieta consumida a largo plazo en 98 voluntarios sanos, rica en grasa y proteínas o rica en fibra, respectivamente. A 10 de estos, se les somete a una dieta vigilada rica en grasa y proteínas y a otro grupo, una rica en fibra durante 10 días, sin comprobar cambio alguno en dichos enterotipos en tan corto espacio de tiempo.
6.*** Arumugam M, Raes J, Pelletier E et al. Enterotypes of the human gut microbiome. Nature. 2011, 473: 174-80.
Se trata de un trabajo multicéntrico en el que se estudia la microflora de personas de diferentes países de varios continentes y se obtienen datos mediante análisis de ADN bacteriano (metodología molecular basada en la secuenciación del gen 16S rRNA y rDNA), que han ampliado y aportado nuevos conocimientos sobre la composición y funcionalidad de las comunidades de bacterias del intestino humano. Ha permitido definir un nuevo concepto, el microbioma, como la totalidad de bacterias, su información genética y las formas en que interactúan entre ellas mismas y con el hospedador humano. Descubren, que solo un pequeño número de especies es compartido por todas las personas, clasificando a los individuos según tres enterotipos identificados por la variación en los niveles de cada uno de los tres géneros predominantes a nivel colónico, independiente de la zona geográfica, etnia, sexo, edad, dieta e índice de masa corporal. Evidencia la importancia del estudio funcional de algunas de estas bacterias que no son precisamente las más numerosas y su correlación más estrecha con el tipo de alimentación, índice de masa corporal e incluso la posibilidad de utilizarse como biomarcadores microbianos para la ayuda diagnóstica y pronóstica de numerosos trastornos humanos.
7.** Khanna S and Tosh PK. A clinician’s primer on the role of the microbiome in human health and disease. Mayo Clin. Proc. 2014; 89 (1): 107-14.
Es un trabajo de revisión de los conocimientos básicos que ha de tener cualquier médico sobre la microflora intestinal y sus implicaciones en la salud y la enfermedad. Se analiza el papel que juega en procesos como la enfermedad inflamatoria intestinal, la colonización con organismos resistentes a múltiples fármacos, obesidad, enfermedades alérgicas, enfermedades autoinmunes y enfermedades neuro-psiquiátricas, y en el estudio del microbioma en terapias revitalizantes.
8. Sánchez B, de los Reyes-Gavilán CG, Margolles A. The F1F0-ATPase of Bifidobacterium animalis is involved in bile tolerance. Environ Microbiol. 2006; 8: 1825-33.
La adaptación y tolerancia al estrés de la bilis son factores importantes para la supervivencia de las bifidobacterias en el intestino. Se ha utilizado un mutante de Bifidobacterium animalis para su estudio, que ha evidenciado la relación existente entre la actividad F1F0-ATPasa y la capacidad de resistencia a la bilis y el pH ácido.
9.** Swidsinski A, Loening-Baucke V, Lochs H, et al. Spatial organization of bacterial flora in normal and inflamed intestine: a fluorescence in situ hybridization study in mice. World J Gastroenterol. 2005; 8: 1131- 40.
Es un trabajo de investigación, donde se estudia la distribución espacial de la microflora a lo largo del colon sano y en dos modelos de ratones con colitis inflamatoria inducida, comprobándose la disposición de las bacterias en tres compartimentos: luz intestinal, moco y epitelio, así como la alteración de esta distribución resultante del daño inflamatorio.
10. Ohland CL and Macnaughton WK. Probiotic bacteria and intestinal epithelial barrier function. Am J Physiol Gastrointest Liver Physiol. 2010; 298: 807-19.
Esta revisión resume la evidencia sobre los efectos de los muchos probióticos disponibles en la función de barrera intestinal, competencia por adhesión a la mucosa y el efecto sobre la inmunomodulación. También, hace referencia a su utilidad para prevenir y mejorar enfermedades, como: la diarrea asociada a antibióticos, el síndrome del intestino irritable y la enfermedad inflamatoria intestinal.
11. Smith K, McCoy KD, Macpherson AJ. Use of axenic animals in studying the adaptation of mammals to their commensal intestinal microbiota. Semin Immunol. 2007, 19: 59-69.
Los autores evidencian la importancia de la microbiota comensal para el correcto desarrollo físico e inmunológico de animales de experimentación, observando las alteraciones en los procesos fisiológicos e inmunológicos en estos modelos libres de gérmenes y los cambios que se producen en los mismos una vez que son colonizados con bacterias comensales.
12.** Hsiao WW, Metz C, Singh DP, Roth J. The microbes of the intestine: an introduction to their metabolic and signaling capabilities. Endocrinol Metab Clin North Am. 2008, 37: 857-71.
En este trabajo, se resumen los avances en el campo de las interacciones que se producen entre la microbiota, tanto entre sí, como con los patógenos, el epitelio colónico y el sistema inmunológico. Además, se evidencian otras funciones metabólicas desarrolladas por la microflora intestinal en beneficio del hospedador.
13. Morrison DJ, Mackay WG, Edwards CA, Preston T, Dodson B, Weaver LT. Butyrate production from oligofructose fermentation by the human faecal flora: what is the contribution of extra-cellular acetate and lactate? Br J Nutr. 2006; 96: 570-77.
Los autores ponen de manifiesto la capacidad de la flora comensal de fermentar los restos hidrocarbonados y producir ácidos orgánicos, como el acetato, butirato y propionato, que reducen el pH intestinal contribuyendo con ello a evitar el establecimiento y proliferación de la flora patógena.
14. Bauerl C, Pérez-Martínez G, Yan F, Polk DB, Monedero V. Functional Analysis of the p40 and p75 Proteins from Lactobacillus casei BL23. J Mol Microbiol Biotechnol. 2010; 19: 231-41.
Estudian el Lactobacillus casei/paracasei y cepas de Lactobacillus rhamnosus como modelos que llevan dos genes que codifican homólogos del p40 y p75 del L. rhamnosus GG, dos proteínas secretadas que muestran efectos protectores anti-apoptóticos en las células epiteliales intestinales humanas, relacionadas, además, con la actividad hidrolasa de la pared celular y con otras funciones, como la unión a mucina, el colágeno y las células epiteliales intestinales y la estimulación de la producción del factor de crecimiento epidérmico en el intestino del ratón.
15. Lebeer S, Verhoeven TL, Francius G, et al. Identification of a Gene Cluster for the Biosynthesis of a Long, Galactose-Rich Exopolysaccharide in Lactobacillus rhamnosusGG and Functional Analysis of the Priming Glycosyltransferase. Appl Environ Microbiol. 2009; 75: 3554-63.
Los polisacáridos de la superficie celular tienen un papel establecido como factor de virulencia en bacterias patógenas humanas. Menos documentadas son la biosíntesis y las funciones biológicas de los polisacáridos de superficie en bacterias beneficiosas. Se identificó un grupo de genes que codifican las enzimas y proteínas reguladoras y transportadoras para los diferentes pasos en la biosíntesis de polisacáridos extracelulares, exopolisacáridos, de la cepa probiótica Lactobacillus rhamnosus GG. Ahora se sabe que estos polisacáridos de superficie ejercen funciones importantes en varias etapas durante la patogénesis, incluida la adhesión de tejidos, la formación de biopelículas y la evasión de las defensas del huésped como la fagocitosis. Además de su papel en los agentes patógenos, tienen una importante función biológica, demostrada recientemente, en la colonización del intestino por bacterias, tanto patógenas como probióticas.
16. Serrano Hernández A. Células colaboradoras (TH1, TH2, TH17) y reguladoras (Treg, TH3, NKT) en la artritis reumatoide. Reumatol Clin. 2009; 5 (S1): 1-5.
Artículo que repasa profundamente las distintas poblaciones de linfocitos y sus interacciones en la respuesta inmunológica.
17.** Guzmán Masías K. La inmunidad innata y los receptores tipo Toll (TLR’S). Sistema de Revisiones en Investigación Veterinaria de San Marcos 2010: 1-10.
Trabajo de revisión muy clarificador para entender la importancia y el papel que estos receptores de patrones asociados a patógenos tienen en la inmunidad innata.
18.** Bernardo D. Células dendríticas del intestino humano como controladoras de la inmunidad mucosa. Rev Esp Enferm Dig. 2013; 105, 5: 279-90.
Interesante artículo donde se evidencia el papel de las células dendríticas como elemento clave en la conexión entre la inmunidad innata y las respuestas de la inmunidad adaptativa. En el intestino, las células dendríticas controlan los mecanismos de la tolerancia inmunológica frente a los antígenos de la dieta y/o la flora comensal, a la vez que son capaces de iniciar una respuesta inmunológica activa en presencia de un patógeno invasor.
19.*** World Gastroenterology Organisation (WGO). Probióticos y prebióticos. En: Guías Mundiales de la Organización Mundial de Gastroenterología (monografía en Internet). Octubre 2011. Disponible en: http://www.worldgastroenterology.org/probiotics-prebiotics.html.
Se trata de un documento práctico que sirve de guía sobre la definición, nomenclatura, dosificación, fabricantes, propiedades e indicaciones específicas reconocidas, con su grado de evidencia científica del uso de prebióticos y probióticos.
20. Timmerman HM, Koning CJ, Mulder L, Rombouts FM, Beynen AC. Monostrain, multistrain and multi-species probiotics –a comparison of functionality and efficacy. Int J Food Microbiol. 2004; 96: 219-33.
En este artículo, se evidencia la superior eficacia de la combinación de varios probióticos a utilizarlos individualmente, dado que muchas de sus funciones se complementan entre sí.
21.** Gibson GR, Probert HM, Van Loo JAE, Rastall RA, Roberfroid MB. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics. Nutr Res Rev. 2004; 17: 257-9.
En este trabajo, se revisa el concepto de prebióticos en cuanto a las propiedades de resistencia a la digestión en los primeros tramos del intestino, la fermentación por la microflora intestinal, la estimulación selectiva del crecimiento de bacterias promotoras de bienestar y salud, y la posibilidad de producir cambios específicos de la microflora comensal mediante el uso de los mismos.
22. Chirdo GF, Menéndez MA, Pita Martín de Portelac LM, et al. Prebiotics in infant health. Arch Argent Pediatr. 2011; 109(1): 49-55.
Este artículo de revisión de sencilla lectura, es una puesta al día de la composición química de los prebióticos y sus beneficios, así como sus utilidades en diferentes procesos, al añadirlos a las leches adaptadas.
| Caso clínico |
|
Historia actual Niño de 8 años y un mes de edad que consulta por cuadro de, al menos, dos meses de evolución, consistente en dolor abdominal de tipo cólico y carácter intermitente, mesogástrico, acompañado de heces de consistencia variable, diarreicas (Bristol 6-7) y, en otras ocasiones, algo más duras (Bristol 4-5), en número de 2-3/día, no vómitos. Tolera alimentación aceptablemente, rechazo parcial de la leche, vomita solo el desayuno si toma leche, pero sí tolera yogures. Antecedentes personales RN AEG: 2.950 g de peso y 40 semanas de gestación; APGAR 9/9: parto eutócico. Vacunado correctamente para su edad, incluyendo dos dosis de varicela y cuatro de antineumocócica. No acudió a guardería. El hábito intestinal ha sido, desde siempre, algo irregular, pasando periodos de estreñimiento, que han cedido con medidas dietéticas y educativas, y otros de heces más blandas, pero nunca tan diarreicas y frecuentes como las actuales. Desde que inicia la escolarización a los 3 años, ha presentado diferentes cuadros infecciosos sin mucho interés, salvo una neumonía a los 4 años y 4 meses, que no precisó ingreso hospitalario; amigdalitis en las que se ha indicado tratamiento antibiótico, 1-2 por año, la última hace dos semanas, tratada durante 10 días con Fenoximetilpenicilina potásica 500 mg/12 horas v.o.; sinusitis, al menos 2, en este periodo, la última hace un mes y medio, que recibió tratamiento con amoxicilina clavulánico a dosis de 80 mg/kg/día v.o. durante 10 días; al menos, 3 otitis que precisaron tratamiento antibiótico, hace dos meses y medio, terminó el tratamiento de la última, para lo cual se utilizó cefuroxima axetilo a dosis de 30 mg/kg/día durante 10 días. Exploración Peso: 25 kg (Pc 25-50), talla: 131 cm (Pc 50-75). Hábito externo: niño de apariencia sana y complexión delgada. A destacar: rinorrea seromucosa; hipertrofia de cornetes; otoscopia: ambos tímpanos deslustrados con cierta retracción; amígdalas hipertróficas grado 2/4; muguet en mucosa de mejilla; auscultación respiratoria: ruidos de transmisión de vía alta, insuficiencia parcial de respiración nasal con muy buena ventilación pulmonar; auscultación cardiaca: ruidos cardiacos normales sin sobreañadidos y rítmicos; y abdomen blando, depresible, con ruidos intestinales presentes, sin visceromegalias ni adenías por el resto de la economía. Exámenes complementarios Hemograma completo y perfil bioquímico normales; estudio de inmunoglobulinas (IgG e IgM normales, IgA 40 mg/dl (54-221) hipoIgA); Rast PLV, huevo, frutos secos y pescados: negativo; Ac IgA antitransglutaminasa y antigliadina: negativos; orina anormales y sedimentos negativos; en heces: coprocultivo, parásitos, sangre oculta y eosinofilia, negativos.
|