|
| Temas de FC |
E. Ramos Boluda
Servicio de Gastroenterología Infantil. Hospital Universitario La Paz. Madrid
| Resumen
El término gastritis es un concepto histológico que hace referencia a un proceso inflamatorio de la mucosa gástrica. En ocasiones, está asociado al concepto de enfermedad péptica, aunque no siempre es así. Las úlceras pépticas son lesiones de la mucosa de mayor o menor profundidad. Pueden afectar a la mucosa gástrica o duodenal. Una de las causas más frecuentes de gastritis y enfermedad péptica en el niño es la infección por Helicobacter pylori. El papel del H. pylori en otros cuadros diferentes de la enfermedad péptica es, en ocasiones, controvertido. Por otra parte, la hemorragia digestiva puede ser alta (sangrados proximales al ángulo de Treitz) o baja (distales al mismo). En el caso de la hemorragia digestiva alta, la manifestación puede ser hematemesis o melena, mientras que el sangrado bajo puede presentarse como rectorragia, hematoquecia o melenas. En este trabajo, se revisan las causas más frecuentes de estas entidades |
| Abstract
The term gastritis refers to an inflammatory condition of the gastric mucosa. It is sometimes associated with the concept of peptic disease, although it is not always like that. Peptic ulcers are mucosal lesions of varying depth. They can affect gastric or duodenal mucosa. One of the most common causes of gastritis and peptic disease in children is infection with Helicobacter pylori. The role of H. pylori in other entities different from peptic disease is sometimes controversial. Gastrointestinal bleeding can be upper bleeding (above the ligament of Treitz) or lower (distal to this structure). In upper gastrointestinal bleeding, the manifestation can be hematemesis or melena, while the lower can be revealed in rectal bleeding, hematochezia or melena. In this manuscript we review the most frequent causes of these affections |
Palabras clave: Gastritis; Úlcera; Hematemesis; Melena; Rectorragia
Key words: Gastritis; Ulcer; Hematemesis; Melena; Rectorrhagia
Pediatr Integral 2015; XIX (2): 83-91
Gastritis, úlcera y hemorragia digestiva
Gastritis y enfermedad ulcerosa péptica
Introducción
El término gastritis debe hacer referencia exclusivamente a un criterio histológico. La causa más frecuente de úlcera péptica en el niño es la infección por Helicobacter pylori.
El término gastritis es, con frecuencia, utilizado de forma indebida. A menudo, el clínico lo utiliza para hacer referencia a un cuadro clínico consistente en epigastralgia o dispepsia y los radiólogos para referirse a cambios inespecíficos en la imagen radiológica. No obstante, la gastritis debe referirse exclusivamente a criterios histológicos y, por definición, consiste en la aparición de un infiltrado inflamatorio en la mucosa gástrica. A pesar de todo, por extensión, muchas veces engloba trastornos gástricos que cursan con lesión de la mucosa de índole no inflamatoria y que, siendo estrictos en la nomenclatura, deben ser englobados dentro del concepto de gastropatía. Otros términos en relación con la patología gástrica son: erosión, que es una lesión de la mucosa gástrica que no alcanza la muscularis mucosae, frente a la úlcera, que se extiende más allá de ella. Han sido varias las clasificaciones que se han hecho, las más conocidas son las de Sidney(1) y la de Dohil et al(2). En las tablas I y II se muestran ambas. La clasificación de Sidney tiene una utilidad limitada en Pediatría, ya que la base de la misma es la existencia de atrofia y/o metaplasia, hechos excepcionales en los niños. La de Dohil, en cambio, se trata de una clasificación específicamente pediátrica.
Respecto a la enfermedad ulcerosa, se clasifica en primaria y secundaria. La causa más frecuente de úlcera primaria en la edad pediátrica es, con diferencia, la infección por Helicobacter pylori. Generalmente, aparece en niños mayores de 10 años, se localiza habitualmente en el duodeno y suele ser de curso crónico. Otras causas de úlcera primaria son: cuadros de hipersecrección, como el síndrome de Zollinger-Ellison, hiperplasia de células G, mastocitosis, etc., todas ellas excepcionales en niños. Las úlceras secundarias suelen ser agudas, tienen lugar en niños más pequeños y aparecen en estómago o duodeno indistintamente. En el caso de neonatos o lactantes, la mayor parte de las úlceras son secundarias, de localización gástrica y en relación con situaciones de estrés (sepsis, traumatismos, quemaduras, etc.).
Dada la importancia por su frecuencia de la infección por H. pylori, vamos a exponer con más detalle esta entidad, haciendo una breve descripción del resto de los cuadros clínicos.
Infección por Helicobacter pylori
Introducción
La infección por H. pylori se ha asociado con el desarrollo de gastritis, enfermedad ulcerosa y algunos tumores gástricos.
El Helicobacter pylori es una bacteria espiriforme gram negativa. Su asociación con la gastritis antral del adulto fue descrita en 1983 por Warren y Marshall(3). Coloniza mucosa gástrica no solo localizada en el estómago, sino también ectópica, como el esófago de Barret o el divertículo de Meckel. En adultos, la infección por H. pylori se ha asociado con la aparición de gastritis crónica activa, enfermedad ulcerosa y tumores, como el adenocarcinoma gástrico o el linfoma del tejido linfoide asociado a la mucosa gástrica (MALT)(4). Asimismo, también, se ha relacionado con cuadros extradigestivos, como: fallo de medro, anemia ferropénica o púrpura trombocitopénica idiopática (PTI)(5).
Epidemiología
La infección por H. pylori está ampliamente extendida. El mecanismo de transmisión no está bien establecido.
Afecta aproximadamente al 50% de la población mundial(6), aunque puede llegar al 80% en países en vías de desarrollo(7) o en pacientes institucionalizados. El hombre es el reservorio natural de esta bacteria y la transmisión se produce de persona a persona (fecal-oral, gastro-oral u oral-oral). El agua contaminada por residuos fecales podría constituir un reservorio ambiental(8). No obstante, el mecanismo de transmisión no está bien establecido. La infección se adquiere frecuentemente en la infancia, sobre todo, antes de los 5 años de edad. Una vez conseguida la erradicación, la reinfección es rara (menor del 2% al año).
Fisiopatología
Tras la infección, se produce una inflamación de la mucosa que solo produce sintomatología en un 20-30% de los infectados.
Una vez que la infección se ha establecido, se produce una inflamación de la mucosa gástrica con un predominio de la localización antral. No está claro por qué solo se produce infección sintomática en un 20-30% de las personas infectadas. Se cree que influyen factores como: la virulencia del germen, factores propios del huésped y factores ambientales. Un factor determinante en la virulencia del germen es su capacidad para producir ureasa, ya que le confiere resistencia frente al ácido gástrico. La presencia en la bacteria del gen asociado a citotoxina (CagA) o la habilidad para producir citotoxina vacuolizante (VacA), también favorecen el desarrollo de patología asociada a la infección. En adultos, a veces, se produce una gastritis predominantemente corporal con el desarrollo de una gastritis atrófica y una hipoclorhidria. Esta situación favorecería la aparición de metaplasia intestinal y el consiguiente aumento en el riesgo de desarrollar adenocarcinoma. Este acontecimiento es más frecuente cuando existen antecedentes familiares de dicha patología y cuanto más prolongada es la infección.
Clínica
La úlcera duodenal se manifiesta fundamentalmente como dolor epigástrico. No parece existir relación entre la infección y el dolor abdominal recurrente funcional.
La presencia de úlcera duodenal se manifiesta, habitualmente, como un cuadro de dolor abdominal de localización preferentemente epigástrica, aunque no de forma exclusiva, sobre todo en preescolares, y que frecuentemente provoca despertares nocturnos. A veces, se acompaña de vómitos. La relación del dolor con la ingesta es menos evidente en los niños que en los adultos. La existencia de antecedentes familiares apoyaría el diagnóstico, basado más en factores ambientales comunes que genéticos (es más frecuente entre cónyuges y en personas institucionalizadas). La aparición de hematemesis sería altamente sugestiva del cuadro.
Aunque la infección por H. pylori está presente en más del 90% de los niños diagnosticados de úlcera duodenal, solo un pequeño número de pacientes infectados por el germen desarrollan esta complicación (menos de un 5% de los niños menores de 12 años y el 10% de los adolescentes con síntomas e infección por Helicobacter, presentaron enfermedad ulcerosa en un estudio multicéntrico europeo)(9). Este riesgo es mayor en los pacientes que reciben tratamiento crónico con antiinflamatorios no esteroideos. Hay poca evidencia de que el H. pylori provoque síntomas en ausencia de úlcera.
Se ha hablado mucho de la asociación entre infección por H. pylori y dolor abdominal recurrente (DAR), definido inicialmente por Apley(10) y, posteriormente, modificado según los criterios de Roma(11,12). Numerosos trabajos muestran una ausencia de relación entre ambos cuadros clínicos. La evidencia de la ausencia de asociación es menor cuando el dolor es de localización epigástrica, pudiéndose englobar dentro del cuadro denominado dispepsia; de tal forma que se ha visto que los niños referidos al gastroenterólogo por epigastralgia, tienen entre 2 y 3 veces más probabilidad de tener infección por H. pylori que el resto de los niños(13). También, se ha especulado con la posible influencia de la infección por Helicobacter y la sintomatología, severidad y respuesta a tratamiento de los pacientes que presentan enfermedad por reflujo gastroesofágico (ERGE).
Se ha asociado la infección por Helicobacter con cuadros extradigestivos. Uno de estos cuadros es la anemia ferropénica refractaria. Se postulan diversos mecanismos. Inicialmente, se pensó que se debería a una pérdida hemática oculta mantenida en relación con la existencia de gastritis, pero este hecho no se ha confirmado. Parece estar más relacionado con la interferencia de la bacteria en el metabolismo del hierro, ya que requiere de su presencia para su crecimiento, compitiendo con el huésped por el hierro de la dieta. También, la hipoclorhidria que, en ocasiones, podría impedir la reducción del hierro necesaria para su absorción (esto sería más propio del adulto). Varios estudios han confirmado la respuesta de la ferropenia al tratamiento erradicador, mientras que los suplementos de hierro solos, no fueron efectivos. La relación de otros cuadros hematológicos, como la púrpura trombopénica idiopática (PTI), está menos establecida, sobre todo en el caso de la población pediátrica.
También se ha asociado al desarrollo de adenocarcinoma gástrico y linfoma MALT. Según algunos estudios, el tratamiento erradicador del Helicobacter disminuiría el riesgo de desarrollar adenocarcinoma en los pacientes que no han desarrollado lesiones precancerosas (gastritis atrófica o metaplasia intestinal), no teniendo ningún efecto, si estas lesiones ya se han establecido. En el caso del linfoma MALT, el tratamiento erradicador conduce a la remisión en un porcentaje muy significativo de los casos.
La asociación con otras manifestaciones extradigestivas, como el retraso ponderoestatural, las alergias alimentarias o el síndrome de muerte súbita del lactante, está insuficientemente documentada en el momento actual.
Diagnóstico
La detección de la infección por Helicobacter no indica la necesidad de tratamiento. Está indicado en caso de úlcera y anemia refractaria. No está indicado en asintomáticos. Otras indicaciones son más controvertidas.
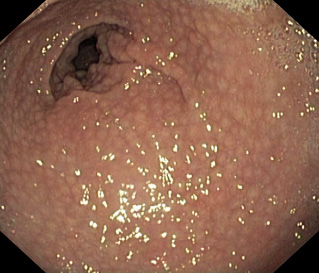
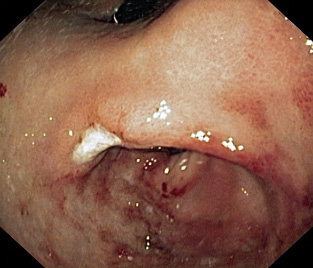
La prueba diagnóstica de referencia es la endoscopia con toma de muestras para examen histológico y/o cultivo. Permite diagnosticar la existencia de gastritis o úlcera péptica. Se ha descrito que el aspecto “en empedrado” de la mucosa antral es altamente sugestivo de gastritis por infección por Helicobacter en el niño (Fig. 1). La úlcera muestra un aspecto inespecífico (Fig. 2). Deben realizarse varias tomas de muestras de diferentes zonas para aumentar la sensibilidad de la prueba, ya que la afectación puede ser parcheada. El examen histológico con tinción de Giemsa o de plata permite la visualización de formas compatibles con el germen. El cultivo de la mucosa es algo dificultoso, pero permite la realización de antibiograma. Debe realizarse la siembra de forma inmediata y, a veces, exige tiempos de crecimiento largos, sobre todo, en niños, en los que el número de colonias suele ser menor. El test de la ureasa en la mucosa se basa en la capacidad que tiene el germen en hidrolizar la urea. Es un test rápido y sencillo de realizar. Es bastante sensible en adultos, pero no tanto en niños, por la misma razón que el cultivo. Aunque la endoscopia sigue siendo la prueba de elección para el diagnóstico de enfermedad por Helicobacter, por ser invasiva tienden a utilizarse otros métodos diagnósticos en determinadas ocasiones.
Figura 1. Aspecto típicamente “en empedrado” de la mucosa gástrica antral en el niño infectado por H. pylori
Figura 2. Úlcera gástrica.
El test del aliento con urea marcada con13C ha demostrado utilidad en el diagnóstico de la infección por Helicobacter. Posee una alta sensibilidad (>96%) y especificidad (>97%). Es difícil de realizar en niños menores de 3 años, por precisar un mínimo de colaboración y por el elevado número de falsos positivos por debajo de los 6 años, por producción de ureasa por los gérmenes orales en este grupo de edad. Es en estos casos en los que algunos autores recomiendan la determinación de antígeno en heces mediante anticuerpos monoclonales. Es importante resaltar que estas pruebas no invasivas indican infección por Helicobacter pylori, no enfermedad ulcerosa, por lo que no servirían para hacer la indicación de tratamiento. La endoscopia tiene la ventaja de diagnosticar la gastritis o úlcera y descartar otras causas que expliquen la clínica diferente de la infección por H. pylori (enfermedad inflamatoria, gastritis eosinofílica, esofagitis, etc.).
Es importante indicar que para la obtención de unos resultados fiables en estas pruebas, debe evitarse el uso de antibióticos en las 4 semanas previas a la prueba y de antiácidos, fundamentalmente inhibidores de la bomba de protones (IBPs), 2 semanas antes.
La serología (IgG) frente a H. pylori no se considera de utilidad. La seroconversión es tardía y permanece positiva años después de la erradicación. Además, sus valores no están estandarizados en el niño.
Una vez establecidas las diferentes pruebas diagnósticas, debe definirse qué pruebas y a quién se deben realizar. Ya hemos dicho que, con las evidencias que existen hasta el momento, no está indicado el tratamiento indiscriminado de la infección por Helicobacter; de tal forma que el objetivo fundamental debe ser determinar la causa de la sintomatología referida, no solo la presencia de la bacteria.
Según las últimas recomendaciones de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN)(14)>, debe considerarse la realización de pruebas de detección de H. pylori en pacientes con anemia ferropénica refractaria, en los que se hayan descartado otras causas y pacientes con antecedentes de cáncer de estómago en familiares de primer grado. No se aconseja su realización en el caso de cuadros de dolor abdominal de características funcionales ni otros cuadros extradigestivos, como infecciones respiratorias, alergias alimentarias, síndrome de muerte súbita del lactante, PTI, retraso ponderoestatural, etc. También aconseja que el diagnóstico inicial se haga mediante la realización de endoscopia con toma de biopsias, basando el diagnóstico de la infección en la obtención de un examen histopatológico positivo, con test de la ureasa positivo o un cultivo positivo. Se aconsejan los métodos no invasivos (test del aliento o determinación de antígeno en heces) para la realización de controles de erradicación. No se consideran útiles otros test diagnósticos.
Otros grupos(15) consideran razonable realizar una estrategia de “test and treat”, que consiste en el diagnóstico de la infección por Helicobacter mediante un test no invasivo y su tratamiento sin realizar endoscopia. Consideran que es apropiado si el riesgo de cáncer es bajo (como sería en el caso de los pacientes pediátricos). Este grupo también acepta el tratamiento de pacientes con cuadros clínicos compatibles con dispepsia funcional, ya que produciría una mejoría de la sintomatología en uno de cada 12 pacientes (más efectivo que cualquier otro tratamiento). También, incluye en este grupo a los pacientes que reciben AINEs o IBPs de forma crónica (incrementaría el riesgo de complicaciones en el caso de los AINEs o del desarrollo de gastritis atrófica en los IBPs) o los que padecen PTI.
En resumen, existe consenso sobre la no indicación en pacientes asintomáticos o con dolor abdominal funcional, retraso de medro y otros cuadros extradigestivos y sobre la recomendación de tratamiento en pacientes con enfermedad ulcerosa y ferropenia refractaria, mientras que el consejo no es unánime en el caso de dispepsia no ulcerosa, gastritis o PTI.
Tratamiento
El tratamiento estándar es la triple terapia con inhibidor de bomba de protones y dos antibióticos.
El tratamiento estándar frente al H. pylori es triple terapia con IBP y dos antibióticos, los más utilizados son: amoxicilina y claritromicina (v. Tabla III y IV). Las tasas de erradicación son muy variables según las regiones, oscilando entre el 50 y el 90%. La duración debe ser entre 7 y 14 días (no hay consenso en este punto, pero la ESPGHAN aconseja 2 semanas).
En el caso de países con alta tasa de resistencia a claritromicina, como es el nuestro, otras pautas han mostrado mayor eficacia, como IBP con amoxicilina y metronidazol, con tasas de curación superiores al 80%.
La pauta secuencial (IBP+amoxicilina durante 5 días seguida de IBP+claritromicina+metronidazol otros 5 días) ha mostrado mayores tasas de éxito según algunos estudios, aunque aún no se ha consolidado como pauta de elección.
Otros tratamientos que incluyen subcitrato de bismuto, levofloxacino o cuádruples terapias, conforman tratamientos de segunda línea.
Por último, y en caso de fracaso de tratamiento, se aconseja cultivo de mucosa gástrica con antibiograma y tratamiento dirigido según el resultado del mismo. El uso de probióticos (Lactobacillus sp) como coadyuvante no está sistematizado en el momento actual.
Otras gastritis
Como ya hemos dicho, en la tabla II se enumeran otras causas de gastritis menos frecuentes en el niño que la asociada a infección por Helicobacter. De todos estos cuadros, vamos a destacar dos entidades que, por su frecuencia en el niño y peculiaridades (gastritis eosinofílica) y por su importancia en el adulto en el otro (gastritis atrófica), merecen mención especial.
Gastritis eosinofílica
El cuadro clínico es atribuido a una hipersensibilización alimentaria. El diagnóstico es histológico y el tratamiento la dieta de exclusión.
La gastritis eosinofílica (GE) forma parte del grupo de trastornos eosinofílicos gastrointestinales. Este grupo incluye, además la esofagitis eosinofílica, la gastroenteritis eosinofílica y la colitis eosinofílica. Excepto en el caso de la esofagitis eosinofílica (que ha sido bien descrita individualizadamente), el resto forma parte de un grupo difícil de caracterizar de forma aislada; ya que, en la mayor parte de los casos, se trata de cuadros solapados en los que los diferentes tramos del tubo digestivo se ven implicados con variable intensidad. La GE consiste en la existencia de eosinofilia en la mucosa gástrica, sin causa sistémica que lo justifique (parasitosis, fármacos, enfermedad inflamatoria intestinal, etc.).
El cuadro se atribuye a una sensibilización a antígeno alimentario, bien por un mecanismo IgE o no IgE mediado. De hecho, un porcentaje importante de pacientes asocian historia de atopia o de alergias alimentarias. El antígeno más frecuentemente implicado es la proteína de leche de vaca, seguido de trigo, huevo y frutos secos. Es más frecuente en los primeros 6-12 meses de vida.
Las manifestaciones clínicas son muy variables, aunque el dolor abdominal, los vómitos y la hemorragia digestiva son los síntomas más frecuentes. La eosinofilia en sangre periférica no es constante y se observa, aproximadamente, en un 25-50% de los casos.
El diagnóstico se basa en la sospecha clínica con exploración endoscópica (el aspecto endoscópico es inespecífico, con: eritema, erosiones, edema, etc.) y toma de muestras para examen histológico, donde se confirmará el infiltrado eosinófilo.
El tratamiento consiste en la dieta de supresión basada en el estudio alérgico o empírico. En el caso de lactantes, unos de los grupos más frecuentemente afectados, se utilizan fórmulas extensamente hidrolizadas, o elementales en aquellos casos sin respuesta a estas. En general, el trastorno es transitorio, similar a otras manifestaciones de la alergia a proteínas de leche de vaca, y su manejo también es similar.
Gastritis atrófica
En niños, los cuadros más frecuentes son: la anemia perniciosa y la gastritis asociada a enfermedades autoinmunes.
Se define atrofia de la mucosa gástrica, como la pérdida del tejido glandular.
La gastritis atrófica de la clasificación de Sidney del adulto(1) se corresponde con la anemia perniciosa y la gastritis de las enfermedades autoinmunes de la clasificación de Dohil en los niños(2) (Tablas I y II).
En el adulto, es frecuente también, la gastritis atrófica asociada a la infección por H. pylori, hecho excepcional en el niño. Es de localización predominantemente antral, se corresponde con la nomenclatura clásica gastritis crónica tipo B y, a menudo, se acompaña del desarrollo de metaplasia intestinal, que predispone al desarrollo de adenocarcinoma gástrico.
La anemia perniciosa, llamada también gastritis tipo A, es una gastritis atrófica resultado de un proceso autoinmune que afecta a las glándulas oxínticas, produciéndose anticuerpos anti-células parietales y anti-factor intrínseco. Afecta fundamentalmente al cuerpo y fundus (no al antro) y el resultado es una hipoclorhidria con hipergastrinemia y anemia por déficit de vitamina B12, por alteración de la absorción de la misma, que precisa el factor intrínseco. Coexiste frecuentemente con otras enfermedades autoinmunes, como tiroiditis, diabetes o vitíligo. El riesgo de desarrollar neoplasias está también aumentado, por lo que está indicado hacer controles endoscópicos periódicos.
La gastritis asociada a enfermedades autoinmunes es una gastritis atrófica que se distingue de la anterior en que el infiltrado inflamatorio es más intenso y persistente, no se acompaña de hiperplasia de células enterocromafines, por lo que no presenta hipergastrinemia, y afecta a cuerpo y antro. Al igual que en los cuadros anteriores está aumentado el riesgo de desarrollo de neoplasia.
Hemorragia digestiva
La hemorragia digestiva es la emisión de sangre acompañando al vómito o a través del ano. Es importante establecer la existencia del sangrado y su origen.
Se define hemorragia digestiva, como la emisión de sangre acompañando al vómito o a través del ano. Conviene, en primer lugar, definir los términos con los que nos referimos a la hemorragia digestiva. La emisión de sangre roja o digerida (oscura) mezclada con el vómito recibe el nombre de hematemesis. Existen varios términos para referirse al sangrado rectal. La rectorragiase define como la emisión de sangre roja por el ano, con o sin emisión de heces. La hematoquecia, en cambio, se refiere a este mismo tipo de sangrado, pero mezclado con las heces. Por último melena hace referencia a la presencia de sangre oscura (negra) en las heces. A veces, el sangrado es pequeño y se presenta de forma “oculta”. En ese caso, la anemización o ferropenia pueden ser los únicos síntomas.
Las manifestaciones clínicas del sangrado van a depender por una parte de la intensidad, por otra de lo agudo del cuadro (menores manifestaciones clínicas cuanto más crónico es el sangrado) y de la causa del mismo.
El primer reto diagnóstico consiste en confirmar que se trata de sangrado. Algunos alimentos, colorantes y fármacos pueden conferir al contenido gástrico o las heces un aspecto parecido al sangrado (tomate, fresas, colorantes en caso de sospecha de hematemesis, espinacas, bismuto, hierro, etc., en caso de melenas). Tradicionalmente, se ha utilizado el guayacol que es oxidado por el peróxido de hidrógeno contenido en el grupo hemo. Es un test simple y barato, pero tiene sus limitaciones, ya que no es específico de sangre humana puede dar falsos positivos con algunos alimentos como la carne y algunos vegetales (coliflor, melón, brécol, uvas…). La ingesta de hierro no provoca falsos positivos en la prueba. Más recientemente, se han empezado a utilizar técnicas inmunoquímicas, que detectan exclusivamente sangre humana.
El segundo punto es definir si el sangrado es digestivo. Hay que recordar que sangrados como la epistaxis, sangrados orofaríngeos (amígdalas, cavum) o hemoptisis pueden conducir, si son deglutidos, a confusión. A veces, estos sangrados son evidentes, pero en ocasiones, sobre todo los sangrados de vías respiratorias, son difíciles de diagnosticar debido a la dificultad para expectorar de los niños más pequeños, que sistemáticamente degluten las secreciones respiratorias.
Por último, distinguir sangrado digestivo alto y bajo. Se define sangrado digestivo alto, como el que se produce por encima del ángulo de Treitz, y bajo cuando es distal al mismo. La hematemesis es la presentación clásica del sangrado digestivo alto y la rectorragia la del sangrado bajo. La hematoquecia, melena y sangrado oculto pueden presentarse en ambos cuadros. Es en este caso cuando la colocación de una sonda nasogástrica permitiría diagnosticar un sangrado gástrico o esofágico activo, no obstante, no diferencia sangrados bajos de sangrado altos inactivos o duodenales.
Hemorragia digestiva alta
La prioridad es establecer la gravedad y estabilizar al paciente si es preciso. El diagnóstico, en gran parte de los casos, exige la realización de una endoscopia.
El primer paso ante una hemorragia digestiva alta es valorar la repercusión. Obviamente, si el sangrado es agudo y cuantioso puede constituir una emergencia y precisar la estabilización mediante transfusión y otras medidas urgentes. Como hemos dicho, la colocación de una sonda nasogástrica puede ser útil en algunos casos, pero no se aconseja el lavado con suero salino frío, ya que se ha visto que puede producir hipotermia. Una vez estabilizado, o si el sangrado es escaso y sin repercusión, trataremos de establecer un diagnóstico. En la tabla V, se encuentran las causas más frecuentes de sangrado por grupos de edad(16). Hay que señalar que, aunque no aparece reflejada por su benignidad, una de las causas más frecuentes en nuestro medio, en lactantes y niños, es la ingesta de gastroerosivos, como antiinflamatorios no esteroideos (ibuprofeno) en el contexto de viriasis. En general, suele provocar hematemesis de escaso contenido hemático, sin repercusión hemodinámica ni anemización y autolimitada en el tiempo al retirar el fármaco. El diagnóstico es clínico y no exige inicialmente (salvo complicaciones) exploración ni tratamiento alguno, excepto protector gástrico de forma transitoria (antisecretor o antiácido). En la tabla VI, se exponen los antiácidos y antisecretores más utilizados.
En el neonato la causa más frecuente es, con mucho, la ingesta de sangre materna, bien en el canal del parto, bien durante la lactancia por presencia de erosiones en el pezón materno. El diagnóstico es sencillo, mediante el test de detección de hemoglobina fetal (test de Apt), y no precisa tratamiento. El déficit de vitamina K (enfermedad hemorrágica del recién nacido) es también frecuente y fácilmente corregible con la administración de vitamina K intramuscular o intravenosa. Suelen ser sangrados de escasa cuantía, pero hay que tener en cuenta que en este grupo de edad los sangrados provocan repercusión de forma muy precoz, por lo que la vigilancia debe ser estrecha. El resto de las causas son más raras en este grupo de edad.
En el lactante y niño pequeño, las causas más frecuentes son: las gastritis/úlceras por estrés en el enfermo crítico, la alergia a proteína de leche de vaca u otros antígenos alimentarios, la enfermedad péptica (esofagitis, gastritis) y el síndrome de Mallory-Weiss, que es un desgarro de la mucosa esofágica en relación al esfuerzo en los cuadros que cursan con vómitos repetidos. No suelen provocar repercusión y se manifiestan más como irritabilidad o rechazo de tomas. Las lesiones vasculares en cambio, si pueden producir sangrados importantes.
En el niño mayor, las causas más frecuentes son parecidas a las del grupo anterior. Aparecen como causa las varices que, aunque no son frecuentes, si provocan sangrados importantes.
El diagnóstico se basa en el estudio endoscópico, que solo se debe realizar si el paciente está hemodinámicamente estable. La radiología simple aporta poca información y la ecografía puede ser útil para valorar procesos obstructivos o hipertensión portal que condiciona la aparición de varices. La angiografía se puede utilizar en casos seleccionados, pero precisa sangrados importantes (0,5 ml/min) para poder ser detectados.
El tratamiento consiste en la estabilización para los sangrados más graves. En esto, a veces, es útil el empleo de sustancias vasoactivas como el octreotido. En el resto, tratamiento antisecretor o antiácido y de la causa, si es posible. A veces, puede ser preciso terapia endoscópica (esclerosis, coagulación o ligadura de varices) o cirugía si el sangrado es incoercible o la causa lo precisa (obstrucción intestinal, membranas gástrica o duodenal, etc.).
Hemorragia digestiva baja
El aspecto del sangrado puede orientar sobre el origen. Comprende un amplio grupo de entidades de relevancia muy variable.
En el sangrado digestivo bajo, al igual que en alto, lo primero es valorar la repercusión. A veces, es difícil intentar cuantificar el sangrado ya que, frecuentemente, es sobrevalorado por los padres por su efecto alarmante. Una vez establecida la estabilidad hemodinámica, se pasa al diagnóstico etiológico. En la tabla VII, se enumeran las causas más frecuentes de sangrado digestivo bajo, por grupos de edad(17).
Respecto al origen del sangrado, de forma general, se puede decir que cuanto más oscura es la sangre, más proximal es el sangrado. De tal forma que, la emisión de sangre roja aislada, en forma de gotas o con las heces (sin mezclarse) correspondería a sangrados rectales. Si la sangre es roja brillante, pero mezclada con heces indica un posible origen colónico (si va mezclada con moco hay que pensar en un pólipo o en la existencia de colitis). Cuando es algo oscura, es probable que venga de intestino delgado. Estos hallazgos pueden verse modificados si el tránsito es más rápido o más lento de lo normal. Vamos a comentar, de forma muy breve, solo los cuadros más frecuentes.
En el neonato, hay que pensar en la enterocolitis necrosante, proceso isquémico de la mucosa intestinal que cursa con sangrado digestivo, distensión abdominal y alteración del estado general. Es más frecuente en pretérminos. Frecuentemente, se acompaña de traslocación bacteriana de gérmenes de la luz intestinal, que da lugar a cuadros de sepsis. El diagnóstico es clínico con el apoyo de estudios de laboratorio donde se aprecia elevación de reactantes, y radiológico, con la aparición de signos de isquemia intestinal (adelgazamiento de pared, neumatosis intestinal y neumoperitoneo, en caso de perforación). La exploración endoscópica está absolutamente contraindicada. El tratamiento en los casos leves es conservador, con la instauración de soporte nutricional parenteral, antibioterapia y medidas de sostén. Los casos más graves exigen cirugía. El vólvulo, en el contexto de una malrotación, es una urgencia quirúrgica. Se presenta como un cuadro obstructivo con gran alteración del estado general. La sospecha diagnóstica se establece por la radiología, pero la confirmación se realiza en la laparotomía. La proctocolitis alérgica y la enfermedad hemorrágica del recién nacido son cuadros clínicos de curso más benigno y que mejoran al introducir fórmulas extensamente hidrolizadas en un caso, y suplementos de vitamina K en el otro.
En los lactantes y niños más mayores, la causa más frecuente es la fisura anal. Generalmente es secundaria a estreñimiento. El diagnóstico se basa en la historia clínica de defecación dificultosa y dolorosa y en la inspección anal. La colitis infecciosa es también una causa muy frecuente de sangrado, sobre todo, si se acompaña de diarrea y fiebre. Es provocado por gérmenes enteroinvasivos, como: Salmonella, Shigella, Campylobacter, E. coli, etc. El diagnóstico se basa en el cultivo, y el tratamiento es el de cada entidad específica, cuando está indicado. La invaginación intestinal es también frecuente en esta edad. Es un cuadro obstructivo agudo, con afectación del estado general y, a veces, se acompaña de la emisión de heces sanguinolentas. El diagnóstico es radiológico y el tratamiento, que constituye una urgencia, es la reducción neumática o hidrostática, o quirúrgica en los casos fallidos. Hay que tener en cuenta que, si la invaginación se produce en niños mayores de 2 años, hay que pensar en una causa favorecedora, como: una hiperplasia linfoide, un pólipo, etc. El divertículo de Meckel es una malformación congénita consistente en una persistencia del conducto onfalomesentérico en el íleon terminal. Aproximadamente, la mitad contienen mucosa gástrica ectópica, que puede ulcerarse y es el origen del sangrado, que a veces es importante y con anemización. La rectorragia, en este caso, es típicamente indolora. El diagnóstico se hace mediante gammagrafía con pertecnectato Tc99 y el tratamiento es quirúrgico. Por último, la hiperplasia folicular linfoide es un cuadro clínico muy frecuente, manifestación de la hiperrespuesta linfoide del niño. Es una hiperplasia de los folículos linfoides de la mucosa del colon. Son sangrados escasos, sin repercusión y autolimitados. Es más frecuente en caso de alergia alimentaria, parasitosis o déficit de IgA. El diagnóstico es endoscópico y no precisa tratamiento.
En los niños mayores, además de los anteriormente comentados, aparecen los pólipos. En el niño, los más frecuentes son los pólipos juveniles, hamartomatosos, benignos, habitualmente solitarios y con escasa sintomatología. El diagnóstico es endoscópico e histológico y el tratamiento es la resección mediante endoscopia con asa de diatermia. A veces, se producen autoamputaciones. En ocasiones, los pólipos forman parte de una poliposis generalizada, muchas de ellas familiares, adenomatosas y con potencial capacidad de malignización, por lo que el correcto diagnóstico de estas entidades es crucial, ya que está indicada la vigilancia endoscópica periódica. Otras causas de sangrado son: la púrpura de Schönlein-Henoch, el síndrome urémico-hemolítico y la enfermedad inflamatoria intestinal, que suele llevar aparejados otros síntomas de la enfermedad de base.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney system. International workshop on the histopathology of gastritis, Houston 1994. Am J Surg Pathol. 1996; 20(10): 1161-1181.
2.*** Dohil R, Hassall E, Jevon G, Dimmick J. Gastritis and gastropathy of childhood. J Pediatr Gastroenterol Nutr. 1999; 29(4): 378-394.
3. Warren JR, Marshall B. Unidentified curved bacilli on gastric epithelium in active chronic gastritis. Lancet. 1983; 1(8336): 1273-1275.
4. Moss SF, Malfertheiner P. Helicobacter and gastric malignancies. Helicobacter. 2007; 12 Suppl 1: 23-30.
5. Suzuki T, Matsushima M, Masui A, et al. Effect of Helicobacter pylori eradication in patients with chronic idiopathic thrombocytopenic purpura-a randomized controlled trial. Am J Gastroenterol. 2005; 100(6): 1265-1270.
6. Logan RP, Walker MM. ABC of the upper gastrointestinal tract: Epidemiology and diagnosis of Helicobacter pylori infection. BMJ. 2001; 323(7318): 920-922.
7. Ozen A, Ertem D, Pehlivanoglu E. Natural history and symptomatology of Helicobacter pylori in childhood and factors determining the epidemiology of infection. J Pediatr Gastroenterol Nutr. 2006; 42(4): 398-404.
8.*** Horvitz G, Gold BD. Gastroduodenal diseases of childhood. Curr Opin Gastroenterol. 2006; 22(6): 632-640.
9. Koletzko S, Richy F, Bontems P, et al. Prospective multicentre study on antibiotic resistance of Helicobacter pylori strains obtained from children living in europe. Gut. 2006; 55(12): 1711-1716.
10.** Apley J, Naish N. Recurrent abdominal pains: A field survey of 1.000 school children. Arch Dis Child. 1958; 33(168): 165-170.
11.*** Hyman PE, Milla PJ, Benninga MA, Davidson GP, Fleisher DF, Taminiau J. Childhood functional gastrointestinal disorders: Neonate/toddler. Gastroenterology. 2006; 130(5): 1519-1526.
12.*** Rasquin A, Di Lorenzo C, Forbes D, et al. Childhood functional gastrointestinal disorders: Child/adolescent. Gastroenterology. 2006; 130(5): 1527-1537.
13.*** Spee LA, Madderom MB, Pijpers M, van Leeuwen Y, Berger MY. Association between Helicobacter pylori and gastrointestinal symptoms in children. Pediatrics. 2010; 125(3): e651-69.
14.*** Koletzko S, Jones NL, Goodman KJ, et al. Evidence-based guidelines from ESPGHAN and NASPGHAN for Helicobacter pylori infection in children. J Pediatr Gastroenterol Nutr. 2011; 53(2): 230-243.
15.*** Malfertheiner P, Megraud F, O’Morain CA, et al. Management of Helicobacter pylori infection – the Maastricht IV/Florence consensus report. Gut. 2012; 61(5): 646-664.
16. Gilger MA. Gastrointestinal bleeding. Upper gastrointestinal bleeding. In: Walker W, Sherman P, Goulet Oea, eds. Pediatric Gastrointestinal Disease. Fourth ed. Ontario. Canada. BC Decker Inc.; 2004: 258-265.
17. Turk D, Michaud L. Gastrointestinal bleeding. Lower gastrointestinal bleeding. In: Walker WA, Sherman PM, Goulet Oea, eds. Pediatric Gastrointestinal Disease. Fourth edition ed. Ontario. Canada: BC Decker Inc; 2004: 266-280.
18.** Boyle JT. Gastrointestinal bleeding in infants and children. Pediatr Rev. 2008; 29(2): 39-52.
Bibliografía recomendada
- Dohil R, Hassall E, Jevon G, Dimmick J. Gastritis and gastropathy of childhood. J Pediatr Gastroenterol Nutr. 1999; 29(4): 378-394.
Clasificación de la gastritis atrófica del niño, adaptación de la del adulto (clasificación de Sydney). Aproximación a los cuadros más frecuentes.
- Spee LA, Madderom MB, Pijpers M, van Leeuwen Y, Berger MY. Association between Helicobacter pylori and gastrointestinal symptoms in children. Pediatrics. 2010; 125(3): e651-69.
Magnífica revisión del papel del Helicobacter pylori en diferentes cuadros clínicos frecuentes en Pediatría.
- Koletzko S, Jones NL, Goodman KJ, et al. Evidence-based guidelines from ESPGHAN and NASPGHAN for Helicobacter pylori infection in children. J Pediatr Gastroenterol Nutr. 2011; 53(2): 230-243.
- Malfertheiner P, Megraud F, O’Morain CA, et al. Management of Helicobacter pylori infection – the Maastricht IV/Florence consensus report. Gut. 2012; 61(5): 646-664.
- Bourke B, Ceponis P, Chiba N et al. Canadian Helicobacter Study Group Consensus Conference: Update on the approach to Helicobacter pylori infection in children and adolescents – an evidence-based evaluation. Can. J. Gastroenterol. 2005; 19(7): 399-408.
Tres guías de manejo de la infección por Helicobacter, indicación de pruebas diagnósticas, indicación de tratamiento y diferentes pautas erradicadoras. Se pone de manifiesto la unanimidad en algunos criterios y el desacuerdo en otros.
| Caso clínico |
|
Lactante de 5 meses que acude a urgencias por presentar un cuadro de vómitos de unos 6-7 episodios al día y de unas dos semanas de evolución. Inicialmente, se acompañaban de restos hemáticos escasos, que han ido en aumento, motivo por el que ingresa para valoración y estudio. Refiere, asimismo, heces oscuras y fétidas. Curva ponderal ascendente. Antecedentes personales Embarazo controlado de curso normal. Parto vaginal a término. PRN: 3.450 g. Periodo neonatal sin incidencias. Lactancia mixta desde el nacimiento, con fórmula de inicio y fórmula antirreflujo. Diversificación no iniciada. Antecedentes familiares Primera hija de padres sanos no consanguíneos. Sin antecedentes familiares de interés. Exploración física P: 8.500 g (P97); Talla: 64 cm (P50). BEG. Bien nutrida e hidratada. Buena coloración de piel y mucosas. Lesiones eccematosas hipocrómicas generalizadas. ACP: normal. Tonos puros y rítmicos, sin soplos. Abdomen: blando, depresible, no distendido. No masas ni megalias. Neurológico: normal. Fontanela normotensa. Exploraciones complementarias Hemograma: Leucocitos: 16.700 (24,9% neutrófilos; 56,4% linfocitos; 14,2% monocitos; 4,4% eosinófilos); Hematíes: 5.290.000; Hb: 11,4 g/dl; Hto: 34,5%; plaquetas: 773.000. Bioquímico: Glucosa: 109 mg/dl; Urea: 15 mg/dl; Creatinina: 0,3 mg/dl; Proteínas totales: 6,7 d/dl; Ca: 9,6 mg/dl; Na: 136 mEq/l; K: 4,1 mEq/l; Cl: 102 mEq/l; AST: 17 UI; ALT: 27 UI; Bilirrubina total: 0,1 mg/dl; PCR: 5 mg/dl. Gasometría venosa: pH: 7,39; pO2: 61,2 mmHg; pCO2: 43,5 mmHg; HCO3–: 25,6; EB: 0,5. E. coagulación: T. protrombina: 11,7; Act. protrombina: 103%; INR: 1; TTPA: 27,9´´; Ratio: 0,9; Fibrinógeno: 690 mg/dl. IgE específica frente a proteínas de leche de vaca (CAP) y prick test: negativos. Esofagogastroduodenoscopia: Mucosa esofágica sin alteraciones. Línea Z a nivel. Buena coaptación de cardias por retro. Mucosa gástrica de fórnix, cuerpo y antro intensamente eritematosa, edematosa y friable con erosiones, hemorragias mucosas y exudado fibrinoso. Píloro edematoso. Mucosa de bulbo y segunda porción duodenal edematosa y nodular. Tercera y cuarta porciones duodenales sin alteraciones. Diagnóstico endoscópico: gastroduodenitis aguda erosiva. Biopsia de antro gástrico: mucosa gástrica con erosiones y abundante infiltrado eosinófilo. Biopsia duodenal: mucosa duodenal con atrofia parcial ligera de las vellosidades y leve inflitrado eosinófilo. Tratamiento y evolución A su ingreso, tras unas horas a dieta absoluta, se reintroduce la alimentación utilizando una fórmula extensamente hidrolizada con buena tolerancia. Durante su estancia, permanece asintomática, motivo por el que es dada de alta para seguimiento ambulatorio. A los 2 meses del ingreso, ha iniciado diversificación sin incidencias. Al año de edad, se decide provocación hospitalaria con fórmula de inicio con buena tolerancia.
|