|
| Temas de FC |
J. Peñarrocha Terés*, C. Hernández-Gancedo**
*Servicio de Otorrinolaringología, **Servicio de Anestesiología. Hospital Universitario La Paz. Madrid
| Resumen
Las malformaciones de la vía aérea superior son entidades poco frecuentes, pero siempre pensar en ellas ante la dificultad respiratoria en el recién nacido. Aquellas que sean leves, darán clínica crónica respiratoria durante el desarrollo del niño. Las más frecuentes son: laringomalacia, estenosis subglóticas congénitas, parálisis de cuerdas vocales, atresia de coanas y fisuras laríngeas. El diagnóstico principal se basa en la rinofibrolaringoscopia. |
| Abstract
Congenital malformations of the upper airway are rare entibies, but you have thinh about them before respiratory distress in the newborn. Those minor malformations will give mild chronic respiratory symptoms during the child ́s development . the most common are: laringomalacia, congenital subglottic stenosis, vocal cord palsy, choanal atresia and laryngeal clefts. Principal diagnosis is based on rhinofiberlaryngoscope. |
Palabras clave: Estridor neonatal; Laringomalacia; Estenosis subglótica congénita; Fisuras laríngeas; Atresia de coanas.
Key words: Neonatal stridor; Laryngomalacia; Congenital subglottic stenosis; Laryngeal cleft; Choanal atresia.
Pediatr Integral 2013; XVII(5): 351-359
Malformaciones congénitas de la vía aérea superior
Introducción
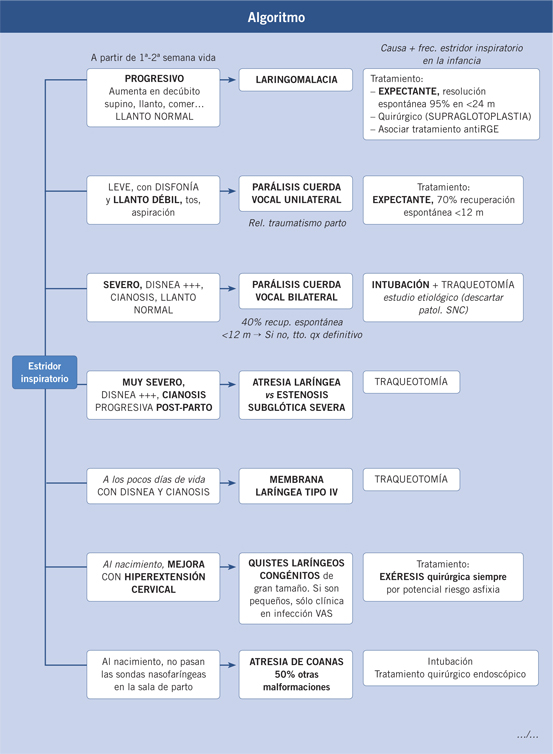
Las malformaciones congénitas de la vía aérea superior abarcan un amplio espectro de patologías, habitualmente poco frecuentes en la práctica clínica. Tienen dos formas típicas de presentación: malformaciones graves, producirán clínica severa y que puede poner en peligro la vida del neonato desde las primeras horas de vida, o malformaciones leves, que pueden pasar desapercibidas en la exploración inicial y dar una clínica muy larvada o crónica durante los primeros años de vida.
Laringomalacia
La laringomalacia es la causa más frecuente de estridor laríngeo. Habitualmente, es un estridor inspiratorio de aparición en la primera semana de vida, no cianosante. En el 95% de los casos, hay que realizar actitud expectante, aunque puede tener una duración de hasta 24 meses.
La laringomalacia es la anomalía laríngea congénita más frecuente siendo el 60-75%. Es la causa más habitual de estridor en la infancia, oscilando entre el 45-75% de los casos de estridor. Se define por el colapso intraluminal de los tejidos supraglóticos durante la inspiración.
Etiología y etiopatogenia
Causa desconocida. Se postulan tres factores que pueden influir en su génesis(1):
• Anatómicos: se han descrito principalmente tres tipos de anomalías anatómicas en la supraglotis: epiglotis enrollada en omega, ligamentos aritenoepiglóticos cortos y aritenoides abultados redundantes. Estos tipos de lesiones se pueden encontrar en forma combinada o aislada, provocando el colapso supraglótico, aunque también pueden estar presentes en recién nacidos sin provocar patología alguna.
• Histológicos: se ha sugerido que la inmadurez de los cartílagos laríngeos darían lugar a una debilidad intrínseca y tendencia al colapso durante la inspiración. Existen estudios que no encuentran diferencias histológicas entre los cartílagos de niños con laringomalacia y niños normales. Además, se debe tener en cuenta que en neonatos prematuros no existe mayor frecuencia de esta patología.
• Neuromusculares: la inmadurez en el control neuromuscular se ha descrito como otra posible causa. Algunos estudios han mostrado una relación entre la laringomalacia y enfermedades neurológicas, sugiriendo que ésta podría ser una manifestación de una hipotonía generalizada del soporte muscular de los cartílagos laríngeos. Dentro de este grupo etiológico, se ha implicado el reflujo gastroesofágico, que se presenta entre un 30 a 80% de los casos de laringomalacia. Se cree debido a la inmadurez neuromuscular, que determina una relajación del esfínter esofágico inferior. Al parecer, simplemente empeora la obstrucción que se observa en la laringomalacia, pero no la provoca.
Clasificación(1)
Las alteraciones anatómicas y mecánicas en la laringomalacia son evidentes y con arreglo a ellas se establecen los siguientes tipos, que pueden verse aislados o de forma combinada:
• Tipo 1: aspiración de la mucosa aritenoidea edematosa, que recubre los cartílagos cuneiformes introduciéndose hacia el interior de la laringe.
• Tipo 2: epiglotis enrollada y alargada que se curva y dobla en la inspiración. Se asocia al tipo 1. La epiglotis en omega per se no es causa de estridor.
• Tipo 3: colapso en báscula de los aritenoides (anterior y medial) durante la inspiración.
• Tipo 4: aspiración y desplazamiento posterior de la epiglotis contra la región aritenoidea.
• Tipo 5: repliegues ariepiglóticos cortos, creando un vestíbulo laríngeo pequeño y colapsable en inspiración.
• Tipo 6: colapso de la pared posterior de la subglotis durante la inspiración.
Clínica(1-3)
Estridor inspiratorio progresivo, generalmente intermitente, aunque también puede ser constante. Su intensidad aumenta con el decúbito supino, mejorando al decúbito prono, y empeora con los esfuerzos del niño, ya sea con el llanto, al agitarse o al mamar. En casos graves, pueden presentar: aspiración por falsas vías, cianosis, apneas obstructivas, accesos de tos, bronquitis de repetición y pectus excavatum. Durante el sueño puede desencadenar crisis de apnea que, incluso, algunos autores han relacionado con la muerte súbita del lactante. Los casos más graves no son los que más ruido inspiratorio hacen, sino los que producen mayor obstrucción laríngea.
Se puede presentar al nacimiento o, de forma más frecuente, a partir de la 1ª o 2ª semana de vida. Su sintomatología es máxima a los 6 meses de vida, y suele disminuir a los 8-10 meses. Habitualmente, se resuelve por completo antes de los 18-24 meses, aunque puede alargarse hasta llegar a los 2 a 7 años de vida.
Diagnóstico(8,9)
El diagnóstico de sospecha debe ser con la historia clínica de estridor inspiratorio, habitualmente no cianosante, que ha aparecido en la primera semana de vida y que empeora con la alimentación, decúbito supino y llanto.
Actualmente, el diagnóstico instrumental se realiza con rinofibrolaringoscopia flexible con el lactante despierto en casi todos los casos por su benignidad, tolerándose realmente bien. Se debería completar el estudio de toda la vía aérea, pero se suele reservar para los casos que no evolucionan bien o los de mayor severidad, con una endoscopia rígida con ventilación espontánea para descartar patología asociada traqueal (traqueomalacias, compresiones traqueales, estenosis subglóticas o estenosis traqueales).
Otras técnicas diagnósticas asociadas pueden ser la pHmetría, por estar asociado en un alto porcentaje el reflujo concomitante, monitorización de la saturación de oxígeno en casos graves y, ocasionalmente, estudio radiológico.
Tratamiento(10-12)
El 95% de los casos sólo requieren una actitud expectante. El 5-25% presentan enfermedad severa que puede requerir un tratamiento activo, que consiste en la resección endoscópica de las estructuras laríngeas redundantes (supraglotoplastia): sección de uno o de los dos repliegues ariepiglóticos, sección parcial de los bordes laterales de la epiglotis y vaporización de mucosa de cartílagos corniculados y borde libre de la epiglotis. Es importante no tocar ni lesionar los aritenoides. Se han descrito múltiples técnicas endoscópicas, ya sea mediante la utilización del láser CO2 o con microinstrumental, con resultados satisfactorios en más del 90% de los casos. La traqueotomía, que antes era el tratamiento inicial, se reserva para casos extremadamente graves y que, tras varias cirugías, presentan clínica severa, siendo habitualmente los pacientes que presentan comorbilidades asociadas los que presentan mayor riesgo de reintervención y/o traqueotomía.
Parálisis de cuerdas vocales
Las parálisis congénitas de cuerdas vocales bilaterales suponen una disnea severa, habitualmente secundarias a patología central. Las unilaterales, habitualmente, generan una clínica banal.
Suponen hasta el 10% de las anomalías congénitas laríngeas.
Etiología y etiopatogenia(8,13)
Las parálisis congénitas habitualmente son bilaterales. Éstas se asocian a lesiones del sistema nervioso central (malformación de Arnold-Chiari –la más frecuente–, hidrocefalia, mielomeningocele, agenesia cerebral o enfermedades neuromusculares). Estas parálisis bilaterales pueden ser provocadas por las mismas enfermedades e instaurarse más tardíamente. Las parálisis congénitas unilaterales obedecen a: traumas obstétricos, vueltas de cordón o malformaciones cardiovasculares; aunque son más frecuentes las unilaterales adquiridas secundarias a cirugía cardiaca (lado izquierdo).
La etiopatogenia de la parálisis bilateral es discutida, pero parece existir afectación de ambos nervios vagos por compresión o estiramiento del tronco del encéfalo en el foramen magnum.
Clínica(5)
La parálisis bilateral ocasiona disnea y estridor inspiratorio severo, con cianosis, apneas, episodios de aspiración debidos a una falta de relajación del músculo cricofaríngeo, con escasa disfonía y llanto normal. Es una urgencia vital.
La parálisis unilateral puede pasar desapercibida por la compensación que hace la otra cuerda vocal. Habitualmente, produce: estridor leve, disfonía y llanto débil; menos frecuentemente, si no se compensa, puede dar: tos, alteraciones en la deglución por incoordinación faringolaríngea, que provoca la apertura de la laringe durante la deglución, episodios de aspiración y neumonías.
Diagnóstico
Se realiza mediante fibrolaringoscopia sin anestesia para ver el movimiento de las cuerdas.
Si se objetiva una sola apertura activa de la laringe en inspiración, se debe poner en duda el diagnóstico y pensar en una discinesia laríngea. La discinesia se presenta debido a una inmadurez del control neuromuscular y, habitualmente, se asocia a reflujo gastroesofágico.
Una vez confirmado el diagnóstico de parálisis laríngea, se debe establecer su etiología, pues de ella dependerá su tratamiento.
Tratamiento
La parálisis unilateral se debe tratar de forma expectante, las no yatrógenas presentan una recuperación espontánea del 60-70% durante el primer año.
En el neonato, el principal problema lo constituye el trastorno de la deglución asociado. Por esta razón, es necesario espesar los alimentos e instaurar tratamiento antirreflujo. Si la clínica de aspiraciones persiste, puede ser necesaria la utilización de sonda nasogástrica e incluso de gastrostomía. Si en edad escolar presenta aspiraciones o disfonía severa, puede realizarse una tiroplastia.
En la parálisis bilateral, si existe disnea obstructiva grave, se debe proceder a la intubación oro o nasotraqueal. Ésta se puede mantener hasta tres semanas. Durante este periodo, se intentará establecer la etiología del caso y se realizarán intentos de extubación, que ayudarán a objetivar la evolución de la parálisis. Si en tres semanas no se ha podido efectuar la extubación, se procederá a realizar una traqueotomía.
El 40% presentan recuperación espontánea. Si durante el primer y segundo año de vida el niño no muestra signos de recuperación espontánea, se debe proponer un tratamiento quirúrgico definitivo. Se han descrito diferentes técnicas endoscópicas, como la realización de una cordotomía posterior en ambas cuerdas o la aritenoidectomía. También existen técnicas abiertas, como la aritenopexia o interposición de injertos junto a dilatación temporal.
Estenosis subglóticas congénitas
Suponen una patología que cursa con disnea de diferente magnitud. El tratamiento quirúrgico es muy satisfactorio.
Resulta de una hipoplasia del anillo cricoideo, habitualmente disminuyendo el diámetro a dicho nivel a menos de 3 ó 4 mm dependiendo de los autores.
Clasificación según Cotton:
• Grado 1: diámetro subglótico menor del 50% del calibre normal.
• Grado 2: diámetro subglótico entre el 50-70%.
• Grado 3: diámetro subglótico entre 70-99%.
• Grado 4: estenosis subglótica total.
Etiología y etiopatogenia
Se cree que puede formar parte de un cuadro de membrana glótica con extensión a la subglotis o de atresia laríngea. Se presenta más frecuentemente de forma aislada a nivel cricoideo, dando lugar a un cricoides de pequeño tamaño o elíptico.
La estenosis podrá ser de tipo mucosa, habitualmente adquirida, o de tipo cartilaginosa, más frecuente congénita. Puede presentarse aislada o en el contexto de un síndrome polimalformativo.
Clínica
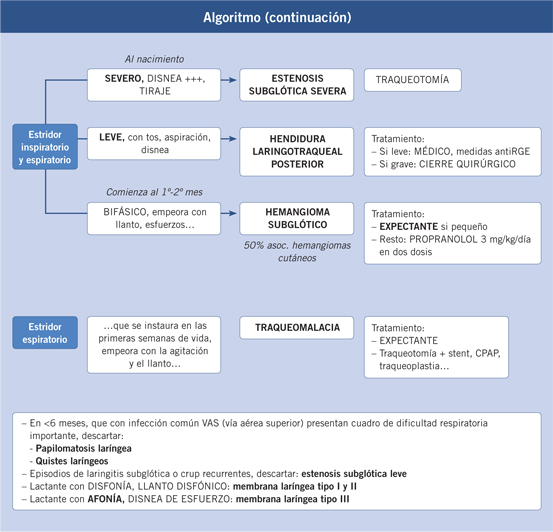
Depende de la edad y del grado de estenosis. La presentación más frecuente es a través de episodios de laringitis subglótica o de“crup” recurrentes, que se da en las formas leves de esta entidad. A partir del tercer episodio de laringitis subglótica en el mismo invierno, se debe tener la sospecha clínica de esta entidad y llevar a cabo una fibrolaringoscopia.
Los casos severos al nacimiento presentan disnea y cianosis progresivas posparto que, en la mayoría de los casos, conducen a la muerte del feto, si no se realiza una traqueotomía.
La estenosis grave, pero compatible con la vida, da lugar a: estridor inspiratorio y espiratorio, disnea, tiraje, voz ronca, dificultad de alimentación y talla pequeña en las formas evolucionadas.
Diagnóstico
El diagnóstico prenatal en las formas graves se realiza mediante ecografía prenatal. Se encuentra una dilatación de la tráquea y de los pulmones que nos debe hacer sospechar una estenosis severa y la valoración de una traqueotomía inmediata en el momento del parto. En el resto de las formas, el estudio diagnóstico fundamental es la fibrolaringoscopia con broncoscopia asociada, si es posible.
También, se ha utilizado la radiografía, observándose un estrechamiento subglótico, y para planificar la cirugía la TAC.
Tratamiento
El tratamiento de esta entidad dependerá principalmente del grado de estenosis, aunque esta patología es susceptible de mejorar con el crecimiento laríngeo.
Las estenosis de grado I o leves se basan en el tratamiento y profilaxis de las infecciones respiratorias y en el tratamiento de los factores que puedan agravar la estenosis, como el reflujo gastroesofágico. En este grupo, se debe tener en cuenta que, a partir de los 18-24 meses de vida, los niños presentan una mejoría evidente de su estenosis por el propio desarrollo de la laringe.
Las estenosis grado II-III o graves suelen requerir tratamiento quirúrgico, y la técnica dependerá del tipo de estenosis. Si se presenta un diafragma delgado y fibroso, se puede intentar una dilatación endoscópica o una vaporización con láser, aunque debemos tener en cuenta que la tendencia de las maniobras endoscópicas es a agravar la estenosis. El ensanchamiento de la subglotis mediante laringotraqueoplastia, con o sin ayuda de injertos, o técnicas de extirpación cricotraqueales con anastomosis término-terminal han demostrado unos resultados satisfactorios cercanos al 90%.
La estenosis subglótica congénita severa se debe tratar con una traqueotomía en el momento del parto, si es posible y, posteriormente, se deberán realizar técnicas de reparación y ensanchamiento de la laringe.
Atresias y membranas laríngeas
Etiología y etiopatogenia
Se originan por una recanalización incompleta de la laringe durante la embriogénesis (persistencia de la lámina epitelial embriológica, que cierra la faringo-laringe primitiva en la 3ª-4ª semana).
Se pueden dividir las atresias laríngeas en tres grupos(1-4):
• Atresia tipo I o completa: ausencia completa de luz laríngea.
• Atresia tipo II: falta de reabsorción de la lámina epitelial en la porción supraglótica.
• Atresia tipo III: comúnmente se denominan membranas laríngeas.
Este grupo se subdivide, según la clasificación de Cohen, en:
• Tipo I: membrana glótica anterior que ocupa menos del 35% de la luz glótica. Es translúcida, sólo presenta porción membranosa y no exhibe extensión subglótica.
• Tipo II: membrana anterior, que ocupa el 50% de la luz glótica. Es más gruesa, ya que puede ser membranosa o conectivo-membranosa. Presenta extensión subglótica.
• Tipo III: membrana que afecta al 75% de la luz con extensión subglótica anterior.
• Tipo IV: fusión de ambas cuerdas en toda su extensión ligamentosa, reduciendo la luz glótica entre el 75 y 90%. El paso aéreo está restringido al espacio interaritenoideo.
Las membranas glóticas se presentan de forma aislada en la mayoría de los casos, aunque también se han descrito asociadas a otros síndromes malformativos.
Clínica
Variable, dependiendo del tipo y extensión de la afectación laríngea que se presente.
Las atresias tipo I y II presentan un cuadro incompatible con la vida. Sólo pueden sobrevivir aquellos fetos que presenten una fístula traqueoesofágica concomitante, a través de la cual se pueda ventilar parcialmente, hasta la realización de una traqueotomía de urgencia.
Las atresias tipo III o membranas laríngeas darán lugar a clínica de disnea y disfonía en función de la extensión de la lesión. Las tipo I no dan disnea y únicamente dan algo de disfonía. Habitualmente pasan desapercibidas y se descubren al hacer una fibroscopia por otras causas. El subtipo II dará un llanto disfónico y voz ronca junto a signos de obstrucción respiratoria moderada, que aparece en los catarros banales. El tipo III produce una afonía prácticamente completa y disnea de pequeños esfuerzos. Por último, el tipo IV da lugar a afonía, estridor y cianosis que, habitualmente, obliga a traqueotomía a los pocos días de vida.
Diagnóstico(8,9)
El diagnóstico de las atresias tipos I y II se realiza de forma más habitual en la autopsia, aunque la evolución de las técnicas ecográficas en el diagnóstico prenatal permite actualmente el diagnóstico, en algunas ocasiones, de estas malformaciones de la vía aérea.
Las membranas tipos I y II se diagnostican mediante fibrolaringoscopia. En estos casos, la movilidad laríngea suele ser normal. Si la membrana no es translúcida, es difícil asegurar la ausencia de extensión subglótica. En esta situación, está indicada la laringoscopia directa bajo anestesia general, que permitirá, además, llevar a cabo un tratamiento endoscópico.
Los tipos III y IV se suelen diagnosticar en situación de urgencia, ya sea mediante fibrolaringoscopia, si el estado del niño lo permite, o por laringoscopia directa justo después del parto.
Tratamiento
Las atresias laríngeas mayores, tipos I y II, y las membranas tipos III y IV, suelen detectarse a través de un cuadro de sufrimiento respiratorio al nacimiento o durante los primeros días de vida. Se deben evitar, en lo posible, traumatismos laríngeos con intentos de intubación infructuosos. Si se encuentra la luz obliterada y la colocación de una sonda de intubación en la parte superior del esófago produce una rápida mejoría del niño, se debe sospechar una atresia completa con fístula traqueoesofágica o una desembocadura directa de la tráquea o de los bronquios en el esófago. En esta situación, la traqueotomía no es posible, ya que, en general, no existirá tráquea cervical y la viabilidad del niño tampoco será posible. En los demás casos, se debe realizar una traqueotomía de urgencia, previa intubación si ésta ha sido posible. Posteriormente, se procederá a la reparación laríngea, fundamentalmente mediante la realización de laringoplastias de ensanchamiento laríngeo por vía externa.
En las membranas tipos I y II, se realizará un tratamiento endoscópico con resección de la membrana mediante láser o bisturí frío si la membrana es fina, con colocación o no de un stent para evitar sinequias, aunque es frecuente la presentación de recidivas que requieran nueva cirugía. Si la membrana es gruesa, puede requerir la realización de una laringoplastia por laringofisura e interposición anterior de un injerto cartilaginoso o de una lámina de silastic.
Los resultados, en general, son satisfactorios en la permeabilidad laríngea, aunque no tanto en la calidad de la voz por la formación de sinequias anteriores.
Hendiduras laringotraqueales posteriores o diastemas laringotraqueales
Consiste en la aparición de una hendidura posterior de la laringe de amplitud variable. Es poco frecuente, <1% de las malformaciones de esta región y 1 entre 10.000-20.000 nacidos vivos.
Etiología y etiopatogenia
Se deben a un defecto en el cierre posterior de la laringe, por un déficit en la fusión de la membrana entre el esófago y el eje laringotraqueal. Se presenta de forma aislada (más frecuente), aunque puede asociarse a otros síndromes polimalformativos, sobre todo que afecten a la línea media, o también a estenosis subglótica, atresia esofágica o fístula traqueoesofágica.
Se han propuesto diversas clasificaciones, la más utilizada es la de Benjamin-Inglis, que divide las hendiduras en 4 grupos, del I al IV(6-8):
• Tipo I: hendidura interaritenoidea posterior profunda, que no supera el plano de las cuerdas vocales.
• Tipo II: hendidura que desciende hasta el extremo inferior del cricoides.
• Tipo III: hendidura hasta la parte superior de la tráquea.
• Tipo IV: hendidura hasta la carina bronquial.
Clínica
Depende de la amplitud de la hendidura. Las tipo I y II producen tos, broncoaspiración y neumonías de repetición. Menos frecuentemente, también pueden dar lugar a una disnea obstructiva y estridor de tipo bifásico: inspiratorio por el colapso de la mucosa redundante a través de la hendidura y espiratorio por la movilización de las secreciones aspiradas. Las tipos III-IV cursan con disnea y dificultades de ingesta desde el nacimiento.
Diagnóstico
La primera exploración a realizar es la fibrolaringoscopia, que revela un aspecto muy redundante de la mucosa interaritenoidea y una hendidura con los movimientos de abducción. Ocasionalmente, puede pasar inadvertido a la exploración fibrolaringoscópica; por lo que, si existe clínica sugestiva, se debe realizar una laringoscopia directa con palpación de la comisura laríngea posterior. En caso de confirmarse, una exploración completa del árbol respiratorio es obligatoria.
El índice de inclusión lipídico de los macrófagos(7), adquirido por lavado brocoalveolar, es un marcador de aspiración en pacientes con clínica respiratoria crónica (tos crónica, laringotraqueitis de repetición, neumonías por aspiración). La RMN es la prueba de imagen que pondría de manifiesto la presencia del mismo.
Una vez obtenido el diagnóstico, se deberá filiar el límite inferior de la malformación.
Tratamiento
Las hendiduras de alto grado (IIII y IV) se deben tratar de forma precoz, ya que presentan mal pronóstico vital para el niño por las alteraciones broncopulmonares. En el resto de casos, el tratamiento dependerá de la sintomatología provocada por la malformación.
En los diastemas tipos I y II poco sintomáticos, se debe realizar tratamiento médico, basado en espesar los alimentos y en medidas antirreflujo.
Si la sintomatología es importante o falla el tratamiento médico, se precisa tratamiento quirúrgico. Las hendiduras tipos I-II se pueden cerrar mediante laringoscopia directa bajo anestesia general. Si la hendidura afecta al anillo cricoideo o tráquea, se precisará un acceso mediante laringofisura para realizar el cierre, aunque las técnicas endoscópicas están en auge. Las hendiduras más avanzadas se deben cerrar mediante toracotomía. Para el cierre quirúrgico de la hendidura, será necesario extirpar el exceso de mucosa y se realizará una sutura en dos planos con interposición de un injerto cartilaginoso o perióstico.
Hemangioma subglótico
Es una neoformación vascular benigna de localización subglótica. Más frecuente en niñas (relación 2:1).
Etiología y etiopatogenia(1,2,8,9)
Rápida proliferación celular a partir de las células del endotelio vascular. Esta lesión presenta una fase proliferativa inicial, seguida de una fase involutiva en la que la proliferación endotelial disminuye y aparece tejido fibroso separando los espacios vasculares.
Se presentan asociados a hemangiomas cutáneos en el 50% de los casos, generalmente de localización cervico-facial.
Clínica
Se presenta como disnea obstructiva inspiratoria acompañada de un estridor inspiratorio bifásico, con accesos de tos tipo “crup”. Si la clínica se produce asociada a un cuadro inflamatorio de vías altas, puede sugerir una laringitis subglótica que responde al tratamiento con corticoides, igual que el hemangioma.
Habitualmente, no está presente en el momento del nacimiento. Sus manifestaciones se inician a los 2-3 meses, y mejoran a partir de los 12-18 meses de forma paralela a la evolución natural de esta entidad.
Diagnóstico
Por fibrolaringoscopia, se observa una masa de color rojo o violáceo, aunque también puede ser de color normal si el angioma se localiza profundo a la mucosa. Su localización más frecuente es a nivel subglótico posterior izquierdo.
La confirmación diagnóstica se puede realizar mediante una RMN o con la realización de una laringoscopia directa que revelará una tumoración elástica y depresible. Delante de estos hallazgos no es necesario llevar a cabo una biopsia de la masa.
Tratamiento
Se debe tener en cuenta que la evolución de estas lesiones es hacia la regresión espontánea a partir del primer año de vida.
El descubrimiento del propranolol como tratamiento para los angiomas de cualquier localización del cuerpo ha supuesto un avance muy significativo en el tratamiento del hemangioma subglótico. Se debe mantener durante unos nueve meses y controlar la posible reaparición tras su retirada y mantener más tiempo de tratamiento en caso de recidiva hasta que, por la evolución del hemangioma, involucione. Control de las glucemias y de posibles bradicardias como factibles efectos secundarios.
Previamente, los corticoides a dosis altas eran el tratamiento. Si, pese al tratamiento inicial la lesión no mejora o se presenta recidiva de la misma, se puede llevar a cabo su exéresis mediante láser CO2. Si la cirugía endoscópica falla, ha demostrado utilidad la extirpación de la lesión por vía externa a través de una laringofisura seguida de intubación durante varios días. En afectaciones graves con afectación mediastínica, el interferón alfa puede ayudar a la regresión o estabilización de las lesiones.
Lesiones quísticas congénitas
Los quistes laríngeos congénitos son poco frecuentes, pero se deben tener en cuenta, ya que es frecuente su diagnóstico en la autopsia, tras un cuadro de asfixia neonatal.
Etiología y etiopatogenia
Se deben a una disontogenia en el desarrollo de los límites del 3º y 5º arcos branquiales, representando el resto de una hendidura branquial. Se forma una lesión quística revestida de mucosa con contenido líquido. Preferentemente, se localiza a nivel del ventrículo laríngeo de Morgagni, aunque también es habitual a nivel anterior en la vallécula glosoepiglótica.
Clínica
Generalmente, asintomáticos en el nacimiento. Presentarán manifestaciones si aumentan su tamaño, especialmente con infecciones del tracto aéreo, antes de los 6 meses de vida.
También, pueden presentarse como disnea desde el momento del nacimiento, acompañada de estridor inspiratorio, que puede mejorar con la extensión de la cabeza.
Diagnóstico
Por fibrolaringoscopia se observa una masa quística, con una pared mucosa de color amarillento, a nivel lateral, si es un quiste de ventrículo, o a nivel anterior, si es un quiste de vallécula.
Los quistes de vallécula se deben diferenciar del tiroides lingual ectópico, de aspecto más hemorrágico y sólido. Para esta razón, se debe completar el estudio endoscópico con una ecografía cervical antes de llegar al diagnóstico definitivo.
Tratamiento
Los quistes laríngeos congénitos se deben tratar independientemente de la clínica asociada. Los casos asintomáticos presentan un potencial riesgo de crecimiento importante que podría dar lugar a una situación clínica grave.
El tratamiento consiste en la exéresis lo más completa posible del quiste a través de la laringoscopia directa con anestesia general. Si esta no es posible, se puede llevar a cabo una marsupialización endoscópica de la lesión o exéresis a través de una cervicotomía lateral.
Atresia de coanas
Es la causa no laríngea más frecuente de estridor. El 50% se asocian a síndromes, especialmente el CHARGE. La atresia bilateral es una urgencia por la respiración nasal obligada de los neonatos.
La atresia de coanas es una rara causa de insuficiencia respiratoria nasal que tiene una incidencia de 1 entre 5.000 a 8.000 recién nacidos. Es más frecuente la unilateral en el lado derecho y parece existir predominancia en el sexo femenino sobre el masculino. Clásicamente, se describían como un 90% placas atrésicas óseas y el 10%, exclusivamente membranosas, pero la literatura reciente las define como mixtas en un 70% y óseas en un 30% de los casos.
La mitad de las presentaciones de las atresias de coanas son aisladas, sin otras patologías asociadas; y el otro 50% se asocian a otras malformaciones, tanto de causa no cromosómica como de causa cromosómica. El síndrome CHARGE(14) (coloboma, alteración cardiaca, atresia de coana, alteraciones renales, retraso en el crecimiento y alteraciones en oído) es el más frecuentemente encontrado, pero se puede asociar a otros síndromes, como los de: Pfeiffer, Crouzon, VATER, síndrome del incisivo único o delección 22q11.
Clínica
La presentación clínica de la enfermedad depende de si es una forma unilateral o si es una forma bilateral. La forma unilateral puede pasar totalmente desapercibida en la sala de parto y el diagnóstico puede ser realizado en los años posteriores de vida por rinorrea unilateral. Si la atresia de coanas es bilateral(15), es una causa de disnea intensa en el neonato, habitualmente cianosis; ya que, el neonato es un respirador nasal obligado hasta los 6 meses aproximadamente.
Diagnóstico
El diagnóstico se basa en la sospecha directa en la sala de parto, ya que se pasan dos sondas nasofaríngeas en todos los recién nacidos. Además, en la forma bilateral, la respiración asfíctica del neonato con tiraje cervical y torácico, junto a la imposibilidad de pasar las sondas nasales, nos hacen tener un diagnóstico de sospecha.
El diagnóstico de certeza se lleva a cabo con una endoscopia flexible, donde se objetiva la no apertura de la coana. En la mayoría de los casos de atresia bilateral, se procede a la intubación del neonato en las primeras 24 horas, ya que estos niños desarrollan una fatiga respiratoria severa. El flujo nasal exhalado en espejo o la radiografía simple nasal tras administración de contraste intranasal ha quedado totalmente en desuso.
Una vez diagnosticado con la fibroscopia nasal, la prueba de imagen de elección es la TAC, para ver posibles referencias anatómicas cara a la cirugía. En los casos de atresia unilaterales sin alteración de la otra coana, se suele diferir la prueba de imagen hasta la planificación quirúrgica; ya que, no se realizará de forma inmediata, al contrario que la bilateral. La imagen típica de la atresia de coanas en cortes axiales es la de un reloj de arena en la zona estenótica, ya que el proceso medial de la apófisis pterigoides se medializa y la parte posterior del vómer se engrosa y lateraliza. Además, también sirve para ver la distancia de la base del cráneo, que en esta zona se hace más baja de lo normal.
Manejo inicial: los neonatos son respiradores nasales obligados hasta las 6-8 semanas, por lo que el neonato con atresia bilateral de coanas se presenta con disnea y cianosis que se alivia con el llanto. El descenso de la laringe y el crecimiento del cuello durante los primeros meses también facilitan el aprendizaje. La respiración se puede mantener con el chupete de McGovern o incluso la intubación orotraqueal puede ser necesaria. En cambio, la atresia unilateral puede pasar desapercibida y presentarse como rinorrea crónica unilateral.
Desde este momento, iniciar un estudio de pluripatologías asociadas, ya que la mitad de estos niños las padecen. Habitualmente, el principal estudio que se hace es el de búsqueda de un CHARGE.
Ante una atresia de coanas unilateral, habitualmente no se requiere intubación neonatal, pero sí búsqueda de posibles órganos afectados.
Diagnóstico diferencial
Estenosis de la apertura piriforme, síndrome del incisivo único (combina las dos etiologías), estenosis de la cavidad nasal, quistes de los conductos nasolacrimales, desviación septal, hematoma septal, encefalocele, hamartoma, cordoma y glioma.
Tratamiento(16,17)
En las atresias de coanas bilaterales, tras detectar posibles malformaciones asociadas, la cirugía se realizará lo antes posible. Actualmente, se realiza por cirugía endoscópica nasal que ofrece grandes ventajas sobre la vía transpalatina. Las complicaciones de la endoscopia son la posible entrada en fosa craneal anterior con fístula LCR, posibles reestenosis (hasta un 30%, aunque en los últimos años se están obteniendo resultados del 10%). La vía transpalatina ofrece resultados igual de buenos en cuanto a reestenosis o incluso menores, pero existe un mayor sangrado, mordida cruzada en el crecimiento, altera el crecimiento facial y produce insuficiencia velopalatina.
Para la práctica pediátrica de Atención Primaria
Las anomalías de la vía aérea son poco frecuentes. Las anomalías graves dan una clínica urgente y dramática (disnea severa, cianosis, asfixia), y de atención en centros hospitalarios pediátricos. Sin embargo, vamos a tener que atender a niños con anomalías en centros de salud. La laringomalacia es la causa más frecuente de estridor laríngeo en el niño y habitualmente se presenta en la primera semana de vida de forma poco intensa, lo que permite el desarrollo del bebé sin problemas y que se resuelve sin tratamiento en la gran mayoría de los casos. En los otros casos en que la malformación sea leve, puede pasar desapercibida en el momento del nacimiento y dar clínica larvada, crónica y sutil del tipo de: tos crónica, episodios de laringitis-crup repetitivos, neumonías de repetición o síndromes pseudoasmáticos no clásicos (membranas laríngea, estenosis suglóticas leves, hendiduras laríngeas…). Ante estas clínicas inusuales, se debería realizar un estudio de la vía aérea superior.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Bartual Pastor J, Bartual Magro J, Sierra Galera G. Malformaciones laringotraqueales. En: Barberán T, Bernal Sprekelsen M, eds. Tratado de ORL Pediátrica (Ponencia Oficial de la SEORL 2000). p. 379-86.
2.*** Clarós A, Clarós P. Malformaciones laringotraqueales congénitas. En: Suárez C, ed. Tratado de ORL y Cirugía de Cabeza y Cuello. Editorial Proyectos Médicos. p. 1883-93.
3.** Llorente Pendás JL, Núñez Batalla F, Suárez Nieto C. Disnea y estridor en el niño. Manejo de la obstrucción aguda de la vía aérea. Tratado de ORL Pediátrica (Ponencia Oficial de la SEORL 2000). p. 367-74.
4.*** Daniel M, Cheng A. Neonatal stridor. Int J Pediatr. 2012; 2012: 859104.
5.** Leung AKC, Robson WLM, Tay-Uyboco J. Chronic cough in children. Canadian Family Physician. 1994; 40: 531-7.
6.** Rahbar R, Rouillon I, Roger G, et al. The presentation and Management of laryngeal cleft, a 10 year experience. Arch Otolaryngol Head and Neck Surg. 2006; 132: 1335-41.
7.** Kieran S, Katz E, Rosen R, et al. The lipid laden macrophage index as a marker of aspiration in patients with type I and II laryngeal clefts. Int J Pediatr Otorhinolaryngol. 2010; 74: 743-6.
8.*** Gerber M, Holinger L. Congenital laryngeal anomalies. En: Alper et al. Pediatric Otolaryngology Bluestone, Stool. 1460-73.
9.*** Hartnick CJ, Cotton RT. Stridor and airway obstrucción. En: Alper et al. Pediatric Otolaryngology Bluestone, Stool. p. 1437-48.
10.** Hwang EB, et al. Success of supraglottoplasty for severe laringomalacia: the experience from Northeastern Ontario, Canada. Int J Pediatr Otorhinolaryngol. 2013. http://dx.doi.org/10.1016/j.ijporl.2013.04.010
11.** Hoff SR, et al. Supraglottoplasty outcomes in relation to age and comorbid conditions. Int J Pediatr Otorhinolaryngol. 2010; 74: 245-9.
12.** Preciado D, Zalzal G. A sistematic review of supraglottoplasty outcomes. Arch Otolaryngol Head Neck Surg. 2012; 138(8); 718-21.
13.*** García-Lopez I, Peñarrocha-Terés J, et al. Paediatric vocal fold paralysis. Acta Otorrinolaringol Esp. 2013 May 30. pii: S001-6519(13)0063-0. doi: 10.1016/j.otorri.2013.02.004.
14.** Bergman JE, et al. CHD7 mutation and CHARGE syndrome: the clinical implications o fan expanding phenotype. J Med Genet. 2011; 48: 334-42. doi: 10.1136/jmg.2010.087106.
15.** Durmaz A, et al. Transnasal endoscopic repair of choanal atresia: Results of 13 cases and meta-analysis. J Craniofac Surg. 2008; 19(5): 1270-4.
16.** Hengerer A, Brickman T, et al. Choanal atresia: embriologic análisis and evolution of treatment, a 30 year experience. The Laryngoscope. 2008; 118: 862-6.
17.** Teissier N, Kaguelidou F, et al. Predective factors for succes alter transnasal endoscopic treatment of choanal atresia. Arch Otolaryngol Head Neck Surg. 2008; 134(1): 57-61.
Bibliografía recomendada
– Bartual Pastor J, Bartual Magro J, Sierra Galera G. Malformaciones laringotraqueales. En: Barberán T, Bernal Sprekelsen M, eds. Tratado de ORL Pediátrica (Ponencia Oficial de la SEORL 2000). p. 379-86.
Tratado de Otorrinolaringología pediátrica de referencia española.
– Gerber M, Holinger L. Congenital laryngeal anomalies. En: Alper et al. Pediatric Otolaryngology Bluestone, Stool. 1460-73.
– Hartnick CJ, Cotton RT. Stridor and airway obstrucción. En: Alper et al. Pediatric Otolaryngology Bluestone, Stool. p. 1437-48
Tratado de Otorrinolaringología pediátrica de referencia mundial.
| Caso clínico |
|
Neonato varón de 37+5 semanas, de padres no consanguíneos, estudios y controles durante embarazo normales, peso recién nacido: 2.800 g. Test de Apgar de 6 al minuto y cinco minutos. Ventilación con mascarilla facial ayudada por cánula de Guedel. Estridor inspiratorio con llanto fuerte, pero entrecortado por los movimientos inspiratorios no efectivos. Durante la exploración pediátrica urgente, se observa: facies sindrómica, oreja derecha de implantación baja, dudosa parálisis facial derecha, auscultación pulmonar sin alteraciones y auscultación cardiaca alterada. El paso de las sondas nasofaríngeas parece no ser posible por ninguna fosa nasal. Ante la dificultad respiratoria del neonato, se decide intubación orotraqueal con buena visibilidad e ingreso en UVI neonatal, consiguiéndose estabilización del neonato. |