|
| Temas de FC |
D. Fernández Álvarez, M. Muriel Ramos
Servicio de Pediatría. Hospital Universitario de Salamanca
| Resumen
El neuroblastoma es un tumor del sistema nervioso simpático frecuente en el niño especialmente antes de los 5 años, siendo el segundo tumor sólido en la infancia, cuya evolución es impredecible y caprichosa, y es la causa del 15% de mortalidad en niños con cáncer. Su diagnóstico es tardío en la mitad de los casos debido a que su asiento es posterior y difícil de detectar. Sus síntomas derivan principalmente de su asiento y de signos paraneoplásicos característicos asociados o síntomas constitucionales si está extendido. Para su orientación y seguimiento, la gammagrafía con MIBG es la prueba más útil, así como las catecolaminas en la orina. El pronóstico depende de su biología, principalmente la amplificación del NMYC, extensión y de la edad del paciente. La supervivencia es excelente para los de bajo riesgo e intermedio y se tiende a minimizar la terapia en estos casos; mientras que, se incrementa en los de alto riesgo dada su supervivencia actual menor del 40%. Actualmente, los distintos grupos de estudio están intentando definir nuevos marcadores pronósticos para mejorar la estimación de riesgo al diagnóstico y mejorar la terapia adecuada para cada subgrupo. |
| Abstract
Neuroblastoma is a tumour of the sympathetic nervous system specially common in children before age 5, the second solid tumour in childhood, whose evolution is unpredictable, and capricious and cause 15% mortality in children with cancer. Diagnosis is often delayed in half the cases because their seat is back and difficult to detect. Her symptoms primarily derived from his seat and paraneoplastic signs and symptoms associated, characteristic of constitutional syndrome if extended. For your guidance and monitoring, the gammagrafia MIBG is the most useful as well as catecholamines in the urine. The prognosis depends on its biology, primarily amplified NMYC, clinical and patient age Survival is excellent for low and intermediate risk and tends to minimize the therapy in these cases while increases in high risk given its survival less than 40%. Currently the different study groups are trying to define new prognostic markers to improve risk estimation to improve diagnosis and appropriate therapy for each subgroup. |
Palabras clave: Neuroblastoma; Tumor abdominal en niños; Opsoclonus-mioclonus; N-MYC.
Key words: Neuroblastoma; Abdominal tumour in children; Opsoclonus; N-MYC.
Pediatr Integral 2012; XVI(7): 515-524
Tumores de la cresta neural
Introducción
Los tumores de la cresta neural son aquellos que derivan de las simpatogonias, que son células embrionarias pluripotenciales que pueden diferenciarse en: células ganglionares, feocromocitos y tejido neurofibroso.
Los tumores que derivan de estas células pueden ser benignos, como el ganglioneuroma (GN), tumor compuesto totalmente por células maduras ganglionares y otras ganglioneuronas maduras, y el feocromocitoma. Los malignos, como el neuroblastoma (NB), formado principalmente por neuroblastos malignos, y el ganglioneuroblastoma (GNB), un tumor con ambos tipos de células maduras e inmaduras, ambos con capacidad de metastatizar(1). Durante el periodo embrionario, las simpatogonias emigran desde la cresta neural a lo que serán en el feto los ganglios simpáticos y la médula adrenal; por este motivo los tumores derivados de ellas pueden asentar en las glándulas suprarrenales o bien en los ganglios simpáticos a lo largo de todo el eje espinal, desde el cuello hasta el sacro (Fig. 1).

Figura 1. Distribución anatómica del sistema nervioso simpático
EL NB es el tumor sólido más frecuente en la infancia después de los tumores del sistema nervioso central, representa entre el 7 y 10% de los tumores infantiles y tiene una incidencia de 10 casos por millón de nacimientos y por año, y es la causa del 15% de mortalidad en niños con cáncer(2).
Ocurre más frecuentemente en niños menores de 5 años pero puede presentarse desde el periodo neonatal hasta niños mayores. La mitad de los casos diagnosticados están entre 1 y 4 años de edad.
Su causa es desconocida y, aunque poco frecuentemente, se asocia a determinadas enfermedades(3). También, existen casos raros familiares de herencia autosómica dominante, asociados a la presencia de un oncogén (Anaplasic Lynphoma Kinasa)(4). La mayoría de los NB son esporádicos. Su comportamiento es difícil de prever, ya que algunos tienden a la regresión espontánea y otros tienden a madurar. Otros tienen un comportamiento agresivo; de tal manera que, casi la mitad de los casos tienen metástasis en el momento del diagnóstico y presentan una mortalidad muy elevada.
Patogenia
La célula tumoral se origina en las células embrionarias, los neuroblastos, y se piensa que uno de los mecanismos que conducen al desarrollo tumoral es un fallo en la respuesta a las señales de diferenciación y maduración.
Los nódulos neuroblásticos presentes en la glándula suprarrenal en la vida fetal, generalmente regresan espontáneamente a las 17-18 semanas de gestación. Cuando algunos de estos nódulos persisten, son el origen del desarrollo tumoral, y el disbalance en su maduración o diferenciación puede suceder en distintas etapas, de ello se derivan las distintos grados de madurez de estos tumores(4).
Anomalías cromosómicas y moleculares
En los últimos años se han identificado múltiples anomalías cromosómicas y moleculares en los pacientes con NB que han sido evaluadas para determinar su significado y su valor pronóstico(1,5-8).
N-MYC: es un encogén que se sobre- expresa en el 25% de los casos de NB amplificando el brazo distal del cromosoma 2. Es el marcador más importante y de valor pronóstico desfavorable, reconocido por todos los grupos de estudio del NB. Es más frecuente en casos con estadio avanzado. Los pacientes con NMYC ampliado tienden a tener una progresión más rápida del tumor y peor pronóstico, incluso cuando coexisten otros factores favorables, como el estadio localizado o 4s.
La deleción del brazo corto del cromosoma 1 es la anomalía cromosómica más frecuente (35%) y confiere mal pronóstico. En esta región existen genes supresores que controlan la diferenciación del neuroblasto. Se ha descrito una asociación entre la deleción del cromosoma 1p y la amplificación del NMYC. Índice de ADN es un test que se correlaciona con la respuesta al tratamiento en lactantes. Si existe hiperploidia, tiene mejor respuesta que si es el índice de ADN es menor de 1, en este caso la respuesta al tratamiento es peor. Este índice no tiene significación pronóstica en niños mayores.
Ganancia del 17q es muy frecuente y ocurre en el 90% de los NB, no está bien establecido su valor pronóstico, actualmente en estudio. Deleción del cromosoma 11 se observa en el 20% de los NB y con frecuencia se asocia a estadios avanzados sin amplificación del NMYC ni alteraciones en el cromosoma 1. Recientemente, se ha perfilado como gen supresor del tumor. Se ha visto asociado a menor supervivencia, derivada de la progresión del tumor y a la inestabilidad cromosómica. Se encuentra en niños mayores con inicio tardío de la enfermedad(9,10). WT1 muestra una significativa asociación entre NB clínicamente agresivo y con elevada posibilidad de recaída(11). Tres genes receptores de neurotrofina TrKA, TrKB y TrKC son tirosinkinasas que codifican un receptor del factor de crecimiento neuronal (NGF). En niños menores de 1 año con alta expresión de TrKA se correlaciona con buen pronóstico, especialmente en estadios 1, 2 y 4s. En contraste con TrKB, que se expresa en tumores con amplificación del NMYC y esta asociación puede representar una vía autocrina de supervivencia tumoral. Genes aberrantes silenciadores de genes supresores pueden ocurrir debido a la alteración de los patrones de metilación y podrían alterar las vías de apoptosis normales. Otro marcador biológico de valor pronóstico desfavorable es la falta de expresión de una glicoproteína (CD44) en la superficie de la célula tumoral, la P-glicoproteína, que con la proteína multidroga resistencia (MRP) son proteínas que confieren resistencia a las drogas y que actualmente están siendo estudiadas como nuevas dianas terapéuticas.
Anatomía patológica
Las células pluripotenciales simpáticas emigran para formar los diferentes órganos del sistema nervioso simpático. Las glándulas suprarrenales contienen células cromafines productoras de catecolaminas y neuropéptidos.
Histológicamente los tumores de la cresta neural pueden ser clasificados como: ganglioneuromas (GN), ganglioneuroblastomas (GNB) y neuroblastomas (NB).
Los NB indiferenciados están compuestos por células pequeñas redondas que se tiñen de azul y forman nidos en la matriz fibrovascular; típicamente, se disponen formando rosetas características de Homer-Wright, estas pseudorrosetas se pueden observar en el 15-50% de las muestras tumorales y pueden describirse como neuroblastos que rodean procesos neuronales eosinofílicos que son neuropilos (Fig. 2).

Figura 2. Rosetas de Homer-Wright
El tumor muestra típicamente células pequeñas uniformes con escaso citoplasma y núcleo hipercromático. Los neuropilos son un patrón muy fino de procesos celulares que se extienden con aspecto de ser extracelulares, aunque corresponden a extensiones de la célula y son característicos del NB. Se contrastan con enolasa neuronal específica (ENE), cromogranina y sinaptofisina, además de S-100 y GD2.
En contraste, el GN maduro está compuesto por células ganglionares maduras, células de Schwann y procesos neuríticos (Fig. 3).

Figura 3. Tejido ganglionar maduro y estroma swaniano (flecha curva) y células ganglionares maduras con abundante citoplasma (flecha recta) en un GN
En el GNB se encuentra todo el espectro de diferenciación celular entre el NB y el GN. Se subclasifica en difuso o nodular, teniendo peor pronóstico el nodular.
Clasificación histopatológica de Shimada
Shimada desarrolla una clasificación histopatológica con valor pronóstico que considera: grado de diferenciación del neuroblasto, presencia o no del estroma swaniano (estroma rico o estroma pobre), índice de proliferación celular (índice de mitosis-cariorrexis
–IMK–) y patrón nodular, además de la edad del niño.
Con estos componentes, podemos clasificar al paciente:
• Grupo histológico favorable: pacientes de cualquier edad con tumores ricos en estroma sin patrón nodular; pacientes de < de 18 meses y estroma pobre, IMK <200/5.000 con neuroblastos diferenciados o indiferenciados; y pacientes de < de 60 meses con estroma pobre e IMK <100/5.000 y neuroblastos bien diferenciados.
• Grupo histológico desfavorable: pacientes de cualquier edad con tumores con estroma rico y patrón nodular; pacientes de cualquier edad y estroma pobre, neuroblastos diferenciados o indiferenciados con IMK >200/5.000; pacientes de >18 meses con estroma pobre, neuroblastos bien diferenciados e IMK 100-200/5.000; y pacientes de > de 60 meses, estroma pobre neuroblasto diferenciado e IMK <100.
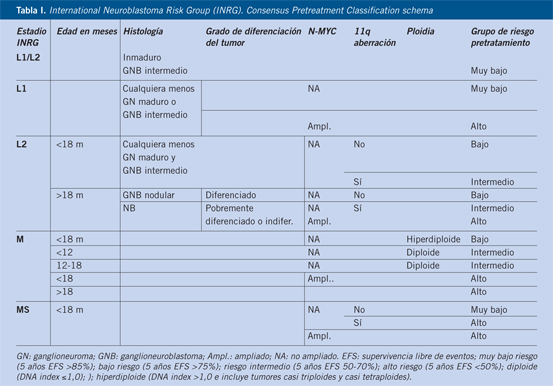
La clasificación de Shimada fue integrada en la International Neuroblastoma Patology Clasification (INPC) revisada en 2009(12) (Tabla I).
Manifestaciones clínicas
Dependen de la localización del tumor y del grado de invasión de los tejidos vecinos, así como de las manifestaciones paraneoplásicas asociadas. Aunque hay que recordar que la manifestación más frecuente es una masa asintomática.
La localización en la cabeza y cuello: puede presentarse como una masa palpable, hemorragias periorbitarias, exoftalmos, equímosis y edema de los párpados, ptosis y miosis (signo de Claudio Bernard Horner) por compresión del plexo braquial (Fig. 4).

Figura 4. Signo de Claudio Bernard Horne: ptosis, miosis y endoftalmos
Alteración de otros pares craneales, también puede ocurrir.
En el tórax: 20% de los casos de los NB asientan en esta localización, es más frecuente en niños menores de 2 años. Suele ser un hallazgo casual al practicar una radiografía por síntomas catarrales. En los casos muy avanzados, puede presentar un síndrome de compresión de cava superior con disnea e ingurgitación del cuello y de la cara.
En el abdomen (75%): puede referir molestias abdominales inespecíficas, provocar estreñimiento, distensión abdominal o palparse accidentalmente una masa indolora, profunda, generalmente mal delimitada y a veces abollonada, que pasa la línea media.
En la pelvis, puede provocar retención urinaria, estreñimiento o una masa presacra.
Área paraespinal: los NB en reloj de arena que se extienden al espacio intramedular y comprimen pueden ocasionar dolor de espalda, cojera, hipotonía, arreflexia, atrofia muscular, paraplejia, escoliosis o alteración de esfínteres.
En la piel: pueden mostrar nódulos de NB azulados y pequeños, frecuentes en lactantes (Fig. 5).
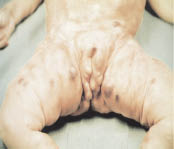
Figura 5. Nódulos en un lactante de 8 m, metástasis de NB
Síntomas paraneoplásicos
Otras manifestaciones pueden acompañar al NB bien localizado, como diseminado.
Al ser tumores productores de catecolaminas, pueden presentar: sofocos, cefaleas, palpitaciones, diarrea con fallo de medro asociada a distensión abdominal o hipertensión por aumento de renina en los que existe compresión renovascular. También pueden producir parathormona y cursar con hipercalcemia.
Encefalopatía mioclónica (2%)
Consiste en descargas bruscas de movimientos rápidos involuntarios de los ojos en todas direcciones de la mirada que no fija (opsoclonus). Asociadas a ellas presenta también mioclonías de los músculos del tronco y de las piernas.
Estos síntomas son paraneoplásicos y se pueden resolver o no con la resección tumoral. Van asociadas a buen pronóstico vital, pero la mejoría puede ser lenta y parcial; con frecuencia, es necesario tratar los síntomas. A veces las manifestaciones neurológicas pueden progresar y ser causa de un grave deterioro(13).
Inversamente, todos los niños que presenten este síndrome de opsoclono-mioclono deben ser investigados para descartar un NB.
El síndrome opsoclono-mioclono parece ser causado por un mecanismo inmunológico que aún no está completamente definido. A diferencia de otros neuroblastomas, el tumor primario está infiltrado de forma difusa con linfocitos. Sugiere un mecanismo inmune por anticuerpos IgG e IgM que se unen al citoplasma de las células de Purkinje y axones de la materia blanca y de los nervios periféricos.
El tratamiento con la hormona adrenocorticotrópica (ACTH) se considera eficaz, pero algunos pacientes muestran resistencia a la ACTH. Se ha informado que varios medicamentos, la plasmaféresis, la gammaglobulina (IVIG), y el rituximab han sido eficaces en casos específicos(14).
Estudios diagnósticos
Laboratorio
Hemograma: puede ocurrir cualquier citopenia si hay invasión de la médula ósea (MO) por el tumor. Catecolaminas en orina: ácido vanilmandélico (AVM) y ácido homovanílico (AH) y catecolaminas totales. Se consideran elevadas si están 3 DS por encima de los valores normales para su edad. Su grado de elevación está asociado a supervivencia acortada. LDH y ferritina, aunque inespecíficas y no consideradas actualmente como marcadores tumorales, pueden encontrarse elevadas en este tumor. Enolasa Neuronal Específica (ENE): es una enzima que se sintetiza en las neuronas y en las células neuroendocrinas, es útil para la monitorización del NB, aunque no es específica, pues también puede estar elevada en otras circunstancias, tales como: lesiones neuronales, hemólisis y en otros tumores(15).
Se encuentra elevada en el 65% de los NB al diagnóstico. Tirosín hidroxilasa: en MO por RT-PCR; marcador de enfermedad residual y de recidivas muy precoz. Se negativiza a los 3 meses del final del tratamiento.
Estudios de imagen
Están consensuados internacionalmente, tanto para el diagnóstico, la extensión local y las metástasis, así como para valorar la respuesta al tratamiento.
Con el fin de unificar criterios en la valoración del estadiaje del proceso, (INSS), en los últimos años, se ha incluido la valoración radiológica inicial con criterios unificados y así poder clasificar el estadio del tumor previamente a la cirugía (International Neuroblastoma Risk Group Staging System –INRGSS–).
Gammagrafía con metaiodobencilguanidina (MIBG)
Este contraste es captado por las células del NB tanto por el citoplasma como por los gránulos de norepinefrina de las células, es un método muy sensible, al diagnóstico es positiva en el 95% de los casos. Se puede marcar con I-123, que tiene más sensibilidad y mejor calidad de imagen, solo 5% de exposición radioactiva. Actualmente, es el método más sensible y específico para el diagnóstico y evaluación de la respuesta al tratamiento, particularmente cuando se usa con un método semicuantitativo. El SPECT (tomografía computarizada por emisión de fotones individuales) combinado con I-123 permite localizaciones anatómicas más precisas.
La gammagrafía con I-131 puede usarse como terapia. El I-131 emite partículas beta y rayos gamma que tienen una vida media de ocho días.
La distribución normal del MIBG incluye: hígado, miocardio, intestino, glándulas salivares, tiroides y riñón. Ocasionalmente, la grasa parda de los lactantes puede captarla en áreas supraclaviculares.
La captación en los NB ocurre en el 95% de los pacientes incluyendo el tumor primario, metástasis en MO y ganglios linfáticos. También es el mejor método para el seguimiento de los niños tratados(16). La respuesta al tratamiento también puede ser evaluada por MIBG y ha sido usada como un marcador pronóstico.
Las metástasis en el sistema nervioso central no son frecuentes, pero no suelen captar MIBG y el PET (tomografía por emisión de positrones) con fluorodeoxiglucosa (FDG) es el mejor método de estudio para estos casos.

Figura 6. A) RMN sagital del abdomen mostrando una masa anterior a la columna lumbar. B) Corte axial en T1 que muestra una masa que crece entre el músculo psoas dcho. y la columna.C) Corte axial en T2 del mismo nivel, mostrando una masa con señal de alta intensidad.
La captación tumoral puede ser uniforme o irregular, con focos de menor captación que indican necrosis o áreas de diferenciación o clones de neuroblastos más inmaduros.
En los casos negativos, puede usase la gammagrafía con Tec-99.
Ecografía
Se usa inicialmente para buscar una masa abdominal u otras masas en el tejido blando, también en lactantes con hígado aumentado o masa abdominal o pélvica. Sin embargo, para precisar el estudio tumoral se deben hacer estudios que definan mejor las características anatómicas del tumor.
RMN
Es la mejor imagen pera el estudio del NB, además no radia por lo que ha suplantado a la TAC. Sus ventajas asientan en que determina con excelente definición el tumor primario, la exacta extensión al canal espinal o la relación con el diafragma. También la afectación de la MO y la afectación cortical, aunque se han descrito falsos positivos en la RMN para el estudio de la afectación de la MO después del tratamiento.
El NB primario en RMN es, típicamente, un tumor heterogéneo con realce con el contraste de gadolinio; se puede observar necrosis o hemorragias, también calcificaciones, aunque pueden no ser detectadas. La afectación hepática se aprecia mejor en la RMN que en la TAC. En caso de masa torácica, es necesario realizar una radiografía de tórax y una RMN/TAC para su estudio.
TAC
Evidencia el sitio y la extensión del tumor, la invasión regional, vascularización y calcificaciones, que ocurren en el 80% de los pacientes, además de los ganglios linfáticos. Diferencia bien el NB con el T. de Wilms, las dos masas abdominales más frecuentes en la edad infantil. El tumor puede ser grande con áreas de necrosis y hemorragias, invadir el orificio de conjunción y el espacio epidural. La afectación del cráneo y de las regiones orbitarias también puede estudiarse por TAC. La afectación cerebral es rara.
PET-FDG
Los datos de este estudio en NB son limitados, se basan en la captación de FDG por las células tumorales que tienen aumentado el metabolismo glicolítico y es proporcional a la masa celular y a la proliferación de la misma. Estos estudios se correlacionan bien con MIBG y la imagen convencional, aunque detectan más áreas afectadas a nivel osteomedular, comparadas con las gammagrafías con MIBG y con Tec. La detección de la enfermedad mínima residual no es posible por este método y tampoco la reacción de la MO tras la quimioterapia.
Diagnóstico anatomopatológico
El papel de la PET es definitivo en una pequeña porción de NB con MIBG negativo al diagnóstico, también en casos con NB del cuello combinando PET con TAC; ya que, la captación fisiológica de las glándulas salivares puede confundir las lesiones en tejidos blandos de este área.
El criterio mínimo establecido por acuerdo internacional para diagnosticar un neuroblastoma se basa en una de las características siguientes:
1. Un diagnóstico patológico inequívoco realizado por análisis del tejido tumoral con microscopia óptica, (con inmunohistología, microscopía electrónica o concentraciones elevadas de catecolaminas séricas o de catecolaminas o sus metabolitos urinarios o sin estos)(8,17).
2. La combinación de una muestra de médula ósea por aspiración o la biopsia por trépano que contenga células tumorales inequívocas (por ejemplo, sincitios o racimos de células inmunocitológicamente positivas) y concentraciones elevadas de catecolaminas séricas o de catecolaminas y de metabolitos urinarios, como se mencionó anteriormente(17).
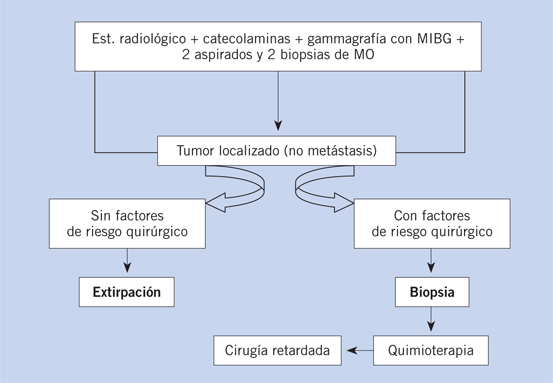
La biopsia o resección del tumor primario en estadios localizados, es necesaria para estudios biológicos e histológicos y asignar a los casos a la categoría de riesgo que les corresponda. En los tumores irresecables, no se deben intentar resecciones amplias. Se practicará un second look para resecar los restos tumorales tras la quimioterapia, biopsia y aspirado bicrestal de MO para descartar infiltración tumoral. Los estudios a realizar en el tejido tumoral: examen histológico y patrón para la clasificación de SHIMADA, tinciones inmuno histoquímicas (ENE, S-100, sinaptofisina, cromogranina y anti GD2), técnicas moleculares FISH y PCR para detectar amplificación de NMYC y otras alteraciones de interés pronóstico(18) (Tabla II). El NB en MO puede ser difícil de demostrar, ya que es un tumor de células pequeñas redondas que coinciden con otros tumores frecuentes en la misma edad. Para su diagnóstico, se tienen que demostrar células inequívocas de NB y aumento de catecolaminas en la orina. La figura 7 ilustra el camino diagnóstico en NB (tomado de V. Castel y A. Cañete, 2010)(8).
Estadios
El paciente debe ser estadiado con los resultados tras el estudio de las muestras biológicas, usando criterios anatómicos, moleculares y radiológicos o quirúrgicos, para estratificar los pacientes y determinar el mejor tratamiento.
El sistema internacional de estadiaje del neuroblastoma (INSS) es usado actualmente por todos los grupos cooperativos.
International Neuroblastoma Staging System:
• Estadio 1: tumor localizado con escisión macroscópica completa, con enfermedad residual microscópica o sin ésta; ganglios linfáticos ipsilaterales microscópicamente negativos para el tumor (los ganglios adheridos al tumor primario y extirpados junto con éste pueden ser positivos).
• Estadio 2A: tumor localizado sin extirpación macroscópica completa; ganglios linfáticos ipsilaterales negativos microscópicamente para el tumor.
• Estadio 2B: tumor localizado con extirpación microscópica completa o sin ésta; ganglios linfáticos ipsilaterales no adherentes positivos para el tumor. Los ganglios linfáticos contralaterales deben ser negativos para el tumor.
• Estadio 3: tumor irresecable unilateral, infiltrante, que pasa la línea media, con afectación de los ganglios linfáticos regionales o sin ésta; o tumor unilateral localizado con compromiso de los ganglios linfáticos contralaterales; o tumor en la línea media con extensión infiltrativa bilateral (irresecable) o por afectación de ganglios linfáticos. La línea media está determinada por la columna vertebral. Los tumores que se originan en un lado y cruzan la línea media deben infiltrarse sobre ésta o hacia el lado opuesto de la columna vertebral.
• Estadio 4: todo tumor primario diseminado a ganglios linfáticos distales, huesos, médula ósea, hígado o piel, a excepción del definido como estadio 4s.
• Estadio 4s: tumor primario localizado, como se define para el estadio 1, 2A y 2B con diseminación limitada a la piel, hígado y/o médula ósea, circunscrito a lactantes menores de 12 meses de edad. La MIBG debe ser negativa para la MO y el número de células tumorales debe ser <10% en biopsia o aspirado de MO.
El INSS está basado en el grado de resección quirúrgica y no parece lo adecuado para el uso como clasificación de riesgo pretratamiento.
Debido a ello, se desarrolla un nuevo sistema que utiliza la imagen pretratamiento para clasificar el riesgo del tumor, con estudios uniformes y criterios bien definidos entre los grupos (Tabla III).
Se desarrolla el INRGSS como sigue:
• L1: tumor localizado que no afecta estructuras vitales (definidos de acuerdo con los factores de riesgo radiológicos) y confinado a un solo compartimento.
• L2: tumor locorregional con presencia de uno o más factores de riesgo en el estudio de imagen.
• M: tumor con metástasis a distancia (excepto MS).
• MS: enfermedad metastásica en niños menores de 18 meses con metástasis en piel, hígado y/o MO.
Factores pronósticos en el neuroblastoma
Aproximadamente, el 70% de los pacientes con neuroblastoma presentan enfermedad metastásica en el momento del diagnóstico. El pronóstico de los pacientes con neuroblastoma está relacionado con: su edad en el momento del diagnóstico, el estadio clínico de la enfermedad, sitio del tumor primario, histología tumoral y, en los pacientes mayores de un año de edad, compromiso de los ganglios linfáticos regionales. Las variables biológicas pronósticas se usan también para ayudar a determinar el tratamiento(19). La supervivencia general a 5 años de todos los lactantes y niños con neuroblastoma ha aumentado del 52%, cuando se diagnosticaron entre 1973 y 1982, al 74% cuando se diagnosticaron entre 1999 y 2005; sin embargo, este número puede resultar engañoso debido al pronóstico extremadamente heterogéneo.
A la edad y al estadio se han añadido consideraciones histológicas y biológicas que permiten diferenciar mejor el pronóstico: clínicos: edad: > de 18 meses, estadio 3 y 4; bioquímicos: LDH: >1.500 U/L, índice AHV/AVM: >1,5, ferritina: >250 ng/ml, ENE: >100 ng/ml; genéticos: amplificación del NMYC, deleción del 11q hipoploidia; e histológicos: grupo histológico desfavorable según la clasificación de Shimada.
La edad, el estadio y la amplificación del NMYC son los factores pronósticos globalmente aceptados (Tabla III).
Tratamiento según grupo de riesgo
La importancia del enfoque del NB según los grupos de riesgo tiene como consecuencia adaptar el tratamiento adecuado a cada caso, permitiendo desescalar terapéutica en casos más favorables e intensificar en otros de mal pronóstico. Solo se podrá realizar con eficacia cuando tengamos un estudio correcto del paciente y completo de la biología del tumor (Tabla IV)(6).
El cuidado de un paciente con NB depende de un equipo multidisciplinario donde se incluyen los oncólogos pediátricos, radiólogos, histólogos, cirujanos, radioterapistas, médicos nucleares y enfermería, entre otros. Según se clasifiquen los pacientes en grupos de riesgo valorando todas las consideraciones anteriormente descritas tendrán un tratamiento diferente:
• Grupo de bajo riesgo: niños con NB estadio 1 ó 2 de cualquier edad y el estadio 4s, todos sin amplificación del NMYC, requieren un tratamiento que incluye cirugía y, en los casos que comprimen la médula espinal, recibirán quimioterapia y dexametasona o bien radioterapia o laminectomía si hay deterioro neurológico muy rápido; y en los que la afectación hepática sea comprometedora de la vida, tendrán tratamiento con quimioterapia carboplatino/etopósido hasta detener la progresión de la enfermedad y estabilizar al paciente. Los lactantes con estadio 3 sin amplificación del NMYC sólo recibirán quimioterapia suave y cirugía diferida.
• Grupo de riesgo intermedio: niños > de 18 meses con estadio 3, sin amplificación del NMYC y estadio 4 en lactantes sin amplificación del NMYC, recibirán un tratamiento con cirugía y quimioterapia moderada. Biopsia al diagnóstico y cirugía retardada, pudiéndose extirpar el 70% de los tumores en estadio 3 y se reduce el riesgo quirúrgico. La quimioterapia incluye: ciclofosfamida, vincristina, carboplatino y etopósido, menos frecuentemente, doxorrubicina y cisplatino.
• Grupo de alto riesgo: pacientes >18 meses con estadio 4 y cualquier estadio con amplificación del NMYC excepto el estadio 1. El tratamiento consiste en: quimioterapia de inducción COJEC +/- consolidación, cirugía, taspe autólogo, radioterapia en lecho tumoral, e inmunoterapia (retinoico, anticuerpo anti-GD2 +/- IL2) para la enfermedad mínima residual.
Nuevas direcciones del
tratamiento del NB de alto riesgo
Con la idea de mejorar el pronóstico y evitar las recaídas, se están estudiando por los grupos más representativos nuevas dianas terapéuticas: Ac. antiGD2: se cree que previene las recaídas basándose en que puede erradicar las células tumorales residuales después de completar la quimioterapia. IL2: su uso está basado en la acción sinérgica con el ác. monoclonal al modificar el microambiente de la célula tumoral. Yu y cols.(20) demostraron con la incorporación de estos dos agentes al tratamiento clásico con retinoico, una mejoría de supervivencia hasta el 86%. Actualmente, se intenta mejorar la terapia con ác. retinoico fenretinide, es un retinoico sintético que tiene un efecto antitumoral primario al inducir la muerte tumoral en el NB. Basado en que las células del NB son derivadas del sistema nervioso parasimpático y tienen un receptor de superficie para la epinefrina. Usando análogos como la metaiodobencilguanidina I-131 como diana sobre las células del NB, ha demostrado ser el método más efectivo para el tratamiento del NB en recaída(21). Se vuelve a considerar este tratamiento en la fase de consolidación. Inhibidor de la amorakinasa A, regulador clave del ciclo celular G2-M está siendo ensayada actualmente por el grupo de Maris. El descubrimiento del ALK como el gen más importante para la predisposición al NB, ya que se ha visto mutación del ALK o la amplificación del mismo en el 15% de los NB al diagnóstico y el 30% de los que recaen. Un tratamiento diana frente a este gen está actualmente en desarrollo(22).
Regresión espontánea del neuroblastoma
Este fenómeno se ha descrito bien en niños, especialmente en aquellos con el patrón 4S de diseminación metastásica. En un ensayo clínico alemán, la regresión espontánea o la falta de evolución se presentó en casi la mitad de 93 lactantes asintomáticos entre 12 meses o menos con tumores en estadios 1, 2 ó 3 sin amplificación del MYCN; todos fueron observados después de reseccion parcial o sin reseccion(23). La regresión generalmente tiene lugar solo en tumores con un número aproximadamente triploide de cromosomas que también carecen de la amplificación de MYCN y pérdida del cromosoma 1p. Las características relacionadas con la regresión espontánea incluyen la falta de expresión de telomerasa, la expresión de Ha-ras, y la expresión del receptor neurotrofina TrkA, un receptor del factor de crecimiento nervioso(24).
NB en adolescentes es un subgrupo especial que se caracteriza por factores pronósticos de alto riesgo y difieren de los que se encuentran en pacientes más jóvenes, especialmente con relación a las anomalías genéticas(25), sugiriendo un tratamiento diferente para este grupo de pacientes.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Lonergan GF, Schwab CM, Suárez ES, Carlason L. Neuroblastoma, Ganglioneuroblastoma and Ganglioneuroma: Radilogic-Pathologic Correlation. RG. 2002; 22: 911-34.
2.*** Ishola TA, Chung DH. Neuroblastoma: Surgical Oncol. 2007; 16: 149-56.
3. Lanzkousky P. Manual of Pediatric Hematology and Oncology. Fourth Edition. Elservier Inc.; 2005.
4. Mossé YP, Laudenslager M, Longo L. Identification of ALK as a mayor familial neuroblastoma predisposition gene. Nature. 2008; 16(455): 930-5.
5.** Park J R, Eggeret A, Caron H. Neuroblastoma: Biology, Prognosis and treatment. Pediatr Clin N Am. 2008; 55: 97-120.
6.** Maris JM. Recent Advances in Neuroblastoma. N Engl J Med. 2010; 362: 2202-11.
7.*** Vermeulen J, De Preter K, Mestdagh P, Laureys G, Speleman F, Vandesompele J. Predicting outcomes for children with neuroblastoma. Discov Med. 2010; 10: 29-36. Review.
8.*** Castel V, Cañete A. Neuroblastoma. En: Sánchez de Toledo J, Ortega JJ, eds. Hepatología y Oncología Pediátricas. Barcelona: Ergon; 2010. p. 281-90.
9. Komotar RJ, Otten ML, Starke RM, Anderson CE. Chromosome 1p and 11q deletions and Outcome in Neuroblastoma. A critical Review. Clin Med Oncology. 2008; 2: 419-20.
10. Attiyeh EF, London WB, Mossé YP. Children´s Oncology Group. Chromosome 1p and 11q deletions and outcome in neuroblastoma. N Engl J Med. 2005; 353: 2243-53.
11. Wang J, Oue T, Uehara S, Yamanaka H, Oji Y, Fukuzawa M. The role of WT1 gene in neuroblastoma. J Pediatr Surg. 2011; 46: 326-31.
12. Conh SL, Pearson AD, London WB. The International Neuroblastoma Risk Group (INRG) Classification System: An INRG Task Force report. J Clin Oncol. 2009; 27: 289-97.
13. Rudnick E, Khakoo Y, Antunes NL. Opsoclonus-myoclonus-ataxia syndrome in neuroblastoma: clinical outcome and antineuronal antibodies-a report from the Children’s Cancer Group Study. Med Pediatr Oncol. 2001; 36: 612-22.
14. Mitchell WG, Davalos-González Y, Brumm VL. Opsoclonus-ataxia caused by childhood neuroblastoma: developmental and neurologic sequelae. Pediatrics. 2002; 109: 86-98.
15. Planche V, Brochet C, Bakkouch A, Bernard M. Importance of haemolyses on neuron-specific enolasa measurement. Ann Biol Clin (Paris). 2010; 68: 239-42.
16. Matthay KK, Shulkin B, Ladenstein R. Criteria for evaluation of disease extent by (123) I-metaiodobenzylguanidine scans in neuroblastoma: a report for the International Neuroblastoma Risk Group (INRG) Task Force. Br J Cancer. 2010; 102: 1319-26.
17. Brodeur GM, Pritchard J, Berthold F. Revisions of the international criteria for neuroblastoma diagnosis, staging, and response to treatment. J Clin Oncol. 1993; 11: 1466-77.
18. Ambros PF, Ambros IM, Brodeur GM. International consensus for neuroblastoma molecular diagnostics: report from the International Neuroblastoma Risk Group (INRG) Biology Committee. Br J Cancer. 2009; 100: 1471-82.
19.** Cotterill SJ, Pearson AD, Pritchard J. Clinical prognostic factors in 1277 patients with neuroblastoma: results of The European Neuroblastoma Study Group ‘Survey’ 1982-1992. Eur J Cancer. 2000; 36: 901-8.
20. Yu AL, Gilman AL, Ozkaynak MF. Anti-GD2 antibody with GM-CSF, interleukin-2, and isotretinoin for neuroblastoma. N Engl J Med. 2010; 363: 1324-34.
21. Matthay KK, Reynolds CP, Seeger RC. Long-term results for children with high-risk neuroblastoma treated on a randomized trial of myeloablative therapy followed by 13-cis-retinoic acid: a children’s oncology group study. J Clin Oncol. 2009; 27: 1007-13.
22. Mosse YP, Diskin SJ, Wasserman Nl. Neuroblastomas have distinct genomic DNA profiles that predict clinical phenotype and regional gene expression. Genes Chromosomes Cancer. 2007; 46: 936-49.
23. Hero B, Simon T, Spitz R. Localized infant neuroblastomas often show spontaneous regression: results of the prospective trials NB95-S and NB97. J Clin Oncol. 2008; 26: 1504-10.
24. Fritsch P, Kerbl R, Lackner H. “Wait and see” strategy in localized neuroblastoma in infants: an option not only for cases detected by mass screening. Pediatr Blood Cancer. 2004; 43: 679-82.
25. Castel V, Villamón E, Cañete A. Neuroblastoma in adolescents: genetic and clinical characterisation. Clin Transl Oncol. 2010; 21: 49-54.
Bibliografía recomendada
– Ishola TA, Chung DH. Neuroblastoma: Surgical Oncol. 2007; 16: 149-56.
Revisión del tema con especial atención a la patobiología, diagnóstico y tratamiento.
– Park J R, Eggeret A, Caron H. Neuroblastoma: Biology, Prognosis and treatment. Pediatr Clin N Am. 2008; 55: 97-120.
Amplia revisión del tema con actualización en los aspectos biológicos y terapéuticos.
– Vermeulen J, De Preter K, Mestdagh P, Laureys G, Speleman F, Vandesompele J. Predicting outcomes for children with neuroblastoma. Discov Med. 2010; 10(50): 29-36.
Revisión de los factores pronósticos y su patogenia.
– Castel V, Cañete A. Neuroblastoma, En: Sánchez de Toledo J, Ortega JJ, eds. Hepatología y Oncología Pediátricas. Barcelona: Ergon; 2010. p. 281-90.
Práctica actualización de las características clínicas, pronósticas, diagnósticas y terapéuticas del neuroblastoma.
– Maris JM. Recent Advances in Neuroblastoma. N Engl J Med. 2010; 362: 2202-11.
Puesta al día de los grupos de riesgo y avances en las nuevas líneas del tratamiento.
– Lonergan GF, Schwab CM, Suárez ES, Carlason L. Neuroblastoma, Ganglioneuroblastoma and Ganglioneuroma: Radilogic-Pathologic Correlation. RG. 2002; 22: 911-34.
Revisión de las características radiológicas del NB y utilidad de las distintas técnicas para su estudio.
– Cotterill SJ, Pearson AD, Pritchard J. Clinical prognostic factors in 1277 patients with neuroblastoma: results of The European Neuroblastoma Study Group ‘Survey’ 1982-1992. Eur J Cancer. 2000; 36: 901-8.
Importante revisión sobre datos de enfermos de NB comunicados al Grupo Europeo de Estudio del NB.
| Caso clínico | |
|
Paciente de 6 años y 7 meses. Antecedentes familiares Padres jóvenes, sanos y no consanguíneos. Hermana de 4 a. Sana. AP: ingresada a los 9 m por cuadro febril catalogado de faringoamigdalitis de etiología viral. Angioma tuberoso 1×1 en región malar dcha. Enfermedad actual Comienza 2 meses antes del ingreso. Acude a su médico por dolor y rigidez a nivel cervical: tratamiento ibuprofeno y fisioterapia. Un mes después acude de nuevo porque no nota mejoría y además le duelen las piernas a lo largo de ambos muslos. Astenia y fiebre <38°C. Se practica analítica: VSG: 90; hemograma: normal; PCR: 7,8 mg/dl; ASLO: 450; LDH: 587U/L; sideremia: 31 mg/dl; IS: 11; no se hizo ferritina. Historia al ingreso Consulta en nuestro servicio a los 2 meses de evolución porque persisten las molestias en piernas, brazos y espalda, no mejora con el reposo, no cojea. Cambios de carácter: irritable, triste. Persiste fiebre intermitente. Pérdida de 1 kg de peso. Exploración Decaída, triste. Ganglionar sin interés. Auscultación respiratoria: normal; auscultación cardiaca: destaca un tercer ruido, con cadencia de galope. No visceromegalias, ni se palpan masas, no signos inflamatorios articulares. Signos meníngeos negativos y pares craneales normales, 3 manchas café con leche en tronco y brazos. No se identifica foco infeccioso. TA: 102/60 mmHg, SatO2: 99%. Peso: 20,5 kg. Estudios complementarios ECG: frecuencia 120 L/min. No hallazgos patológicos. Eje QRS -10º, precordiales y repolarización: normales. ECO Doppler: FE: 65%, FA: 35%. Estructura y flujos normales. Coronarias y pericardio: normal, analítica: VSG: 107, hemograma: H: 4.290, Hb: 10,7, L: 5.990. Ne: 61,3%, plaq.: 533.000, LDH: 700, PCR: 12.86 mg/dl, se cataloga de fiebre sin foco e ingresa para estudio. Otros estudios: Rx tórax: imagen retrocardiaca paravertebral (Fig 8A). Fondo de ojo: normal, ecografía abdominal: normal, poblaciones linfocitarias: normal, proteinograma: hiper alfa2 inmunoglobulinas, C3, C4, CK-MB, FR, colesterol, triglicéridos, F. renal y hepática: normales, ferritina: 335, LDH: 979, fibrinógeno 586, DD: 2,77. PCR: 6,59 mg/dl, Ac ANA, DNA, ENA, ANCA: negativos. Se practica gammagrafía con MIBG (Fig. 8B). Se determinan: AVM: 30 mg/24 h (N: 0,5-12), dopamina >1.194 ng/24 h (N: 190-450). Epinefrinas y metanefrinas: normales, enolasa neuronal específica: 56 ng/ml (N: 2-18), ferritina: 416 ng/ml y biopsia de médula ósea (Fig. 10). |
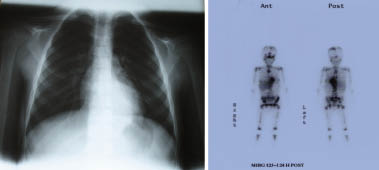
Figura 8. A) Rx de tórax: imagen de condensación retrocardiaca en forma de huso. B) Gammagrafía con MIBG: depósito patológico de trazador en región retrocardiaca a nivel de la tumoración existente en esa zona. Además, en calota craneal, vértebras dorsales, pala ilíaca izquierda, húmeros, fémures y 6º arco costal en hemitórax

Figura 9. RMN. Masa paravertebral izquierda (3x8x6 cm) toracoabdominal y retrocrural con presencia de calcificaciones en su interior. Afectación ósea en D7-D8-D9-D10 y L5 sin invasión del canal medular.
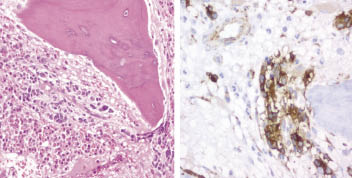
Figura 10. A) Cilindro óseo que presenta infiltración neoplásica en forma de pequeños islotes celulares a nivel inter y peritrabecular en algunas celdillas. Las células tumorales presentan núcleos ovoides hipercromáticos y citoplasmas pobremente definidos. B) Con técnicas de inmunohistoquímica fueron enolasa +.
|