|
| Temas de FC |
A. Cervera Bravo
Servicio de Pediatría del Hospital de Móstoles. Madrid
| Resumen
Se explican las bases fisiológicas de la coagulación, comentando tanto el modelo clásico de cascada de la coagulación, útil para entender los resultados de las pruebas de cribado coagulación, como el modelo más actual basado en la célula, que se ajusta mejor a lo que ocurre in vivo. Se habla de los trastornos de coagulación hereditarios más frecuentes: La enfermedad de von Willebrand (EVW) y la hemofilia A (déficit del factor VIII) y B (déficit del factor IX). La EVW se debe a la disminución cualitativa o cuantitativa de la actividad del factor de von Willebrand, produce clínica de hemorragia mucocutánea y tiene, generalmente, herencia autosómica dominante. Se destaca la importancia de la clínica de sangrado para el diagnóstico y se muestran las pruebas de laboratorio para diferenciar los distintos subtipos y el tratamiento más adecuado en los mismos. La hemofilia A o B tiene herencia recesiva ligada a X y hay un 30% de mutaciones de novo. La gravedad de la clínica se correlaciona con los niveles del factor. Se expone cómo se realiza el diagnóstico, el consejo genético y el tratamiento actual con factor VIII o IX. |
| Abstract
Physiology basis of coagulation is expounded. Both classic “cascade” model that better explains the results of coagulation screening tests, and actual cell-based model that adjusts better to what occurs “in vivo” are remarked. The most frequent inherited coagulation disorders are commented: Von Willebrand disease (VWD), hemophilia A (factor VIII deficiency) and hemophilia B (factor IX deficiency). VWD is characterized by a qualitative or quantitative decrease of the von Willebrand factor activity, produces mucocutaneous bleeding and usually has autosomal dominant inheritance. The importance of the bleeding symptoms for its diagnosis is emphasized. Laboratory work up to differentiate the distinct subtypes and their most adequate treatment are shown. Hemophilia A or B has X-linked recessive inheritance and there is a 30% of “de novo” mutations. Clinical severity correlates with factor levels. Diagnosis, genetic counseling and present treatment with factors are exposed. |
Palabras clave: Coagulación de la sangre; Enfermedades de von Willebrand; Hemofilia A; Hemofilia B.
Key words: Blood coagulation; Von Willebrand diseases; Hemophilia A; Hemophilia B.
Pediatr Integral 2012; XVI(5): 387-398
Fisiopatología y trastornos de la coagulación hereditarios más frecuentes
Fisiología de la hemostasia y de la coagulación
La hemostasia es el mecanismo que se pone en marcha tras una lesión vascular para impedir la hemorragia y que incluye una respuesta vascular (vasoconstricción y activación de la coagulación), otra celular (adherencia y agregación plaquetaria) y un componente plasmático (factores de la coagulación) que, finalmente, llevan a la producción y estabilización de un coágulo de fibrina. Existe un mecanismo regulador que limita la coagulación al lecho afectado (anticoagulantes) y, finalmente, se restablece la permeabilidad del vaso sanguíneo por medio de la fibrinólisis y la cicatrización vascular. Si la coagulación es defectuosa, se producirá una hemorragia. Si es excesiva porque fallan los mecanismos reguladores, se producirá una trombosis.
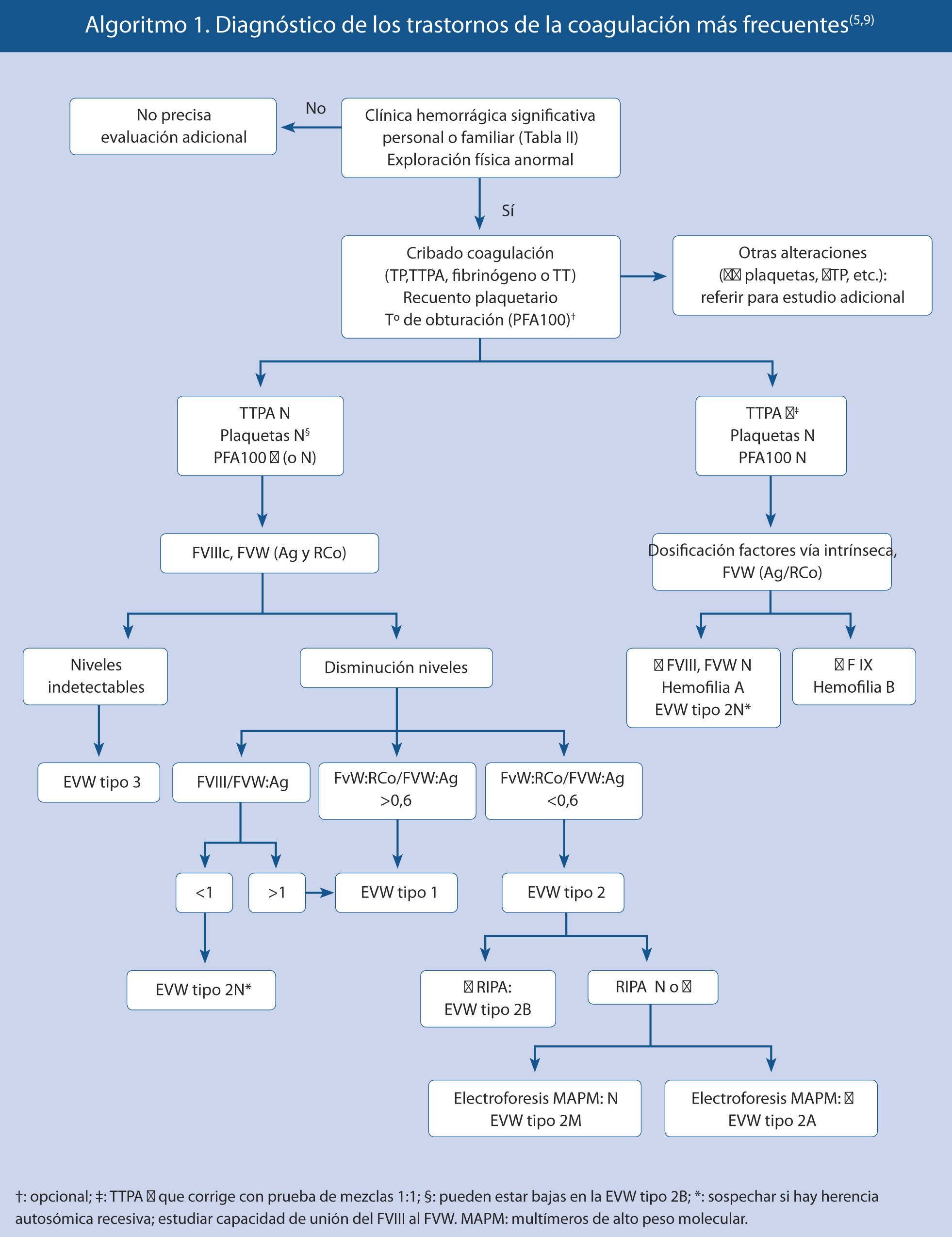
Tras la lesión vascular, se produce una vasoconstricción y el flujo de sangre queda expuesto a la matriz subendotelial. El factor de von Willebrand (FVW) producido por las células endoteliales o el que fluye por el plasma, unido al factor VIII (FVIII), entra en contacto con las proteínas de la matriz subendotelial, cambia su conformación y proporciona el pegamento al que se unen las plaquetas por medio de un receptor para el mismo (adherencia plaquetaria). Una vez adheridas, las plaquetas se activan y liberan unos gránulos (ADP, tromboxano A2, etc.), que aumentan el coágulo por medio de la interacción plaquetaria (agregación plaquetaria) y atraen otras plaquetas hacia el coágulo plaquetario. Los fosfolípidos de la membrana plaquetaria se exteriorizan e interaccionan con los complejos X-asa y protrombinasa donde actúan como cofactores el FVIII de la coagulación y el factor V (FV), respectivamente, regulando la velocidad del proceso de coagulación, que precisa de esa superficie fosfolipídica para su correcto funcionamiento (Fig. 1). A su vez, la lesión vascular libera el factor tisular y altera la superficie vascular, iniciándose la cascada de la coagulación y la formación final del coágulo de fibrina(1,2). Unos factores de la coagulación circulan por el plasma como proteínas precursoras inactivas, llamadas zimógenos. Al iniciarse la coagulación, los zimógenos se activan y, a su vez, activan a otros, en una reacción en cadena, en la que otros factores de la coagulación actúan como cofactores, catalizando esas reacciones hasta que, finalmente, el fibrinógeno se transforma en fibrina, formando el coágulo. Este se retrae y estabiliza por medio del factor XIII (FXIII) (Fig. 1). Las plaquetas proporcionan la superficie en la que se producen las reacciones de los factores de la coagulación, forman un tapón en el lugar del daño vascular y se contraen para limitar el tamaño del coágulo.
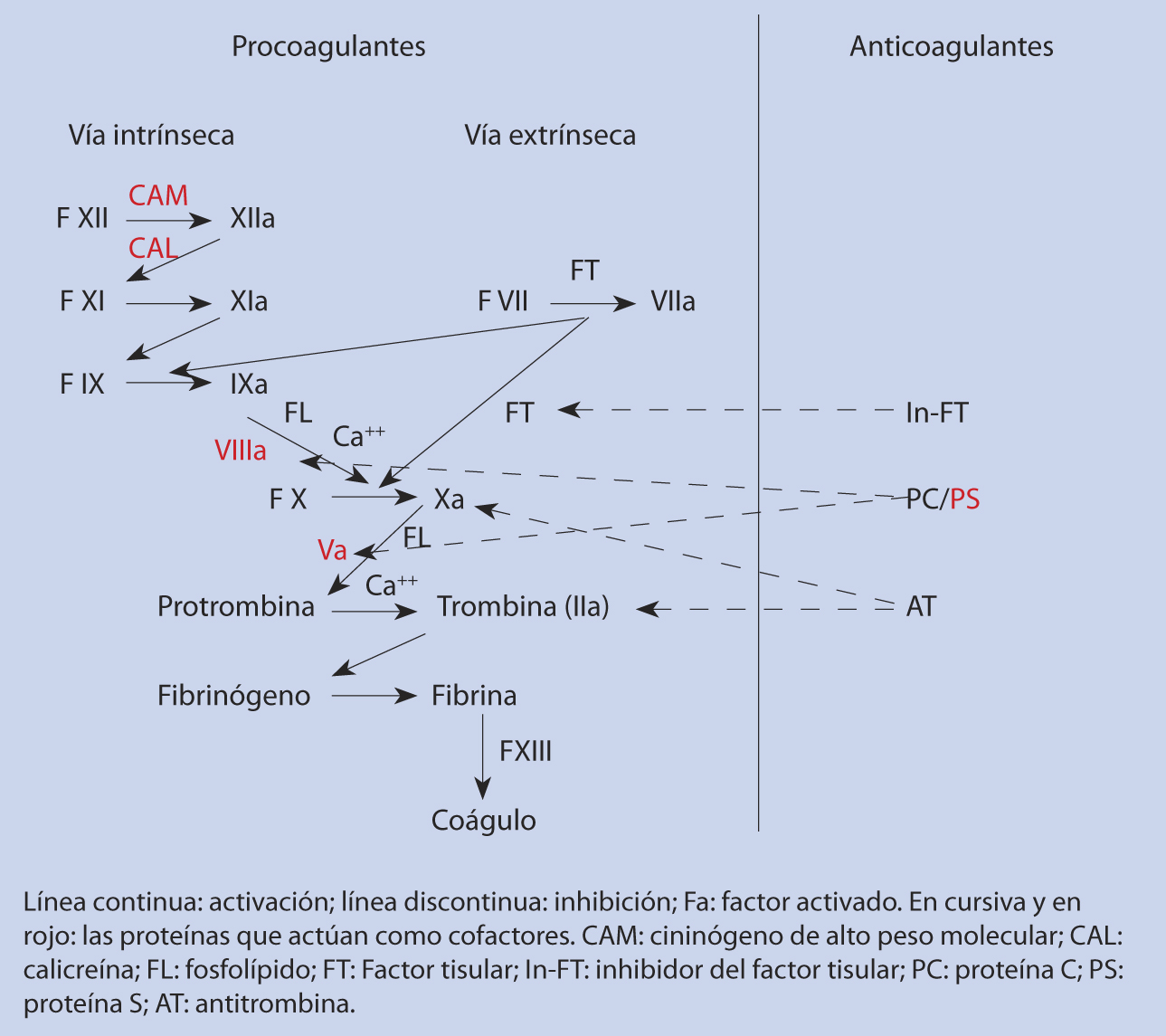 Figura 1. Cascada de la coagulación sanguínea.
Figura 1. Cascada de la coagulación sanguínea.
El modelo clásico de coagulación que separa las vías intrínseca (activada por factores de contacto) y extrínseca (mediada por el factor tisular) es útil desde el punto de vista didáctico y para valorar los resultados de los estudios de laboratorio (Fig. 1). Sin embargo, in vivo, la realidad es más compleja y ambos procesos están imbricados: el factor VII activado (FVIIa) por el factor tisular, no sólo activa el factor X (FX), sino también el factor IX (FIX). El FXa puede activar tanto el FVIII como el FV. Además, en el modelo actual de la coagulación basado en la célula, la trombina juega un papel fundamental, amplificando todo el proceso. Según este modelo, la coagulación podría esquematizarse en tres estadios(3):
1. Iniciación: en la superficie de la célula portadora del factor tisular (FT).
2. Amplificación: activación de las plaquetas y de los cofactores, para poder generar mayores cantidades de trombina.
3. Propagación: generación de grandes cantidades de trombina en la superficie plaquetar.
La generación de trombina, no sólo ayuda a producir una pequeña cantidad inicial de fibrina por la acción del FVIIa-FT (vía extrínseca) sino que, además, amplifica y propaga la coagulación, activando las plaquetas, que son las que proporcionan la superficie sobre la que se desencadena la vía intrínseca de la coagulación in vivo(3) y activando, además, los factores XI, VIII, V, y XIII (Fig. 2). Eso explica que el déficit del factor XI tenga relevancia clínica(4) y, en cambio, no la tenga el déficit de los factores de contacto; también, justifica que los hemofílicos sangren, a pesar de la pequeña formación inicial de trombina y fibrina desde la vía extrínseca, porque en ellos no se produciría esa amplificación(3). Además, la trombina, al unirse a la trombomodulina, su receptor endotelial, actúa como anticoagulante, activando la proteína C. De ese modo, cuando la trombina no encuentra un endotelio dañado, cambia su función y actúa como anticoagulante, impidiendo así la formación de coágulos.
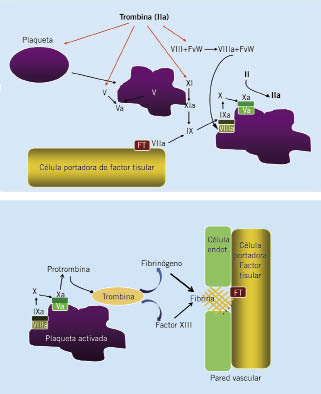 Figura 2. Modelo celular de la vía intrínseca de la coagulación in vivo. A) La trombina inicial, formada por la vía extrínseca, activa las plaquetas que, tras el daño vascular, se ponen en contacto con las células portadoras del factor tisular y proporcionan la superficie celular sobre la que se desencadena esta vía. La trombina activa, además, los factores V, XI y VIII. El factor VIIa contribuye activando el factor IX. B) El fibrinógeno es transformado por acción de la trombina en fibrina, que se estabiliza por el factor XIII, reparando el daño vascular. Los factores VIIIa-IXa forman el complejo X-asa (en marrón) y los factores Xa-Va forman el complejo protrombinasa (en verde).
Figura 2. Modelo celular de la vía intrínseca de la coagulación in vivo. A) La trombina inicial, formada por la vía extrínseca, activa las plaquetas que, tras el daño vascular, se ponen en contacto con las células portadoras del factor tisular y proporcionan la superficie celular sobre la que se desencadena esta vía. La trombina activa, además, los factores V, XI y VIII. El factor VIIa contribuye activando el factor IX. B) El fibrinógeno es transformado por acción de la trombina en fibrina, que se estabiliza por el factor XIII, reparando el daño vascular. Los factores VIIIa-IXa forman el complejo X-asa (en marrón) y los factores Xa-Va forman el complejo protrombinasa (en verde).
La coagulación está regulada por anticoagulantes naturales: la proteína C y la proteína S (que actúa como cofactor) que inactivan el FVIII y FV; la antitrombina, que inhibe principalmente al FXa y la trombina y, en menor grado, los factores IXa, XIa y XIIa; y el inhibidor del factor tisular (Fig. 1). Finalmente, la restauración de la permeabilidad vascular se establece por la fibrinólisis: la plasmina, proteína final de la vía fibrinolítica, degrada la fibrina, apareciendo los productos de degradación de la fibrina (PDF) y los dímeros-D. La generación de la plasmina desde el plasminógeno está estimulada por el activador tisular del plasminógeno y la reacción está limitada por el inhibidor del activador del plasminógeno (IAP), por la a2-antiplasmina y por el inhibidor de la fibrinólisis activable por trombina (a través del complejo trombina-trombomodulina), que actúan a nivel más distal(1,2) (Fig. 3).
 Figura 3. Sistema fibrinolítico.
Figura 3. Sistema fibrinolítico.
Algunas proteínas de la coagulación son vitamina K-dependientes: los factores procoagulantes II (protrombina), VII, IX y X y las proteínas anticoagulantes C y S. Todas ellas comparten un residuo, el ácido g-carboxiglutámico, producido por acción de la vitamina K, que les permite unirse a iones de calcio y, como resultado, unirse a vesículas compuestas de fosfolípidos o a receptores específicos(2).
Trastornos hereditarios de la coagulación más frecuentes
Los trastornos de la coagulación más frecuentes son la enfermedad de von Willebrand, la hemofilia A y la hemofilia B, que son las que cursan con clínica más importante en la infancia. La mayoría de los trastornos graves se manifiestan en el periodo neonatal o en la primera infancia.
Enfermedad de von Willebrand (EVW)
Es la causa congénita más común de diátesis hemorrágica originada por la deficiencia cualitativa o cuantitativa del factor de von Willebrand (FVW). Tiene herencia autosómica dominante y, más infrecuentemente, recesiva.
La prevalencia en la población es del 1%(5-7), aunque la enfermedad sintomática es menos frecuente, del 0,11% en estudios de Atención Primaria(7). Existe un trastorno cuantitativo o cualitativo del FVW, proteína multimérica sintetizada en megacariocitos y células endoteliales, que cumple dos funciones: 1) promover la adhesión y agregación plaquetaria y su unión al colágeno en los lugares de daño endotelial; 2) actuar como transportador del FVIII, estabilizándolo y prolongando su vida media. El gen de la proteína se encuentra en el brazo corto del cromosoma 12. La proteína que circula en el plasma lo hace con una masa molecular que oscila entre 500-20.000 kDa, según el grado de multimerización de las subunidades. Los multímeros de peso molecular más alto son los que tienen mayor funcionalidad hemostásica(5,6).
Clasificación(5-7)
Hay varios tipos de EVW según el grado y alteración cualitativa o cuantitativa del factor.
La clasificación de los diferentes tipos y su prevalencia se muestran en la tabla I.

• Tipo 1: es el más frecuente, producido por un déficit cuantitativo parcial del FVW, debido a mutaciones del gen que conllevan una menor síntesis o un mayor aclaramiento del factor, aunque también podría ser consecuencia de afectación de otros genes que regularán la síntesis del FVW. Es autosómica dominante, pero con gran variabilidad en la penetrancia y expresión clínica.
• Tipo 2: se caracteriza por alteraciones cualitativas del FVW. Se subdivide en 4 subtipos: el tipo 2A tiene un menor número de multímeros de intermedio y alto peso molecular del FVW, que son los más funcionales. Eso ocurre por incapacidad inherente para formar dichos multímeros, o porque son más susceptibles a la proteólisis inducida por la enzima ADAMS13. En el tipo 2B, el FVW se une con mayor afinidad a la glicoproteína plaquetaria Ib (GPIb), receptor plaquetario del FVW, produciendo una disminución de los multímeros de alto peso molecular y mayor agregación plaquetaria con trombocitopenia en algunos pacientes. El tipo 2M es raro y se caracteriza porque el FVW tiene menor capacidad de unión a la GPIb. Los multímeros están presentes pero no son funcionales. El tipo 2N es una alteración poco frecuente; la mutación del gen de FVW afecta al lugar de unión del factor VIII, por lo que la función hemostásica del FVW está conservada, pero existe una disminución del factor VIII (5-15% de lo normal) que, al no estar unido al FVW, se cataboliza más rápidamente. Puede confundirse con la hemofilia A.
• Tipo 3: es una forma grave, con afectación de los dos alelos del gen del FVW, con niveles muy bajos o indetectables de FVW. Eso, a su vez, produce una disminución severa del factor VIII. Los padres pueden tener EVW tipo 1 o pueden ser heterocigotos para un alelo nulo que sólo se manifieste en situación de homocigosis o doble heterocigosis(4).
La herencia, en general, es autosómica dominante, salvo en el tipo 2N, el tipo 3 y algunos casos de otros subtipos, que son autosómicos recesivos (Tabla I).
Clínica(5-8)
La EVW produce clínica de hemorragia mucocutánea exclusiva, salvo los tipos 2N y 3 en los que puede sumarse sangrado en tejidos blandos y profundos.
La EVW de tipo 1 puede pasar bastante desapercibida, ya que, en muchos pacientes, es una enfermedad leve que, produce pocos síntomas de sangrado o estos pasan desapercibidos (menorragias, etc.). Cuando dan clínica, ésta es de hemorragia mucocutánea: facilidad de sangrado cutáneo con petequias o equimosis, hemorragias prolongadas de mucosas orofarígea (epistaxis, hemorragias gingivales o tras extracción dentaria, etc.), uterina (menorragias) o gastrointestinal (hemorragias digestivas) o tras intervenciones quirúrgicas en dichas localizaciones. El sangrado post-cirugía con pruebas de coagulación previas normales obliga a descartar EVW. Los tipos 2A, 2M y 2B suelen tener clínica moderada o algo más severa. El tipo infrecuente 2N puede producir clínica de leve a moderada de sangrado en tejidos blandos, musculares o articulares tras traumatismos, hematuria o hemorragia post-cirugía parecido a la hemofilia A leve-moderada (véase más adelante), pero con herencia autosómica. Si es un doble heterocigoto en el que la mutación de un alelo afecta a la unión del FVIII y el otro es otra forma de EVW, puede haber también clínica de hemorragia mucocutánea. El tipo 3 es una forma grave, en la que, a la clínica mucocutánea grave por niveles indetectables de FVW, se suma la de sangrado en los tejidos profundos por disminución severa del FVIII.
Diagnóstico
El diagnóstico de EVW requiere tres criterios: 1) disfunción cualitativa o cuantitativa del factor de von Willebrand; 2) clínica hemorrágica; y 3) herencia familiar autosómica.
No es fácil el diagnosticar la EVW en muchos pacientes, dado que la actividad del factor puede estar en límites inferiores de lo normal y aumentar en diferentes situaciones (estrés, ejercicio, hormonas, tratamiento con contraceptivos…); ya que, tanto el FVIII como el FVW, son reactantes de fase aguda, enmascarando el problema(1-8). Eso obliga a realizar varias determinaciones en diferentes ocasiones. Además, los niveles del FVW pueden estar influenciados por otros genes, como el grupo sanguíneo ABO (p. ej.: son un 25-30% más bajos en el grupo O). Por otro lado, el diagnóstico de un trastorno hemorrágico debe estar más centrado en la presencia de clínica de sangrado que en los hallazgos incidentales de alteraciones en los resultados de laboratorio. Actualmente, para el diagnóstico de la EVW se requiere la presencia de síntomas de sangrado en el paciente y en algún familiar con herencia autosómica dominante o recesiva(8,9). La presencia de algún síntoma hemorrágico es bastante frecuente en la población general (especialmente epistaxis o menorragia…), por lo que no es fácil diferenciar cuándo una clínica de sangrado es o no significativa. Recientemente, se han elaborado cuestionarios y escores clínicos(5,7,8), aunque todavía no hay consenso sobre su empleo. Las preguntas más informativas están relacionadas con el sangrado prolongado tras la cirugía o extracciones dentales, la presencia de hematomas musculares o hemartros, y la historia familiar de una enfermedad hemorrágica establecida(5). También, ayuda el grado y severidad del sangrado y la presencia de varios síntomas hemorrágicos(8). La tabla II muestra el cuestionario sugerido en la guía clínica americana(5).

Los estudios de laboratorio deben iniciarse con un cribado de la coagulación (Algoritmo 1). Puede haber una disminución del FVIII coagulante (FVIIIc) paralela a la disminución cuantitativa del FVW que prolongue levemente el tiempo de tromboplastina parcial activado (TTPA). El PFA-100® o tiempo de obturación es un buen método de cribado (mide el tiempo que tarda en cerrarse la abertura de un cartucho recubierto de colágeno con ADP o epinefrina al pasar por ella sangre citratada: las plaquetas tienden a adherirse y agregarse cerrando el orificio); en la EVW (al igual que en alteraciones plaquetarias) está prolongado. El tiempo de hemorragia es menos sensible y es más difícil de estandarizar(4,5). Puede haber, sin embargo, una normalidad en las pruebas de cribado, por lo que, si la clínica y los antecedentes familiares son sugerentes, se debería estudiar directamente el FVW(5).
El estudio del FVW debe incluir los niveles cuantitativos de la proteína (FVW:Ag), su función o actividad por la prueba del cofactor de ristocetina (FVW:RCo) y el FVIIIc. La FVW:RCo mide la capacidad de FVW (con diferentes diluciones de plasma) de aglutinar plaquetas, uniéndose a su principal receptor, el GPIb, en presencia de ristocetina, antibiótico que se une tanto al FVW como a GPIb y produce aglutinación plaquetaria. Niveles bajos de FVW:Ag entre un 35-50 UI/dl pueden aparecer también en personas normales y sólo se asocian a anomalías del gen en un 51% de los casos(5,7,8). Por eso, sólo debería hacerse el diagnóstico de EVW tipo 1 si, además, hay herencia clara y síntomas de sangrado. Una disminución paralela de ambos niveles (FVW:Ag y FVW:RCo) manifiesta una alteración cuantitativa (EVW tipo 1), y una mayor disminución de la función (FVW:RCo) muestra una alteración cualitativa (EVW tipo 2). La tabla I y el algoritmo 1 muestran cómo diagnosticar los diferentes subtipos de EVW(5,6,9). De forma práctica, sin embargo, el único subtipo que habría que descartar es el subtipo 2B, porque en él está contraindicado el empleo de desmopresina, principal tratamiento en la mayoría de estos pacientes(8). Para ello, se realiza la agregación plaquetaria medida por diferentes concentraciones de ristocetina (RIPA) que será mayor de lo normal en el tipo 2B, inducida por una concentración baja de ristocetina, que no produce agregación en individuos normales (Algoritmo 2). Este tipo puede confundirse con una afectación plaquetaria intrínseca (pseudo-EVW) con trombopenia y RIPA incrementado.
Tratamiento
El tratamiento fundamental en la EVW tipo 1 y el tipo 2 leve es la desmopresina; en los tipos 2, moderados-graves, o el tipo 3, los concentrados de FVW. Los antifibrinolíticos son útiles como tratamiento coadyuvante.
En todos los pacientes con EVW excepto en el tipo 2B o el tipo 3, se debe ensayar al diagnóstico la respuesta a la desmopresina (1-desamino-8-D-arginina vasopresina: DDAVP), que libera tanto el FVIII como el FVW de su lugar de almacenamiento en el endotelio. La respuesta es variable de unos pacientes a otros, pero es consistente en un mismo paciente y permite planificar el tratamiento más adecuado en las diferentes situaciones clínicas (hemorragias o pre-cirugía). La mayoría de los pacientes con tipo 1 responden y un porcentaje de los de tipo 2, generalmente los menos graves, aunque se debe ensayar en todos(8,10,11) (Algoritmo 2). En la mayoría de las formas graves del tipo 2, el defecto cualitativo no puede ser compensado por la liberación de más moléculas de FVW defectuoso. En el tipo 2B, la liberación de FVW anormal puede aumentar la aglutinación plaquetaria y acentuar la trombopenia, por lo que no se recomienda; en el tipo 3 no habrá respuesta. La dosis y administración se muestra en la tabla III. Produce un incremento de 3-5 veces los niveles basales hacia los 30-60 minutos y dura de 6-12 horas (por lo que se puede administrar/3 veces al día el primer día y luego cada 12-24 horas). Se debe monitorizar la actividad del FVW:RCo y del FVIIIc en casos de cirugías mayores pero no es necesaria para episodios de sangrados leves. Con las dosis repetidas, el efecto va siendo menor (taquifilaxia), por lo que si se precisa mantener niveles adecuados de FVW más de 3 días hay que emplear concentrados de FVW. Puede aparecer enrojecimiento, cefalea, hiper o hipotensión, molestias gastrointestinales e hiponatremia como efectos secundarios(5) (Tabla III).

En los casos en los que no puede emplearse el DDAVP, hay que administrar concentrados plasmáticos de FVIII/FVW inactivados para virus, que contengan grandes cantidades de FVW. Existen unas recomendaciones para las dosis a emplear dependiendo del tipo de hemorragia o como profilaxis en cirugía, para mantener niveles adecuados de FvW:RCo y FVIIIc(5,11) (Tabla III). De forma excepcional, puede ser necesaria la transfusión de plaquetas cuando la hemorragia no cede con altas dosis de concentrado de FVIII/FVW(7,11).
El tratamiento con antifibrinolíticos (Tabla III) puede ser eficaz como tratamiento aislado o adyuvante en todos los pacientes con sangrado en mucosas con gran actividad fibrinolítica (epistaxis, extracciones dentarias, menorragias, etc.) al estabilizar el coágulo(5,8,11). Está contraindicado en la hematuria. El tratamiento con estrógenos puede emplearse en las menorragias que no responden a antifibrinolíticos o DDAVP intranasal(7,8). La aplicación local de agentes tópicos (selladores de fibrina, colágeno) puede restablecer la hemostasia en vasos pequeños, especialmente en la cavidad bucal(5).
Hemofilia A y B
Se originan por el déficit o ausencia de la función del factor VIII (hemofilia A) o IX (hemofilia B). Tienen herencia recesiva ligada al X.
La hemofilia A es cinco veces más frecuente que la B, afecta de 1/5.000-10.000 y la B a 1/30.000-50.000 recién nacidos varones. Se producen por mutaciones del gen del factor VIII (FVIII), en posición Xq28 o del factor IX (FIX) en posición Xq27. Un tercio de las mutaciones aparecen de novo, dando lugar a una mujer portadora o un varón enfermo, en los que no habrá antecedentes familiares(2,6). La clínica es idéntica, ya que ambos factores actúan conjuntamente en la vía intrínseca de la coagulación. La gravedad del fenotipo depende de la actividad del factor VIII o IX. Se considera deficiencia grave si la actividad del factor es <1%, moderada entre 1-5 % y leve si es >5 %.
Clínica
Los niveles del factor determinan la gravedad clínica del cuadro.
Aunque los pacientes hemofílicos pueden sangrar en cualquier área, son las hemorragias en las articulaciones y los hematomas musculares los más específicos y los que producen, sin tratamiento adecuado, una mayor morbilidad. La edad de aparición y la gravedad de las manifestaciones clínicas dependen de los niveles del factor. Los casos graves, que son los más frecuentes en la hemofilia A, tienen sangrado profundo de forma espontánea o con mínimos traumatismos, presentando síntomas antes del primer año de vida, cuando inician la deambulación. Los segundos tienen menos hemorragias espontáneas pero pueden sangrar de forma importante tras traumatismos o cirugía y dan la cara más tarde. Los leves sangran sólo con traumatismos o tras cirugía(6,12,13)(Tabla IV). En los casos graves, la incidencia de hemorragias cerebrales en el periodo neonatal es baja, de un 2%. Las formas habituales de presentación en los primeros años son: equimosis, hematomas grandes al mínimo traumatismo (p. ej., vacunaciones intramusculares) y sangrado bucal. La hemartrosis puede presentarse en cualquier articulación, pero el tobillo, la rodilla y el codo suelen ser las localizaciones más frecuentes. Se manifiesta como dolor, tumefacción y aumento de la temperatura de la articulación con impotencia funcional con o sin traumatismo previo, y cuando aparece debe sospecharse y tratarse de forma inmediata para evitar un daño irreparable. Las hemartrosis repetidas producen una hipertrofia sinovial, que facilita nuevos sangrados, depósitos de hemosiderina, sinovitis crónica y, en pocos años, se desarrolla una artropatía grave irreversible(13). La presentación de hematomas musculares, especialmente en el psoas-ilíaco y en el brazo, con compromiso vascular, y las hemorragias del SNC son otras de las manifestaciones clínicas graves que precisan un tratamiento sustitutivo de urgencia. Los pacientes con déficit moderado o leve suelen diagnosticarse más tarde y, en ocasiones, se detectan en análisis preoperatorios (Tabla IV)(6,13).

Diagnóstico
El diagnóstico se establece por la disminución de la actividad del factor.
El déficit de FVIII o FIX produce una prolongación del TTPA con tiempo de protrombina normal. La confirmación se da cuando el nivel de actividad del factor –factor coagulante– es inferior al normal en dos determinaciones analíticas (<50% o 50 UI/dl), tanto por déficit de la proteína, como por alteración de su función. El diagnóstico diferencial principal se establece con la EVW, porque, como se ha comentado, el FVW transporta y estabiliza al FVIII evitando su degradación proteolítica y, por tanto, en esa enfermedad, los niveles de FVIII pueden ser bajos. Por eso, es necesario también determinar los niveles y función del FVW y, en especial, descartar el tipo 2N de EVW, si la herencia es autosómica(6,13).
Consejo genético(6,13)
La hemofilia es una enfermedad hereditaria ligada al sexo con mutaciones espontáneas (de novo) en un tercio de los pacientes.
Es importante conocer si se trata de una nueva mutación o es un caso heredado para establecer un pronóstico frente a otros hijos. En los heredados, suele haber casos familiares. Debido a su transmisión por el cromosoma X, en un varón afecto todas sus hijas serán portadoras y no habrá hijos varones enfermos. Las mujeres portadoras tendrán un 50% de hijos varones afectos y un 50% de mujeres portadoras. Los árboles genealógicos pueden ayudar a establecer a las portadoras obligadas. También, se puede hacer un estudio de la actividad del FVIII o FIX en madres de varones enfermos graves, pues suelen estar disminuidos. El estudio genético es complejo, puesto que se han descrito más de 2.500 mutaciones diferentes, pero puede ayudar a confirmar o descartar las posibles portadoras. De forma excepcional, las mujeres pueden tener clínica y niveles bajos del FVIII o FIX, bien por el fenómeno de inactivación al azar de un cromosoma X (fenómeno de Lyon), por ser portadoras de anomalías en ambos genes, tanto de origen paterno como materno, o por enfermedad de Turner. Se puede realizar un diagnóstico prenatal por biopsia de vellosidad coriónica (10-14 semanas de gestación –SG–) o amniocentesis (15-20 SG). Es posible determinar el sexo del feto a las 7 SG por estudio de DNA fetal en sangre materna y evitar, si son mujeres, exploraciones más invasivas(14). También, se ha desarrollado el diagnóstico genético pre-implantacional para elegir el embrión sano antes de su implantación en el útero(15), aunque es una técnica controvertida por sus implicaciones éticas.
Tratamiento
El tratamiento principal es el empleo de concentrado plasmático inactivado o recombinante, de forma precoz en las hemorragias y/o de forma profiláctica (casos graves), aunque puede inducir al desarrollo de inhibidores. En la hemofilia A moderada o leve se puede emplear el DDAVP.
El tratamiento se basa en el empleo de FVIII o FIX recombinante altamente purificado, que evita la transmisión de posibles agentes infecciosos o priónicos, como ocurrió en el pasado, al no ser un producto biológico de origen humano y tener una muy escasa o nula contaminación proteica y celular humana o animal. Los derivados de origen plasmático también tienen un alto grado de seguridad por el proceso de inactivación viral(16). Una unidad del concentrado/kg sube la actividad al 2% de FVIII y alrededor de 1% de FIX. La vida media es de 12 horas para el FVIII y de 18-24 h para el FIX, por lo que se necesitan dos infusiones/día para el FVIII y sólo una para el FIX. El nivel de hemostasia al que se debe llegar depende del tipo y gravedad de la hemorragia (Tabla III). Se debe emplear de forma precoz en las hemorragias para evitar mayor morbilidad.
El mayor avance en los últimos años ha sido el empleo profiláctico de factor en los casos graves, con infusiones 2-3 veces/semana de FVIII o dos/semana de FIX a partir de 1-2 años, porque eso evita el desarrollo de la artropatía hemofílica(17), convirtiendo a los hemofílicos graves en moderados. Por eso, es eficaz la implantación de una vía central de acceso venoso para recibir el tratamiento domiciliario profiláctico o precoz en las hemorragias(13). El mayor problema es el desarrollo de inhibidores (anticuerpos frente al FVIII o FIX) que aparecen en un 20-30% de los pacientes graves con hemofilia A y en un 5% de los que tienen hemofilia B(12). En estos se puede utilizar el complejo protrombínico activado o el FVIIa recombinante, que actúan de by-pass generando trombina de forma directa sin necesidad de intervención del FVIII o FIX. También, se intenta la inducción de tolerancia inmune para poder emplear posteriormente el factor recombinante(12,13,18).
En los hemofílicos A de moderados a leves, se puede emplear el DDAVP asociado o no a antifibrinolíticos (Tabla III) y otras medidas coadyuvantes comentadas en la EVW. El DDAVP en la hemofilia B es ineficaz.
Las vacunas rutinarias deben administrarse por vía subcutánea profunda o por vía convencional con la aguja más pequeña posible y aplicando posteriormente presión y frío local. Se recomienda vacunar además de la hepatitis A(12,13).
Es importante potenciar la actividad física, para no contribuir al sobrepeso y a la limitación de movimientos a lo que son especialmente vulnerables(13).
Función del pediatra de Atención Primaria
La sospecha diagnóstica de un trastorno hereditario de la coagulación se realiza, en primer lugar, en Atención Primaria. Para el diagnóstico de una posible EVW, es fundamental la historia clínica con preguntas adecuadas y una exploración física cuidadosa, que evitará ya, de entrada, referir al paciente y realizar pruebas adicionales si el sangrado no es clínicamente significativo y no existe historia familiar. Por otro lado, si el sangrado mucocutáneo es significativo, o aparecen hematomas musculares o hemartros, hay que realizar pruebas de cribado de la coagulación, que orientarán al diagnóstico. Hay que tener en cuenta que, si el trastorno es leve, las pruebas de cribado pueden ser normales por lo que, si la clínica de sangrado o la anamnesis familiar es significativa, habría que derivar al paciente para cuantificar el factor. Es necesario conocer los cuidados básicos que requieren estos pacientes en Atención Primaria (administración de vacunas, vacunaciones específicas –VHA–, normas de higiene dental, ejercicio, etc.) y conocer las bases de sus tratamientos, aunque deban ser derivados para su manejo por un hematólogo experto en trastornos de la coagulación.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.* Allen GA, Glader B. Approach to the bleeding child. Pediatr Clin N Am. 2002; 49: 1239-56.
2.** Nathan DG, Ginsburg D, Orkin SH, Look AT. Nathan and Oski’s Hematology of infancy and childhood. 6ª edición. Philadelphia: Saunders; 2003.
3.* Hoffmann M. A cell-based model of coagulation and the role of factor VIIa. Blood Reviews. 2003; 17: S1-S5.
4.* Khair K, Liesner R. Bruising and bleeding in infants and children –a practical approach. Br J Haematol. 2006; 133: 221-31.
5.*** Nichols WL, Hultin MB, James AH, et al. Von Willebrand disease (VWD): evidence-based diagnosis and management guidelines, the National Heart, Lung, and Blood Institute (NHLBI) Expert Panel report (USA). Haemophilia. 2008; 14: 171-232.
6.*** Arceci RJ, Hann IM, Smith OP. Pediatric Hematology. 3ª edición. Oxford: Blackwell Publishing; 2006.
7.* Mikhail S, Kouides P. Von Willebrand disease in the pediatric and adolescent population. J Pediatr Adolesc Gynecol. 2010; 23: S3-S10.
8.** Rodeghiero F, Castaman G, Tosetto A. How I treat von Willebrand disease. Blood. 2009; 114: 1158-65.
9.* Federici AB, Canciani MT. Clinical and laboratory versus molecular markers for correct classification of von Willebrand disease. Haematologica. 2009; 94: 610-5.
10.** Castaman G, Lethagen S, Federici AB, et al. Response to desmopressin is influenced by the genotype and phenotype in type 1 von Willebrand disease (VWD): results from the European Study MCMDM-1VWD. Blood. 2008; 111: 3531-9.
11.** Mannucci PM, Franchini M, Castaman G, Federici AB. Evidence-based recommendations on the treatment of von Willebrand disease in Italy. Blood Transfus. 2009; 7: 117-26.
12.** Rodríguez NI, Hoots WK. Advances in haemophilia: experimental aspects and therapy. Pediatr Clin North Am. 2008; 55: 357-76.
13.*** Hoots WK, Shapiro AD. Clinical manifestations and diagnosis of hemophilia. Treatment of haemophilia. UpToDate version 19.3, septiembre 2011.
14.* Bustamante-Aragonés A, Rodríguez de Alba M, González-González C, et al. Foetal sex determination in maternal blood from the seventh week of gestation and its role in diagnosing haemophilia in the foetuses of female carriers. Haemophilia. 2008; 14: 593-8.
15.* Lavery S. Preimplantation genetic diagnosis of haemophilia. Br J Haematol. 2009; 144: 303-7.
16.** Mannucci PM. Back to the future: a recent history of haemophilia treatment. Haemophilia. 2008; 14(suppl 3):10-18.
17.** Manco-Johnson MJ, Abshire TC, Shapiro AD, et al. Prophylaxis versus episodic treatment to prevent joint disease in boys with severe hemophilia. N Engl J Med. 2007; 357: 535-44.
18.** Franchini M, Lippi G. Recent improvements in the clinical treatment of coagulation factor inhibitors. Semin Thromb Hemost. 2009; 35: 809-13.
Bibliografía recomendada
– National Heart, Lung and Blood Institute. The diagnosis, evaluation and management of von Willebrand Disease-2008 Clinical Practice Guidelines. Disponible en: www.nhlbi.nih.gov/guidelines/vwd (consultado el 27 de enero de 2012).
Resumen completo y actualizado de la fisiopatología, clasificación, genética, clínica, diagnóstico y tratamiento de la enfermedad de von Willebrand con recomendaciones de manejo clínico basadas en la evidencia.
– Scott P, Montgomery RR. Hemorrhagic and thrombotic diseases. En: Kliegman RM, Behrman RE, Jenson HB, Stanton BF, eds. Nelson. Text Book of Pediatrics. 18ª edición. Philadelphia: Saunders/Elsevier; 2007. p. 2060-89.
Revisión bastante completa sin ser exhaustiva, ideal para un pediatra general, de la fisiología de la coagulación, estudios de laboratorio y principales enfermedades hemorrágicas y trombóticas en la infancia, con tablas de referencia de las pruebas de coagulación por edad.
– Arceci RJ, Hann IM, Smith OP. Pediatric Hematology. 3ª edición. Oxford: Blackwell Publishing; 2006.
Los 2 capítulos que hablan de esta patología se exponen de forma clara y completa y son de fácil lectura.
– Hoots WK, Shapiro AD. Clinical manifestations and diagnosis of hemophilia. Treatment of haemophilia. UpToDate version 19.3, septiembre 2011.
Revisión completa y actualizada y no demasiado exhaustiva.
| Caso clínico |
|
Niño de 9 años que acude al hospital de Móstoles por presentar sangrado gingival intermitente de al menos 12 horas de evolución. Afebril. No traumatismo previo. Nacido y seguido en otra Comunidad Autónoma. Aporta un informe con un estudio de coagulación realizado a los 4 años con los siguientes datos: plaquetas: 404.000; TP: 12,7 seg; act. protrombina 100%; TTPA: 74,1 seg (control: 28-38 seg); fibrinógeno: 354 mg/dl; FVIIIc: 3%; FvW:RCo: 5%; RIPA: muy disminuido respecto a control para todas las diluciones. Tiempo de hemorragia: >20 minutos. Antecedentes familiares Padres sanos de raza gitana, primos hermanos. Temporeros, se encuentran en nuestra comunidad por vendimia. No refieren manifestaciones hemorrágicas. Una tía paterna y otra materna con epistaxis. Una hermana de 5 años con el mismo problema de coagulación que el hermano, ha precisado ingresar por hemorragias y ha recibido transfusiones de sangre. Otros dos hermanos sanos. Padres no estudiados. Antecedentes personales Embarazo y parto normales. Intervenido de hernia inguinal a los 20 días de vida. Tuvo que ser reintervenido unos días después por sangrado de un vaso y precisó transfusión sanguínea. Al año y medio, episodio de epistaxis y gingivorragia importante por el que se llegó al diagnóstico. Varios ingresos posteriores por el mismo motivo en diferentes hospitales, y a los 5 años, por TCE. No antecedentes de hematomas musculares o hemartros. No transfusiones posteriores. Exploración física Sangrado gingival activo no importante. Caries dentales. Resto de exploración normal. Pruebas complementarias Hemograma: leucocitos: 8.640/µl; Hb: 9,7 g/dl; Hcto: 31%; VCM: 66,8 fl; plaquetas: 238.000/µl. Coagulación: TP: 14,1 seg; actividad de protrombina: 85%; INR: 1,12; TTPA: 61,2 seg. F VIIIc: 3%; factor VW:Ag: <1%. Estudio padres: Padre: tiempo de hemorragia: 13 minutos (normal <9 min); TP: 13,2 seg; act. protrombina: >100%; TTPA: 35 seg (N: 26-40); F VIIIc: 52% (N: 50-150%); factor VW:Ag: 39% (N: 50-150%). Madre: tiempo de hemorragia: 12,3 minutos; TP: 13,5 seg; act. protrombina: 98%; TTPA: 37,2 seg; F VIIIc: 82%; factor VW:Ag: 49%. |