 |
| Regreso a las bases |
D. Lledín Barbancho*, R. Vecino López**
*Médico adjunto del Servicio de Hepatología y Trasplante hepático. Hospital Infantil La Paz.
**Médico adjunto especialista en Digestivo Infantil, Hospital Universitario de Torrejón, Madrid
| Resumen
La sintomatología referida al aparato digestivo es un motivo muy frecuente de consulta en la práctica pediátrica, en la mayoría de las ocasiones, se trata de procesos banales que no van a precisar ninguna prueba complementaria para el diagnóstico, tratamiento y seguimiento posterior. El principal reto para el pediatra es detectar aquellos casos que precisarán algún estudio más extenso. |
| Abstract
Symptomatology of gastrointestinal disease is a very common cause of pediatric consultation in the clinical practice. The majority of cases are not important processes and need no further diagnostic laboratory or imaging work-up. The main challenge for paediatricians is to detect those cases that need them. |
Palabras clave: Síntomas gastrointestinales; Enfermedad hepatobiliar; Pruebas de función gastrointestinal y hepática; Técnicas de imagen hepáticas; Test de función gastrointestinal
Key words: Gastrointestinal symptoms; Liver-biliary disease; Test function liver; Hepatic imaging; Functional gastrointestinal test
Pediatr Integral 2015; XIX(1): 66.e1–66.e18
Exploraciones clínicas, bioquímicas y técnicas de imagen en la valoración de la patología digestiva y hepatobiliar
Manifestaciones clínicas digestivas
Los síntomas de los trastornos del aparato digestivo son muy poco específicos y comunes a otras patologías de otros sistemas, por lo que es necesario realizar un amplio diagnóstico diferencial. En el enfoque inicial, se debe realizar una historia clínica exhaustiva y una exploración dirigida en busca de signos de alarma que puedan indicar procesos orgánicos. Si estos signos de alarma se objetivan, puede ser necesaria la realización de pruebas complementarias. La escasa ganancia ponderal en el niño es uno de los signos de alarma más importantes a considerar.
A continuación, exponemos los síntomas que con mayor frecuencia son motivo de consulta.
Dolor abdominal
Es un motivo de preocupación y consulta muy frecuente en Pediatría. El dolor es percibido de forma muy distinta de unos individuos a otros, siendo la tolerancia interpersonal muy variable. El dolor abdominal agudo es el que comienza de forma brusca y es generalmente intenso, siendo producido, en la mayoría de las ocasiones, por procesos autolimitados, pero en ocasiones, nos advierte realmente de una urgencia médica o quirúrgica. El dolor abdominal crónico se define como episodios de dolor recurrente, más de uno a la semana y de duración superior a un mes, y puede ser de carácter funcional u orgánico. Los criterios de Roma III clasifican los procesos intestinales que son de carácter funcional (Tabla I)(1,2). Si el dolor es de carácter orgánico de tipo visceral, se describe como “sordo”, de localización difusa y, generalmente, se percibe a nivel del dermatoma de la víscera afectada. Cuando el origen está en el hígado, páncreas, árbol biliar, estómago y porción superior del intestino, se suele percibir a nivel del epigastrio. Si el origen está en la porción distal del intestino, ciego, apéndice y colon proximal, se percibe a nivel periumbilical. Por último, cuando el origen está en el colon, tracto urinario o vísceras pélvicas, es referido a nivel suprapúbico.
Regurgitaciones
Es el paso del contenido gástrico a la cavidad oral que se genera sin esfuerzo y no de forma proyectiva, debido a la incompetencia o inmadurez del esfínter esofágico inferior. En los lactantes, el reflujo gastroesofágico (RGE) se considera un proceso fisiológico que se produce en hasta un 75% en los menores de 4 meses. Hay que diferenciarlo de la enfermedad por reflujo gastroesofágico (ERGE), que se produce cuando se acompaña de síntomas esofágicos o extraesofágicos molestos y/o complicaciones tales como: fallo de medro, pérdida de peso, esofagitis, disfagia o alteraciones respiratorias. Mientras el RGE fisiológico no requiere tratamiento, la ERGE suele precisarlo y, si no mejora, además, requiere estudios para realizar un diagnóstico diferencial con otros procesos patológicos(3).
Vómitos
Se define como la expulsión forzada y repentina del contenido gástrico asociada a contracción de la musculatura tóraco-abdominal. Es un síntoma muy inespecífico, que puede tener como causa una patología gastrointestinal o de otro origen: sistema nervioso central, renal, infeccioso, metabólico, etc. Se puede producir en el contexto de cuadros banales y autolimitados, pero también en enfermedades graves que comprometen la vida del paciente y que requieren tratamiento inmediato. El contenido del vómito puede orientar al diagnóstico, pueden ser: alimentario (comida no digerida), bilioso (amarillo-verdosos), mucoso, hemático (sangre fresca), “en posos de café” (sangre digerida) o fecaloideo. Los signos de alarma que orientan a una etiología grave son: aparición en el periodo neonatal, fontanela abombada, afectación del estado general o deshidratación, contenido hemático o bilioso, distensión abdominal, dolor abdominal intenso, vómitos “en escopetazo” o vómitos persistentes(3).
Diarrea
Se define como el aumento en el volumen y número de deposiciones, junto con una disminución de su consistencia habitual. La cantidad máxima que se considera normal en un lactante pequeño es de 10 g/kg/día, que va aumentando hasta un máximo de 200 g/m2/día en el adulto. Dependiendo de la duración de la diarrea, se clasifica en: aguda (proceso autolimitado durante 3-6 días), prolongada (supera las 2 semanas) y crónica (supera las 6-8 semanas). Se describen cuatro mecanismos básicos de producción de la diarrea: osmótica (presencia en el intestino de solutos no absorbidos que aumentan la carga osmótica y arrastran agua a la luz intestinal desde el plasma), secretora (mayor secreción de agua y electrolitos desde el plasma a la luz intestinal que supera la capacidad de absorción), inflamatoria o exudativa (aumento de la permeabilidad de la mucosa intestinal con secreción pasiva de solutos y agua a la luz intestinal) y por alteraciones de la motilidad intestinal (Tabla II).
Estreñimiento
Se define como la disminución en la frecuencia de las deposiciones o la dificultad para defecar que causa dolor y que persiste en el tiempo. La frecuencia normal de defecación de los niños entre 1 y 4 años de edad, generalmente, es de 1 a 2 veces al día, y más del 90% defeca como mínimo pasado un día. Cuando un niño que ya presentaba control de esfínteres está estreñido por un tiempo prolongado, puede comenzar a ensuciar su ropa interior con heces que pueden ser líquidas y que expulsa de forma involuntaria, situación que se conoce como encopresis o ensuciamiento y que, en ocasiones, se confunde con diarrea. Cuando hay una importante acumulación de material fecal en el recto, que resulta en una masa abdominal dura en la parte inferior del abdomen, se ha producido una impactación fecal. El estreñimiento funcional o psicógeno constituye el 95% de las causas de estreñimiento crónico en los niños y hay que diferenciarlo del estreñimiento orgánico, sobre todo, el producido por la enfermedad de Hirschsprung, las malformaciones anorrectales, la fibrosis quística o el hipotiroidismo. Los signos de alarma que nos deben orientar hacia un proceso orgánico son: retraso en la expulsión de meconio, escasa ganancia ponderal, distensión abdominal, vómitos biliosos, inicio tras la introducción de leche de vaca y ampolla rectal vacía(4).
Hemorragia gastrointestinal
En Pediatría, generalmente es un motivo de alarma en los padres, aunque la mayoría de las veces no traduce una patología grave. Dependiendo de la localización del sangrado, hablamos de hemorragia digestiva alta, cuando se produce proximalmente al ángulo de Treitz, y hemorragia digestiva baja, cuando es distal a este. Las manifestaciones clínicas van a variar en función de la localización, volumen y rapidez de instauración. Clínicamente, se define como hematemesis a la emisión de sangre por la boca en forma de vómito. El origen puede ser de la zona ORL o de la porción proximal del tracto digestivo (esófago, estómago y duodeno). El sangrado suele ser rojo, aunque si la sangre ha estado en contacto con los jugos gástricos o intestinales, puede tener un color marrón o “en posos de café”. La hematoquecia es la emisión de sangre roja con las heces, que puede estar mezclada o no. Generalmente, se debe a hemorragias digestivas bajas aunque, en ocasiones, pueden tener su origen en tramos superiores si existe una aceleración del tránsito intestinal. La rectorragia es la emisión de sangre roja por el recto, generalmente de origen en colon distal, mientras que las melenas son deposiciones negras y pegajosas que traducen un sangrado digestivo alto. Cuando la sangre no se observa macroscópicamente, se habla de sangre oculta en heces. Para su detección, es necesario utilizar análisis microscópicos o test de laboratorio. Las causas del sangrado digestivo en Pediatría son múltiples y difieren según la edad (Tabla III).
Distensión abdominal
Puede estar motivada por acúmulo de gases que, además, se puede acompañar de dolor. En otras ocasiones, puede estar producida por una hepatomegalia u otras masas que precisarán estudios más detallados. También, es frecuente en niños celíacos o con procesos de malabsorción intestinal.
Técnicas diagnósticas en la patología del tracto digestivo
La sintomatología referida al aparato digestivo es un motivo muy frecuente de consulta en la práctica pediátrica y, en un gran número de casos, hace referencia a patologías funcionales y, muchas veces, banales. El pediatra debe discernir entre qué situaciones es necesario ir más allá de los datos clínicos y realizar pruebas complementarias que ayuden al diagnóstico de una patología que se beneficie de un tratamiento concreto.
Estas pruebas deben orientarse según la parte del aparato digestivo en que se sospeche que radica el problema.
Pruebas funcionales esofágicas
El esófago tiene dos funciones básicas que son las que pueden verse alteradas por distintos procesos: el transporte del bolo alimenticio y la prevención del flujo retrógrado del contenido gastrointestinal.
Manometría esofágica
Es una técnica fundamental para el estudio de la función contráctil del esófago y el diagnóstico de procesos que causan una alteración en su motilidad normal (disfunciones cricofaríngeas, acalasia y espasmos esofágicos). Para su realización, se coloca una sonda de varios canales de presión conectada a un sistema manométrico, con transductores de presión y sistema de registro. Se valora, por un lado, la presión del esfínter esofágico superior e inferior basal y su relajación en respuesta a la deglución y, a nivel del cuerpo esofágico, la amplitud, duración y propagación de las contracciones(5).
pHmetría e impedanciometría
La pHmetría esofágica es una técnica que mide la acidez del contenido gástrico, lo que la convierte en el método de referencia para el estudio de la ERGE. Está indicada en caso de síntomas sugestivos y evolución desfavorable a pesar del tratamiento correcto, si se desea establecer relación entre RGE y síntomas extradigestivos o como control de la eficacia del tratamiento del RGE moderado-severo previamente diagnosticado por pHmetría. Se realiza una medición continua del pH esofágico, habitualmente durante 24 horas, incluyendo tanto periodo diurno como nocturno. Cuando el pH baja de 4, se considera que hay reflujo y los 4 parámetros clásicos empleados para medirlo son:
1. IR:índice de reflujo o fracción de tiempo con pH < 4. El diagnóstico de RGE se realiza cuando el IR es > 4-5% o siempre que haya un episodio de RGE con duración mayor a 20 minutos. También, se emplea para clasificar el RGE en leve (IR < 10%), moderado (IR del 10-20%) y grave (IR > 20%).
2. NR:número de episodios de reflujo, definido como pH esofágico menor de 4 durante más de 30 segundos. Valor normal: < 22 episodios.
3. NR > 5: número de episodios de duración mayor a 5 minutos. Valor normal: < 3.
4. DR + L: duración del reflujo más largo. Valor normal: < 15 minutos.
Los 3 últimos parámetros son útiles para indicar si existe un problema de barrera (NR alto, el resto normal) o de aclaramiento (NR > 5 y DR + L aumentado).
La pHmetría presenta diversos inconvenientes: se debe retirar la medicación antirreflujo y antiácida, al menos 72 horas antes; no mide reflujos con pH > 4 (que son la mayoría en los lactantes); y no se correlaciona con el grado de intensidad del reflujo (Fig. 1).
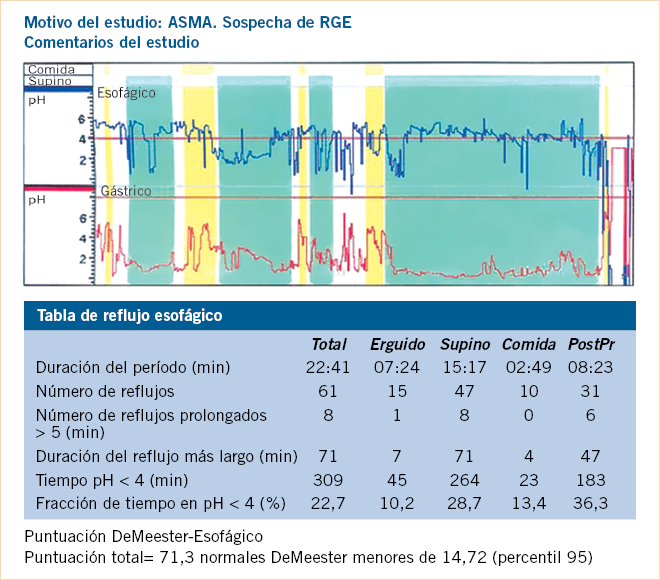
Figura 1. Ejemplo de pHmetría en niño con bronquitis de repetición asociado a importante reflujo esofágico que precisó tratamiento quirúrgico. Se objetiva que presenta un RGE severo (IR 22,7%), que se debe, por un lado, a un problema de barrera (NR 61) y, por otro, a un problema de aclaramiento (NR+5 es 8 y DR+L es 71).
La impedanciometría es una nueva técnica que se basa en la detección de un cambio de la resistencia al flujo de corriente entre dos electrodos cuando un bolo líquido (baja la impedancia) o de gas (sube la impedancia) cruza a través de estos. Actualmente, se recomienda el empleo conjunto con la pHmetría, ya que presenta la ventaja de registrar los reflujos no ácidos y los débilmente ácidos, y determina si se correlacionan con la sintomatología del paciente. Además permite especificar si el material refluido es sólido, líquido, gaseoso o mixto, y también mide la altura a la que asciende. Las limitaciones de esta técnica son: su alto coste, la falta de unificación de criterios en el estudio de RGE en el paciente pediátrico y que la lectura del registro requiere un tiempo prolongado, ya que los sistemas de análisis automático aún presentan múltiples errores que es necesario corregir antes de obtener el resultado final de la prueba, lo que hace que, además, sea observador dependiente(6).
Pruebas funcionales gástricas
Biomarcadores plasmáticos
En pacientes con dispepsia, la determinación de los niveles de gastrina 17 y pepsinógeno (PG) I y II ayuda en el diagnóstico de gastritis atrófica. Mientras que en adultos, este tipo de gastritis es frecuente en relación con la evolución en el tiempo de la infección por H. pylori, en el paciente pediátrico es excepcional y aparece, sobre todo, en el contexto de síndromes poliglandulares autoinmunes. La gastrina 17 está aumentada en los pacientes con anemia perniciosa y en gastrinomas, siendo el valor sérico normal en niños de 15-95 pg/ml. El PG I está aumentado en la atrofia gástrica, y el valor normal en niños es <80 pg/ml. La determinación del cociente PG I/PG II normal es 2-6, si fuera inferior a 2 indicaría también atrofia de la mucosa gástrica(7).
Pruebas para la detección de Helicobacter Pylori
El H. pylori es un bacilo gran negativo que coloniza el epitelio gástrico y se ha relacionado con la enfermedad péptica, siendo la principal causa de gastritis crónica en todas las edades y, en adultos, además de úlceras gástrica y duodenal. Está claramente relacionado con el cáncer gástrico, tanto de tipo adenocarcinoma como de linfoma tipo MALT (linfoma de tejido linfoide asociado a mucosa). Los niños infectados con gastritis antral desarrollan úlcera duodenal, en un porcentaje pequeño, inferior al 10 %, y úlcera gástrica en un porcentaje aún menor, siendo excepcional el cáncer gátrico. El estudio de infección se basa en la actividad ureasa de la bacteria, que le permite desdoblar la urea en NH3 y CO2, metabolitos que se utilizan en los test de detección. El método invasivo de detección de infección y enfermedades es la gastroscopia con toma de biopsias, que se emplea para estudio anatomopatológico y cultivo con antibiograma, además de que permite la realización de la prueba de urea rápida, que da el resultado en aproximadamente una hora. En el estudio de las muestras de biopsias, se pueden identificar los genotipos citotóxicos (VacA o CagA). Los métodos no invasivos demuestran solo colonización o infección, pero no enfermedad, siendo la prueba de aliento con urea marcada 13C la más sensible y específica, además de la más utilizada. Otras pruebas no invasivas son: por un lado, la determinación de antígeno fecal, útil en niños pequeños que no colaboran para la realización del test de aliento, y por otro, la determinación de anticuerpos frente a H. pylori mediante técnica ELISA en suero, saliva o heces, que solo se emplea para estudios epidemiológicos. Para el control de erradicación tras finalizar el tratamiento, también se utilizan los métodos no invasivos(8).
Pruebas funcionales intestinales
Parámetros bioquímicos del estado nutricional
Mediante la determinación de determinados parámetros bioquímicos, se puede obtener información acerca del estado nutricional del paciente:
Proteínas séricas: son sintetizadas por el hígado y por células inmunocompetentes.
• Proteínas de vida media larga (albúmina, transferrina y somatomedina). Indican el estado nutricional del paciente en las últimas semanas. La albúminatiene vida media de 18-20 días y su valor normal es 3,5-5 g/dl. Normalmente, el 40% está en la sangre, pero en situación de estrés disminuye (pasa a tejidos, sobre todo, a la piel); mientras que, en la malnutrición pasa lo contrario (se sobreestima). Disminuye en: estrés fisiológico, hepatopatía, nefropatía, hipotiroidismo y exceso de cortisol sérico. La transferrina tiene vida media de 8-10 días. Puede elevarse si hay ferropenia y disminuye en situaciones de enfermedad hepática, síndrome nefrótico e infección. La somatomedina C (IGF-I) se produce como respuesta a la estimulación de la hormona de crecimiento. Disminuye en la malnutrición proteico-calórica, pero se normaliza en 3-15 días tras la terapia nutricional (en este tiempo, el resto de marcadores proteicos no se modifican).
• Proteínas de vida media corta (prealbúmina, proteína transportadora del retinol y fibronectina). Son indicadores muy útiles para la monitorización de cambios nutricionales agudos (en las últimas 48 horas). La prealbúmina o transtirretina tiene vida media de 2 días y su valor normal es 15-30 mg/dl. Responde más rápidamente que la albúmina y la transferrina a los cambios del estado proteico. El RBP o proteína transportadora del retinol tiene vida media de 12 horas. Su utilidad clínica es muy limitada, puesto que sus valores se alteran en múltiples situaciones (déficit de vitamina A o zinc, inflamación, enfermedades renales y hepáticas). La fibronectina tiene una vida media de 20 horas. La sintetizan células hepáticas, endoteliales y fibroblastos, por lo que disminuye, no solo en la malnutrición, sino también si hay quemadura extensa, sepsis o traumatismo.
Perfil lipídico, vitaminas y minerales. El perfil lipídico solamente se altera en los casos de malnutrición crónica. Las vitaminas liposolubles (A, D, E y K) disminuyen en cuadros de colestasis y en otros de maldigestión o malabsorción de grasa; mientras que, las hidrosolubles (B y C) suelen indicar déficit alimentario. El déficit de hierro está relacionado con pobre ingesta o difícil absorción, aunque también con malnutrición leve. El déficit de zinc, cobre, cromo o selenio indica una patología malabsortiva grave o una malnutrición moderada-grave.
Estudios de maldigestión y/o malabsorción de nutrientes
La digestión de nutrientes comienza en la boca con la secreción de saliva, pero su absorción se realiza casi exclusivamente en el intestino delgado. Esta última no se realiza de forma uniforme en toda su longitud, por lo que la malabsorción puede ser selectiva de un nutriente o global de todos ellos. El dato clínico característico de maldigestión y/o malabsorción es la diarrea(9-11).
Maldigestión y/o malabsorción de hidratos de carbono. La digestión parcial y la absorción incompleta de los hidratos de carbono produce una diarrea osmótica (al ser sustancias osmóticamente muy activas que atraen agua y electrólitos a la luz intestinal) y fermentativa (por ser hidrolizados por las bacterias colónicas, produciendo gases y ácidos), acompañándose con frecuencia de dolor abdominal, flatulencia e irritación perianal. Ante estos datos clínicos, puede ser necesario confirmar la sospecha mediante un cribado de azúcares o/y pruebas de sobrecarga con azúcares. El cribado de azúcares consiste en la determinación, por un lado, de azúcares en las heces que no han sido absorbidos (glucosa, sacarosa y cuerpos reductores) y, por otro, de parámetros que indican que son fermentados por las bacterias (pH fecal ácido < 5). El pH fecal normal es de 6-8; aunque, durante la lactancia materna son normales valores más bajos: 4,5-6. Podría ser normal en los casos de tránsito digestivo muy rápido, sin que dé tiempo a que las bacterias fermenten el azúcar, o si carece de dichas bacterias (antibioterapia). La sacarosa no es un agente reductor, por lo que es necesaria la hidrólisis ácida previa: test de Selivanoff. Hay dos tipos de pruebas de sobrecarga con azúcares. En primer lugar, el test de hidrógeno espirado, se basa en que, si un azúcar no se absorbe, cuando llega al colon (a los 90 minutos, aproximadamente), se empieza a metabolizar por las bacterias, generándose hidrógeno, que se absorbe a la sangre y se elimina por el pulmón. Tras una sobrecarga del azúcar específico, se determina la elevación de la concentración de hidrógeno espirado a lo largo del tiempo. Sería patológico si se produce una elevación tardía (a los 90-120 minutos) de 10-20 ppm de hidrógeno sobre el basal. Una elevación precoz en los primeros 90 minutos es característica de sobrecrecimiento bacteriano o tránsito acelerado. Pueden existir falsos negativos por uso previo de antibióticos o por la existencia de flora no fermentadora. En segundo lugar, el test de absorción de mono-disacáridos complementa la prueba anterior con la determinación seriada de glucemia capilar, tras la administración del azúcar correspondiente. El paciente será “absorbente” si la glucemia aumenta por encima de 20 mg respecto a la basal, en las dos horas posteriores a la ingesta, con curva de hidrógeno normal. También, se determina si el paciente es o no “tolerante” en función de si dicha ingesta le produce sintomatología. La determinación de oligosacaridasas en biopsia intestinal solamente se emplea para confirmar la sospecha de casos de intolerancia congénita a hidratos de carbono por déficit enzimático.
Maldigestión y/o malabsorción de grasas. La esteatorrea hace referencia al exceso de grasa en las heces, que le da un aspecto brillante y un olor rancio. Se produce en aquellas enfermedades en las que se produce alteración de la lipólisis (disfunción del páncreas exocrino), atrofia vellositaria, (enfermedad celíaca, entre otras), disminución de ácidos biliares u obstrucción de los vasos linfáticos. La cuantificación directa de grasa fecal se ha realizado, tradicionalmente, con la técnica de Van de Kamer, que requiere la recogida de heces durante 72 horas, tras una dieta con una sobrecarga de 100 g de grasa al día. Esta técnica es engorrosa debido a la necesidad de manipulación de las heces, por lo que se están utilizando nuevas técnicas de absorción en el infrarrojo cercano (FENIR). Los parámetros relevantes que se recogen son:
• Peso de las heces: sirve como indicador de una recogida correcta de las heces. Lo normal en niños pequeños serían 4 g/kg y, en mayores, de 100 a 120 g.
• Gramos de grasa total en 24 h: sirve para detectar esteatorrea si las heces han sido bien recogidas. Los valores normales son: lactante < 2,5 g/d, niño mayor <3-4 g/d, y adolescentes < 6 g/d. La esteatorrea leve (< 6-8 g/d) es inespecífica y se puede producir incluso en situaciones de sobrecrecimiento bacteriano, si es moderada (8-15 g/d) puede ser malabsortiva, como en un niño celíaco y, si es grave (> 15-20 g/d), ya es indicativa de insuficiencia pancreática.
• Cociente de absorción de grasas (CAG): requiere combinar la prueba con una encuesta dietética y una calibración de la dieta ingerida. Se calcula con la fórmula: [grasa ingerida-grasa excretada (g)/grasa ingerida (g)] x 100. Los valores normales son: en recién nacido pretérmino, 60-65%; en recién nacido a término, 80-85%; en niños de 10 meses a 3 años, 85-95%; y en niños mayores de 3 años, > 95%.
Maldigestión y/o malabsorción de proteínas. La creatorrea o aumento del contenido proteico de las heces se puede producir por malabsorción proteica (como en la enfermedad pancreática) o por secreción desde la mucosa (como en una enteropatía exudativa). Se valora mediante la determinación de nitrógeno fecal y de a1-antitripsina en heces. Si ambas están aumentadas, orienta el diagnóstico hacia una enteropatía exudativa, mientras que el incremento aislado del nitrógeno fecal orienta más hacia una malabsorción proteica. El valor normal en niños de nitrógeno fecal es de 0,8-1,2 g/24 horas por el método de NIRA. La α1-antitripsinaes una proteasa sintetizada por el hígado que se filtra en pequeña cantidad a través de la pared intestinal y se elimina por las heces, aumentando dicha filtración en enteropatías exudativas proteicas. Es resistente a otras proteasas intestinales, pero se descompone en medio ácido con pH < 3, como el del jugo gástrico, por lo que no es útil en el diagnóstico de gastropatía pierde proteínas (como la enfermedad de Ménétrier). El valor normal en niños es de 0,2-0,7 mg/g de heces secas. La determinación simultánea de su valor sérico permite conocer su aclaramiento, cuyo valor normal es de < 12 ml/24 h.
Estudio de heces
El examen de las heces tiene su máxima indicación clínica en el diagnóstico diferencial de la diarrea crónica. Para diferenciar entre diarrea osmótica y secretora, es muy útil la determinación de iones en heces y el cálculo del GAP osmolar. El GAP osmolar es la diferencia entre la osmolaridad habitual plasmática y la calculada a partir de los iones fecales, y se obtiene por la fórmula: 290 – 2 [(Na+) + (K+)]. En la diarrea secretora, las partículas osmóticamente activas son electrólitos (Na+, K+, Cl–, HCO3–), por lo que la osmolaridad de las heces será similar a la plasmática; mientras que, en la diarrea osmótica, las principales partículas osmóticas no son electrólitos y el GAP osmolar será mayor de 20 mmol/kg. Los exámenes macroscópico y microscópico de las heces también orientan hacia el diagnóstico de las distintas causas de diarrea. En la malabsorción de grasas, es típico encontrar unas heces voluminosas, brillantes, pastosas y fétidas. En las enfermedades inflamatorias, encontraríamos moco, sangre o pus, y en las alteraciones de la motilidad, presencia de restos vegetales sin digerir. El estudio microscópico de virus, bacterias y parásitos es la prueba definitiva para llegar al diagnóstico de las diarreas infecciosas. Por último, en la diarrea inflamatoria es útil la determinación de ciertas proteínas fecales derivadas de los neutrófilos (lactoferrina, lisozima, elastasa, mieloperoxidasa y calprotectina), ya que su elevación se correlaciona con la actividad inflamatoria intestinal.
Marcadores específicos de enfermedad celíaca
La enfermedad celíaca se considera actualmente como un trastorno sistémico mediado inmunológicamente, provocado por la ingestión de gluten en individuos genéticamente susceptibles. Se caracteriza por la presencia de una combinación variable de manifestaciones clínicas dependientes del gluten, marcadores serológicos específicos de la enfermedad, haplotipos HLA DQ2 o DQ8 y enteropatía con atrofia de la mucosa intestinal. En las últimas guías de diagnóstico de la enfermedad en pacientes pediátricos, propuestas por la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN), aumenta la importancia de los marcadores serológicos, ya que se considera que no siempre se precisa una biopsia intestinal, que demuestre atrofia mucosa, para iniciar el tratamiento con dieta sin gluten, que tradicionalmente siempre se indicaba. De entre estos marcadores, los anticuerpos antitransglutaminasa tisular de clase IgA (anti-TG2) son los de elección para el diagnóstico de la enfermedad en la práctica clínica. Los anticuerpos antiendomisio de clase IgA (AAE) tienen una alta especificidad y sensibilidad pero, como desventaja, su determinación es un método largo y costoso y requiere bastante experiencia del examinador. Los anticuerpos antigliadina (AAG) son menos específicos que los anti-TG2 y los AAE, con más porcentaje de falsos positivos, aunque su sensibilidad es mayor que la de estos, en niños menores de dos años; por lo que, en ese rango de edad, es útil la determinación simultánea de AAG y AGTt.
Marcadores específicos de enfermedad inflamatoria intestinal (EII)
La EII conlleva la inflamación de la lámina propia de la mucosa intestinal, con activación de distintas células de la inflamación que producirán citosinas, que inducen la formación de reactantes de fase aguda. La determinación de estos reactantes de fase aguda es útil para medir la actividad de la enfermedad y la respuesta al tratamiento. La proteína C reactiva (PCR) y la velocidad de sedimentación globular (VSG) son reactantes de fase aguda plasmáticos inespecíficos, mientras que los marcadores fecales son más específicos de EII. La calprotectina fecal es el marcador fecal que presenta mayor sensibilidad y especificidad en el estudio de EII y su valor de normalidad descrito en adultos es de 50 mg/L, pero en los pacientes pediátricos no está bien definido. Por otro lado, los marcadores serológicos son útiles en el diagnóstico de la EII y en la diferenciación entre enfermedad de Crohn (EC) y colitis ulcerosa (CU), pero no se correlacionan con la actividad de la enfermedad. Los marcadores serológicos más utilizados son: los anticuerpos anticitoplasma de los neutrófilos o p-ANCA(su positividad indica con mayor probabilidad una CU) y los anticuerpos anti-Saccharomyces cerevisiae o ASCA (más específicos de EC).
Manometría intestinal
La manometría antroduodenal se utiliza en estudios de gastroparesia y en los casos de pseudo-obstrucción intestinal, mientras que la manometría del esfínter de Oddi se usa para estudiar los espasmos de este. La manometría anorrectal se utiliza para el despistaje de la enfermedad de Hirschsprung, al valorar la ausencia de reflejo anal inhibitorio (RIA) (Fig. 2).

Figura 2. Manometría anorrectal en lactante con estreñimiento. Se descarta la enfermedad de Hirschprung al presentar reflejo anal inhibitorio (RIA).
Pruebas funcionales del páncreas exocrino
Marcadores de reserva funcional
La evaluación de la función pancreática exocrina en los niños, se basa en métodos indirectos, empleando los métodos directos, excepcionalmente, por su complejidad e invasividad. El método directo más importante es el test de estimulación hormonal con secretina o colecistoquinina (hormonas que estimulan la secreción pancreática) con sondaje duodenal, aspiración del contenido duodenal y medición de la actividad enzimática y bicarbonato. Es una prueba altamente sensible y específica, pero apenas se utiliza en la práctica, actualmente. Como pruebas indirectas, están aquellas que detectan esteatorrea, al ser característica de la insuficiencia pancreática, y la determinación de quimiotripsina y elastasa fecal. La quimiotripsina fecal es una enzima proteolítica cuya concentración en heces está relacionada con la función exocrina del páncreas. El valor normal en heces de 24 horas es > 20 U/g de heces y, en muestra aislada, 6-30 U/g de heces. Valores < 2-3 U/g obligan a descartar fibrosis quística, entre 4 y 12 U/g a valorar otras causas de insuficiencia pancreática, y entre 12 y 21 U/g se pueden encontrar en situación de malnutrición. Si está en tratamiento con enzimas pancreáticas, es necesario suspenderlo 5 días antes, por lo que es de utilidad en el diagnóstico pero no en el seguimiento. La elastasa-1 fecal es una endopeptidasa resistente a la degradación de la flora intestinal. En su determinación no interfiere el tratamiento enzimático, por lo que su determinación seriada es el método de elección para el control evolutivo de los pacientes con insuficiencia pancreática en tratamiento sustitutivo. Su valor normal es >200 µg/g de heces (ideal > 400 µg/g); valores entre 100 y 200 µg/g indican insuficiencia pancreática moderada y, si es < 100 µg/g, insuficiencia pancreática grave.
Marcadores de pancreatitis
Las enzimas pancreáticas en situación normal deben pasar a la luz intestinal donde realizan su acción pero, en caso de inflamación y exceso de producción, parte pueden pasar a la sangre donde se determinan. La amilasa sérica es una enzima secretada en la saliva (60%) o por el páncreas (40%). Una elevación mayor de 127 U/L indica patología por aumento de la saliva (parotiditis, traumatismo de parótida, obstrucción de conducto salival, cetoacidosis diabética…), pancreática (pancreatitis > 330 U/L, obstrucción del conducto pancreático, obstrucción biliar, tumor pancreático, ulcus gástrico penetrante en el páncreas…) o de ambas (insuficiencia renal, tumor cerebral, quemaduras…). La elevación en pancreatitis aguda es precoz, a partir de las 2-12 horas del inicio del cuadro clínico, y suele permanecer elevada hasta el tercer o quinto día, sin que exista correlación con la gravedad del proceso. La lipasa sérica se eleva (>140 U/L) en pancreatitis aguda (más específica que la amilasa), carcinoma de páncreas y en la cirrosis hepática. Permanece elevada durante más tiempo, alrededor de dos semanas, y tampoco se correlaciona con la gravedad. El TIRS o tripsina inmunorreactiva sérica tiene un valor normal entre 10 y 57 ng/ml. Aumenta en etapas tempranas de la fibrosis quística (uso en el cribado neonatal), aunque también en la pancreatitis aguda y en la coledocolitiasis. Disminuye en pancreatitis crónica con insuficiencia exocrina(5,6,9).
Estudio específico de la fibrosis quística (FQ)
La FQ es una enfermedad hereditaria de carácter autosómico recesivo, debida a un defecto en el transportador epitelial de electrólitos, que conduce al desarrollo de una insuficiencia pancreática exocrina. Es la causa más frecuente de insuficiencia pancreática en los niños. La determinación de TIRS es la base del cribado neonatal. Se realiza una primera determinación en sangre de talón a los 2-5 días de vida que, si está elevada (>70 ng/ml), indica que debe realizarse una segunda a los 45-60 días. Si esta segunda determinación se mantiene elevada o, por el contrario, está muy baja, habrá que realizar estudio genético para descartar FQ. El test del sudor o ionotest se basa en que los enfermos con FQ producen un sudor con mayor concentración de sodio y cloro. Consiste en realizar una iontoforesis inducida por pilocarpina y una corriente eléctrica de baja intensidad, recogiéndose el sudor, donde se mide la concentración de cloruro sódico. Si el resultado es < 40 mEq/L, se considera normal, entre 40 y 60 mEq/L sería dudoso, y si es igual o superior a 60 mEq/L, patológico. El ionotest se considera un método de cribado, por lo que su resultado debe confirmarse midiendo la conductividad de cloro, que es patológica cuando es mayor de 50 mEq/L(10).
Pruebas de imagen
Dependiendo de la clínica del paciente y de la sospecha diagnóstica, se pueden realizar diversas pruebas de imagen. Sería conveniente siempre utilizar la más precisa e inocua en cada momento.
Radiografía simple de abdomen
Ofrece mucha información sobre el patrón de distribución de aire, efecto masa, presencia de fecalitos, aire libre en peritoneo, signos de obstrucción intestinal, etc.
Ecografía abdominal
Muy utilizada en Pediatría por su inocuidad. Permite el estudio de vísceras abdominales con posibilidad, además, de valorar el flujo arterial y las resistencias vasculares por estudio Doppler. Se considera de elección en casos de sospecha de: estenosis hipertrófica de píloro, invaginación intestinal, apendicitis, masas abdominales, hematomas en hígado o bazo, ascitis o líquido libre, entre otros.
Tomografía axial computarizada (TAC)
Útil para el estudio de traumatismos abdominales, estudio de masas o abscesos o en determinadas patologías en casos seleccionados. Actualmente, la TAC helicoidal ofrece importantes ventajas en Pediatría por el poco tiempo empleado para su realización y por las reconstrucciones que se pueden obtener.
Resonancia magnética (RM)
La excelente definición anatómica de tejidos blandos que se obtiene, junto con el hecho de no requerir contrastes yodados ni radiaciones ionizantes, le confiere cada vez más importancia en Pediatría. Destaca el uso cada vez mayor de la entero-RM en el diagnóstico de la EII, ya que permite valorar mejor el tránsito digestivo, la afectación inflamatoria, definir el grado de actividad y valorar complicaciones extraluminales.
Radiografías con contraste baritado
• Tránsito digestivo: se administra el contraste por vía oral y se realizan radiografías seriadas. Evalúa alteraciones a nivel de la luz o de la pared del tracto digestivo, permitiendo el diagnóstico de: estenosis atresias, fístulas, hernias, malrotaciones o vólvulos. Es útil en el diagnóstico de alteraciones deglutorias (valorando la deglución del contraste a nivel orofaríngeo) y en alteraciones de la motilidad, como en la acalasia esofágica.
• Enema de bario: se administra el contraste en forma de enema. Ofrece información sobre el intestino grueso, es útil en el seguimiento en casos de EII (evidencia fístulas, abscesos o divertículos) y en la pseudoobstrucción intestinal, en la que detecta dilataciones o estenosis (Fig. 3).

Figura 3. Niño con enfermedad de Crohn ileocólica con respuesta parcial al tratamiento médico con fármacos biológicos y que presenta peristaltismo de lucha. En el tránsito intestinal completo, se objetivan, en la porción distal del íleon, dos zonas de estenosis.
Endoscopia
La endoscopia digestiva alta y la colonoscopia son una herramienta fundamental para el diagnóstico de un importante número de patologías digestivas (localización de sangrados intestinales, estudio de procesos inflamatorios o tumorales), además de que constituye una herramienta terapéutica (esclerosis de varices esofágicas, polipectomía). Permite la observación directa de la luz del tubo digestivo, la mucosa y la toma dirigida de biopsias.
Angiografía selectiva
Se utiliza para la localización de un punto sangrante en el intestino y posterior embolización, si fuera necesario.
Pruebas de medicina nuclear
• Gammagrafía con pertecnato tecnecio99m:se administra el isótopo por vía intravenosa. Es la primera prueba de imagen no invasiva a realizar en la sospecha de divertículo de Meckel sintomático (generalmente, asociado a presencia de mucosa gástrica ectópica). Presenta una sensibilidad del 85% y especificidad del 95%.
• Gammagrafía con leucocitos marcados con tecnecio 99m o indio 111:se extrae una muestra de sangre al paciente, los leucocitos se marcan con el trazador y se administra, posteriormente, vía intravenosa. La existencia de un foco inflamatorio provoca la llegada de leucocitos de la circulación a dicho foco. Tiene su principal indicación en la EII, para la localización de los segmentos afectos, valoración de la extensión y del grado de actividad.
• Gammagrafía con glóbulos rojos marcados:es útil para detectar las hemorragias de origen oscuro; es decir, aquellas que no se detectan ni con endoscopia alta ni con colonoscopia.
Manifestaciones clínicas hepáticas
Al explorar a un paciente con sospecha de patología hepática, debemos realizar una exploración meticulosa para hacernos una correcta primera impresión diagnóstica.
Debemos buscar diversos signos típicos de patología hepática.
Hepatomegalia
Se considera patológico cuando el hígado sobrepasa el reborde costal en 2-3 centímetros en neonatos, 1-2 centímetros en lactantes y niños pequeños, y no se debe palpar en los adolescentes. Hay que tener en cuenta que, diversas situaciones pueden producir una falsa hepatomegalia, como las patologías que cursan con dificultad respiratoria y que producen un descenso del diafragma. Es importante anotar las características a la palpación: su consistencia (dura o pétrea en los casos de cirrosis, como por ejemplo, en la atresia de vías biliares, importante hepatomegalia blanda en la mayoría de las glucogenosis…), presencia de masas, dolor a la palpación, etc. Además, es obligatorio comprobar la existencia de esplenomegalia, lo que puede indicar una situación de hipertensión portal o una enfermedad de depósito o infiltrativa(20).
Existen múltiples causas de hepatomegalia: por afectación hepática o extrahepáticas (insuficiencia cardíaca congestiva, leucemia…), como se exponen en la tabla IV.
Ictericia
El tinte amarillo de piel y conjuntivas se hace evidente cuando la cifra de bilirrubina alcanza los 2-3 mg/dl; en los neonatos, pueden ser necesarios valores más altos. La ictericia puede traducir situaciones de colestasis, en ese caso se acompaña de coluria y puede presentar también hipocolia o acolia.
Las causas de ictericia son variadas y para su diagnóstico es importante conocer el tipo de bilirrubina predominante: directa o indirecta (Tabla V).
Arañas vasculares
Se caracterizan por tener una arteriola central que se irradia en pequeñas vénulas, se localizan en cara, tórax y extremidades superiores. Suelen ser más típicas de patología crónica. Se relacionan con alteraciones en el metabolismo de los estrógenos.
Eritema palmar
Es un eritema parcheado más evidente en la punta de los dedos y región tenar e hipotenar; se debe a la vasodilatación e incremento del flujo. Suele reflejar una hepatopatía crónica.
Xantomas
Se deben al acúmulo de lípidos en dermis y tejido celular subcutáneo. Se manifiestan más típicamente en los párpados y superficie extensora de los miembros. También, suele traducir una hepatopatía crónica(19).
Prurito
Se produce en pacientes con colestasis por el acúmulo de ácidos biliares y bilis. No se correlaciona con las cifras de bilirrubina. En ocasiones, el prurito puede llegar a ser muy intenso, pudiéndose apreciar lesiones de rascado. Para su tratamiento, se emplean sustancias que quelan los ácidos biliares como la colesteramina o agentes coleréticos, como el fenobarbital y el ácido ursodeoxicólico. Otros tratamientos empleados son: los antihistamínicos, los antagonistas de los opiáceos y la rifampicina. En ocasiones, algunos pacientes se benefician de una derivación biliar parcial externa.
Acropaquias
Se ven en patologías crónicas que se acompañan de hipertensión portal, debido a los shunt arteriovenosos intrapulmonares (síndrome hepatopulmonar)(19)(Fig. 4).

Figura 4. Acropaquias en paciente con síndrome hepato-pulmonar.
Ascitis
Es el acúmulo de líquido en la cavidad abdominal. Puede ser debido a enfermedades infecciosas, renales, cardiacas, tumorales y en pacientes con cirrosis e hipertensión portal, siendo esta última la más frecuente en el ámbito pediátrico(23). En casos de pequeños acúmulos de líquido, es difícil evidenciarlos únicamente con la exploración física, siendo necesario recurrir a la ecografía abdominal.
Dependiendo de las características bioquímicas del líquido, se clasifica en: trasudado, cuando la concentración de proteínas es < 2,5 g/dL, y en exudado, si la concentración de proteínas es más elevada(19) (Fig. 5).

Figura 5. Circulación colateral y ascitis en paciente con cirrosis.
Afectación neurológica
La encefalopatía hepática se puede observar en pacientes con shunt porto-sistémico y en situaciones de disfunción hepática severa. Se puede desencadenar por distintos procesos intercurrentes, como: infecciones, sangrado digestivo, medicamentos… En su patogenia, se han implicado los niveles altos de amonio, aunque no existe una correlación directa entre sus niveles en sangre y el grado de encefalopatía, y otras sustancias, como neurotransmisores inhibitorios del SNC, entre ellos el más estudiado es el GABA.
En los lactantes, la clínica inicial puede ser muy anodina, consistiendo, inicialmente, en: irritabilidad, decaimiento y/o somnolencia. En los niños más mayores, además podemos observar asterixis o flapping, consistente en un temblor fino distal (Tabla VI).
Signos de hipertensión portal
Se produce cuando la presión en la vena porta supera los 10 mm Hg. Las manifestaciones clínicas suelen consistir en la aparición de circulación colateral (venas dilatadas alrededor del ombligo, varices rectales y varices esofágicas), con el consiguiente riesgo de sangrado dando lugar a hematemesis o melenas. El sangrado digestivo es la principal causa de mortalidad y morbilidad de los pacientes con hipertensión portal. Es típico en estos niños encontrarnos un mayor o menor grado de esplenomegalia y datos de hiperesplenismo con: trombocitopenia, leucopenia, petequias o equimosis(19).
Otros
Los pacientes con hepatopatías crónicas pueden presentar alteraciones en diversos sistemas durante el curso de su enfermedad, pudiendo presentar: disfunción renal (síndrome hepato-renal), afectación pulmonar (síndrome hepato-pulmonar e hipertensión porto-pulmonar) y alteraciones endocrinológicas (retraso del crecimiento), entre otras.
Pruebas diagnósticas de la patología hepatobiliar
Pruebas bioquímicas de función hepática
A la hora de valorar los parámetros bioquímicos, conviene recordar que no existe ninguna prueba patognomónica de una determinada patología; por lo tanto, hay que hacer un análisis secuencial, junto con las manifestaciones clínicas acompañantes, para una correcta interpretación.
Los parámetros utilizados evalúan las distintas funciones del hígado: su actividad bioquímica y su capacidad de síntesis.
Es relativamente frecuente encontrarnos alteraciones analíticas en sujetos asintomáticos que, en la mayoría de las ocasiones, no traducen ninguna enfermedad hepática. Pero es importante recordar que varias patologías pueden debutar por leves disfunciones, como: enfermedad de Wilson, hepatitis autoinmunes y hepatitis C, entre otras, por lo que se deberá realizar un seguimiento y, si fuera necesario, estudios más avanzados para llegar a un diagnóstico.
Marcadores de daño hepatocelular
Transaminasas: indican daño celular y necrosis. Son dos: la aspartato aminotransferasa (AST), que cataliza la trasferencia de un grupo amino del ácido aspártico al a-cetoglutárico para formar ácido oxaloacetato y ácido glutárico; y la alanino aminotransferasa (ALT), que cataliza la transferencia de un grupo a amino desde la alanina al ácido a– cetoglutárico para formar ácido pirúvico y glutámico.
• La AST, también denominada con las siglas GOT (transaminasa glutámico-oxalacético sérica), se encuentra en las mitocondrias y en el citosol del hepatocito. Es una enzima muy ubicua, que podemos encontrar en otros tejidos como: corazón, músculo, riñón, páncreas y glóbulos rojos, además del hígado. Generalmente, no es necesario, en la práctica clínica, estudiar las diferentes isoenzimas.
Hay que valorar con cautela, elevaciones desproporcionadas de la GOT, puesto que pueden ser debidas a causas extrahepáticas, como extracciones dificultosas (por hemólisis y al masajear el músculo), a cuadros hemolíticos, a rabdomiolisis, etc. En estos casos, son de ayuda la determinación de otras sustancias como: creatín fosfoquinasa (CPK), aldolasa, lactato deshidrogenasa (LDH) y haptoglobina. También, puede ser debida a una macro AST aislada (macroenzima formada por un complejo de AST unido a inmunoglobulinas)(23).
• La ALT o transaminasa glutamato piruvato sérica (GPT) es más específica de enfermedad hepática, ya que se encuentra en el citosol de los hepatocitos. Su aumento puede indicar lesión funcional severa. Las elevaciones de esta suelen ir paralelos a aumentos de la GOT.
Las cifras absolutas de transaminasas no guardan correlación directa con la severidad del cuadro clínico ni con el pronóstico; así, tras la fase aguda de patologías con gran necrosis hepática, como las hepatitis fulminantes, podemos hallar cifras de transaminasas levemente elevadas o incluso normales, indicando la escasa reserva del parénquima hepático restante.
La relación entre ambas AST/ALT es útil para el diagnóstico de algunas patologías más habituales en adultos, como la hepatitis alcohólica, donde el cociente es mayor de 2. Cuando se produce una inversión del cociente (AST mayor que ALT) está reflejando un daño hepático severo. En las situaciones de hepatitis isquémicas, se puede encontrar una elevación llamativa de la LDH sérica, siendo la relación ALT/LDH menor de 1(16) (Tabla VII).
Marcadores de colestasis
Bilirrubina: este pigmento procede de la degradación del grupo hem de la hemoglobina y de la mioglobina. La bilirrubina se encuentra en el organismo en dos formas: forma no conjugada y forma conjugada.
La forma no conjugada o liposoluble es transportada por la albúmina desde su lugar de producción al hígado. Cuando se sobrepasa la capacidad de transporte de la albúmina, la fracción libre atraviesa la barrera hematoencefálica, produciendo lesiones en el SNC (kernicterus).
En el hígado, se realiza la conjugación de la bilirrubina, que se produce al unirle dos moléculas de ácido glucorónico, obteniéndose dos formas de bilirrubina conjugada o hidrosoluble: la mono y digliconidasa.
En las analíticas rutinarias, los valores de bilirrubina vienen expresados como bilirrubina indirecta y directa que corresponderían, de forma aproximada, a la fracción no conjugada y conjugada del plasma, respectivamente. El método de laboratorio consiste en un análisis por espectrofotometría que mide la fracción que reacciona directamente con un reactante (bilirrubina directa) y la que necesita un alcohol como acelerador (bilirrubina total). La fracción indirecta se obtiene de la diferencia entre ambas.
Siempre que exista un predominio de bilirrubina directa (> 2 mg/dl o > 15% de la total) se debe considerar patológico. La coluria se debe siempre a un aumento de la bilirrubina conjugada(16).
Urobilinógeno urinario: se forma en el intestino a partir de la degradación de la bilirrubina conjugada por las bacterias intestinales. Hasta un 20% se reabsorbe por la circulación enterohepática. Si existe disfunción hepática, el hígado no reabsorbe toda la cantidad y aparece en orina. No se considera un parámetro útil para evaluar la función hepática, puesto que existen múltiples factores que influyen en su excreción renal (Ph, alteraciones tubulares…).
Fosfatasa alcalina (FA): el término de FA se refiere a una familia de enzimas que cataliza la hidrólisis de los esteres de fosfato a un pH alcalino. El aumento de su actividad se correlaciona con situaciones de colestasis, pero no es un marcador útil para diferenciar las formas intrahepáticas de las extrahepáticas.
La actividad de la FA no es exclusiva del hígado, aparece en otros tejidos como: hueso, intestino delgado, riñón y placenta.
En la etapa de crecimiento, se producen elevaciones de esta enzima de, hasta tres veces por encima de sus valores normales, por lo que siempre hay que valorarla conjuntamente con otros parámetros de función hepática para poder establecer el diagnóstico de patología biliar. Actualmente, se dispone de los reactantes necesarios para poder estudiar los distintos isoenzimas, en los casos que sea necesario. Entre las causas extrahepáticas que pueden elevar la FA, se encuentran: afectaciones óseas (raquitismo, osteomielitis…), afectación del intestino delgado, linfoma de Hodgking, hipotiroidismo…
5`Nucleotidasa: es una enzima muy específica de origen hepático. Sirve para confirmar el origen hepático de la FA. No se usa habitualmente en la práctica clínica(16).
Gamma-glutamiltranspeptidasa (GGT): es una enzima de origen microsomal, que se localiza en el epitelio de los pequeños ductus y hepatocitos, además de en otros tejidos, por lo que es posible encontrarla elevada en diversas patologías extrahepáticas, como: cardiacas, renales, pulmonares y pancreáticas. En las patologías del árbol biliar, se encuentra aumentada paralelamente a la FA, sin servir tampoco para diferenciar entre colestasis extra o intrahepática.
En los recién nacidos, es posible encontrar valores hasta cinco veces superiores a las cifras normales del adulto, siendo esto más llamativo en los prematuros; progresivamente, los valores se van normalizando hacia los 6-9 meses de vida. La actividad de la GGT puede ser inducida por ciertos fármacos, como el fenobarbital y la fenitoína(23).
También, resulta útil para el diagnóstico de ciertas patologías hepáticas que cursan con colestasis y GGT normal, como ciertos errores innatos en la síntesis de ácidos biliares, y en las colestasis familiares por defecto de FIC1 (colestasis intrahepática familiar 1) y por defecto de BSEP (bomba exportadora de sales biliares).
Ácidos biliares: se forman en el hepatocito a partir del colesterol y se eliminan en la bilis (ácidos biliares primarios: cólico y quenodeoxicólico). En el intestino delgado, por acción de las bacterias, se transforman en ácidos biliares secundarios (deoxicólico y litocólico). La mayor parte del pool se reabsorbe por la circulación enterohepática en el íleon distal. En ciertas patologías, se puede producir una reentrada de los ácidos biliares, desde el hepatocito o desde la vía biliar dañada hacia la sangre. Su estudio es útil en el caso de los errores innatos del metabolismo de los ácidos biliares, donde se cuantifican mediante técnicas de espectrometría de masas (FAB-MS y GC-MS) en una muestra de sangre u orina, detectándose los ácidos biliares atípicos acumulados por el defecto enzimático(23).
Marcadores de la función de síntesis
Proteínas plasmáticas y albúmina
La albúmina es la principal proteína del plasma, se sintetiza en el retículo endoplásmico del hepatocito. Su misión es transportar ciertas sustancias del suero: calcio, bilirrubina y fármacos, además de mantener la presión oncótica. La vida media de la albúmina es de aproximadamente 20 días, por lo que no es útil como marcador de patología hepática en la fase aguda. Los niveles de albúmina se alteran cuando el daño hepático es intenso, considerándose un marcador de gravedad en las hepatopatías crónicas. En los pacientes con cirrosis y ascitis asociada, podemos encontrarnos, además, niveles bajos por la dilución, al aumentar el volumen plasmático(16).
Otras patologías que pueden asociar niveles bajos de albúmina son: situaciones de malnutrición (ver en el apartado anterior), síndrome pierde proteínas y patología renal, como se ha expuesto anteriormente.
Globinas: en este grupo se incluyen el resto de las proteínas plasmáticas. Su valor se obtiene restando las proteínas totales menos la albúmina.
Las distintas fracciones de las proteínas se obtienen mediante técnica de electroforesis, a su vez, cada una de ellas se compone por distintos tipos.
• Alfa 1: incluye la alfa 1-antitripsina y la ceruloplasmina, ambas reactantes de fase aguda, por lo que las podemos encontrar elevadas en diversos procesos inflamatorios.
• Alfa 2: incluye la haptoglobina entre otras, también considerada como reactante de fase aguda.
• Beta: transferrina y beta lipoproteína.
• Gamma: Inmunoglobulinas (IgG, IgA e IgM) sintetizadas por los linfocitos B.
Las anomalías en estas proteínas pueden verse tanto en patologías hepáticas como extrahepáticas. Se pueden observar elevaciones en la fracción gamma en el caso de patologías de origen autoinmune, como la hepatitis autoinmune, entre otras.
Amonio: se forma a partir de las proteínas de la dieta por la acción de las bacterias del intestino grueso que contienen ureasa. Es eliminado por el hígado a través del ciclo de la urea. En situaciones como: shunts porto-sistémicos, enfermedades metabólicas y alteraciones graves del parénquima hepático, el amonio no es depurado y llega al SNC produciendo clínica de encefalopatía. No existe correlación directa entre la cifra de amonio y el grado de encefalopatía. Con frecuencia, podemos encontrarnos niveles falsamente elevados por problemas en la extracción y procesamiento de la muestra sanguínea, ya que hay que realizarlo de forma muy precisa y rigurosa(21).
En hepatópatas crónicos compensados, distintas circunstancias como: episodios de sangrado digestivo agudo, catabolismo aumentado, etc., pueden conducir a que el amonio aumente de forma significativa y produzca un empeoramiento de las manifestaciones neurológicas (Tabla VIII).
Coagulación: el hígado es un órgano clave en la coagulación, ya que interviene en la síntesis de todos los factores (excepto el factor Von Willebrand) y de otros componentes que participan en la coagulación: plasminógeno y factor activador del plasminógeno.
Los factores vitamina K dependientes (II, VII, IX y X) pueden alterarse en las patologías colestáticas, porque la capacidad de almacenamiento de esta vitamina por parte del hígado es muy limitada(22).
En la absorción de la vitamina K intervienen varias variables: la ingesta, la secreción biliar y la mucosa intestinal integra.
Los parámetros de la coagulación que se estudian de forma rutinaria son:
• Tiempo de protrombina (TP): valora el tiempo en formarse la trombina a partir de la protrombina; para ello, es necesario la presencia de los factores V, VII y X. Evalúa la vía extrínseca de la coagulación. Su valor normal oscila entre 11 y 15 segundos. Si el alargamiento del TP es debido a una situación de colestasis que produce malabsorción, se corregirá en 24-48 horas tras la administración de vitamina K parenteral. En pacientes con patología hepatocelular, se considera un parámetro muy útil, que refleja rápidamente variaciones en la función hepática y es indicador pronóstico.
• Tiempo de tromboplastina parcial activado (TPPa): mide la formación de trombina por la vía intrínseca, evaluando los factores XII, IX, XI y VIII.
• El fibrinógeno es sintetizado por el hígado y por otros tejidos. Niveles bajos se pueden observar en los cuadros que cursen con CID (coagulación intravascular diseminada) y en situaciones de disfribrinogenemia, que pueden coexistir a la vez con algunas hepatopatías. Niveles altos se dan en situaciones de disfunción hepática y como reactantes de fase aguda (Fig. 6) (Tabla IX).

Figura 6. Cascada de la coagulación.
Otros parámetros bioquímicos
Metabolismo de los lípidos: en el hígado, se sintetiza la mayor parte de los lípidos (colesterol, triglicéridos, fosfolípidos) y de las apoproteínas, excepto los quilomicrones. Las alteraciones hepáticas se pueden acompañar de alteraciones en el perfil lipídico. En las situaciones de colestasis, se produce un aumento del colesterol sérico debido a la regurgitación del colesterol de la vía biliar a la sangre, por aumento de la síntesis hepática y por una disminución de la actividad de la LCAT (enzima lecitina colesterol acil transferasa), entre otras causas. Cifras por encima de cinco veces los valores normales favorecen su acúmulo en la piel formando los xantomas. Son característicos, niveles muy elevados de colesterol en ciertas patologías que cursan con colestasis, como el síndrome de Alagille, y en enfermedades metabólicas por déficit de la lipasa ácida lisosomal (enfermedad por depósito de ésteres de colesterol y enfermedad de Wolman), entre otras.
Metabolopatías: se pueden encontrar alteraciones hepáticas en un amplio número de metabolopatías: tirosinemia, galactosemia, fructosemia, acidemias orgánicas, defectos del ciclo de la urea, defectos de la beta oxidación de los ácidos biliares, enfermedades por depósito lisosomal, etc. En otros capítulos, se abordarán extensamente estas patologías.
Otras determinaciones útiles para el diagnóstico de ciertas patologías, son:
• Alfa 1-antitripsina: cuantificación y determinación del fenotipo.
• Ceruloplasmina y cobre en sangre y en orina de 24 horas, para diagnóstico de la enfermedad de Wilson. Las cifras de ceruloplasmina están disminuidas fisiológicamente en los primeros 6 meses de vida.
• Estudio del metabolismo del hierro: estarán elevados de forma llamativa en la hepatitis congénita aloinmune, que presenta cifras muy elevadas de ferritina y porcentaje de saturación de transferrina > 80%.
• Alfa fetoproteína estará elevada en los casos de hepatoblastoma y en la tirosinemia tipo I, teniendo en cuenta que los niveles están elevados de manera fisiológica durante los primeros meses de vida.
• Anticuerpos séricos: ANA, LKM, músculo liso y antitransglutaminasa, entre otros.
• Marcadores serológicos de hepatitis víricas.
• Porcentaje de transferrina deficiente en carbohidratos para el estudio del grupo de enfermedades englobadas dentro del déficit de glucosilación de carbohidratos, también estarán alterados en la galactosemia y en la intolerancia hereditaria a la fructosa.
• Determinación de la galactosa 1-fosfato-uridil transferasa en la galactosemia, no siendo válido si el paciente ha recibido una trasfusión de concentrado de hematíes las semanas previas.
• Estudios genéticos cada vez más amplios y útiles para el diagnóstico de múltiples enfermedades, como: enfermedad de Wilson, colestasis intrahepáticas familiares, síndrome de Alagille, fibrosis quística, enfermedades mitocondriales, glucogenosis, fructosemia, enfermedad de Niemann-Pick, etc.
• Estudio inmunohistoquímico en biopsia hepática, para el diagnóstico de ciertas formas de colestasis intrahepática familiar progresiva tipo 2 y 3, por defecto de BSEP y de MDR3, respectivamente(23).
Técnicas de imagen y estudio anatomopatológico
El abanico de pruebas de imagen para el estudio de las patologías hepatobiliares es muy amplio. El más útil en la Pediatría primaria es la ecografía, pero conviene recordar la indicación y el valor de otras exploraciones.
Radiología simple de abdomen: tiene una utilidad limitada en el estudio de la patología hepatobiliar, en ella podemos estudiar:
• Lesiones calcificadas: quistes hidatídicos, cálculos, tumores, lesiones vasculares…
• Aerobilia: aire en las vías biliares.
• Tamaño hepático y situación: se puede apreciar hepatomegalia.
Ecografía: es la técnica más utilizada en el manejo de la patología hepática en Pediatría, debido a su bajo coste y a la no radiación de los niños. Gracias a los distintos tipos de ecografía (modo B, doppler color, elastografía y ecografía con contraste ecogénico), la información obtenida con esta técnica es cada vez mayor(18,23).
A continuación, enumeramos su utilidad en las distintas situaciones:
• Patología de la vía biliar: es muy sensible y específica para su estudio. Podemos apreciar: barro biliar, colelitiasis, dilatación de vías biliares, colecistitis, tumores, compresión externa, etc. Aunque las técnicas que ofrecen más sensibilidad para el diagnóstico de este tipo de patologías son: la colangio-RM o la colangiografía.
• En caso de lesiones parenquimatosas, tiene mayor resolución para lesiones focales (quistes, abscesos…), que para lesiones difusas (esteatosis, hepatitis, infiltración, cirrosis…).
• Valoración del grado de ascitis o líquido libre peritoneal.
• Características de los vasos abdominales: venas suprahepáticas, vena porta, arteria hepática, estudio de venas colaterales porto-sistémicas…
• Con el estudio doppler permite estudiar los flujos, sus velocidades y resistencias en los vasos. Siendo de gran utilidad en el seguimiento de los pacientes con trasplante hepático.
• Realización de PAAF (punción aspiración con aguja fina) bajo control ecográfico.
• La elastografía (fibroscan) consiste en un traductor de ultrasonidos que emite unas ondas que, dependiendo de la elasticidad del parénquima, se propagan a distintas velocidades. Es útil para determinar el grado de fibrosis en ciertas patologías, como las hepatitis B y C crónicas y en la esteatohepatitis(23) (Fig. 7).

Figura 7. Ecodoppler de la arteria hepática en un paciente con trasplante hepático.
TAC: se obtiene mayor definición en los estudios anatómicos, comparándolo con la ecografía. Como desventaja, supone un mayor coste económico, mayor radiación y, en niños muy pequeños, la necesidad de sedación para su realización. Existen tres tipos de TAC: secuencial, helicoidal y multicorte. Las nuevas técnicas como el PET-TAC (tomografía por emisión de positrones) y el SPECT-TAC (por emisión de fotón único) pueden estar indicadas en determinadas patologías.
• Útil para el estudio de masas hepáticas, pudiendo administrar contraste para aumentar su resolución (abscesos, tumores, afectación de vasos…), mediante el estudio de las fases arteriales, portales y venosa tardía.
• En enfermedades difusas, tiene menor utilidad, excepto en determinadas patologías como la hemocromatosis neonatal (hepatitis congénita aloinmune).
• Para el estudio de la vía biliar, la primera prueba a realizar sería la ecografía, la TAC permitiría localizar e identificar con más exactitud las lesiones.
Resonancia magnética (RM): sus indicaciones se solapan con las de la TAC. Si se realiza una secuencia T2, se puede visualizar con detalle la vía biliar y pancreática sin necesidad de inyectar contraste (colangioRM). También, es útil para el estudio de la anatomía vascular (angioRM). Otras modalidades son: las técnicas de espectroscopia por RM (estudio del espectro de los componentes bioquímicos) y la elastrografía por RM (estudio de la rigidez de los tejidos).
Gammagrafía con isótopos: consiste en inyectar un contraste con isótopos radioactivos que son captados por el hígado y eliminados en la bilis. Dependiendo del estudio que se quiera realizar, se pueden utilizar diferentes isótopos.
El más utilizado en Pediatría es el Tecnecio 99 con ácido iminodiacético. Su principal indicación es el diagnóstico diferencial entre colestasis intrahepáticas y extrahepáticas, aunque en la actualidad su indicación se limita a casos concretos. Habitualmente, antes de someterlos a esta prueba, se pauta fenobarbital durante unos días para estimular el flujo biliar y así aumentar su sensibilidad.
La prueba consiste en medir el tiempo que tarda el contraste en ser captado por el hígado y en eliminarse por la bilis, apareciendo en el intestino delgado que, en condiciones normales, es en las dos siguientes horas tras la infusión iv., haciéndose controles incluso a las 24 horas.
En el caso de la atresia de vías biliares extrahepática, la captación por el hígado es normal, pero no existe excreción al intestino; en cambio, en las hepatitis neonatales la captación es pobre, pero sí existe excreción. Existen situaciones con gran colestasis intrahepática que no eliminan el contraste al intestino, por lo que hay que interpretarlo con cautela y siempre en el contexto de la evolución clínica y analítica del paciente.
Colangiografía percutánea transhepática (CPTH): bajo control radiológico, se llega al árbol biliar con una aguja fina, donde se inyecta contraste radiopaco, visualizándose con precisión la anatomía de la vía biliar. En determinadas circunstancias, las zonas de estenosis visualizadas (frecuente en los trasplantes hepáticos infantiles) se pueden dilatar “in situ” mediante balones inflables de distintos calibres, evitándose en muchas ocasiones, la realización de cirugía en la vía biliar para resolver la obstrucción.
Colangiografía endoscópica retrógrada (CPER): consiste en la canalización de la papila de Vater por visión directa mediante endoscopia. Se inyecta contraste en la vía biliar y pancreática. Las ventajas que ofrece respecto a la anterior es que, en situaciones de estenosis distal, se puede realizar esfinterectomía, extracción del cálculo, etc.
Arteriografía selectiva: se utiliza en caso de tumores para estudiar la afectación vascular y estudio de la anatomía vascular para la cirugía de derivaciones porto-sistémicas, entre otros.
Biopsia hepática: habitualmente se obtiene mediante PAAF guiada por ecografía. Es una técnica relativamente segura, precisando, en la mayoría de los casos, que el paciente esté sedado. Entre las complicaciones que pueden aparecer, figuran: hemorragias, hematomas, fístulas arteriovenosas, peritonitis biliar y neumotórax.
Las indicaciones son variadas: estudio de metabolopatías, estudio de enfermedades de depósito y seguimiento de ciertas patologías como: trasplantes hepáticos, hepatitis, etcétera (Fig. 8).

Figura 8. Imagen de biopsia hepática, donde se visualizan células gigantes (hepatocitos multinucleados) en un paciente con hepatitis a células gigantes asociada a anemia autoinmune.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** Hyman PE, Milla PJ, Benninga MA, Davidson GP, Fleisher DF, Taminiau J. Childhood functional gastrointestinal disorders: neonate/toddler. Gastroenteroloy. 2006; 130: 1519-1526.
2.** Rasquin A, Di Lorenzo C, Forbes D, Guiraldes E, Hyams JS, Staiano A et al. Childhood gastrointestinal disorders: child/adolescent. Gastroenterology. 2006; 130: 1527-1537.
3.* Vandenplas Y, Rudolph CD, Di Lorenzo C, Hassall E, Liptak G, Mazur L et al. Pediatric gastroesophageal reflux clinical practice guidelines: joint recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition (NASPGHAN) and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition (ESPGHAN). J Pediatr Gastroenterol Nutr. 2009; 49: 498-547.
4.* Tabbers MM, DiLorenzo C, Berger MY, Faure C, Langendam MW, Nurko S et al. Evaluation and treatment of functional constipation in infants and children: evidence-based recommendations from ESPGHAN and NASPGHAN. J Pediatr Gastroenterol Nutr. 2014; 58: 258-274.
5. Pandolfino JE, Kahrilas PJ. American Gastroenterological Association medical position statement: Clinical use of esophageal manometry. Gastroenterology. 2005; 128: 207.
6. Wenzl T, Benninga MA, Loots CM, Salvatore S and Vandenplas Y. ESPGHAN EURO-PIG Working Group. Indications, methodology, and interpretation of combined esophageal impedance-pH monitoring in children: ESPGHAN EURO-PIG standard protocol. J Pediatr Gastroenterol Nutr. 2012; 55: 230-234.
7. Germaná B, Di Mario F, Cavallaro LG, Moussa AM, Lecis P, Liatoupolou S, et al. Clinical usefulness of serum pepsinogens I and II, gastrin-17 and anti-Helicobacter pylori antibodies in the management of dyspeptic patients in primary care. Dig Liver Dis. 2005; 37: 501-8.
8.* Koletzko S, Jones N, Goodman K, Gold B, Rowland M, Cadranel M et al. H pylori Working Groups of ESPGHAN and NASPGHAN. Evidence-based guidelines from ESPGHAN and NASPGHAN for Helicobacter pylori infection in children. J Pediatr Gastroenterol Nutr. 2011; 53: 230-243.
9.*** Codoceo R, Perdomo M. Interpretación del laboratorio en gastroenterología. En: Tratamiento en gastroenterología, hepatología y nutrición pediátrica. Madrid: Sociedad Española de Gastroenterología, Hepatología y Nutrición pediátrica. 2004; p. 241-55.
10.* Muñoz R, Codoceo R. Pruebas de laboratorio en gastroenterología. An Pediatr Contin. 2006; 4: 375-9.
11.** Bhutta ZA, Ghishan F, Lindley K, Memon IA, Mittal S, Rhoads JM. Persistent and chronic diarrhea and malabsorption: Working Group report of the second World Congress of Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr. 2004; 39: 711-6.
12.* Husby S, Koletzko S, Korponay-Szabó IR, Mearin ML, Phillips A, Shamir R, et al. European Society for Paediatric Gastroenterology, Hepatology and Nutrition guidelines for the diagnosis of coeliac disease. J Ped Gastroenterol Nutr. 2012; 54: 136-60.
13.* Walkowiak J, Nousia-Arvanitakis S, Henker J, Stern M, Sinaasappel M, Dodge JA. Indirect pancreatic function tests in children. J Pediatr Gastroenterol Nutr. 2005; 40: 107-14.
14.* Molina M, Ramos E. Fibrosis quística: aspectos digestivos y nutricionales. An Pediatr Contin. 2008; 6: 65-75.
15.* Medina E. Enfermedad inflamatoria intestinal (II): diagnóstico y tratamiento. An Pediatr Contin. 2013; 11(2): 68-78.
16.*** Lee V, M.D, FRCPC. Laboratory Assesment of liver function and injury in children. En: Suchy F, Sokol R, Balisteri W. Third Ed. Liver disease in children. Philadelphia. Lippincott Williams & Wilkins. 2007; p 163-175.
17.*** Kelly D. Useful Investigations in the assessment of Liver Disease. En: Diseases of the liver and biliary system in the children. Second edition Blackwell. Ed. 2004; p 17-24.
18*** Sherlock S. Assessment of liver function. The haematology of liver disease. Ultrasound, Computerized axial tomography and magnetic Resonance imaging. En: Blackwell Scientific Publications. 11nd Ed. Diseases of the liver and biliary system. London. Blackwell scientific publications. 1989. p 19-79.
19.** Balisteri W. Manifestation of liver disease. En Berhman R, Klliegman R, Jenson; senior editor, Nelson W. 16 ed Nelson. Textbook of Pediatrics. Philadelphia. Mc Graw Hill Interamericana 2000. p 1312-1318.
20.*** Batista Ferreira R, Gonzalez Zarate A, Muñoz Bartolo G, Jara Vega P. Hepatomegalia, esplenomegalia. Elevación asintomática de transaminasas. En: Manual de Diagnóstico y terapéutica en Pediatría, 5ª ed. Libro Verde. Hospital Infantil La Paz. Publimed 2009; p193-195.
21.** Patrick S. Kamath M.D. Clinical approach to the patient with abnormal liver test results. Mayo Clin Proc. 1996; 71: 1089-1095.
22.*** Zafra Anta MA, Jara Vega P. Hepatomegalia y otras alteraciones hepáticas en Atención Primaria. En: Garcia Sicilia-López J. Publimed 1ª ed. 2001.
23.*** Jara P. Enfermedad hepática en el niño. Ed. Tile Von Spain. S.L. 2013.
Bibliografía recomendada
– Codoceo R, Perdomo M. Interpretación del laboratorio en gastroenterología. En: Tratamiento en gastroenterología, hepatología y nutrición pediátrica. Madrid: Sociedad Española de Gastroenterología, Hepatología y Nutrición pediátrica; 2004. p. 241-55.
Excelente resumen de las pruebas de laboratorio en el campo de la gastroenterología pediátrica. El texto se divide en apartados que desarrollan las pruebas funcionales de cada parte del aparato digestivo. Es de gran utilidad en la práctica y facilita los valores normales y patológicos de las distintas determinaciones en niños.
– Jara P. Enfermedad hepática en el niño. Ed Tile Von Spain. S.L. 2013.
Libro dirigido por la Dra. Jara, impulsora de la Hepatología Infantil en España, que abarca la patología hepática infantil con capítulos elaborados por autores nacionales e internacionales de gran experiencia y prestigio. Este manual es de fácil lectura, con tablas y gráficos muy didácticos, enfocado sobre todo, a la práctica clínica.
| Caso clínico |
|
Niño de 12 años que acude a Urgencias por tercera vez en 20 días al persistir un cuadro consistente en dolor abdominal en hipogástrico, de tipo cólico, asociado a 4-5 deposiciones diarreicas líquidas diarias. En las ocasiones anteriores, dado el buen estado general y de hidratación, fue dado de alta con el diagnóstico de probable gastroenteritis aguda infecciosa, recomendando sueroterapia oral. En esta ocasión, ha sido remitido por su pediatra de Atención Primaria para nueva valoración al referir en la última semana detección de abundante sangre y moco en las heces, además de evidenciar una pérdida de 2 kg de peso desde el inicio del cuadro clínico. Como antecedentes familiares relevantes, destaca que la madre padece colitis ulcerosa y la tía materna enfermedad de Behçet. Respecto a los antecedentes personales, solo destaca que en los últimos 2 años había presentado dolor abdominal recurrente en mesogastrio, catalogado como trastorno funcional y estreñimiento ocasional. Está bien vacunado y no ha precisado ingresos hospitalarios. En la exploración física, se objetiva febrícula de 37,5ºC, regular estado general, palidez de piel y mucosas y signos de leve deshidratación. El abdomen es blando y depresible, pero presenta dolor y sensación de empastamiento a la palpación en fosa ilíaca izquierda y en la zona suprapúbica. Se detecta hepatomegalia a 2 traveses. No se objetiva tumefacción articular ni lesiones cutáneas o mucosas. Los datos antropométricos son: peso 38 kg (p 22), talla 160 cm (p 71), IMC 14,8 kg/m2 (p 13). Se realiza analítica urgente con los siguientes resultados: hemoglobina 10,5 g/dl; hematocrito 32%; plaquetas 428.000/mm3; serie blanca normal; VSG 35 mm/h; PCR 16 mg/l; ferritina 9 ng/ml; coagulación normal. Bioquímica: GOT: 76 U/l, GPT 134 U/l, GGT 330 mg/dl, bilirrubina total 2,8 mg/dl y directa 1,5 mg/dl. Se realiza además ecografía abdominal urgente, que no evidencia datos de abdomen agudo ni signos de ileítis, con ligera hepatomegalia de ecogenicidad homogénea. Se decide ingreso hospitalario para ampliar estudio y realizar diagnóstico diferencial entre proceso infeccioso y enfermedad inflamatoria intestinal. Se realiza estudio microbiológico de heces (coprocultivo, estudio de parásitos, toxina de Clostridium difficile: negativos), calprotectina fecal (618 mg/g), estudios serológicos (inmunoglobulinas normales, ANCA positivo, ASCA negativo, ANA negativo, antitransglutaminasa IgA negativo), Mantoux negativo y radiografía de tórax normal. El estudio endoscópico alto es normal, pero en la ileocolonoscopia se objetivan datos de colitis izquierda moderada. Los hallazgos histológicos son compatibles con colitis ulcerosa. Se realizó tratamiento del brote con corticoides orales y mesalazina oral, con buena respuesta en la primera semana, con descenso progresivo de la dosis de corticoides hasta su retirada a las 12 semanas sin complicaciones. Se ajusta la mesalazina oral a dosis de mantenimiento.
|

