
Enseñanza no reglada y sin carácter oficial. Los créditos de formación continuada, no son aplicables
a los profesionales que estén formándose como especialistas en Ciencias de la Salud.

 |
| Editorial |
A. Cansino Campuzano
Hospital Universitario Materno Infantil de Canarias
«La pediatría social será uno de los pilares básicos del Congreso, como corresponde a las demandas de nuestros pacientes y sus familias. Los talleres, cada vez mas solicitados por los congresistas, aumentarán su número intentando ofrecer variedad y calidad» |
La isla de Gran Canaria dista de Cádiz, el punto más próximo de la península unos 1.500 kilómetros, de Madrid casi 2.000 y de Barcelona 2.500. Entendemos que esto pueda parecer un hándicap, sin embargo nosotros lo sentimos como una oportunidad para reunir a pediatras de toda la geografía española y compartir ciencia, aprendizaje y experiencias en nuestra ciudad, Las Palmas de Gran Canaria.
Solo quedan tres meses para que se celebre la XXVII edición del Congreso Nacional de Pediatría Extrahospitalaria y Atención Primaria, y han trascurrido casi tres años desde que se votara en Asamblea General celebrada en Murcia la candidatura de Las Palmas.
Hemos diseñado un programa científico que creemos se corresponde con los intereses de la pediatría extrahospitalaria del siglo XXI.
La pediatría social será uno de los pilares, como corresponde a las necesidades y las demandas de nuestros pacientes y su entorno. Sería cansino, valga la redundancia, hablar de crisis. Pero lo cierto es que esto no termina y tendríamos que ponernos una venda en los ojos para no ver cómo está afectando a nuestros pacientes y a sus familias. Padres sin derecho a asistencia, lactantes que no toman leche de fórmula, vacunas fuera de calendario que no se administran o vacunas que se sacan de calendario, medicamentos que no se compran porque son caros, niños y niñas con enfermedades crónicas y discapacidades sin ayudas, padres que viven separados porque ambos están desempleados, etc. Este drama se nos presenta al otro lado de la mesa día tras día. En realidad, todo está mal y eso hace que nos sentamos impotentes, pero es importante tener conciencia que la situación actual ha repercutido de manera negativa en la salud de nuestros pequeños pacientes y ¡no se lo merecen!
Dentro de este campo se desarrollarán ponencias en las que se tratarán tanto los “aspectos legales en la atención al niño y al adolescente” como la “coordinación interinstitucional ante el maltrato infantil”, exponiendo las competencias y responsabilidades de cada una de las instituciones que representan, o problemáticas tan novedosas y a la vez tan en auge como “violencia filio-paternal“, las denuncias de padres contra hijos por maltrato, amenazas y violencia verbal, física y psicológica se han multiplicado casi ocho veces en los últimos años; así como “los procedimientos sancionadores a menores” o las “nuevas adicciones en los adolescentes”, como el eyeballing, Cibersex, Shopaholic, Peting, Speed-datin g, o el Ko-guiaru. Una mención especial requiere el abordaje de la “transexualidad en Pediatría” que, aún siendo una situación poco frecuente, tiene una gran repercusión, tanto en el presente como en el futuro de estos niños y niñas, de manera individual y en sus relaciones sociales. Se expondrán algunos de los protocolos existentes, así como la manera de identificar la disforia de género y las posibilidades de tratamiento en la infancia y la adolescencia. Para todo ello, además de pediatras expertos en el tema, contaremos con magistrados, médicos forenses, psicólogos y otros especialistas.
El formato que tanta aceptación ha tenido en los últimos años, “las controversias”, enfrentarán temas tan apasionantes como “la comida rápida vs dieta mediterránea” y “vacunación antigripal universal vs grupos de riesgo”. Los “contrincantes”, grandes profesionales de reconocido prestigio internacional defenderán con las armas de la ciencia sus posturas.
Sabemos que la práctica de deportes de competición en ocasiones “pasa factura” a un cuerpo en crecimiento y desarrollo, y nos encontramos con consultas en este aspecto que a veces no sabemos resolver; para conocer los inconvenientes y las consecuencias que pueden generar una mala práctica deportiva en nuestra población infantil contaremos con dos especialistas de excepción en un mesa redonda en la que se desarrollarán éstos y otros aspectos de la “Medicina deportiva en el niño y el adolescente”.
También tendrán cabida aspectos tradicionales de la pediatría, como el seguimiento del prematuro en Atención Primaria, el insomnio infantil o la lactancia materna. Cabe destacar la ponencia que aborda la patología ginecológica en la que se desarrollaran la “anticoncepción y prevención de las enfermedades de transmisión sexual en la adolescencia”.
Con respecto a las enfermedades infecto-contagiosas, los cambios epidemiológicos en los últimos años nos obligan a volver a hablar de tosferina y sarampión. Las presentaciones atípicas de estas enfermedades emergentes, así como las estrategias para mejorar esta situación y la realidad de los Grupos Antivacunas serán los puntos claves a tratar.
En cuanto a los talleres, cada vez más solicitados por los congresistas, hemos incrementado el número procurando ofrecer como siempre variedad y calidad. Los clásicos como el de “Técnicas de inhalación y uso del espirómetro” o el de radiología, esta vez con un enfoque diferente “Guía de supervivencia para el pediatra de Atención Primaria”, y por supuesto no podía faltar el “Taller de Simulación Avanzada”. Repetimos el taller de “Ecografía para el pediatra de Atención Primaria”. Como novedades tenemos algunos relacionados con la atención urgente como “el acceso vascular y el uso de la vía intraósea” o la “atención inicial al trauma pediátrico”; otros con el uso de técnicas como “el retinógrafo para la interpretación del fondo de ojo” o el “taller de comunicación”, tan necesario en la consulta diaria. “La exploración neurológica del recién nacido y el lactante” será objeto de otro taller. Otros temas a tratar de rabiosa actualidad, serán las “redes sociales” o la “atención al niño viajero”; y también habrá lugar para las necesidades personales del pediatra con un “taller de inteligencia emocional” y, el más novedoso, el de “defensa personal”, que les aseguro les va a sorprender.
Esperamos una gran participación de pediatras en formación, nuestros residentes están cada vez más involucrados en la Atención Primaria y son uno de los pilares de nuestros congresos; un verdadero impulso para la comunidad científica. Ellos son los autores de muchas de las más de 200 comunicaciones que se presentan, un verdadero éxito dicho sea de paso, y muchos de ellos optan a los diferentes premios y becas que se conceden para estimular esta valiosa aportación.
No podemos terminar sin hacer una invitación especial a todos los pediatras de Canarias, tanto a las islas de Fuerteventura y Lanzarote, parte de nuestra provincia de Las Palmas y por ende de nuestra sociedad, como a los de nuestra provincia hermana de Santa Cruz de Tenerife.
Estaremos encantados de compartir este proyecto lleno de ilusión con ustedes… este año… en octubre… en Las Palmas de Gran Canaria.
 |
| Temas de FC |
J.I. Benito Orejas*, J.C. Silva Rico**
*Servicio ORL Hospital Clínico Universitario de Valladolid. **Pediatra. Centro de Salud Laguna de Duero
| Resumen
Los avances tecnológicos de los últimos años, junto a un mayor conocimiento de la función auditiva, han permitido elaborar nuevas estrategias de diagnóstico precoz y comprobar científicamente que el potencial discapacitante de la sordera disminuye en gran medida con la intervención temprana. El pediatra de Atención Primaria tiene un papel fundamental en el control y seguimiento de la hipoacusia infantil, orientando a las familias para que sus hijos reciban, en el momento apropiado y en las mejores condiciones, los servicios de cribado, diagnóstico y tratamiento; e intercambiando información con profesores y rehabilitadores para facilitar el buen curso del proceso de intervención. Debe reconocer a aquellos niños que están en riesgo o sufren de hipoacusia congénita o adquirida, ser capaz de evaluar la normalidad de la audición, el estado del oído medio y conocer los medios de derivación a los centros especializados en el diagnóstico y tratamiento de la hipoacusia infantil. |
| Abstract
The latest technological advances, together with greater knowledge about auditory function, have made new early diagnosis strategies possible. In addition, they allow us to demonstrate scientifically that early intervention greatly reduces the capacity for impairment that deafness involves. |
Palabras clave: Cribado auditivo; Hipoacusia infantil; Conocimiento médico; Factores de riesgo; Audiología.
Key words: Hearing screening; Childhood hearing loss; Physician knowledge; Risk factors; Audiology.
Pediatr Integral 2013; XVII(5): 330-342
Introducción
“Hablamos porque oímos y hablamos como oímos, pero no oímos con el oído sino con el cerebro” (W.G. Hardy).
Todos recibimos con alegría las primeras palabras de nuestro hijo, porque el desarrollo del lenguaje hablado es una de las hazañas más espectaculares y una de las características más propias del ser humano. A través de la audición, el niño aprende “por imitación” el habla y, por medio de éste, desarrolla la comunicación y adquiere conocimiento(1). Aunque el órgano auditivo ha madurado antes del nacimiento, las conexiones nerviosas aferentes y la corteza auditiva sólo se desarrollan morfológica y funcionalmente bajo la influencia del estímulo sonoro y además, como otras funciones biológicas, con una precisa cronología. La adquisición del lenguaje depende de un “periodo crítico” comprendido entre el nacimiento y los 3 años. Un niño que no tenga contacto con el sonido durante ese tiempo, nunca logrará la competencia lingüística acorde con su potencial(2). A medida que el niño crece, la deprivación auditiva genera una reorganización cortical donde, por ejemplo, los impulsos visuales se expanden hacia las áreas auditivas corticales secundarias; de forma que, la duración de la sordera antes del tratamiento se correlaciona negativamente con la capacidad para percibir y utilizar el lenguaje hablado después de iniciado el mismo.
El sentido del oído no sirve exclusivamente para oír, aprender a hablar, controlar la voz y comunicarse, sino que tiene otras funciones asociadas al desarrollo global del individuo. Cuando la sordera es profunda, bilateral y de inicio temprano, la falta de tratamiento puede llevar a la instauración de un amplio síndrome psico-social, con problemas psico-afectivos derivados del aislamiento, alteraciones del comportamiento, falta de desarrollo intelectual y dificultades en la integración social.
La identificación precoz, el seguimiento y el diagnóstico de la hipoacusia infantil resultan fundamentales para iniciar el proceso de rehabilitación, que permitirá al niño sordo recibir la máxima información auditiva durante el período crítico de desarrollo del lenguaje hablado, reduciendo los efectos de la deprivación sonora.
Clasificación de la hipoacusia
Una hipoacusia puede definirse en función de diversos criterios. Por su intensidad: leve, moderada, severa y profunda. Por su localización: conductiva, neurosensorial, mixta y central. Y por su momento de aparición respecto al lenguaje: prelocutiva, perilocutiva y postlocutiva.
Según la intensidad de la pérdida auditiva, hay varias clasificaciones algo diferentes unas de otras, por lo que resulta esencial indicar siempre la referencia utilizada. Siguiendo las normas de la BIAP (1997)(3), se establecen cuatro grupo: hipoacusias leves (21-40 dB HL), moderadas o medias (41-70 dB HL), graves o severas (71-90 dB HL) y profundas (>90 dB HL) (Tabla I).
En relación a la localización de la lesión, se distinguen las hipoacusias de transmisión o conductivas, donde la parte afectada es la puramente mecánica del oído externo o medio, y las de percepción o neurosensoriales, en las que el daño se localiza en el órgano de Corti (sensorial) o en la vía auditiva (neural). Cuando se asocian ambos tipos de hipoacusia, conductiva y neurosensorial, se habla de hipoacusia mixta. Finalmente, referimos que una hipoacusia es central cuando hay dificultades en el procesamiento perceptual de la información auditiva a nivel cerebral.
En cuanto al momento de aparición del déficit auditivo respecto a la adquisición del lenguaje, diferenciamos las hipoacusias prelocutivas o prelinguales, que acaecen antes de la aparición del lenguaje entre 0 y 2 años, las perilocutivas, entre los 2 y 4 años, y las poslocutivas o poslinguales, que se instauran después de que las adquisiciones lingüísticas fundamentales están consolidadas. Las hipoacusias pre y perilocutivas bilaterales, de intensidad severa-profunda, interfieren o impiden el desarrollo del lenguaje.
Incidencia de la hipoacusia infantil
La hipoacusia neurosensorial congénita es la deficiencia sensorial más frecuente: tres veces más que el síndrome de Down, seis más que la espina bífida o cincuenta veces más que la fenilcetonuria.
La incidencia de hipoacusia severa-profunda bilateral en los recién nacidos (RN) es de alrededor del 1 por mil y de cualquier tipo de hipoacusia del 5 por mil. En los RN con factores de riesgo (FR) de hipoacusia, es diez veces superior(4). La incidencia de hipoacusia unilateral varía del 0,8 al 2,7 por mil, y la de la hipoacusia leve bilateral, del 0,4 al 1,3 por mil, pudiendo representar más del 40% de las hipoacusias permanentes infantiles(5).
El 80% de las hipoacusias infantiles son congénitas y aproximadamente un 20% se desarrollan en los primeros años de la vida. Pero la prevalencia de la hipoacusia permanente continúa creciendo durante la infancia y alcanza una tasa del 2,7 por mil antes de los 5 años de edad y del 3,5 por mil en la adolescencia. Por cada 10 niños con hipoacusia congénita, similares pérdidas auditivas se desarrollan en otros 5 a 9 niños antes de los 9 años(6).
Etiología de la hipoacusia infantil
Las causas de la hipoacusia infantil son numerosas y su conocimiento evoluciona en función del desarrollo de la genética, de la comprensión e influencia de las exposiciones ambientales y de la mutua relación entre ambos factores.
En las sociedades desarrolladas se estima que el 50-60% de las hipoacusias congénitas son heredadas. En el 30% de estos casos la hipoacusia se agrupa con otras alteraciones que, en conjunto, definen un síndrome genético. Existen alrededor de 600 síndromes que asocian hipoacusia. Destaca entre ellos el síndrome de Pendred, de herencia autosómica recesiva, que asocia hipoacusia neurosensorial con un grado variable de bocio, debido a las alteraciones de una proteína (pendrina) que se encuentra en las células del tiroides, oído interno y riñón. En el 70% restante, la hipoacusia se presenta aislada. El 80% de los pacientes con hipoacusia genética aislada lo son como consecuencia de una transmisión hereditaria de tipo autosómico recesivo, que pasa fácilmente desapercibida al no existir, generalmente, antecedentes familiares cercanos de hipoacusia. La más relevante es la mutación del gen GJB2 (conexina 26). Un 35-40% de las sorderas infantiles son adquiridas, por infecciones, en especial por citomegalovirus (CMV), tóxicos y otros agentes, que acaecen durante el periodo prenatal en un 20% de pacientes, en otro 20% durante el parto y, en el 60% restante, en los primeros años de vida. Finalmente, un 10-20% de hipoacusias son de causa desconocida(7) (Fig. 1).

Figura 1. Incidencia estimada de las diferentes causas de hipoacusia al nacimiento (Morton y cols., 2006). En el diagrama se pretende resaltar la relativa importancia del síndrome de Pendred, entre las hipoacusias genéticas sindrómicas; las mutaciones del gen GJB2, en las hipoacusias genéticas no sindrómicas, y la infección por citomegalovirus (CMV) en las hipoacusias adquiridas prelinguales.
Justificación de los programas de cribado
“Cada día que pasa sin detectar una hipoacusia en la vida de un niño es un día sin acceso completo al lenguaje” (Davis A, Wood S, 1992).
La hipoacusia neonatal y las pruebas utilizadas para el cribado cumplen todos los requisitos epidemiológicos que sirven para justificar su detección precoz. Sin programas específicos de detección, la hipoacusia congénita bilateral, no será diagnosticada hasta aproximadamente los 2-3 años de edad dejando, como hemos visto, secuelas permanentes(4).
Se ha demostrado(8,9) que el diagnóstico de la hipoacusia congénita antes de que el lactante cumpla 6 meses de edad y su inmediato tratamiento permiten alcanzar unos buenos niveles de lenguaje y de desarrollo social y emocional, independientemente de que el modo de comunicación sea oral, signado o mixto. Por el contrario, sin identificación e intervención tempranas, 1/3 de los niños con hipoacusia leve bilateral o unilateral mostrarán retraso del desarrollo(5).
A partir de los años 70, se produce un gran salto tecnológico en el campo de la audiología infantil. La evolución de la impedanciometría clínica, el reconocimiento de los potenciales evocados auditivos del tronco cerebral (PEATC) y las primeras observaciones de otoemisiones acústicas (OEA) ofrecen la posibilidad de disponer de procedimientos objetivos para la evaluación auditiva, hasta este momento inexistentes (Fig. 2). Es entonces cuando, a raíz de las recomendaciones del Comité Americano de Audición Infantil, el Joint Committee on Infant Hearing (JCIH), surgen dos tipos de programas de cribado auditivo que únicamente se diferencian en la población de estudio: niños con “alto riesgo de hipoacusia” y “población general”, siendo el objetivo, en ambos casos, detectar las hipoacusias neonatales, uni o bilaterales, iguales o superiores a 35 dB HL.
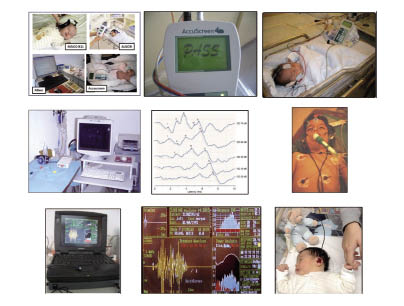
Figura 2. Pruebas de audición electrofisiológicas. OEA: equipo clínico de otoemisiones acústicas. PEATC: equipo diagnóstico de Potenciales Evocados Auditivos del Tronco Cerebral. PEATC-A: equipo de cribado automático de PEATC. Gráficos de resultados, en función del tipo de prueba (con datos numéricos en caso de los equipos clínicos y en forma de “PASA/NO PASA” en los automatizados). Finalmente, imágenes de la realización de las pruebas (los neonatos están dormidos con sueño natural y el niño al que se realizan PEATC está monitorizado y con sedación).
La incidencia de hipoacusia en el “grupo de riesgo” es del 3-5%, 10 veces superior a la de la población general, siendo los indicadores más frecuentemente implicados: los antecedentes familiares de pérdida auditiva, el ingreso en UCI neonatal y las malformaciones craneofaciales. Como ventaja adicional, el protocolo de cribado a neonatos de alto riesgo disminuye el número de pacientes a examinar, a unos 10-16% de los RN, reduciendo costes. El gran inconveniente de esta estrategia es que sólo detecta, como máximo, el 40-50% de las hipoacusias congénitas, que es el porcentaje que se asocia a FR(4).
En febrero de 1999, la Academia Americana de Pediatría(4) publica un informe que justifica la puesta en marcha de un programa neonatal de “cribado universal de hipoacusia” en todos los hospitales con partos. En este documento, se establecen las líneas básicas que deben regir el cribado, seguimiento, identificación e intervención de los casos detectados y la forma de evaluar el programa.
En 1995, se constituye en nuestro país la “Comisión para la Detección Precoz de la Hipoacusia” (CODEPEH), integrada por miembros de la Sociedad Española de Otorrinolaringología, la Asociación Española de Pediatría, la Federación Española de Amigos y Padres del Sordo (FIAPAS) y el Instituto Nacional de la Salud, con objeto de promover la detección neonatal de la hipoacusia en España. En 2003, se aprueba el Registro Mínimo de Datos que recoge los indicadores de cobertura, proceso y resultado de los programas de detección precoz de la sordera, siendo la Administración Sanitaria la encargada de su difusión en todos los hospitales(10). En el momento actual, la CODEPEH considera que los objetivos se están cumpliendo, con mayor o menor fortuna según las CC.AA., pero que aún hay problemas por resolver. Se debe mejorar la calidad de los programas establecidos y unificar criterios que, dentro de la diversidad, permitan comparar los resultados; por lo que, se propone la creación de un registro nacional centralizado. El seguimiento audiológico de los niños con factores de riesgo, donde resulta fundamental la implicación de los pediatras de Atención Primaria, y el desarrollo de programas de (re)habilitación para los niños con sordera, serían también objetivos de actualidad(11).
Características de un programa de detección e intervención precoces de la hipoacusia
“Más importante que el equipo de cribado o el protocolo utilizado, es que haya alguien que comprenda la importancia del programa y se comprometa con su éxito” (White, 2008).
Objetivo general
Según las indicaciones del JCIH (2007)(12) y de la CODEPEH (2010)(10), se deben detectar todas las hipoacusias congénitas permanentes uni o bilaterales, de “cualquier grado” y etiología, ya sea sensorial, conductiva o neural (neuropatía o disincronía auditiva). Por tanto, el cribado ha de ser universal(4).
• Elección de la técnica de cribado(13): la técnica de cribado perfecta sería aquella en la que pasaran todos los individuos sanos (100% de especificidad) y no pasara ninguno de los que presentan hipoacusia (100% de sensibilidad). Pero esta prueba no existe (Fig. 3). Un importante estudio multicéntrico(14) concluye que, la efectividad de las OEA y de los PEATC es similar.
La prueba con OEA es más rápida y de menor coste, pero con mayor número de falsos positivos en las primeras 48 horas. Por otra parte, en caso de neuropatía/disincronía auditiva, que se estima afecta al 10% de la población sorda, la lesión se encuentra más allá de las células ciliadas externas y, por tanto, las OEA son normales, originándose un falso negativo, porque se pasa la prueba y hay afectación auditiva. Por este motivo, las recomendaciones actuales(10,12) expresan que, “la única técnica de cribado auditivo apropiada en la UCI neonatal de 2º-3er nivel, donde la neuropatía auditiva es más frecuente, debe ser la de PEATC automáticos (PEATC-A)”.
• Estrategia del cribado: a fin de reducir los falsos positivos, se recomienda re-cribar a todos los niños que no pasan, antes del alta hospitalaria; porque, probablemente, las condiciones transitorias que causaron el fallo inicial como: fluido en oído medio, vérmix bloqueando CAE, irritabilidad del niño, elevado nivel de ruido ambiente… podrían haberse resuelto. Un programa en 2 fases como el descrito se puede realizar repitiendo la misma prueba: OEA o PEATC-A, o utilizando ambas; acogiéndose a las ventajas del bajo coste y de la rapidez de las OEA y a las bajas tasas de referencia de los PEATC-A, establecer una estrategia de cribado que empiece por OEA y a los que no pasen se les haga una 2ª prueba con PEATC-A.
Objetivos específicos(10,12,15)
Recomendaciones al Programa: “Plan 1-3-6” (Fig. 4):
• Todos los RN serán cribados antes del primes mes de edad (corregida para los prematuros).
• Los que no pasen el cribado, tendrán un diagnóstico audiológico con 3 meses de edad.
• Todos los niños con hipoacusia permanente iniciarán la intervención apropiada a los 6 meses edad.

Figura 4. Plan 1-3-6: cribado auditivo en el 1er mes, diagnóstico durante los 3 primeros meses y tratamiento antes de los 6 meses (corregidos por prematuridad). El pediatra de Atención Primaria controla el seguimiento de este proceso y participa, junto con los servicios de apoyo, en la información aportada a la familia. El programa incluye cribado, diagnóstico y atención precoz (CODEPEH).
Indicadores de riesgo de hipoacusia infantil(15,16)
“PASAR el cribado auditivo no impide la aparición de una hipoacusia tardía y es, por tanto, esencial, seguir monitorizando el desarrollo del lenguaje y de la audición” (Johnson y cols., 2005).
Aunque la mayoría de neonatos con hipoacusia congénita se identifican con el cribado auditivo universal, alrededor de un 20% manifiestan su hipoacusia tardíamente: “hipoacusia tardía”. Pero, además, durante la infancia se producen hipoacusias de causa adquirida; como resultado de determinadas enfermedades infecciosas, en especial la meningitis, traumatismo craneoencefálico, ruido intenso o tratamientos con ototóxicos. Ciertos hallazgos físicos, sobre todo craneofaciales, determinados acontecimientos perinatales, retrasos globales del desarrollo o del lenguaje, nos pueden indicar la presencia de un problema auditivo.
En la tabla II, se numeran estos indicadores de riesgo de hipoacusia infantil, constantemente redefinidos por el JCIH para adaptarse a los nuevos resultados publicados en la literatura médica. Cada uno de estos factores tiene su importancia relativa.
En relación a los indicadores de riesgo, el pediatra debe tener en cuenta las siguientes recomendaciones(10,12,15,16):
• Todo niño con un indicador de riesgo de hipoacusia, independientemente de que el cribado neonatal y su posterior seguimiento sean normales, será remitido para una evaluación audiológica especializada al menos una vez, entre los 24 y 30 meses de edad. Y aquellos niños con indicadores de riesgo que muestren una elevada incidencia de hipoacusia tardía (véase tabla II), como la oxigenación extracorpórea o la infección por CMV, deben ser evaluados con más frecuencia, cada 6-9 meses, aproximadamente.
• En cada visita periódica del Programa de salud infantil, se deben estimar las habilidades auditivas, el estado del oído medio y los hitos del desarrollo, pues un 25% de hipoacusias tardías no tienen FR (Tablas III y IV). Si un niño no pasa la valoración del habla y del lenguaje o si existe la “sospecha” del pediatra o de los padres o cuidadores de que tiene una pérdida de audición, debe ser inmediatamente derivado a una unidad de diagnóstico de hipoacusia infantil, para su estudio. Prohibida la actitud de “esperar y ver”.
• Se recomienda explorar en cada revisión el estado del oído medio y, cuando se compruebe una otitis media serosa de al menos 3 meses de duración, se debe remitir al paciente a ORL.
• Tras confirmar la hipoacusia en un niño, sus hermanos son considerados de alto riesgo y se les debe realizar un estudio auditivo.
El “examen físico” es parte esencial en la evaluación de un niño con hipoacusia, porque nos puede permitir revelar la existencia de un cuadro sindrómico(14). Las anomalías de cabeza y cuello que se relacionan con una posible hipoacusia incluyen la heterocromía del iris, la malformación del pabellón auricular o del conducto auditivo externo, fístulas o apéndices preauriculares, fisura del labio o del paladar, asimetría o hipoplasia de las estructuras faciales y microcefalia. El hipertelorismo y las alteraciones de pigmentación de la piel, del pelo o de los ojos, también se asocian con pérdida auditiva, como en el síndrome de Waardenburg. La presencia de anormalidades renales (síndrome de Alport), cardíacas (alargamiento del espacio QT en el síndrome de Jervell y Lange-Nielsen)… nos alertarán de su posible vinculación con la hipoacusia. La otoscopia puede descubrir ciertas deformidades timpánicas sospechosas de hipoacusia.
Evaluación objetiva de la audición(17)
El principio de las pruebas cruzadas de Jerger y Hayes, en 1976, determina la necesidad de establecer un diagnóstico audiológico a través del concierto de varias exploraciones auditivas diferentes.
Además del cribado auditivo universal y de la vigilancia regular del desarrollo general, de la capacidad auditiva, del inicio del habla, de la opinión de los padres y del estado del oído medio, a los niños se les debe estudiar la audición con métodos objetivos en los periodos recomendados por el Programa de Actividades Preventivas y de Promoción de la Salud (PAPPS). La tecnología utilizada para esta valoración debe elegirse en función de la edad, del grado de cooperación y de los recursos disponibles (Tabla V).
Los Potenciales Evocados Auditivos del Tronco Cerebral son la exploración audiológica fundamental para determinar el umbral de audición en menores de 9 meses y en los que no puedan evaluarse con pruebas de comportamiento. Los PEATC de estado estable nos permiten, además, obtener una valoración frecuencial de la audición.
En niños de 8 a 24 meses, se completa el estudio electrofisiológico con la realización de una audiometría del comportamiento con refuerzo visual (ARV), en la que se condiciona el estímulo sonoro con otro de refuerzo (juguete luminoso). Los resultados son parecidos a los de la audiometría convencional, que es la técnica que aplicaremos a los más mayores, a partir de 2,5 años ayudados, en ocasiones, de alguna actividad lúdica, dependiendo del grado de participación.
Los niños con hipoacusia unilateral o leve también precisan seguimiento audiológico, pues se ha demostrado que tienen riesgo de presentar alteraciones en la comunicación, así como en el desarrollo social, emocional y educativo(5).
Seguimiento y diagnóstico(10,12,15,16,18)
La historia clínica sigue siendo el medio diagnóstico fundamental para identificar la causa de una hipoacusia.
Si el resultado del cribado al nacimiento o en cualquier otro momento de la evolución del niño es “NO PASA”, se debe iniciar un estudio diagnóstico. El fracaso en los programas de cribado se produce en el seguimiento y confirmación de la hipoacusia. Un problema similar ocurre en los niños mayores y adolescentes en los que, tras descubrir una pérdida de audición (Tabla VI), no se ponen en marcha las medidas necesarias para restituir dicha pérdida.
Como hemos explicado, en un neonato se utilizarán los PEATC para establecer el diagnóstico, mediante 2 pruebas que, salvo circunstancias excepcionales, se realizarán a lo largo de los 3 primeros meses de vida. La información que ofrecen los PEATC es suficiente para iniciar una adaptación protésica antes de cumplir los 6 meses de edad (corregida por prematuridad). El diagnóstico audiológico se continuará con reevaluaciones periódicas para determinar si la hipoacusia es fluctuante, progresiva o estable, siendo fundamental monitorizar continuamente el estado del oído medio mediante otomicroscopia y timpanometría.
Confirmada la pérdida auditiva, se debe transmitir la noticia a la familia. Son muchas las preguntas y, entre todo el equipo de atención, se comparten las respuestas y los interrogantes. La información será veraz (objetiva, adecuada y suficiente), pero intentando ser capaces de empatizar y alentar a los padres, para ayudarles a superar su estado emocional. Necesitan tiempo para procesar todo lo relativo a la deficiencia sensorial de su hijo. También es muy útil comunicarles la existencia de las asociaciones de padres (FIAPAS), donde se desarrollan programas de información y apoyo a las familias y a sus hijos.
Pero, además del diagnóstico audiológico, debemos buscar la causa de la sordera, porque puede ofrecer importantes beneficios en relación al pronóstico, a la identificación de factores de riesgo asociados o patologías coexistentes y al hecho de entender la verdadera causa de la pérdida auditiva. Generalmente, se requiere la intervención de diferentes disciplinas. En caso de una hipoacusia neurosensorial, el estudio dependerá de los antecedentes familiares y de la exploración física. Más del 90% de los niños que nacen con hipoacusia tienen padres oyentes, siendo importante por su elevada incidencia, la evaluación genética con su correspondiente consejo, que les ofrecerá información útil para planificar sus propósitos de futuro. También, pediremos un estudio de imagen del hueso temporal buscando defectos estructurales, y siempre solicitaremos un estudio oftalmológico, que nos asegura la correcta visión del niño y descarta patología asociada, que está presente en 1/3 de los pacientes. La realización de otras exploraciones dependerá del tipo de hipoacusia y de los antecedentes. En alrededor del 40%, la causa es desconocida.
Tratamiento(12,15,18)
La comunicación entre los diferentes profesionales que atienden a un niño con problemas de audición es fundamental para conseguir el tratamiento más apropiado (Fig. 5).

Figura 5. Alrededor de la hipoacusia infantil participan una gran variedad de profesionales procedentes de diferentes áreas del conocimiento y de la administración. De la coordinación de este multitudinario equipo, depende la adecuación del niño sordo al entorno elegido por su familia.
En general, todo el mundo está de acuerdo en que la intervención de la sordera infantil debe ser multidisciplinar. El equipo encargado de su cuidado y seguimiento (ORL, pediatra, audioprotesista, logopeda, maestro) mantendrá una interrelación que permita la mejor asistencia. Pero la sordera es un problema familiar. La familia es el marco y el principal agente que impulsa el desarrollo personal, comunicativo y social del niño. La finalidad es ofrecer a las familias las opciones más apropiadas para que puedan tomar sus decisiones con suficiente información. Pero los deseos y expectativas de cada familia están influidos por la educación, el nivel socio-económico, la accesibilidad a los recursos, el lenguaje utilizado en casa (oral, signado)…; así que, todo el equipo debe estar de acuerdo en que no existen decisiones definitivas sin vuelta hacia atrás y seguramente habrá otras oportunidades que permitirán nuevos planteamientos en relación al progreso y la aplicación de alternativas.
Si se decide la intervención oralista, un audioprotesista infantil será el encargado de seleccionar y adaptar, generalmente en ambos oídos, una determinada prótesis auditiva, no más tarde del mes siguiente al diagnóstico. Si, con el apoyo intensivo de la habilitación logopédica, la sordera bilateral severa/profunda muestra un progreso insuficiente, el paciente podría ser candidato a un implante coclear hacia el primer año de vida. En este caso, para pretender el mayor beneficio a largo plazo, es preferible que la toma de decisiones se realice a través de un experto equipo multidisciplinar, que ofrezca la autoridad a los padres y les sitúe en el centro de este proceso de elaboración(2).
El éxito de las técnicas audioprotésicas depende fundamentalmente de una correcta rehabilitación, en colaboración con el entorno familiar y escolar, basada en el estímulo auditivo desde la más temprana edad.
A lo largo del periodo de intervención, el pediatra de Atención Primaria sigue desempeñando un papel fundamental, al poder controlar la disponibilidad de los medios logopédicos y audioprotésicos, comprobando su correcto funcionamiento (audífonos, implante coclear, implante osteointegrado…) y, llegado el momento, recomendando la adaptación de equipos de apoyo auditivo en el ambiente escolar, cuyo beneficio está demostrado en la mayoría de los casos. Desde el punto de vista médico, el pediatra vigilará potenciales complicaciones, como la impactación de cerumen en el conducto auditivo, que alteraría el funcionamiento del audífono, o la presencia de otitis externa o de otitis media serosa que disminuye los niveles de audición.
Al menos 1/3 de los niños con hipoacusia presentarán alguna otra condición patológica asociada. De ahí, la importancia del estudio oftalmológico sistemático. El diagnóstico de un síndrome de Usher, que asocia hipoacusia y pérdida de visión progresiva, condiciona las posibilidades de comunicación. Pero los niños con pérdida de audición deben, específicamente, ser evaluados por dificultades en el desarrollo y comportamiento, como: déficit de atención, hiperactividad, autismo o alteraciones del aprendizaje, y solicitar estudios especializados cuando se considere necesario. Los problemas psicológicos son de 2 a 5 veces más frecuentes en el niño sordo que en el oyente, sobre todo si hay discapacidades añadidas o alteraciones familiares, tales como un divorcio. La adolescencia añade nuevos cambios y muchos jóvenes con sordera sufren una disminución de la autoestima y manifiestan incertidumbre respecto a su identidad.
En resumen, la asombrosa extensión de los programas universales de cribado auditivo neonatal por todo el mundo desarrollado ha supuesto una revolución a nivel de salud pública, aunque quede mucho por hacer hasta alcanzar la plena efectividad (Fig. 6). Los profesionales implicados, las asociaciones de padres y las diferentes administraciones públicas debemos actuar conjunta y coordinadamente para conseguir que los programas de asistencia al niño sordo, que incluyen la detección, diagnóstico e intervención precoz, sean un estándar más en los programas de atención integral del niño(19).

Figura 6. El cribado e intervención precoz de la hipoacusia infantil tiene otros retos pendientes de resolver, en función del tipo y características de la hipoacusia, de enfermedades añadidas y de factores socioeconómicos concomitantes.
Funciones del pediatra de Atención Primaria (Algoritmo)
1. Comprobar que al niño se le ha realizado la prueba de cribado de hipoacusia y que el resultado queda reflejado en el Documento de Salud Infantil.
2. Si “NO PASO” la prueba de cribado, explicar a la familia el significado y controlar el inicio de los estudios de diagnóstico e intervención.
3. A los familiares de los niños que “PASAN” la prueba de cribado, sin factores de riesgo de hipoacusia, se les debe interrogar en los controles periódicos del Programa de salud infantil, sobre la audición y la adquisición del lenguaje de sus hijos.
4. Los niños con factores de riesgo de hipoacusia, que PASAN el cribado auditivo, serán remitidos al centro de referencia para estudio audiológico, al menos una vez con 24-30 meses de edad y a los 6-9 meses si el riesgo de hipoacusia adquirida es elevado.
5. La sospecha de hipoacusia por parte de la familia o del pediatra obliga a una evaluación objetiva de la audición del niño o adolescente.
6. Dadas las dificultades exploratorias que presentan los niños con anomalías del desarrollo o problemas del comportamiento, se les remitirá al otorrino de referencia para realizar el seguimiento auditivo.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. Northern JL, Downs MP. La audición en los niños. Versión española. 2ª ed. Barcelona (España): Salvat Editores, S.A.; 1981.
2.* Kral A, O´Donoghue G. Profound deafness in chidhood. N Engl J Med. 2010; 363: 1438-50.
3. Bureau International d´Audiophonologie. Recomendación BIAP 02/1. Lisboa; 1997.
4.** American Academy of Pediatrics. Task Force on Newborn an Infant Hearing. Newborn and infant hearing loss: Detection and intervention. Pediatrics. 1999; 103: 527-30.
5. Fitzpatrick EM, Durieux-Smith A, Whittingham J. Clinical practice for children with mild bilateral and unilateral hearing loss. Ear Hear. 2010; 31: 1-9.
6. Weichbold V, Nekahm-Heis D, Welzl-Mueller K. Universal newborn hearing screening and postnatal hearing loss. Pediatrics. 2006; 117(4): e631-636.
7.* Morton CC, Nance WE. Newborn hearing screening. A silent revolution. N Engl J Med. 2006; 354: 2151-64.
8. Yoshinaga-Itano C, Sedey AL, Coulter DK, Mehl AL. Language of early-and later-identified children with hearing loss. Pediatrics. 1998; 102: 1161-71.
9. Moeller MP. Early intervention and language development in children who are deaf and hard of hearing. Pediatrics. 2000; 106: E43.
10.** CODEPEH (Comisión para la detección precoz de la hipoacusia infantil). Trinidad-Ramos G, Alzina V, Jaudenes-Casaubón C, Núñez Batalla F, Sequí-Canet JM. Recomendaciones de la CODEPEH para 2010. Acta Otorrinolaringol Esp. 2010; 61(1): 69-77.
11. Núñez F. Entrevista de Irene Patiño al Presidente de la CODEPEH. FIAPAS. 2012; 140: 11.
12.*** Joint Committee on Infant Hearing. Year 2007 position statement: principles and guidelines for early hearing detection and intervention programs. American Academy of Pediatrics. Pediatrics. 2007; 120(4): 898-921.
13. Benito-Orejas JI, Ramírez B, Morais D, Almaraz A, Fernández-Calvo JL. Comparison of two-step transient evoked otoacoustic emissions (TEOAE) and automated auditory brainstem response (AABR) for universal newborn hearing screening programs. Int J Pediatr Otorhinolaryngol. 2008; 72: 1193-201.
14. Norton SJ, Gorga MO, Widen JE, Folsom RC, Sininger Y, Cone-Wesson B, et al. Identification of neonatal hearing impairment: evaluation of transient evoked otoacoustic emission, distortion product otoacoustic emission, and auditory brain stem response test performance. Ear Hearing. 2000; 21: 508-28.
15.*** Harlor AD Jr, Bower C. Committee on Practice and Ambulatory Medicine; Section on Otolaryngology Head and Neck Surgery. (American Academy of Pediatrics). Hearing assessment in infants and children: recommendations beyond neonatal screening. Pediatrics. 2009; 124: 1252-63.
16. Núñez-Batalla F, Trinidad-Ramos G, Sequí-Canet JM, Alzina De Aguilar V, Jáudenes-Casaubón C. (CODEPEH). Indicadores de riesgo de hipoacusia neurosensorial infantil. Acta Otorrinolaringol Esp. 2012; 63(5): 382-90.
17. Bachmann KR, Arvedson JC. Early identification and intervention for children who are hearing impaired. Pediatrics in Review. 1998; 19: 155-65.
18.* Munoz K, Shisler L, Moeller MP, White KR. Improving the quality of early hearing detection and intervention services through physician outreach. Semin Hear. 2009; 30(3): 184-92.
19.* Alzina V. El pediatra y la detección precoz de la sordera. FIAPAS/112 (separata); septiembre-octubre 2006. 10 p.
Bibliografía recomendada
– Madell JR, Flexer C, eds. Pediatric Audiology: diagnosis, technology and management. New York: Thieme Medical Publishers, Inc.; 2008.
Es un libro publicado en inglés, que en 325 páginas recoge los aspectos fundamentales de la hipoacusia infantil en relación con sus características generales y en todo lo referente a la detección e intervención precoces, tanto a nivel protésico como educativo. Además de las autoras y editoras de la obra, hay un amplio grupo de colaboradores que proceden de diferentes áreas de EE.UU.
– Trinidad G, Jáudenes C. Confederación Española de Familias de Personas Sordas- FIAPAS y Comisión para la Detección Precoz de la Hipoacusia (CODEPEH): sordera infantil: del diagnóstico precoz a la inclusión educativa. Guía práctica para el abordaje interdisciplinar. Madrid; 2011.
Se trata de un libro recién editado por FIAPAS, coordinado conjuntamente con la CODEPEH y publicado en español que, a través de 250 páginas, refiere todos y cada uno de los aspectos de la hipoacusia infantil. Cada tema es escrito por autores del ámbito nacional.
– Joint Committee on Infant Hearing. Year 2007 position statement: principles and guidelines for early hearing detection and intervention programs. American Academy of Pediatrics. Pediatrics. 2007; 120(4): 898-921.
Se describen cada uno de los aspectos del programa de detección e intervención precoces de la hipoacusia infantil, indicando los procedimientos y el tiempo disponible para su puesta en funcionamiento.
– Harlor AD Jr, Bower C. Committee on Practice and Ambulatory Medicine; Section on Otolaryngology Head and Neck Surgery (American Academy of Pediatrics). Hearing assessment in infants and children: recommendations beyond neonatal screening. Pediatrics. 2009; 124: 1252-63.
Cuenta detalladamente las directrices que deben orientar al pediatra de Atención Primaria en el proceso de detección e intervención precoces de la hipoacusia infantil. Como en el artículo anterior, el análisis es efectuado por un grupo de expertos que repasan los diversos aspectos del programa.
– Patel H, Feldman M. Universal newborn hearing screening. Pediatr Child Health. 2011; 16(5): 301-10.
Es un “documento de principios” definidos por el Comité de Pediatría Comunitaria de la Sociedad Canadiense de Pediatría en el que se realiza una puesta al día del cribado auditivo neonatal, con abundante bibliografía actualizada.
– Finalmente, en las dos direcciones de correo electrónico que se adjuntan, puede obtenerse abundante información sobre este tema:
www.babyhearing.org: es una excelente web con traducción al español, que ofrece documentación de la hipoacusia infantil y de las mejores prácticas en relación con el proceso de detección e intervención. Muy útil para responder a las dudas que las familias puedan plantear.
www.infanthearing.org: el Hospital Boys Town National Research, con el apoyo del National Institute of Deafness and Other Communication Disorders de EE.UU., ha desarrollado esta web dirigida a las familias y a los profesionales, parcialmente traducida al español, donde pueden encontrarse vídeos de apoyo e información específica para Atención Primaria.
| Caso clínico |
|
Un niño de 3 años acude con sus padres a la consulta de Atención Primaria por sospecha de problemas de comportamiento y cierto retraso del lenguaje en relación al desarrollo que tuvo su hermano mayor de 5 años. No hay antecedentes familiares de hipoacusia. El embarazo y parto fueron normales. Catarros frecuentes y varias visitas al servicio de urgencias por otitis media aguda. No se refieren otros antecedentes. Los padres están preocupados por su déficit de atención. Explican que con frecuencia no responde a las preguntas que se le hacen o se queda ensimismado o se equivoca cuando se le pide algo. En relación a los niños de su edad, con los que habitualmente juega, observan que coge muchas rabietas. Comprende las actividades preescolares cuando toda la clase realiza la misma tarea, pero tiene dificultades cuando se le dan instrucciones individuales. Al preguntar a la madre si “PASÓ” el cribado auditivo, nos dice que: “La enfermera comentó algo respecto a tenerle que repetir la prueba en un oído, pero por entonces yo andaba muy atareada y se me pasó. Como después no me lo volvieron a mencionar, pensé que no era importante”. La exploración otoscópica muestra unos tímpanos retraídos, con posible ocupación del oído medio. La timpanometría es plana en un oído y negativa en el otro. Se documenta una respiración oral con moco en ambas fosas nasales y en pared posterior de faringe, lo que indica una posible hipertrofia adenoidea. |
 |
| Temas de FC |
M.C. Torres Hinojal*, J.M. Marugán de Miguelsanz**
*Pediatra de Atención Primaria. Centro de Salud de Laguna de Duero. Valladolid. **Servicio de Pediatría. Hospital Clínico Universitario de Valladolid
| Resumen
La laringitis aguda subglótica o crup es la causa de obstrucción aguda de la vía aérea superior más frecuente en la infancia. Asocia la típica tríada: disfonía, tos perruna y estridor inspiratorio, con o sin disnea, generalmente tras un cuadro prodrómico catarral. Es de causa mayoritariamente viral y, aunque con frecuencia es una urgencia respiratoria, suele ser benigna. Debe diferenciarse, no obstante, de patologías más graves que pueden cursar de forma similar, como la epiglotitis y la traqueítis bacteriana. Los corticoides son el tratamiento más útil en la laringitis aguda, y se aconseja tratar a todos los casos que acuden a urgencias con una dosis única de dexametasona oral, que disminuye las complicaciones y mejora su curso evolutivo. |
| Abstract
Subglottic acute laryngitis or croup is the more common cause of acute obstruction of the upper airway during the childhood. It associates dysphonia, hoarse cough and inspiratory stridor, with or without dyspnea, in most cases during a catarrhal illness. Most of them are of viral cause, and although it is often a respiratory emergency, it is usually benign. However, you must differentiate more serious pathologies that can manifest itself in a similar way, such as epiglottitis and bacterial tracheitis. Corticosteroids are the most useful treatment in acute laryngitis, and it is advised to treat all cases with a single dose of oral dexamethasone, which decreases the complications and improves its clinical evolution. |
Palabras clave: Laringitis aguda; Crup; Laringotraqueobronquitis.
Key words: Acute laryngitis; Croup; Laryngotracheobronchitis.
Pediatr Integral 2013; XVII(5): 343-350
Laringitis aguda
Concepto
El término laringitis aguda describe un síndrome clínico producido por inflamación y obstrucción aguda de la laringe. La etiología es, mayoritariamente, vírica, y en ese caso son términos equivalentes: laringitis subglótica, crup, laringotraqueítis y laringotraqueobronquitis aguda.
El término laringitis aguda describe un síndrome clínico agudo caracterizado por: ronquera, tos disfónica y estridor inspiratorio, con o sin dificultad respiratoria. Es un proceso inflamatorio y obstructivo de las cuerdas vocales y estructuras inferiores, habitualmente como consecuencia de una infección vírica(1,2). Es también denominada “crup” por analogía con el sonido característico que emiten los pacientes.
Existen numerosos términos para referirse al mismo proceso patogénico. La zona más estrecha de la vía respiratoria alta en menores de 10 años está situada justo por debajo de las cuerdas vocales, a nivel del cartílago cricoides(1), lugar de máxima estenosis durante un proceso inflamatorio; de ahí que, a veces se utilicen también los términos sinónimos de laringitis subglótica o laringitis subglótica estenosante aguda. Además, en la mayoría de laringitis infecciosas, el proceso inflamatorio se extiende a estructuras inferiores; por lo que, se utiliza también indistintamente el término laringotraqueítis aguda o incluso laringotraqueobronquitis.
Una forma particular de laringitis aguda, es la laringitis espasmódica o estridulosa, muy similar a la forma descrita y con el mismo tratamiento, pero con alguna peculiaridad clínica, y se tratará aparte dentro de este capítulo.
Todos estos cuadros deben diferenciarse de otros procesos infecciosos, como la laringitis supraglótica o epiglotitis y la traqueítis bacteriana aguda, con una etiopatogenia, clínica, pronóstico y tratamiento diferentes.
El crup incide, sobre todo, en otoño-invierno, en niños entre 6 meses y 3 años.
Epidemiología
La laringitis aguda subglótica es la causa de obstrucción de la vía aérea superior más frecuente en la infancia, y puede llegar a afectar al 3-5% de los niños(2-5). Incide, sobre todo, entre los 6 meses y 3 años de edad, con un pico en el segundo año de vida, donde puede alcanzar una incidencia máxima de 60 casos por cada 1.000 niños y año(2), e importante reducción a partir de los 6 años(1,5-7). Esto se debe a motivos anatómicos en los primeros años de vida, con una glotis más alta, con un espacio subglótico de menor tamaño por la influencia del cartílago cricoides, y tejidos submucosos laxos menos fibrosos(1,2,5).
Existe un predominio masculino (1,5-2/1)(5,7) y una clara predisposición familiar. Hasta un 15% refieren antecedentes familiares importantes de crup(1).
Puede aparecer en cualquier época, aunque es más frecuente en otoño e invierno, por los cambios climáticos bruscos y las epidemias de virus respiratorios(5).
Etiopatogenia y fisiopatología
La etiología suele ser vírica, y los virus parainfluenza, sobre todo el tipo 1, son los agentes predominantes, suponiendo un 75% del total de casos.
La etiología de la laringitis aguda subglótica es, mayoritariamente, vírica. Los virus parainfluenza (por orden de frecuencia, los tipos 1, 3 y 2) son los agentes predominantes y suponen un 75% del total, siendo el virus parainfluenza 1 el más frecuente, incidiendo, sobre todo, a finales del otoño e invierno y es el causante de aproximadamente la mitad de los casos(1,2,4,7). Otros agentes frecuentemente aislados son: virus influenza (tipo A y B), adenovirus y virus respiratorio sincitial, y, en menor medida: enterovirus, rinovirus y metapneumovirus humano(2,6,7). Puede aparecer este síndrome también en el curso de enfermedades virales exantemáticas, como la varicela o el sarampión(6,8).
Excepcionalmente, se atribuye a una causa bacteriana. Se ha aislado: Haemophilus influenzae tipo b (responsable en cambio de la mayoría de casos de epiglotitis), Mycoplasma pneumoniae (en formas de crup generalmente leve), Streptococus, Neiseria, bacilos gram-, Clamydia y sobreinfecciones por Staphilococcus aureus, entre otros(1).
En inmunodeprimidos, debe considerarse la Candida albicans, y todavía no debe olvidarse el Corynebacterium difteriae en niños no vacunados. La difteria fue la forma más frecuente y a menudo mortal de laringitis estenosante en otra época pero, actualmente, es casi inexistente en población vacunada.
En general, existe el antecedente de rinitis o catarro de vías altas y, en unos días, la infección progresa de forma insidiosa, con edema e inflamación de mucosa y submucosa, aumento de secreciones y espasmo. La clínica se produce, sobre todo, por el estrechamiento que la inflamación ocasiona y que provoca un aumento exponencial de la resistencia al flujo del aire, con disminución del mismo y turbulencias a su paso. En formas graves, puede llegar a producir hipoxemia e hipercapnia(7,9).
Clínica
La tríada característica del crup se compone de: disfonía, tos perruna y estridor inspiratorio, con o sin disnea, en el contexto de un cuadro catarral.
En la laringitis aguda vírica, suelen existir pródromos catarrales 1-3 días antes, con una combinación de rinorrea, tos leve y febrícula, y, progresivamente, se instauran los síntomas típicos: disfonía, tos perruna y, si la obstrucción es suficiente, estridor inspiratorio. La tos es disfónica, seca, metálica, a modo de ladrido. El estridor, sonido respiratorio rudo, suele ser inspiratorio, aunque a veces es bifásico. Al inicio, sólo aparece con la agitación o el llanto pero, al aumentar la gravedad, es patente también en reposo(1,9); sin embargo, su intensidad no es un buen indicador de la severidad del crup(9). Puede o no haber fiebre. Los síntomas suelen empeorar por la noche y en decúbito y desaparecen, generalmente, en menos de una semana(1,6,7).
Puede observarse según la intensidad, una dificultad respiratoria progresiva muy variable, con tiraje de predominio supraesternal pero, incluso, a los tres niveles. Predomina una respiración bradipneica; mientras que, suele haber polipnea cuando hay afectación del tracto respiratorio inferior (laringotraqueobronquitis).
El intercambio gaseoso alveolar es normal, y sólo habrá hipoxia cuando se va a producir la obstrucción casi completa(1). Signos sutiles de hipoxia pueden ser la ansiedad o inquietud en el niño. La hipoventilación marcada, palidez excesiva, cianosis y la alteración de la conciencia, precisan una intervención inmediata.
La exploración física debe hacerse en un ambiente tranquilo, en la postura que elija el paciente y en presencia de sus padres. Se puede explorar la faringe en casos leves, pero debe retrasarse en los más graves(10). Se observará una faringe congestiva de apariencia vírica. Finalmente, algunos pueden tener sibilancias, además del estridor inspiratorio, cuando existe una laringotraqueobronquitis(1). Además, niños que padecen asma pueden mostrar signos de broncoespasmo en el contexto de una laringotraqueítis aguda(6).
Diagnóstico
El diagnóstico es clínico y no suelen precisarse exámenes complementarios.
Habitualmente, el diagnóstico del crup es clínico y no se precisan exámenes complementarios. El uso de una escala de puntuación para valorar su gravedad y evolución tienen en general escasa utilidad por la variabilidad interobservador en su interpretación, especialmente en formas leves-moderadas, pero puede ser útil en personal con menos experiencia(3,11). Se han utilizado distintas escalas de evaluación, siendo las más conocidas la de Taussig (Tabla I) y, especialmente, la de Westley(12) (Tabla II), que establece una puntuación entre 0 y 17. Valores iguales o superiores a 7 indican gravedad, ante la presencia de estridor audible en reposo, tiraje intenso e hipoventilación grave, con o sin cianosis y alteración del nivel de conciencia.
La pulsioximetría tiene una utilidad escasa, ya que puede ser normal incluso con grados importantes de obstrucción de la vía aérea(13). Debe monitorizarse en la forma grave, aunque en otros casos la molestia que ocasiona al niño puede ser perjudicial(2).
No suele ser necesaria la realización de una radiografía anteroposterior del cuello. Ésta puede mostrar el típico estrechamiento progresivo y simétrico de la tráquea con el vértice en la glotis, en la estenosis subglótica, denominado signo en punta de lápiz, de la aguja o del campanario(4,9,10) (Fig. 1), aunque no existe una buena correlación entre este hallazgo y la gravedad de la laringitis.
Una radiografía lateral del cuello puede ser útil para diferenciar la laringitis de la epiglotitis y del absceso retrofaríngeo, pero sólo se plantea en casos dudosos o evolución atípica, aunque la prioridad es la permeabilidad de la vía aérea y debe realizarse con el paciente estable desde el punto de vista respiratorio(6,7).
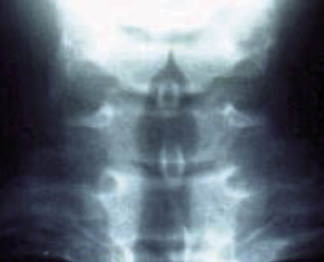
Figura 1. Signo del campanario o en punta de lápiz en la estenosis subglótica.
La realización de un aspirado nasofaríngeo a la búsqueda de la posible etiología infecciosa puede ser útil en pacientes ingresados y para control de la infección.
Diagnóstico diferencial
Debe establecerse diagnóstico diferencial, sobre todo, con la laringitis espasmódica, la epiglotitis y la traqueítis bacteriana y, en general, con todas las causas de obstrucción aguda de la vía aérea superior.
El diagnóstico diferencial de la laringitis aguda vírica debe establecerse con la laringitis espasmódica, aunque la actitud terapéutica será similar en ambos casos, y con dos procesos diferentes y de mayor gravedad, como la epiglotitis y la traqueítis bacteriana. Por su mayor importancia, todos ellos serán analizados más adelante.
Debemos pensar en todas las causas de obstrucción de la vía aérea superior, que pueden manifestarse de manera similar a la laringitis subglótica(2,6,7,10) (Tabla III).
La aspiración de cuerpo extraño puede debutar bruscamente, pero también debe descartarse en niños que no responden al tratamiento o con una evolución prolongada. Igual ocurre con la ingestión de cáusticos e inhalación de tóxicos. No siempre se reconoce el antecedente de inhalación accidental o atragantamiento.
Un estrechamiento preexistente de la vía aérea superior, por una masa intraluminal, una malformación laríngea o vascular congénita subyacente o una parálisis bilateral de cuerdas vocales, suelen producir síntomas crónicos, persistentes o recurrentes. La laringomalacia es la malformación congénita laríngea más habitual y primera causa de estridor en lactantes, con síntomas ya desde las primeras semanas de vida, seguida en frecuencia por la estenosis subglótica congénita(1). Debemos determinar si el paciente ha tenido episodios de crup previos o estridor entre crisis, que puedan orientar a estos diagnósticos. Una laringitis añadida a una lesión preexistente entraña un mayor riesgo de obstrucción grave.
En niños pequeños, especialmente en lactantes, debemos determinar si ha habido problemas en la deglución, episodios de cianosis, o bien síntomas sugerentes de reflujo gastroesofágico.
Un absceso retrofaríngeo o periamigdalino puede confundirse con el crup. La TAC de vía aérea superior puede ser útil en la sospecha de absceso retrofaringeo, y la inspección directa en el periamigdalino. La disfagia y el babeo continuo pueden indicar epiglotitis, absceso periamigdalino o retrofaríngeo o cuerpo extraño en la vía aérea o en el esófago. El angioedema alérgico también puede simularla, aunque suele aparecer en el contexto de otras manifestaciones anafilácticas.
Tratamiento
Los corticoides son los fármacos más útiles en el tratamiento del crup, siendo eficaz una dosis única de dexametasona oral en todos los casos, independientemente de su gravedad.
Medidas generales
Debemos explicar el proceso a los padres, y tranquilizar y molestar lo menos posible al niño. No explorar la faringe de entrada, si no colabora. Podemos aconsejar analgésicos y antitérmicos que mejoren el bienestar del niño, y líquidos abundantes.
Humidificación y oxigenoterapia
Aunque existe la experiencia general de que, al salir a la calle, el vapor frío de la noche parece beneficioso, no existen pruebas de su eficacia(1). La humidificación no ha demostrado una acción específica, pero puede producir mejoría subjetiva, reducir la sequedad de las mucosas y puede aportar tranquilidad a los padres, pudiendo utilizarse siempre que no genere ansiedad en el niño(3,6,7,9). Si existe dificultad respiratoria, y la saturación de O2 es inferior al 94%, puede ser útil el uso de oxígeno humidificado.
Corticoides
Los corticoides son los fármacos más útiles en el tratamiento del crup, reducen el edema por acción antiinflamatoria, y la intensidad y duración de los síntomas(1).
La dexametasona ha demostrado su eficacia y es el corticoide de elección; en dosis única si es posible por vía oral(14). Su efecto se inicia tras 1-2 horas, y dura más de 12. La dosis de 0,15 mg/kg es igual de eficaz que dosis superiores de 0,30 y 0,60 mg/kg (en este caso, con un máximo de 10 mg). No existe una solución oral comercializada, disponiendo sólo de comprimidos y ampollas inyectables (que, incluso, pueden ser utilizadas por boca, o para preparar una solución oral mediante fórmula magistral)(3,4,7,9,15,16).
Los beneficios de la dexametasona están demostrados a las 6 y 12 horas, pero no a las 24 horas(7). Se desconoce si las dosis repetidas mejorarían el cuadro, dado su carácter autolimitado, pero puede ser utilizada otra vez en caso necesario a las 24 horas. Dada su eficacia, debería aconsejarse en todos los casos de crup, independientemente de su gravedad, aunque queda a juicio del pediatra en función de los antecedentes del niño, del posible control sobre el seguimiento clínico o distancia al domicilio del enfermo. Su administración universal en los servicios de urgencia ha reducido el número de nuevas consultas, de tratamientos con adrenalina, de ingresos y la necesidad de intubación endotraqueal(1,7). La dexametasona intramuscular no es más eficaz y sí más traumática, y queda reservada para los niños que vomitan o no ingieren los preparados orales(7).
Podría utilizarse la dosis equivalente de prednisolona o prednisona (1-2 mg/kg), si no hay disponible dexametasona oral. Sin embargo, una dosis única de prednisolona oral es menos eficaz que la dosis única de dexametasona oral en disminuir la necesidad de nuevas consultas por el mismo proceso(15). No hay estudios controlados suficientes para dosis múltiples de corticoides, aunque, cuando se utiliza prednisolona, suele recomendarse durante 3 días(17). No deben darse corticoides en niños con varicela o tuberculosis no tratada(1). En formas graves, se puede administrar el corticoide por vía oral, intramuscular o intravenosa.
La budesonida inhalada tiene una eficacia similar a la dexametasona oral, y es una alternativa a la misma, a dosis de 2 mg sin diluir, aunque su efecto no es más rápido, es más cara y su administración puede aumentar la agitación del niño(6,10,18). Su acción se inicia a los 30 minutos, y se puede repetir cada 6-8 horas, pudiendo intercalarse en formas graves con la adrenalina. No existe mejor resultado terapéutico, combinando dexametasona y budesonida, que con cada una de ellas por separado(18).
Adrenalina
La adrenalina nebulizada también ha demostrado su eficacia y suele indicarse en crups moderados y graves(1,6,7), con un efecto similar para la adrenalina racémica y la L-adrenalina. Disminuye el edema de la mucosa laríngea por la vasoconstricción que produce. Su acción es evidente ya antes de los 30 minutos de su administración, aunque su efecto es breve y no va más allá de las 2 horas, con recidiva clínica precoz, mal interpretada como efecto rebote.
Se utiliza L-adrenalina 1:1.000 a dosis de 0,5 ml/kg, hasta un máximo de 5 ml, completando hasta 10 ml con suero salino, nebulizado con un flujo de 5-10 L/min con O2 al 100%(17,18). Puede repetirse en intervalos de 20-30 minutos, hasta un total de 3 ocasiones, aunque en dosis repetidas conviene vigilar la aparición de taquicardia(6). Cuando se utiliza, deben asociarse corticoides y, en formas graves, reduce el número de niños que precisan intubación(3,4). Está contraindicada en ciertas cardiopatías, como: tetralogía de Fallot, estenosis pulmonar y estenosis aórtica subvalvular(5).
Heliox
El heliox es una mezcla gaseosa de helio y oxígeno (70/30), de densidad menor que el aire, lo que facilita el paso del gas a través de las vías aéreas. Se administra con mascarilla con reservorio a un flujo de 9-12 L/min en formas graves, previamente a plantear la intubación(1,6,7). No hay aún suficiente evidencia sobre su eficacia, aunque se ha publicado buena respuesta en casos de crup grave en pacientes ingresados, pero no superior a adrenalina(19).
Otros fármacos
En la laringitis vírica no debe recomendarse el uso de antibióticos. Además, la sobreinfección bacteriana es muy rara. En otro tiempo se han utilizado fármacos con acción antiespasmódica, sedante y antitusígena, como: sulfato de magnesio, papaverina y atropina, sobre todo en la laringitis espasmódica, aunque no hay estudios que demuestren su eficacia(7). En general, los fármacos descongestivos y antitusígenos no han demostrado utilidad y no deben recomendarse(4). Se utilizarán broncodilatadores sólo en las laringotraqueobronquitis, cuando exista broncoespasmo asociado.
Algoritmo terapéutico de la laringitis aguda
1. Formas leves. Se aplicarán medidas generales. Todos los que acuden a urgencias deberían recibir una dosis de dexametasona oral, pudiendo dar el alta tras un breve periodo de observación en urgencias.
2. Formas moderadas. Además de lo anterior, deben recibir adrenalina nebulizada, una o varias dosis, junto a los corticoides. Hoy se puede dar el alta al domicilio sin riesgo, después de 3-4 h de administración del tratamiento, y en ausencia de estridor en reposo. En caso contrario, o por alguno de los motivos recogidos en la tabla IV, estará indicado el ingreso hospitalario(1,6,9,18).
3. Formas graves. Precisarán ingreso para observación y tratamiento. Junto a la administración de corticosteroides, precisarán dosis repetidas de adrenalina y/o tratamiento con heliox. Considerar el ingreso en UCIP para observación o, incluso, la intubación cuando aparezcan signos de hipoxia, disminución del nivel de conciencia o gran disnea progresiva. Es mejor intubar en un quirófano o una UCIP, bajo anestesia inhalatoria sin relajantes musculares, con personal entrenado y material disponible para endoscopia, traqueostomía y cricotirotomía de urgencia si fuera necesario, con O2 al 100%, y utilizando un tubo endotraqueal al menos un número inferior al recomendado para la edad del niño.
Pronóstico
A pesar de suponer muchas veces una urgencia respiratoria, en la mayoría de las ocasiones presenta un curso benigno.
En muchas ocasiones, por lo llamativo de su sintomatología, la laringitis aguda se convierte en una urgencia respiratoria. Sin embargo, la mayoría de casos de crup son formas leves, no suelen precisar hospitalización, y se recuperan en unos días. El tratamiento con dexametasona oral parece acortar la duración del proceso y reducir la sintomatología(2,4).
De los casos atendidos en urgencias, sólo requieren hospitalización entre un 1-5%, la mitad de ellos en la unidad de cuidados intensivos(3,5). De los pacientes que ingresan, menos del 5% van a requerir intubación endotraqueal. La mortalidad del proceso es baja, incluso en formas graves que requieren intubación(4). Finalmente, en alrededor del 15% de los casos tiene un carácter descendente, con afectación bronquial añadida.
Crup espasmódico o laringitis estridulosa
El crup espasmódico o falso crup no suele asociar cuadro vírico, es autolimitado y su tratamiento es similar a la laringitis aguda subglótica.
Antes llamado falso crup, aparece en la misma franja de edad o incluso en niños algo más mayores (hasta los 6 años) y, clínicamente, recuerda a la laringitis subglótica, aunque no suelen referir un cuadro prodrómico vírico ni fiebre. Se presenta bruscamente de noche en un niño previamente sano, comenzando súbitamente con tos perruna, disfonía y estridor inspiratorio intenso. Dura una o varias horas y, al día siguiente, parece estar bien o con leve disfonía y tos. Puede haber nuevos episodios una o dos noches más, menos intensos(1,6,7). Suele existir también un predominio invernal.
Afecta más a varones, suele ser recurrente y es evidente la presencia de casos familiares(5). Se ignora su etiopatogenia exacta aunque, para muchos autores, tiene un componente alérgico(1,4), con antecedente frecuente de atopia, hiperreactividad de la vía aérea y posible influencia de factores psicológicos(1,5). Sólo en algunas ocasiones se observa una infección vírica asociada. Aquí se asocian el espasmo glótico y una contracción brusca del vestíbulo laríngeo(5,6).
Diferenciarla de la laringitis subglótica no es importante, ya que el tratamiento es similar en ambos cuadros. El vapor de agua cálido parece aliviar los síntomas, dudándose de la eficacia de los antiespasmódicos, muy utilizados en otra época(5).
Traqueítis bacteriana
Sospecharla ante una laringotraqueítis grave, que no responde al tratamiento.
Es uno de los principales diagnósticos diferenciales del crup, y presenta un alto riesgo de obstrucción de la vía respiratoria. Hay que pensar en ella ante un niño con aparente laringotraqueítis “grave”, con fiebre alta, afectación general y mayor dificultad respiratoria, y que no responde al tratamiento(1).
Los agentes productores son diversos, predominando: Haemophilus influenzae, Staphilococcus aureus, Streptococcus, Branhamella catharralis, Clamidias y bacterias entéricas gram negativas. Se debe considerar una laringoscopia para un diagnóstico de seguridad(6).
El tratamiento es antibiótico, según antibiograma, o empírico con cefalosporinas parenterales o vancomicina más un beta lactámico resistente a betalactamasas, como la oxacilina. Puede precisar intubación y ventilación mecánica, necesitando aspiración traqueal frecuente. No están indicados los corticoides ni la adrenalina(6).
Epiglotitis
La epiglotitis ha disminuido drásticamente desde la vacunación universal frente a Haemophilus influenzae tipo b, y requiere intubación traqueal precoz.
Es la laringitis supraglótica aguda. El agente productor principal es Haemophilus influenzae tipo b, y su incidencia ha disminuido drásticamente, hasta en un 80-90%, desde la vacunación universal del mismo(1). Otros gérmenes mucho menos frecuentes son: Streptococcus pyogenes, Streptococcus pneumoniae y Staphylococus aureus(6).
Puede existir un proceso catarral previo que, bruscamente, se agrava, con clínica que al principio puede recordar a la laringitis, pero con fiebre alta. Suelen faltar la afonía, el estridor y la tos perruna, presentan voz apagada y la tos es escasa. Hay un intenso dolor de garganta y dificultad para tragar, produciéndose salivación y babeo constantes (como en el absceso retrofaríngeo), permaneciendo sentados hacia adelante apoyados en los brazos, con la cabeza en hiperextensión y la boca abierta. Suele producir un estado tóxico, con palidez y dificultad respiratoria rápidamente progresiva, incluso con cianosis y coma(1,3,6).
Ante la mínima sospecha, hay que evitar maniobras que produzcan ansiedad en el niño, hasta no tener asegurada la vía aérea(1).
La radiografía lateral del cuello la confirma, con la típica imagen en porra o signo del pulgar, si el paciente no tiene compromiso respiratorio, y en el hemograma se suele observar leucocitosis intensa y neutrofilia. La epiglotis tumefacta de color rojo cereza a veces es visible en la simple inspección directa, pero puede llevarse a cabo una laringoscopia confirmatoria, siempre realizada en quirófano o UCIP(1).
La evolución espontánea es mala, incluso mortal, requiriendo establecer lo antes posible una vía aérea permeable, con intubación nasotraqueal precoz, incluso traqueotomía si aquella no fuera posible. Asimismo, debe ser tratada con antibióticos intravenosos, como cefotaxima, ceftriaxona o meropenem, hasta recibir el resultado del hemocultivo y cultivo local(1). La adrenalina no es eficaz y los corticoides pueden necesitarse, en ocasiones, para evitar complicaciones. Puede extubarse en general a los 3-4 días de evolución, por la buena respuesta a antibióticos(1).
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Roosevelt GE. Obstrucción inflamatoria aguda de las vías superiores. En: Kliegman RM et al., eds. Nelson. Tratado de Pediatría, vol. 2, 19ª ed. Barcelona: Elsevier; 2012. p. 1503-7.
2.*** Geelhoed G. Laringotraqueítis aguda. En: Cameron P, et al. eds. Tratado de Medicina de Urgencias Pediátricas. Madrid: Elsevier España; 2007. p. 158-61.
3.*** Callén Blecua M, Cortés Rico O. El pediatra de Atención Primaria y la laringitis aguda-crup. Documentos técnicos del Grupo de Vías Respiratorias de la AEPap. 2010. Disponible en: www.aepap.org/gvr/protocolos.htm
4.* Merino Alonso de Ozalla R, Ortega del Álamo P. Laringitis y otras causas de estridor. Disfonías. En: Muñoz Calvo MT, et al., eds. Pediatría Extrahospitalaria, 4ª ed. Majadahonda (Madrid): Ergon; 2008. p. 247-50.
5.** Malmierca Sánchez F, Pellegrini Belinchón J. Patología infecciosa laringotraqueal. En: del Pozo J, et al., eds. Tratado de Pediatría Extrahospitalaria, 2ª ed. Tomo I. Majadahonda (Madrid): Ergon; 2011. p. 377-84.
6.* Pastor-Durán X, Hernández-Martínez M. Procesos inflamatorios laringotraqueales. Laringitis. En: Cruz-Hernández M, et al., ed. Tratado de Pediatría. 9ª ed. Vol. II. Majadahonda (Madrid): Ergon; 2006. p. 1289-94.
7.* García Puig R, Krauel Jiménez-Salinas L, Sarquella Brugada G. Laringitis aguda. En: Benito J, et al., eds. Tratado de Urgencias en Pediatría. Majadahonda (Madrid): Ergon; 2005. p. 295-300.
8.* Geelhoed GC. Croup. Pediatr Pulmonol. 1997; 23: 370-4.
9.* Fernández Rodríguez B, Ordóñez Saez O. Laringitis. En: Martín Ferrer M. y cols. (eds), Manual de Urgencias en Pediatría. Hospital 12 de Octubre. Majadahonda (Madrid): Ergon; 2011. p. 527-33.
10.** Grau Olive JL, Torres Cañadillas C, Garrido Palomo R. Obstrucción de la vía aérea superior. En: del Pozo J, et al., eds. Tratado de Pediatría Extrahospitalaria, 2ª ed. Tomo II. Majadahonda (Madrid): Ergon; 2011. p. 1549-54.
11.* Díaz Carrión E. Laryngitis crup y estridor. Pediatr Integral. 2009; 13: 468-76.
12.* Westley CR, Cotton EK, Brooks JG. Nebulized racemic epinephrine by IPPB for the treatment of croup. Am J Dis Child. 1978; 132: 484-7.
13.* Stoney PJ, Chakrabarti MK. Experience of pulse oximetry in children presenting with croup. J Laryngol Otol. 1991; 105: 295-8.
14.*** Geelhoed GC, Turner J, Macdonald WB. Efficacy of a small single dose of oral dexamethasone for outpatient croup: A double blind placebo controlled clinical trial. BMJ. 1996; 313(7050): 140-2.
15.** Sparrow A, Geelhoed G. Prednisolone versus dexamethasone in croup: a randomised equivalence trial. Arch Dis Child. 2006; 91: 580-3.
16.* Mazza D, Wilkinson F, Turner T, Harris C. Evidence based guideline for the management of croup. Aust Fam Physician. 2008; 37(6 Spec No): 14-20.
17.** Calvo Rey C, García García ML, Casas Flecha I, Pérez Breña P. Infecciones respiratorias virales. Protocolos diagnóstico-terapéuticos de la AEP. Infectología Pediátrica, 3ª ed. Sociedad Española de Infectología Pediátrica, 2011. Disponible en: www.aeped.es/documentos/protocolos-infectologia
18.* Jabón Serradilla A, García Herrero MA. Laringitis. En: García Herrero MA, et al. eds. Algoritmos diagnóstico-terapéuticos en urgencias pediátricas en Atención Primaria. Madrid: Grupo 2 comunicación médica; 2012. p. 79-82.
19.* Arroba Basanta ML. Laringitis aguda (crup). An Pediatr. Monogr. 2003; 1: 55-61.
Bibliografía recomendada
– Roosevelt GE. Obstrucción inflamatoria aguda de las vías superiores. En: Kliegman RM, et al., eds. Nelson. Tratado de Pediatría, vol. 2, 19ª ed. Barcelona: Elsevier; 2012. p. 1503-7.
Amplia y muy reciente revisión y actualización de los procesos inflamatorios e infecciosos agudos que cursan con obstrucción de la vía respiratoria alta.
– Geelhoed G. Laringotraqueítis aguda. En: Cameron P, et al. eds. Tratado de Medicina de Urgencias Pediátricas. Madrid: Elsevier España; 2007. p. 158-61.
Revisión exhaustiva de la laringotraqueítis aguda desde el punto de vista de la medicina pediátrica de urgencia, por uno de los autores que más ha aportado al conocimiento de esta patología.
– Callén Blecua M, Cortés Rico O. El pediatra de Atención Primaria y la laringitis aguda-crup. Documentos técnicos del Grupo de Vías Respiratorias de la AEPap. 2010. Disponible en: www.aepap.org/gvr/protocolos.htm
Documento técnico del Grupo de Vías Respiratorias de la Asociación Española de Pediatría de Atención Primaria sobre laringitis, que revisa ampliamente todos los aspectos de esta patología, especialmente los relativos al tratamiento de la misma. Hace especial hincapié en el manejo del niño con laringitis en el Centro de Salud, presentando un algoritmo del mismo, y en la información para padres y cuidadores.
– Malmierca Sánchez F, Pellegrini Belinchón J. Patología infecciosa laringotraqueal. En: del Pozo J, et al., eds. Tratado de Pediatría Extrahospitalaria, 2ª ed. Tomo I. Majadahonda (Madrid): Ergon; 2011. p. 377-84.
Excelente y reciente revisión sobre las laringotraqueítis agudas infecciosas en Pediatría, y las principales entidades para el diagnóstico diferencial de las mismas.
– Westley CR, Cotton EK, Brooks JG. Nebulized racemic epinephrine by IPPB for the treatment of croup. Am J Dis Child. 1978; 132: 484-7.
Publicación que sirvió como base al score de Westley, probablemente el más utilizado en la evaluación de la gravedad en los cuadros de obstrucción de la vía respiratoria superior.
– Sparrow A, Geelhoed G. Prednisolone versus dexamethasone in croup: a randomised equivalence trial. Arch Dis Child. 2006; 91: 580-3.
Estudio comparativo sobre la eficacia de distintas pautas terapéuticas en el tratamiento del crup, especialmente del uso de una dosis única de distintos esteroides, sobre el porcentaje de pacientes que vuelven a consultar por el mismo proceso.
| Caso clínico |
|
Paciente varón, previamente sano, de 18 meses de edad, que consulta por tos seca y dificultad respiratoria. Antecedentes familiares, sin interés. Antecedentes personales, 2º/2 hermanos, embarazo, parto y periodo neonatal normales. Lactancia materna 6 meses, mixta desde los 4 meses, con introducción correcta de la alimentación complementaria. Ha cumplido con el calendario vacunal oficial y además ha recibido la vacuna de rotavirus y neumococo. Desarrollo psicomotor y crecimiento corporal normales. Desde el inicio de la guardería, a los 4 meses, ha padecido múltiples infecciones respiratorias de vías altas y un episodio de bronquiolitis, que fueron todos tratados ambulatoriamente. Proceso actual Estando previamente bien, el niño comienza hace 2 días con rinorrea seromucosa, tos escasa y fiebre de 38°C. Hace unas horas la tos es más persistente, en accesos, perruna, con disfonía y, en ocasiones, sobre todo con el llanto, emite un ruido rudo al coger el aire. Acude a la consulta de su pediatra por este motivo. A la exploración, mantiene buen estado general, aunque presenta estridor inspiratorio, con ventilación normal y leve tiraje supraesternal. Frecuencia respiratoria 30/min, FC: 130 lpm, TºC: 38,1º, saturación de O2: 97%. Su pediatra le administra una dosis de prednisolona oral, se le dan normas generales y se le envía a su domicilio sin otro tratamiento. Seis horas después, el paciente es llevado a urgencias por empeoramiento clínico. El niño presenta afectación media del estado general, llanto ronco y débil, está algo obnubilado, con discreta palidez cutánea, estridor inconstante y tiraje a los 3 niveles, con hipoventilación media y sin estertores añadidos a la auscultación. La saturación de O2 es del 90%. Se administra una dosis nebulizada de 500 mcgr de budesonida diluída en 5 ml de suero salino y se decide el ingreso hospitalario. Durante el ingreso, recibe 3 dosis de adrenalina 1:1.000 nebulizada, a dosis de 0,5 ml/kg separadas media hora, con escasa respuesta inmediata, y 6 horas después otra dosis posterior de budesonida nebulizada, sin cambios. A las 10 horas presenta fiebre de 39,5°C, y tos intensa ronca y dificultad respiratoria progresiva, por lo que se decide su ingreso en UCI. Ante la mala evolución el paciente es intubado, y durante el procedimiento se realiza el diagnóstico y se obtiene un cultivo de secreciones respiratorias. |
 |
| Temas de FC |
J. Peñarrocha Terés*, C. Hernández-Gancedo**
*Servicio de Otorrinolaringología, **Servicio de Anestesiología. Hospital Universitario La Paz. Madrid
| Resumen
Las malformaciones de la vía aérea superior son entidades poco frecuentes, pero siempre pensar en ellas ante la dificultad respiratoria en el recién nacido. Aquellas que sean leves, darán clínica crónica respiratoria durante el desarrollo del niño. Las más frecuentes son: laringomalacia, estenosis subglóticas congénitas, parálisis de cuerdas vocales, atresia de coanas y fisuras laríngeas. El diagnóstico principal se basa en la rinofibrolaringoscopia. |
| Abstract
Congenital malformations of the upper airway are rare entibies, but you have thinh about them before respiratory distress in the newborn. Those minor malformations will give mild chronic respiratory symptoms during the child ́s development . the most common are: laringomalacia, congenital subglottic stenosis, vocal cord palsy, choanal atresia and laryngeal clefts. Principal diagnosis is based on rhinofiberlaryngoscope. |
Palabras clave: Estridor neonatal; Laringomalacia; Estenosis subglótica congénita; Fisuras laríngeas; Atresia de coanas.
Key words: Neonatal stridor; Laryngomalacia; Congenital subglottic stenosis; Laryngeal cleft; Choanal atresia.
Pediatr Integral 2013; XVII(5): 351-359
Introducción
Las malformaciones congénitas de la vía aérea superior abarcan un amplio espectro de patologías, habitualmente poco frecuentes en la práctica clínica. Tienen dos formas típicas de presentación: malformaciones graves, producirán clínica severa y que puede poner en peligro la vida del neonato desde las primeras horas de vida, o malformaciones leves, que pueden pasar desapercibidas en la exploración inicial y dar una clínica muy larvada o crónica durante los primeros años de vida.
Laringomalacia
La laringomalacia es la causa más frecuente de estridor laríngeo. Habitualmente, es un estridor inspiratorio de aparición en la primera semana de vida, no cianosante. En el 95% de los casos, hay que realizar actitud expectante, aunque puede tener una duración de hasta 24 meses.
La laringomalacia es la anomalía laríngea congénita más frecuente siendo el 60-75%. Es la causa más habitual de estridor en la infancia, oscilando entre el 45-75% de los casos de estridor. Se define por el colapso intraluminal de los tejidos supraglóticos durante la inspiración.
Etiología y etiopatogenia
Causa desconocida. Se postulan tres factores que pueden influir en su génesis(1):
• Anatómicos: se han descrito principalmente tres tipos de anomalías anatómicas en la supraglotis: epiglotis enrollada en omega, ligamentos aritenoepiglóticos cortos y aritenoides abultados redundantes. Estos tipos de lesiones se pueden encontrar en forma combinada o aislada, provocando el colapso supraglótico, aunque también pueden estar presentes en recién nacidos sin provocar patología alguna.
• Histológicos: se ha sugerido que la inmadurez de los cartílagos laríngeos darían lugar a una debilidad intrínseca y tendencia al colapso durante la inspiración. Existen estudios que no encuentran diferencias histológicas entre los cartílagos de niños con laringomalacia y niños normales. Además, se debe tener en cuenta que en neonatos prematuros no existe mayor frecuencia de esta patología.
• Neuromusculares: la inmadurez en el control neuromuscular se ha descrito como otra posible causa. Algunos estudios han mostrado una relación entre la laringomalacia y enfermedades neurológicas, sugiriendo que ésta podría ser una manifestación de una hipotonía generalizada del soporte muscular de los cartílagos laríngeos. Dentro de este grupo etiológico, se ha implicado el reflujo gastroesofágico, que se presenta entre un 30 a 80% de los casos de laringomalacia. Se cree debido a la inmadurez neuromuscular, que determina una relajación del esfínter esofágico inferior. Al parecer, simplemente empeora la obstrucción que se observa en la laringomalacia, pero no la provoca.
Clasificación(1)
Las alteraciones anatómicas y mecánicas en la laringomalacia son evidentes y con arreglo a ellas se establecen los siguientes tipos, que pueden verse aislados o de forma combinada:
• Tipo 1: aspiración de la mucosa aritenoidea edematosa, que recubre los cartílagos cuneiformes introduciéndose hacia el interior de la laringe.
• Tipo 2: epiglotis enrollada y alargada que se curva y dobla en la inspiración. Se asocia al tipo 1. La epiglotis en omega per se no es causa de estridor.
• Tipo 3: colapso en báscula de los aritenoides (anterior y medial) durante la inspiración.
• Tipo 4: aspiración y desplazamiento posterior de la epiglotis contra la región aritenoidea.
• Tipo 5: repliegues ariepiglóticos cortos, creando un vestíbulo laríngeo pequeño y colapsable en inspiración.
• Tipo 6: colapso de la pared posterior de la subglotis durante la inspiración.
Clínica(1-3)
Estridor inspiratorio progresivo, generalmente intermitente, aunque también puede ser constante. Su intensidad aumenta con el decúbito supino, mejorando al decúbito prono, y empeora con los esfuerzos del niño, ya sea con el llanto, al agitarse o al mamar. En casos graves, pueden presentar: aspiración por falsas vías, cianosis, apneas obstructivas, accesos de tos, bronquitis de repetición y pectus excavatum. Durante el sueño puede desencadenar crisis de apnea que, incluso, algunos autores han relacionado con la muerte súbita del lactante. Los casos más graves no son los que más ruido inspiratorio hacen, sino los que producen mayor obstrucción laríngea.
Se puede presentar al nacimiento o, de forma más frecuente, a partir de la 1ª o 2ª semana de vida. Su sintomatología es máxima a los 6 meses de vida, y suele disminuir a los 8-10 meses. Habitualmente, se resuelve por completo antes de los 18-24 meses, aunque puede alargarse hasta llegar a los 2 a 7 años de vida.
Diagnóstico(8,9)
El diagnóstico de sospecha debe ser con la historia clínica de estridor inspiratorio, habitualmente no cianosante, que ha aparecido en la primera semana de vida y que empeora con la alimentación, decúbito supino y llanto.
Actualmente, el diagnóstico instrumental se realiza con rinofibrolaringoscopia flexible con el lactante despierto en casi todos los casos por su benignidad, tolerándose realmente bien. Se debería completar el estudio de toda la vía aérea, pero se suele reservar para los casos que no evolucionan bien o los de mayor severidad, con una endoscopia rígida con ventilación espontánea para descartar patología asociada traqueal (traqueomalacias, compresiones traqueales, estenosis subglóticas o estenosis traqueales).
Otras técnicas diagnósticas asociadas pueden ser la pHmetría, por estar asociado en un alto porcentaje el reflujo concomitante, monitorización de la saturación de oxígeno en casos graves y, ocasionalmente, estudio radiológico.
Tratamiento(10-12)
El 95% de los casos sólo requieren una actitud expectante. El 5-25% presentan enfermedad severa que puede requerir un tratamiento activo, que consiste en la resección endoscópica de las estructuras laríngeas redundantes (supraglotoplastia): sección de uno o de los dos repliegues ariepiglóticos, sección parcial de los bordes laterales de la epiglotis y vaporización de mucosa de cartílagos corniculados y borde libre de la epiglotis. Es importante no tocar ni lesionar los aritenoides. Se han descrito múltiples técnicas endoscópicas, ya sea mediante la utilización del láser CO2 o con microinstrumental, con resultados satisfactorios en más del 90% de los casos. La traqueotomía, que antes era el tratamiento inicial, se reserva para casos extremadamente graves y que, tras varias cirugías, presentan clínica severa, siendo habitualmente los pacientes que presentan comorbilidades asociadas los que presentan mayor riesgo de reintervención y/o traqueotomía.
Parálisis de cuerdas vocales
Las parálisis congénitas de cuerdas vocales bilaterales suponen una disnea severa, habitualmente secundarias a patología central. Las unilaterales, habitualmente, generan una clínica banal.
Suponen hasta el 10% de las anomalías congénitas laríngeas.
Etiología y etiopatogenia(8,13)
Las parálisis congénitas habitualmente son bilaterales. Éstas se asocian a lesiones del sistema nervioso central (malformación de Arnold-Chiari –la más frecuente–, hidrocefalia, mielomeningocele, agenesia cerebral o enfermedades neuromusculares). Estas parálisis bilaterales pueden ser provocadas por las mismas enfermedades e instaurarse más tardíamente. Las parálisis congénitas unilaterales obedecen a: traumas obstétricos, vueltas de cordón o malformaciones cardiovasculares; aunque son más frecuentes las unilaterales adquiridas secundarias a cirugía cardiaca (lado izquierdo).
La etiopatogenia de la parálisis bilateral es discutida, pero parece existir afectación de ambos nervios vagos por compresión o estiramiento del tronco del encéfalo en el foramen magnum.
Clínica(5)
La parálisis bilateral ocasiona disnea y estridor inspiratorio severo, con cianosis, apneas, episodios de aspiración debidos a una falta de relajación del músculo cricofaríngeo, con escasa disfonía y llanto normal. Es una urgencia vital.
La parálisis unilateral puede pasar desapercibida por la compensación que hace la otra cuerda vocal. Habitualmente, produce: estridor leve, disfonía y llanto débil; menos frecuentemente, si no se compensa, puede dar: tos, alteraciones en la deglución por incoordinación faringolaríngea, que provoca la apertura de la laringe durante la deglución, episodios de aspiración y neumonías.
Diagnóstico
Se realiza mediante fibrolaringoscopia sin anestesia para ver el movimiento de las cuerdas.
Si se objetiva una sola apertura activa de la laringe en inspiración, se debe poner en duda el diagnóstico y pensar en una discinesia laríngea. La discinesia se presenta debido a una inmadurez del control neuromuscular y, habitualmente, se asocia a reflujo gastroesofágico.
Una vez confirmado el diagnóstico de parálisis laríngea, se debe establecer su etiología, pues de ella dependerá su tratamiento.
Tratamiento
La parálisis unilateral se debe tratar de forma expectante, las no yatrógenas presentan una recuperación espontánea del 60-70% durante el primer año.
En el neonato, el principal problema lo constituye el trastorno de la deglución asociado. Por esta razón, es necesario espesar los alimentos e instaurar tratamiento antirreflujo. Si la clínica de aspiraciones persiste, puede ser necesaria la utilización de sonda nasogástrica e incluso de gastrostomía. Si en edad escolar presenta aspiraciones o disfonía severa, puede realizarse una tiroplastia.
En la parálisis bilateral, si existe disnea obstructiva grave, se debe proceder a la intubación oro o nasotraqueal. Ésta se puede mantener hasta tres semanas. Durante este periodo, se intentará establecer la etiología del caso y se realizarán intentos de extubación, que ayudarán a objetivar la evolución de la parálisis. Si en tres semanas no se ha podido efectuar la extubación, se procederá a realizar una traqueotomía.
El 40% presentan recuperación espontánea. Si durante el primer y segundo año de vida el niño no muestra signos de recuperación espontánea, se debe proponer un tratamiento quirúrgico definitivo. Se han descrito diferentes técnicas endoscópicas, como la realización de una cordotomía posterior en ambas cuerdas o la aritenoidectomía. También existen técnicas abiertas, como la aritenopexia o interposición de injertos junto a dilatación temporal.
Estenosis subglóticas congénitas
Suponen una patología que cursa con disnea de diferente magnitud. El tratamiento quirúrgico es muy satisfactorio.
Resulta de una hipoplasia del anillo cricoideo, habitualmente disminuyendo el diámetro a dicho nivel a menos de 3 ó 4 mm dependiendo de los autores.
Clasificación según Cotton:
• Grado 1: diámetro subglótico menor del 50% del calibre normal.
• Grado 2: diámetro subglótico entre el 50-70%.
• Grado 3: diámetro subglótico entre 70-99%.
• Grado 4: estenosis subglótica total.
Etiología y etiopatogenia
Se cree que puede formar parte de un cuadro de membrana glótica con extensión a la subglotis o de atresia laríngea. Se presenta más frecuentemente de forma aislada a nivel cricoideo, dando lugar a un cricoides de pequeño tamaño o elíptico.
La estenosis podrá ser de tipo mucosa, habitualmente adquirida, o de tipo cartilaginosa, más frecuente congénita. Puede presentarse aislada o en el contexto de un síndrome polimalformativo.
Clínica
Depende de la edad y del grado de estenosis. La presentación más frecuente es a través de episodios de laringitis subglótica o de“crup” recurrentes, que se da en las formas leves de esta entidad. A partir del tercer episodio de laringitis subglótica en el mismo invierno, se debe tener la sospecha clínica de esta entidad y llevar a cabo una fibrolaringoscopia.
Los casos severos al nacimiento presentan disnea y cianosis progresivas posparto que, en la mayoría de los casos, conducen a la muerte del feto, si no se realiza una traqueotomía.
La estenosis grave, pero compatible con la vida, da lugar a: estridor inspiratorio y espiratorio, disnea, tiraje, voz ronca, dificultad de alimentación y talla pequeña en las formas evolucionadas.
Diagnóstico
El diagnóstico prenatal en las formas graves se realiza mediante ecografía prenatal. Se encuentra una dilatación de la tráquea y de los pulmones que nos debe hacer sospechar una estenosis severa y la valoración de una traqueotomía inmediata en el momento del parto. En el resto de las formas, el estudio diagnóstico fundamental es la fibrolaringoscopia con broncoscopia asociada, si es posible.
También, se ha utilizado la radiografía, observándose un estrechamiento subglótico, y para planificar la cirugía la TAC.
Tratamiento
El tratamiento de esta entidad dependerá principalmente del grado de estenosis, aunque esta patología es susceptible de mejorar con el crecimiento laríngeo.
Las estenosis de grado I o leves se basan en el tratamiento y profilaxis de las infecciones respiratorias y en el tratamiento de los factores que puedan agravar la estenosis, como el reflujo gastroesofágico. En este grupo, se debe tener en cuenta que, a partir de los 18-24 meses de vida, los niños presentan una mejoría evidente de su estenosis por el propio desarrollo de la laringe.
Las estenosis grado II-III o graves suelen requerir tratamiento quirúrgico, y la técnica dependerá del tipo de estenosis. Si se presenta un diafragma delgado y fibroso, se puede intentar una dilatación endoscópica o una vaporización con láser, aunque debemos tener en cuenta que la tendencia de las maniobras endoscópicas es a agravar la estenosis. El ensanchamiento de la subglotis mediante laringotraqueoplastia, con o sin ayuda de injertos, o técnicas de extirpación cricotraqueales con anastomosis término-terminal han demostrado unos resultados satisfactorios cercanos al 90%.
La estenosis subglótica congénita severa se debe tratar con una traqueotomía en el momento del parto, si es posible y, posteriormente, se deberán realizar técnicas de reparación y ensanchamiento de la laringe.
Atresias y membranas laríngeas
Etiología y etiopatogenia
Se originan por una recanalización incompleta de la laringe durante la embriogénesis (persistencia de la lámina epitelial embriológica, que cierra la faringo-laringe primitiva en la 3ª-4ª semana).
Se pueden dividir las atresias laríngeas en tres grupos(1-4):
• Atresia tipo I o completa: ausencia completa de luz laríngea.
• Atresia tipo II: falta de reabsorción de la lámina epitelial en la porción supraglótica.
• Atresia tipo III: comúnmente se denominan membranas laríngeas.
Este grupo se subdivide, según la clasificación de Cohen, en:
• Tipo I: membrana glótica anterior que ocupa menos del 35% de la luz glótica. Es translúcida, sólo presenta porción membranosa y no exhibe extensión subglótica.
• Tipo II: membrana anterior, que ocupa el 50% de la luz glótica. Es más gruesa, ya que puede ser membranosa o conectivo-membranosa. Presenta extensión subglótica.
• Tipo III: membrana que afecta al 75% de la luz con extensión subglótica anterior.
• Tipo IV: fusión de ambas cuerdas en toda su extensión ligamentosa, reduciendo la luz glótica entre el 75 y 90%. El paso aéreo está restringido al espacio interaritenoideo.
Las membranas glóticas se presentan de forma aislada en la mayoría de los casos, aunque también se han descrito asociadas a otros síndromes malformativos.
Clínica
Variable, dependiendo del tipo y extensión de la afectación laríngea que se presente.
Las atresias tipo I y II presentan un cuadro incompatible con la vida. Sólo pueden sobrevivir aquellos fetos que presenten una fístula traqueoesofágica concomitante, a través de la cual se pueda ventilar parcialmente, hasta la realización de una traqueotomía de urgencia.
Las atresias tipo III o membranas laríngeas darán lugar a clínica de disnea y disfonía en función de la extensión de la lesión. Las tipo I no dan disnea y únicamente dan algo de disfonía. Habitualmente pasan desapercibidas y se descubren al hacer una fibroscopia por otras causas. El subtipo II dará un llanto disfónico y voz ronca junto a signos de obstrucción respiratoria moderada, que aparece en los catarros banales. El tipo III produce una afonía prácticamente completa y disnea de pequeños esfuerzos. Por último, el tipo IV da lugar a afonía, estridor y cianosis que, habitualmente, obliga a traqueotomía a los pocos días de vida.
Diagnóstico(8,9)
El diagnóstico de las atresias tipos I y II se realiza de forma más habitual en la autopsia, aunque la evolución de las técnicas ecográficas en el diagnóstico prenatal permite actualmente el diagnóstico, en algunas ocasiones, de estas malformaciones de la vía aérea.
Las membranas tipos I y II se diagnostican mediante fibrolaringoscopia. En estos casos, la movilidad laríngea suele ser normal. Si la membrana no es translúcida, es difícil asegurar la ausencia de extensión subglótica. En esta situación, está indicada la laringoscopia directa bajo anestesia general, que permitirá, además, llevar a cabo un tratamiento endoscópico.
Los tipos III y IV se suelen diagnosticar en situación de urgencia, ya sea mediante fibrolaringoscopia, si el estado del niño lo permite, o por laringoscopia directa justo después del parto.
Tratamiento
Las atresias laríngeas mayores, tipos I y II, y las membranas tipos III y IV, suelen detectarse a través de un cuadro de sufrimiento respiratorio al nacimiento o durante los primeros días de vida. Se deben evitar, en lo posible, traumatismos laríngeos con intentos de intubación infructuosos. Si se encuentra la luz obliterada y la colocación de una sonda de intubación en la parte superior del esófago produce una rápida mejoría del niño, se debe sospechar una atresia completa con fístula traqueoesofágica o una desembocadura directa de la tráquea o de los bronquios en el esófago. En esta situación, la traqueotomía no es posible, ya que, en general, no existirá tráquea cervical y la viabilidad del niño tampoco será posible. En los demás casos, se debe realizar una traqueotomía de urgencia, previa intubación si ésta ha sido posible. Posteriormente, se procederá a la reparación laríngea, fundamentalmente mediante la realización de laringoplastias de ensanchamiento laríngeo por vía externa.
En las membranas tipos I y II, se realizará un tratamiento endoscópico con resección de la membrana mediante láser o bisturí frío si la membrana es fina, con colocación o no de un stent para evitar sinequias, aunque es frecuente la presentación de recidivas que requieran nueva cirugía. Si la membrana es gruesa, puede requerir la realización de una laringoplastia por laringofisura e interposición anterior de un injerto cartilaginoso o de una lámina de silastic.
Los resultados, en general, son satisfactorios en la permeabilidad laríngea, aunque no tanto en la calidad de la voz por la formación de sinequias anteriores.
Hendiduras laringotraqueales posteriores o diastemas laringotraqueales
Consiste en la aparición de una hendidura posterior de la laringe de amplitud variable. Es poco frecuente, <1% de las malformaciones de esta región y 1 entre 10.000-20.000 nacidos vivos.
Etiología y etiopatogenia
Se deben a un defecto en el cierre posterior de la laringe, por un déficit en la fusión de la membrana entre el esófago y el eje laringotraqueal. Se presenta de forma aislada (más frecuente), aunque puede asociarse a otros síndromes polimalformativos, sobre todo que afecten a la línea media, o también a estenosis subglótica, atresia esofágica o fístula traqueoesofágica.
Se han propuesto diversas clasificaciones, la más utilizada es la de Benjamin-Inglis, que divide las hendiduras en 4 grupos, del I al IV(6-8):
• Tipo I: hendidura interaritenoidea posterior profunda, que no supera el plano de las cuerdas vocales.
• Tipo II: hendidura que desciende hasta el extremo inferior del cricoides.
• Tipo III: hendidura hasta la parte superior de la tráquea.
• Tipo IV: hendidura hasta la carina bronquial.
Clínica
Depende de la amplitud de la hendidura. Las tipo I y II producen tos, broncoaspiración y neumonías de repetición. Menos frecuentemente, también pueden dar lugar a una disnea obstructiva y estridor de tipo bifásico: inspiratorio por el colapso de la mucosa redundante a través de la hendidura y espiratorio por la movilización de las secreciones aspiradas. Las tipos III-IV cursan con disnea y dificultades de ingesta desde el nacimiento.
Diagnóstico
La primera exploración a realizar es la fibrolaringoscopia, que revela un aspecto muy redundante de la mucosa interaritenoidea y una hendidura con los movimientos de abducción. Ocasionalmente, puede pasar inadvertido a la exploración fibrolaringoscópica; por lo que, si existe clínica sugestiva, se debe realizar una laringoscopia directa con palpación de la comisura laríngea posterior. En caso de confirmarse, una exploración completa del árbol respiratorio es obligatoria.
El índice de inclusión lipídico de los macrófagos(7), adquirido por lavado brocoalveolar, es un marcador de aspiración en pacientes con clínica respiratoria crónica (tos crónica, laringotraqueitis de repetición, neumonías por aspiración). La RMN es la prueba de imagen que pondría de manifiesto la presencia del mismo.
Una vez obtenido el diagnóstico, se deberá filiar el límite inferior de la malformación.
Tratamiento
Las hendiduras de alto grado (IIII y IV) se deben tratar de forma precoz, ya que presentan mal pronóstico vital para el niño por las alteraciones broncopulmonares. En el resto de casos, el tratamiento dependerá de la sintomatología provocada por la malformación.
En los diastemas tipos I y II poco sintomáticos, se debe realizar tratamiento médico, basado en espesar los alimentos y en medidas antirreflujo.
Si la sintomatología es importante o falla el tratamiento médico, se precisa tratamiento quirúrgico. Las hendiduras tipos I-II se pueden cerrar mediante laringoscopia directa bajo anestesia general. Si la hendidura afecta al anillo cricoideo o tráquea, se precisará un acceso mediante laringofisura para realizar el cierre, aunque las técnicas endoscópicas están en auge. Las hendiduras más avanzadas se deben cerrar mediante toracotomía. Para el cierre quirúrgico de la hendidura, será necesario extirpar el exceso de mucosa y se realizará una sutura en dos planos con interposición de un injerto cartilaginoso o perióstico.
Hemangioma subglótico
Es una neoformación vascular benigna de localización subglótica. Más frecuente en niñas (relación 2:1).
Etiología y etiopatogenia(1,2,8,9)
Rápida proliferación celular a partir de las células del endotelio vascular. Esta lesión presenta una fase proliferativa inicial, seguida de una fase involutiva en la que la proliferación endotelial disminuye y aparece tejido fibroso separando los espacios vasculares.
Se presentan asociados a hemangiomas cutáneos en el 50% de los casos, generalmente de localización cervico-facial.
Clínica
Se presenta como disnea obstructiva inspiratoria acompañada de un estridor inspiratorio bifásico, con accesos de tos tipo “crup”. Si la clínica se produce asociada a un cuadro inflamatorio de vías altas, puede sugerir una laringitis subglótica que responde al tratamiento con corticoides, igual que el hemangioma.
Habitualmente, no está presente en el momento del nacimiento. Sus manifestaciones se inician a los 2-3 meses, y mejoran a partir de los 12-18 meses de forma paralela a la evolución natural de esta entidad.
Diagnóstico
Por fibrolaringoscopia, se observa una masa de color rojo o violáceo, aunque también puede ser de color normal si el angioma se localiza profundo a la mucosa. Su localización más frecuente es a nivel subglótico posterior izquierdo.
La confirmación diagnóstica se puede realizar mediante una RMN o con la realización de una laringoscopia directa que revelará una tumoración elástica y depresible. Delante de estos hallazgos no es necesario llevar a cabo una biopsia de la masa.
Tratamiento
Se debe tener en cuenta que la evolución de estas lesiones es hacia la regresión espontánea a partir del primer año de vida.
El descubrimiento del propranolol como tratamiento para los angiomas de cualquier localización del cuerpo ha supuesto un avance muy significativo en el tratamiento del hemangioma subglótico. Se debe mantener durante unos nueve meses y controlar la posible reaparición tras su retirada y mantener más tiempo de tratamiento en caso de recidiva hasta que, por la evolución del hemangioma, involucione. Control de las glucemias y de posibles bradicardias como factibles efectos secundarios.
Previamente, los corticoides a dosis altas eran el tratamiento. Si, pese al tratamiento inicial la lesión no mejora o se presenta recidiva de la misma, se puede llevar a cabo su exéresis mediante láser CO2. Si la cirugía endoscópica falla, ha demostrado utilidad la extirpación de la lesión por vía externa a través de una laringofisura seguida de intubación durante varios días. En afectaciones graves con afectación mediastínica, el interferón alfa puede ayudar a la regresión o estabilización de las lesiones.
Lesiones quísticas congénitas
Los quistes laríngeos congénitos son poco frecuentes, pero se deben tener en cuenta, ya que es frecuente su diagnóstico en la autopsia, tras un cuadro de asfixia neonatal.
Etiología y etiopatogenia
Se deben a una disontogenia en el desarrollo de los límites del 3º y 5º arcos branquiales, representando el resto de una hendidura branquial. Se forma una lesión quística revestida de mucosa con contenido líquido. Preferentemente, se localiza a nivel del ventrículo laríngeo de Morgagni, aunque también es habitual a nivel anterior en la vallécula glosoepiglótica.
Clínica
Generalmente, asintomáticos en el nacimiento. Presentarán manifestaciones si aumentan su tamaño, especialmente con infecciones del tracto aéreo, antes de los 6 meses de vida.
También, pueden presentarse como disnea desde el momento del nacimiento, acompañada de estridor inspiratorio, que puede mejorar con la extensión de la cabeza.
Diagnóstico
Por fibrolaringoscopia se observa una masa quística, con una pared mucosa de color amarillento, a nivel lateral, si es un quiste de ventrículo, o a nivel anterior, si es un quiste de vallécula.
Los quistes de vallécula se deben diferenciar del tiroides lingual ectópico, de aspecto más hemorrágico y sólido. Para esta razón, se debe completar el estudio endoscópico con una ecografía cervical antes de llegar al diagnóstico definitivo.
Tratamiento
Los quistes laríngeos congénitos se deben tratar independientemente de la clínica asociada. Los casos asintomáticos presentan un potencial riesgo de crecimiento importante que podría dar lugar a una situación clínica grave.
El tratamiento consiste en la exéresis lo más completa posible del quiste a través de la laringoscopia directa con anestesia general. Si esta no es posible, se puede llevar a cabo una marsupialización endoscópica de la lesión o exéresis a través de una cervicotomía lateral.
Atresia de coanas
Es la causa no laríngea más frecuente de estridor. El 50% se asocian a síndromes, especialmente el CHARGE. La atresia bilateral es una urgencia por la respiración nasal obligada de los neonatos.
La atresia de coanas es una rara causa de insuficiencia respiratoria nasal que tiene una incidencia de 1 entre 5.000 a 8.000 recién nacidos. Es más frecuente la unilateral en el lado derecho y parece existir predominancia en el sexo femenino sobre el masculino. Clásicamente, se describían como un 90% placas atrésicas óseas y el 10%, exclusivamente membranosas, pero la literatura reciente las define como mixtas en un 70% y óseas en un 30% de los casos.
La mitad de las presentaciones de las atresias de coanas son aisladas, sin otras patologías asociadas; y el otro 50% se asocian a otras malformaciones, tanto de causa no cromosómica como de causa cromosómica. El síndrome CHARGE(14) (coloboma, alteración cardiaca, atresia de coana, alteraciones renales, retraso en el crecimiento y alteraciones en oído) es el más frecuentemente encontrado, pero se puede asociar a otros síndromes, como los de: Pfeiffer, Crouzon, VATER, síndrome del incisivo único o delección 22q11.
Clínica
La presentación clínica de la enfermedad depende de si es una forma unilateral o si es una forma bilateral. La forma unilateral puede pasar totalmente desapercibida en la sala de parto y el diagnóstico puede ser realizado en los años posteriores de vida por rinorrea unilateral. Si la atresia de coanas es bilateral(15), es una causa de disnea intensa en el neonato, habitualmente cianosis; ya que, el neonato es un respirador nasal obligado hasta los 6 meses aproximadamente.
Diagnóstico
El diagnóstico se basa en la sospecha directa en la sala de parto, ya que se pasan dos sondas nasofaríngeas en todos los recién nacidos. Además, en la forma bilateral, la respiración asfíctica del neonato con tiraje cervical y torácico, junto a la imposibilidad de pasar las sondas nasales, nos hacen tener un diagnóstico de sospecha.
El diagnóstico de certeza se lleva a cabo con una endoscopia flexible, donde se objetiva la no apertura de la coana. En la mayoría de los casos de atresia bilateral, se procede a la intubación del neonato en las primeras 24 horas, ya que estos niños desarrollan una fatiga respiratoria severa. El flujo nasal exhalado en espejo o la radiografía simple nasal tras administración de contraste intranasal ha quedado totalmente en desuso.
Una vez diagnosticado con la fibroscopia nasal, la prueba de imagen de elección es la TAC, para ver posibles referencias anatómicas cara a la cirugía. En los casos de atresia unilaterales sin alteración de la otra coana, se suele diferir la prueba de imagen hasta la planificación quirúrgica; ya que, no se realizará de forma inmediata, al contrario que la bilateral. La imagen típica de la atresia de coanas en cortes axiales es la de un reloj de arena en la zona estenótica, ya que el proceso medial de la apófisis pterigoides se medializa y la parte posterior del vómer se engrosa y lateraliza. Además, también sirve para ver la distancia de la base del cráneo, que en esta zona se hace más baja de lo normal.
Manejo inicial: los neonatos son respiradores nasales obligados hasta las 6-8 semanas, por lo que el neonato con atresia bilateral de coanas se presenta con disnea y cianosis que se alivia con el llanto. El descenso de la laringe y el crecimiento del cuello durante los primeros meses también facilitan el aprendizaje. La respiración se puede mantener con el chupete de McGovern o incluso la intubación orotraqueal puede ser necesaria. En cambio, la atresia unilateral puede pasar desapercibida y presentarse como rinorrea crónica unilateral.
Desde este momento, iniciar un estudio de pluripatologías asociadas, ya que la mitad de estos niños las padecen. Habitualmente, el principal estudio que se hace es el de búsqueda de un CHARGE.
Ante una atresia de coanas unilateral, habitualmente no se requiere intubación neonatal, pero sí búsqueda de posibles órganos afectados.
Diagnóstico diferencial
Estenosis de la apertura piriforme, síndrome del incisivo único (combina las dos etiologías), estenosis de la cavidad nasal, quistes de los conductos nasolacrimales, desviación septal, hematoma septal, encefalocele, hamartoma, cordoma y glioma.
Tratamiento(16,17)
En las atresias de coanas bilaterales, tras detectar posibles malformaciones asociadas, la cirugía se realizará lo antes posible. Actualmente, se realiza por cirugía endoscópica nasal que ofrece grandes ventajas sobre la vía transpalatina. Las complicaciones de la endoscopia son la posible entrada en fosa craneal anterior con fístula LCR, posibles reestenosis (hasta un 30%, aunque en los últimos años se están obteniendo resultados del 10%). La vía transpalatina ofrece resultados igual de buenos en cuanto a reestenosis o incluso menores, pero existe un mayor sangrado, mordida cruzada en el crecimiento, altera el crecimiento facial y produce insuficiencia velopalatina.
Para la práctica pediátrica de Atención Primaria
Las anomalías de la vía aérea son poco frecuentes. Las anomalías graves dan una clínica urgente y dramática (disnea severa, cianosis, asfixia), y de atención en centros hospitalarios pediátricos. Sin embargo, vamos a tener que atender a niños con anomalías en centros de salud. La laringomalacia es la causa más frecuente de estridor laríngeo en el niño y habitualmente se presenta en la primera semana de vida de forma poco intensa, lo que permite el desarrollo del bebé sin problemas y que se resuelve sin tratamiento en la gran mayoría de los casos. En los otros casos en que la malformación sea leve, puede pasar desapercibida en el momento del nacimiento y dar clínica larvada, crónica y sutil del tipo de: tos crónica, episodios de laringitis-crup repetitivos, neumonías de repetición o síndromes pseudoasmáticos no clásicos (membranas laríngea, estenosis suglóticas leves, hendiduras laríngeas…). Ante estas clínicas inusuales, se debería realizar un estudio de la vía aérea superior.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Bartual Pastor J, Bartual Magro J, Sierra Galera G. Malformaciones laringotraqueales. En: Barberán T, Bernal Sprekelsen M, eds. Tratado de ORL Pediátrica (Ponencia Oficial de la SEORL 2000). p. 379-86.
2.*** Clarós A, Clarós P. Malformaciones laringotraqueales congénitas. En: Suárez C, ed. Tratado de ORL y Cirugía de Cabeza y Cuello. Editorial Proyectos Médicos. p. 1883-93.
3.** Llorente Pendás JL, Núñez Batalla F, Suárez Nieto C. Disnea y estridor en el niño. Manejo de la obstrucción aguda de la vía aérea. Tratado de ORL Pediátrica (Ponencia Oficial de la SEORL 2000). p. 367-74.
4.*** Daniel M, Cheng A. Neonatal stridor. Int J Pediatr. 2012; 2012: 859104.
5.** Leung AKC, Robson WLM, Tay-Uyboco J. Chronic cough in children. Canadian Family Physician. 1994; 40: 531-7.
6.** Rahbar R, Rouillon I, Roger G, et al. The presentation and Management of laryngeal cleft, a 10 year experience. Arch Otolaryngol Head and Neck Surg. 2006; 132: 1335-41.
7.** Kieran S, Katz E, Rosen R, et al. The lipid laden macrophage index as a marker of aspiration in patients with type I and II laryngeal clefts. Int J Pediatr Otorhinolaryngol. 2010; 74: 743-6.
8.*** Gerber M, Holinger L. Congenital laryngeal anomalies. En: Alper et al. Pediatric Otolaryngology Bluestone, Stool. 1460-73.
9.*** Hartnick CJ, Cotton RT. Stridor and airway obstrucción. En: Alper et al. Pediatric Otolaryngology Bluestone, Stool. p. 1437-48.
10.** Hwang EB, et al. Success of supraglottoplasty for severe laringomalacia: the experience from Northeastern Ontario, Canada. Int J Pediatr Otorhinolaryngol. 2013. http://dx.doi.org/10.1016/j.ijporl.2013.04.010
11.** Hoff SR, et al. Supraglottoplasty outcomes in relation to age and comorbid conditions. Int J Pediatr Otorhinolaryngol. 2010; 74: 245-9.
12.** Preciado D, Zalzal G. A sistematic review of supraglottoplasty outcomes. Arch Otolaryngol Head Neck Surg. 2012; 138(8); 718-21.
13.*** García-Lopez I, Peñarrocha-Terés J, et al. Paediatric vocal fold paralysis. Acta Otorrinolaringol Esp. 2013 May 30. pii: S001-6519(13)0063-0. doi: 10.1016/j.otorri.2013.02.004.
14.** Bergman JE, et al. CHD7 mutation and CHARGE syndrome: the clinical implications o fan expanding phenotype. J Med Genet. 2011; 48: 334-42. doi: 10.1136/jmg.2010.087106.
15.** Durmaz A, et al. Transnasal endoscopic repair of choanal atresia: Results of 13 cases and meta-analysis. J Craniofac Surg. 2008; 19(5): 1270-4.
16.** Hengerer A, Brickman T, et al. Choanal atresia: embriologic análisis and evolution of treatment, a 30 year experience. The Laryngoscope. 2008; 118: 862-6.
17.** Teissier N, Kaguelidou F, et al. Predective factors for succes alter transnasal endoscopic treatment of choanal atresia. Arch Otolaryngol Head Neck Surg. 2008; 134(1): 57-61.
Bibliografía recomendada
– Bartual Pastor J, Bartual Magro J, Sierra Galera G. Malformaciones laringotraqueales. En: Barberán T, Bernal Sprekelsen M, eds. Tratado de ORL Pediátrica (Ponencia Oficial de la SEORL 2000). p. 379-86.
Tratado de Otorrinolaringología pediátrica de referencia española.
– Gerber M, Holinger L. Congenital laryngeal anomalies. En: Alper et al. Pediatric Otolaryngology Bluestone, Stool. 1460-73.
– Hartnick CJ, Cotton RT. Stridor and airway obstrucción. En: Alper et al. Pediatric Otolaryngology Bluestone, Stool. p. 1437-48
Tratado de Otorrinolaringología pediátrica de referencia mundial.
| Caso clínico |
|
Neonato varón de 37+5 semanas, de padres no consanguíneos, estudios y controles durante embarazo normales, peso recién nacido: 2.800 g. Test de Apgar de 6 al minuto y cinco minutos. Ventilación con mascarilla facial ayudada por cánula de Guedel. Estridor inspiratorio con llanto fuerte, pero entrecortado por los movimientos inspiratorios no efectivos. Durante la exploración pediátrica urgente, se observa: facies sindrómica, oreja derecha de implantación baja, dudosa parálisis facial derecha, auscultación pulmonar sin alteraciones y auscultación cardiaca alterada. El paso de las sondas nasofaríngeas parece no ser posible por ninguna fosa nasal. Ante la dificultad respiratoria del neonato, se decide intubación orotraqueal con buena visibilidad e ingreso en UVI neonatal, consiguiéndose estabilización del neonato. |
 |
| Regreso a las bases |
F. Sánchez Fernández*, S. Benítez Robaina**, L. Jiménez Ferreres***
*Facultativo-Especialista ORL. **Residente de 4º año de ORL. Hospital Universitario Ramón y Cajal. Madrid. ***Facultativo-Especialista ORL. Hospital San Rafael. Madrid
Pediatr Integral 2013; XVII(5): 360-367
La patología que afecta al oído externo y medio con frecuencia es fácil de evaluar mediante una correcta anamnesis y una exploración clínica básica, llegando al diagnóstico en la mayoría de los pacientes sin precisar de pruebas complementarias.
La palabra otoscopia deriva del griego ous/otos, oreja/oído, y skopein, examinar. Como tal entendemos los procedimientos empleados para visualizar el aspecto del oído externo y de la membrana timpánica, y valorar el estado del oído medio, la presencia de secreciones en su interior, la capacidad de ventilación de la caja y, en los casos en que la membrana timpánica está perforada, valorar directamente el estado de la mucosa del oído medio y, en ocasiones, la cadena osicular.
Clásicamente el instrumento utilizado para este procedimiento es el otoscopio, del que existen numerosos modelos y sistemas, pero que podríamos simplificar como una fuente de luz acoplada a un espéculo de forma cónica que se adapta a la forma del conducto auditivo externo. También podemos explorar mediante el microscopio o el endoscopio que permite mayor amplificación de la imagen y la mejor obtención de imágenes para su estudio.
Técnica de exploración
El examen clínico del oído comienza con la inspección del pabellón auricular y región retroauricular prestando atención a la forma y posición, al despegamiento respecto a la cabeza, signos de infección o alteraciones de la piel (Fig. 1). Siempre, en especial cuando sospechemos la existencia de infecciones agudas, deberemos comenzar por el oído sano, o el menos sintomático, para evitar contaminaciones.
Elegiremos el espéculo mas grande que nos permita el oído, lo introduciremos en el conducto auditivo externo (CAE) cuidadosamente para evitar lesionar la piel o producir dolor. Dado que el CAE no es rectilíneo, nos ayudamos de una pequeña tracción del pabellón hacia atrás y arriba en niños mayores y adultos, o hacia atrás y abajo en los niños mas pequeños. Exploramos la piel del CAE, la existencia de lesiones, cera, secreciones o lesiones tumorales que, aunque infrecuentes, pueden asentar en esta zona (Fig. 2).

Figura 1. En el pabellón auricular normal encontramos una serie de relieves que dan a la oreja su forma característica: 1) raíz del Hélix; 2) hélix; 3) antehélix; 4) concha auricular; 5) fosita triangular; 6) trago; 7) antitrago; 8) meato auditivo externo; 9) lóbulo.

Figura 2. CAE. El conducto auditivo externo (CAE) no es un tubo rectilíneo, sino que presenta cierta angulación, habitualmente presenta restos de cera que muchas veces no es necesario retirar para visualizar correctamente el tímpano. La piel del CAE presenta un aspecto normal, no inflamado y sin productos patológicos.
Si el conducto es permeable, pasamos a valorar la membrana timpánica, su integridad, posición, coloración y transparencia, e intentaremos a través de ella valorar el estado del oído medio (Fig. 3). En pacientes con tímpanos muy transparentes podremos incluso visualizar la silueta de los osículos. En caso de no poder visualizar el tímpano por ocupación del CAE, retiraremos cuidadosamente el contenido con los instrumentos adecuados, y posteriormente valoraremos la membrana.

Figura 3. Tímpano normal: se aprecia una membrana timpánica íntegra, transparente brillante, de color nacarado o ligeramente sonrosado o amarillento. Por transparecia se intuye la caja timpánica aireada, sin líquido en su interior. Vemos el mango del martillo normoposicionado y el triángulo luminoso.
Otoscopia normal
La membrana timpánica está constituida por tres capas, la más superficial es la capa epitelio epidérmico que se continúa con la piel del conducto auditivo externo, una capa intermedia fibrosa y una capa interna de epitelio mucoso. Estas están presentes en toda su extensión salvo a nivel de la pars flácida que no encontramos capa intermedia.
En la unión al marco timpanal encontramos un engrosamiento que se conoce como annulus que sirve de fijación y soporte al hueso. Faltando también a nivel de la pars flácida.
En un oído normal se pueden identificar y valorar una serie de estructuras sólo con la otoscopia (Fig. 4).
Figura 4. Tímpano normal en el que se han dibujado los cuatro cuadrantes. Se muestran los puntos más importantes que debemos valorar en la otoscopia.
En primer lugar, la imagen del tímpano la dividimos en cuatro cuadrantes, la zona anterior y posterior viene dividida por el mango del martillo, mientras que la zona superior e inferior por una línea perpendicular a la anterior, a la altura del umbo, en cada uno de ellos podemos identificar lo siguiente:
• Anterosuperior: trompa de Eustaquio.
• Anteroinferior: triángulo luminoso de Politzer.
• Posterosuperior: pars flácida, ático, articulación incudoestapedial.
• Posteroinferior: promontorio y ventana redonda.
Malformaciones congénitas del oído externo
Concepto. Son anomalías del pabellón auricular y el conducto auditivo externo (CAE) por alteraciones en el desarrollo embriológico del niño. El oído medio e interno pueden ser normales, dado que tienen otro origen embriológico, aunque en ocasiones se producen en el seno de síndromes polimalformativos que pueden asociar hipoacusia. En la mayor parte de los casos no se determina la causa concreta, puede deberse a alteraciones hereditarias, infecciones connatales, o toxicidad durante el embarazo.
Clínica. La producida por la propia alteración estética, y aquellos casos que asocien hipoacusia.
Diagnóstico. Por la observación del pabellón auricular y la otoscopia. En ocasiones se precisa de pruebas de imagen para valorar el estado del oído medio e interno. Si se sospecha hipoacusia, debe ser valorada la audición del niño con las técnicas apropiadas a su edad.
• Alteraciones en el tamaño: existe gran variabilidad del tamaño del pabellón, considerándose patológico cuando es muy llamativo u ocasiona problemas de aceptación por el paciente.
• Alteraciones en el desarrollo (agenesia): la ausencia completa del pabellón (anotia) es muy infrecuente. A menudo se asocia la existencia de un pabellón pequeño y malformado en lo que llamamos microtia, que puede variar desde una pequeña alteración (microtia tipo I) hasta la sola presencia de rudimentos (microtia tipo III). Suele ir acompañado de estenosis o agenesia de CAE, condicionando una hipoacusia transmisiva. (Figs. 5 y 6).
Figura 5. Malformación leve del pabellón auricular (microtia grado I). Se aprecia una mayor plicatura del tercio superior del pabellón, con una deformidad del cartílago, mientras que los dos tercios inferiores tienen una configuración normal. La audición de la paciente era completamente normal.
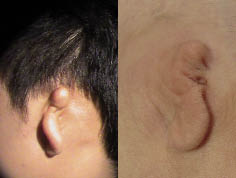
Figura 6. Agenesia severa de pabellón auricular (microtia grado III): Aparecen restos de cartílago sin forma, mientras el lóbulo está mejor desarrollado. En ambos pacientes se asociaba una agenesia de CAE y una hipoacusia de transmisión. Las pruebas de imagen demostraron un oído medio e interno normales en ambos casos.
• Alteraciones de la forma o posición (orejas de implantación baja, orejas en asa, oreja en concha, oreja péndula…). Producidas por alteración en el desarrollo de los cartílagos, o por crecimiento facial anómalo (las orejas de implantación baja aparecen en muchos síndromes polimalformativos) (Fig. 7).
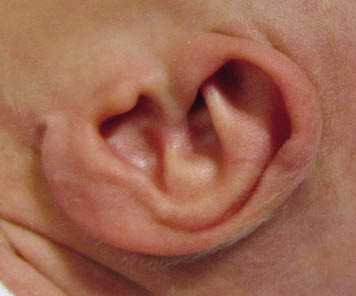
Figura 7. Malformación de pabellón auricular izquierdo en un recién nacido. Presenta un tamaño muy aumentado (macrotia) y una prolongación de la raíz (crus) del hélix; recibe el nombre de “Crus prolongada”.
• Alteraciones en el número (poliotia): la presencia de mamelones o apéndices auriculares por delante del pabellón, que puede ser normal o malformado.
• Fístulas y quistes preauriculares: Se presentan como un pequeño orificio por delante de la raíz del hélix y pueden producir cuadros infecciosos de repetición, siendo estos casos una indicación quirúrgica. Son el resultado de una mala fusión de los arcos branquiales primero y segundo (Fig. 8).
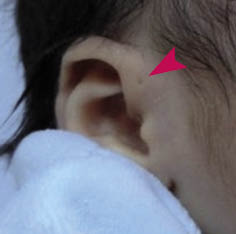
Figura 8. Fístula preauricular en un recién nacido. Se aprecia un agujerito por delante de la raíz del hélix (punta de flecha). Puede producir infecciones de repetición o ser completamente asintomático.
• Tubérculo de Darwin: prolongación superior del hélix, que ocasiona una forma puntiaguda del pabellón. Se considera un retraso en el desarrollo filogenético. Clásicamente se relacionó con la epilepsia o la criminalidad, aunque hoy en día no se sustenta esta asociación.
Tratamiento. Mediante cirugía reconstructiva de la malformación. Los casos que asocien una hipoacusia deberán ser tratados precozmente para asegurar el mejor desarrollo del niño.
Pericondritis
Concepto. Infección del pericondrio o cartílago del pabellón auricular. Habitualmente en el contexto de traumatismos y heridas que suponen una vía de entrada a esta región. Existen casos idiopáticos.
Clínica. Dolor y tumefacción en pabellón auricular. Puede acompañarse de otorrea.
Diagnóstico. Anamnesis y exploración física.
• Anamnesis: antecedente traumático con otohematoma o herida.
• Exploración física: tumefacción dolorosa a nivel del pabellón auricular perdiendo los relieves cartilaginosos habituales y respetando el lóbulo de la oreja (carente de tejido cartilaginoso) (Fig. 9).
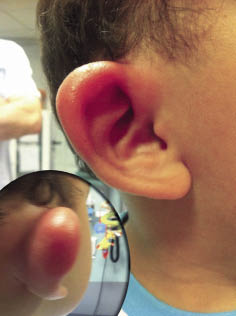
Figura 9. La pericondritis es una inflamación del pabellón auricular, que no afecta al lóbulo (carente de cartílago). Produce un despegamiento del pabellón por inflamación de los tejidos blandos que no debe confundirnos con una mastoiditis.
Tratamiento. Antibioterapia cubriendo Pseudomona aeruginosa y Staphilococcus aureus. Se aconseja la administración intravenosa los primeros días, según la gravedad. Si precisa se asocian gotas antibióticas para la otorrea. Cuidado apropiado de las heridas. En caso de colecciones purulentas, drenaje quirúrgico.
Cuerpos extraños en CAE
Concepto. El hallazgo de cuerpos extraño en el CAE es especialmente frecuente en la edad pediátrica. En este grupo incluimos los tapones de cera y los objetos extraños introducidos de manera voluntaria o accidental.
Clínica. Muy frecuentemente asintomáticos, pueden producir molestias más o menos intensas según el grado de oclusión que produzcan. La introducción de animales (insectos) vivos en el CAE puede ser muy sintomática y precisa una actuación de forma urgente.
Diagnóstico. Otoscopia (Figs. 10-12).
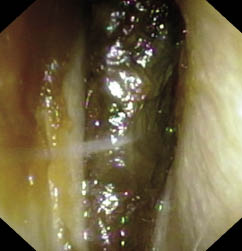
Figura 10. Tapón de cera obstructivo, no permite la visualización de la membrana timpánica.
Figura 11. Cuerpo extraño en oído: se visualizan varios fragmentos de un cuerpo extraño (goma de borrar) introducidos por el propio niño. Es importante explorar siempre los dos oídos, porque es muy habitual que se hayan introducido cosas en ambos. La variabilidad de los cuerpos extraños está sólo limitada por la imaginación del niño y la posibilidad de conseguir pequeños fragmentos: papeles, piedras, plastilina, pequeños elementos de juguetes, fichas, imanes… Mucho cuidado con los insectos vivos y con las pilas de botón.
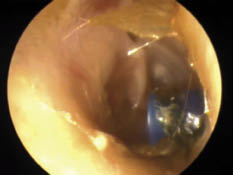
Figura 12. Los drenajes transtimpánicos también se comportan como un cuerpo extraño. Normalmente el tímpano “expulsa” el drenaje, y el crecimiento de la piel y la descamación lo van haciendo avanzar hacia el exterior. Se pueden retirar con unas pinzas de oído si el niño lo permite, pero no es imprescindible.
Tratamiento. La extracción instrumental del cuerpo extraño. Los insectos vivos se deben matar previamente. La pilas de botón deben ser extraídas de manera urgente, puesto que en contacto con la piel pueden producir lesiones cáusticas severas. Cuando no es posible la colaboración del niño, es necesaria la extracción bajo anestesia general o sedación.
Otitis externas
Concepto. Representa la forma de otitis más frecuente en periodo estival. Existen distintas entidades diferenciadas.
• Otitis externa difusa: de origen bacteriano, se presentan con un dolor intenso, habitualmente con otorrea escasa. El tratamiento con asociaciones de antibiótico tópico empírico y antiinflamatorio suele ser muy efectivo (Fig. 13).
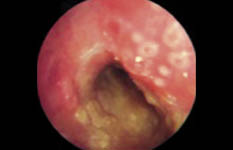
Figura 13. La otitis externa difusa es una infección del CAE. La piel se muestra engrosada y eritematosa, con otorrea purulenta en la superficie. En ocasiones la inflamación es tan intensa que no permite valorar la membrana timpánica. La sola introducción del espéculo en el oído es muy dolorosa.
• Otitis externa micótica: es más infrecuente y se manifiesta de forma más larvada, con picor y otorrea de larga evolución, resistente a antibióticos tópicos. El tratamiento se realiza mediante antimicóticos tópicos y aspiración o lavado del oído, debe ser prolongado hasta confirmar la ausencia de lesiones. En casos graves, se puede asociar antimicótico sistémico.
• Otitis externa circunscrita (forúnculo de CAE): infección de un folículo piloso en el CAE. Produce una intensa otalgia en ausencia de otorrea. El tratamiento es el drenaje y la antibioterapia oral.
Diagnóstico. La otoscopia en todas ellas. En casos dudosos o que no responden adecuadamente al tratamiento, se puede realizar cultivo de la otorrea para identificación del agente causal.
Otitis seromucosa
Concepto. Presencia de líquido en oído medio sin síntomas o signos de infección aguda. En contexto generalmente de patología o inmadurez a nivel de la trompa de Eustaquio. Puede producirse como un proceso residual tras una otitis media aguda, en contexto de catarros de repetición o por una mala ventilación de la trompa de Eustaquio.
Clínica. Hipoacusia de transmisión en grado variable y sensación de taponamiento, en niños más pequeños, a menudo sólo se manifiesta como retraso del desarrollo del lenguaje, déficit de atención o mal rendimiento escolar.
Diagnóstico. Es fundamentalmente otoscópico, las pruebas complementarias como la impedanciometría nos ayudan a corroborar dicho diagnóstico.
Otoscopia. Es muy variable, podemos observar un leve abombamiento con una membrana timpánica más opaca, color amarillento-anaranjado, retracciones timpánicas, niveles hidroaéreos o burbujas de líquido. En algunas ocasiones puede asemejar un tímpano normal. Siempre deben estar ausentes los signos de infección aguda. Se puede completar la exploración con la otoscopia neumática observando un cambio de posición del nivel líquido o burbujas (Fig. 14).
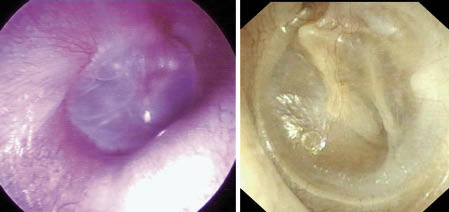
Figura 14. La imagen otoscópica de la otitis serosa es muy variable, siendo frecuentemente difícil de distinguir de un tímpano normal. En la foto izquierda podemos ver burbujas retrotimpánicas. En la foto derecha apreciamos un tímpano levemente retraído con un nivel hidroaéreo inferior y la presencia de un líquido ambarino en el interior del oído medio.
Tratamiento. Ningún tratamiento médico ha demostrado efectividad basada en la evidencia. Es una patología que habitualmente cederá espontáneamente con el paso del tiempo. Pero los niños con hipoacusia o con retraso del lenguaje y la persistencia de moco en el oído durante más de 3 meses, deben derivarse al ORL por la posibilidad de beneficio con tubos de drenaje transtimpánicos (Fig. 15).
Figura 15. Tubo de ventilación transtimpánico en posición. La posición y coloración del tímpano son normales. No existe drenaje mucopurulento a través del tubo, que permanece permeable. Con el tiempo se almacenan restos de cera y descamación alrededor del drenaje.
Otitis media aguda
Concepto. Es un proceso infeccioso agudo que afecta al oído medio.
Clínica. Se manifiesta clínicamente como otalgia y fiebre, normalmente acompañado de hipoacusia de transmisión. Puede presentar otorrea purulenta. En niños pequeños es típica la presentación como llanto incontrolable a las pocas horas de acostar al niño.
Diagnóstico. Es clínico y otoscópico fundamentalmente, no requiere pruebas complementarias salvo que se sospeche una complicación.
Otoscopia. Hiperemia o bullas en membrana timpánica, abombamiento con ocupación mucopurulenta, perforación timpánica, otorrea mucopurulenta, incluso otorragia limitada (Fig. 16).
Figura 16. Otitis media aguda: 1) Tímpano eritematoso, íntegro, con caja ocupada y trasudación de la otorrea a través del tímpano. 2) Tímpano abombado a tensión, eritematoso, ocupación de oído medio sin otorrea. 3) Tímpano eritematoso, no se visualiza perforación pero se aprecia otorrea purulenta en CAE.
Tratamiento. Debe incluir medidas higiénicas para mejorar la ventilación y limpieza nasal. Antibioterapia vía oral y gotas tópicas en caso de otorrea, analgésicos y antiinflamatorios.
Retracción timpánica (Tabla I)
Concepto. La membrana timpánica se invagina o retrae hacia el oído medio en distinta medida. Se origina en el contexto de una mala ventilación tubárica o la presencia de moco retrotimpánico.
Clínica. Hipoacusia de transmisión.
Diagnóstico. Anamnesis y otoscopia.
• Anamnesis: hipoacusia, historia de otitis seromucosas.
• Otoscopia: según los distintos grados (Figs. 17 y 18).
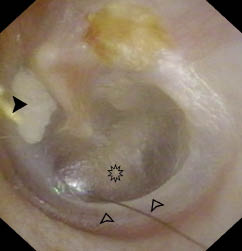
Figura 17. Retracción timpánica leve (grado I) de la pars tensa (oído izquierdo). La parte retraída (marcada con la estrella) permite visualizar la parte inferior del annulus timpánico (puntas de fecha huecas). En la parte anterosuperior se ve una placa de miringoesclerosis (punta de flecha sólida).
Figura 18. Retracción timpánica moderada (grado II) de la pars tensa en hemitímpano posterior (oído izquierdo). El tímpano está en contacto con la cadena de huesecillos, pudiéndose apreciar claramente: 1) umbo; 2) mango del martillo; 3) apófisis corta del martillo; 4) rama larga del yunque; 5) articulación incudo-estapedial y cabezuela del estribo; 6) tendón del estribo; 7) apófisis piramidal. Podemos ver que el hemitímpano anterior (marcado con la estrella) permanece en posición.
Tratamiento. Grados I, II y III puede intentarse colocación de drenaje transtimpánico, si no es suficiente el tratamiento es quirúrgico. Si se trata de un grado IV y V el único tratamiento posible será la cirugía.
Otitis media crónica (OMC)
Se divide en dos tipos:
• OMC colesteatomatosa: presencia de epitelio epidérmico en oído medio.
A su vez la clasificamos en tres tipos:
– Colesteatoma congénito: defecto en el desarrollo embrionario a nivel del segundo arco branquial que origina un acúmulo de epitelio en oído medio. No refieren historia de otorreas, otitis de repetición, traumatismo o cirugía previa.
– Colesteatoma adquirido primario: en el contexto de una mala ventilación tubárica, se origina una retracción timpánica en la cual se acumula epitelio y posteriormente evoluciona a una perforación de la membrana timpánica. Puede venir acompañado o no de lesiones de otras estructuras.
– Colesteatoma adquirido secundario: tras una perforación timpánica de cualquier etiología, se produce una migración de la piel del CAE hacia el oído medio a través de dicha perforación.
• OMC simple: inflamación a nivel de la mucosa del oído medio de manera persistente o recurrente, manifestándose habitualmente en forma de otorreas de repetición. La perforación timpánica es una solución de continuidad de la membrana, que permite la comunicación entre el oído medio y el oído externo. Los episodios de otorrea pueden llegar a alterar la cadena osicular (Fig. 19).
Figura 19. La otitis media crónica se caracteriza por episodios repetidos de otorrea. En la foto izquierda se muestra una otorrea cremosa espesa que emerge a través del tímpano (oído derecho). Una vez aspirada (foto derecha), se visualiza una perforación central, con un tímpano engrosado y eritematoso. A través de la perforación se aprecia la mucosa de la caja también engrosada, con abundante otorrea acuosa.
Clínica de la OMC. Hipoacusia de transmisión, otorreas de repetición (en OMC colesteatomatosa se describe como otorrea maloliente), vértigo, parálisis facial, complicaciones intracraneales. El colesteatoma congénito puede ser asintomático, presentar hipoacusia de transmisión por erosión de cadena u otitis seromucosa por obstrucción tubárica.
Diagnóstico. Anamnesis y otoscopia.
• OMC colesteatomatosa: retracción timpánica o perforación timpánica con acúmulo de escamas de colesteatoma de color blanquecino. Generalmente en región atical (pars flácida). Lesiones de aspecto polipoideo, otorrea maloliente y, en ocasiones, otorragia. En el congénito la membrana timpánica permanece íntegra, con acúmulo de epitelio retrotimpánico que se trasluce más frecuente en cuadrante anterosuperior (Fig. 20).
Figura 20. Acúmulo de piel y restos de cera/otorrea en la pars fláccida, por encima de la cadena osicular, que parece erosionar el hueso. Posterior al mango del martillo, a través del tímpano se puede apreciar una ocupación perlada muy sugestiva de colesteatoma.
• OMC simple: perforación timpánica generalmente en pars tensa sin acúmulo de epitelio acompañado o no de otorrea. En ocasiones puede visualizarse la cadena de huesecillos (Fig. 21).
Figura 21. Perforación simple de la membrana timpánica (oídos derechos). 1) Muestra una perforación posterior, sin visualización de la cadena osicular. 2) Muestra una perforación anterior amplia, se puede visualizar la mucosa del oído medio que no se encuentra inflamada.
La audiometría tonal y las pruebas de imagen se realizan para completar el diagnóstico y para la planificación quirúrgica.
Tratamiento:
• En fase activa con otorrea, humedad o lesiones polipoideas: gotas óticas con antibiótico + corticoide.
• OMC colesteatomatosa: quirúrgico.
• OMC simple: tras un periodo de inactividad si persiste la perforación o han quedado secuelas, como una hipoacusia de transmisión, puede beneficiarse de una intervención quirúrgica. En niños se aconseja esperar hasta la maduración completa de la trompa, cuando las posibilidades de éxito quirúrgico son mayores.
Bibliografía
1. Gil-Carcedo. Otología. Ed Médica Panamericana; 2004.
2. Rosenfeld, et al. Clinical practice guideline: acute otitis externa. Otolaryngol Head Neck Surg. 2006; 134(4 Suppl): S4-23.
3. American Academy of Family Physicians; American Academy of Otolaryngology-Head and Neck Surgery; American Academy of Pediatrics Subcommittee on Otitis Media With Effusion. Otitis Media With Effusion. Pediatrics. 2004; 113: 1412.
4. Screening for otitis media with effusion: recommendation statement from the Canadian Task force on preventive health care. CMAJ. 2001; 165: 1092-3.
5. Sanna M, et al. Color Atlas of Otoscopy From Diagnosis to Surgery. Thieme 1999.
6. Flint PW. Cummings. Otolaryngology Head and neck surgery. Fifth edition. Mosby Elsevier; 2010.
7. Sadé J, Berco E. Atelectasis and secretory otitis media. Ann Otol Rhinol Laryngol. 1976; 85(2 Suppl 25 Pt 2): 66-72.
 |
M.J. Galiano Segovia*, J.M. Moreno Villares**
*Pediatra. Centro de Salud María Montessori. Leganés. Madrid.
**Pediatra. Unidad de Nutrición Clínica. Hospital 12 de Octubre. Madrid
|
|
Pediatr Integral 2013; XVII(5): 371-376
A diferencia del resto de mamíferos, el ser humano consume la leche de otras especies animales para alimentarse, consumida como tal o mediante la elaboración de productos lácteos fermentados como el yogur, el queso, etc. Aunque en otras partes del mundo se consume leche de especies como el búfalo, el camello o la llama, en Europa Occidental se consume principalmente leche de vaca, seguida de las de cabra y oveja.
La leche y el resto de productos lácteos constituyen un grupo de alimentos completo y equilibrado. Proporciona un elevado contenido en nutrientes en relación con el contenido calórico. Sus proteínas (caseína y proteínas del suero) son de alto valor biológico, aporta hidratos de carbono (lactosa), grasas y vitaminas liposolubles. El consumo de leche y derivados lácteos mejora la calidad global de la dieta, en especial de calcio, potasio, magnesio, cinc, vitaminas A y D, riboflavina y folato(1). Se recomienda una ingesta diaria de 2 a 4 raciones, en concreto dos raciones en la primera infancia, 2 a 3 para los escolares y entre 3 y 4 para los adolescentes (una ración de leche equivale a 200-250 ml, una de yogur a 125 ml y una de queso curado de 40 a 50 g).
La leche es un alimento rico en minerales, en especial calcio y fósforo. El calcio constituye el principal componente del hueso y es esencial para el mantenimiento de una buena salud ósea. La masa ósea aumenta a lo largo de la infancia para alcanzar su pico de máxima mineralización en algún momento entre el final de la 2ª y el inicio de la 3ª década de la vida. La acreción de calcio es mayor cuando el estirón puberal está en su cénit, en el comienzo de la pubertad(2,3). La adquisición de un pico de masa ósea adecuada en este periodo disminuye de forma sustancial el riesgo de fracturas osteoporóticas en la edad adulta (un aumento del 10% reduce el riesgo en un 50%). Otros estudios, sin embargo, apoyan más el papel de la actividad física en la acreción ósea que el consumo de lácteos(4). Además de su papel en el desarrollo y mantenimiento de la masa ósea, el calcio parece tener otras funciones beneficiosas para la salud(5,6).
A partir de estas consideraciones se han establecido unos niveles aconsejables de consumo para los distintos grupos de edad. Un documento del Comité de Nutrición de la Asociación Española de Pediatría revisaba las recomendaciones más recientes y señalaba como recomendable una ingesta diaria de calcio entre 200 (0 a 6 meses) y 1.300 mg (adolescentes)(7).
Por razones no del todo conocidas, en los últimos años hemos asistido a una campaña de desprestigio de la leche de vaca, atribuyéndola efectos nocivos para la salud. La disminución en el consumo de productos lácteos puede contribuir a que no se cubran los requerimientos de nutrientes en algunos grupos de edad, por eso es preciso ahondar en las razones que se presentan detrás de estas consideraciones negativas(8,9). Nos referiremos exclusivamente al consumo de leche de vaca por encima del año de edad, dando por sentado el papel primordial de la alimentación al pecho en el primer año de vida y sin considerar tampoco los efectos del consumo de fórmulas infantiles(10).
Controversias sobre el consumo de leche de vaca en edades tempranas
Dentro de las posibles consecuencias negativas del consumo de leche y derivados, hemos considerado tres categorías de situaciones: situaciones en que pudiera haber una relación entre consumo de leche y aparición de síntomas; situaciones en que esta relación podría ser posible, pero poco probable; y, finalmente, situaciones en las que es poco posible y poco probable encontrar una asociación entre consumo de leche y enfermedad. Esta clasificación se ha realizado a partir de los datos publicados en la literatura científica al uso.
Situaciones en las que se ha atribuido la presencia de síntomas al consumo de leche
Ferropenia y anemia ferropénica
En los años 1970s se puso de manifiesto que administrar leche de vaca a lactantes se asociaba a una disminución marcada de los depósitos de hierro y, en ocasiones, a ferropenia. Las razones argumentadas eran, fundamentalmente, el bajo contenido en hierro de la leche de vaca y las micropérdidas intestinales de sangre. En esos estudios iniciales, la introducción de la leche de vaca se produjo en edades tempranas (antes de los 9 meses de edad). Estudios en lactantes de entre 9 y 12 meses también encontraban pérdidas intestinales aumentadas de sangre y riesgo de ferropenia, aunque en menor incidencia e intensidad que en el grupo de edad inferior. Sólo cuando la introducción de la leche de vaca se producía por encima de los 12 meses de edad no se encontraban aumentos significativos de la concentración de hemoglobina en las heces(11). La causa de esas pérdidas hemáticas en heces es probablemente inmunológica, aunque no está bien definida(12).
La consecuencia lógica de estos hallazgos es la recomendación de no consumir leche de vaca no modificada antes de los 12 meses de edad(13). Algunos autores, como Ziegler, apuntan a mantener esa recomendación por encima del año de edad y hacerla extensiva a la primera infancia (1 a 3 años)(11). Recomienda, de no ser posible la leche materna, el empleo de fórmulas infantiles enriquecidas en hierro. La leche de vaca puede consumirse en niños mayores de 12 meses, pero es una mala fuente de hierro y se ha observado que su consumo excesivo puede ejercer una influencia negativa sobre el estado de hierro(14).
Intolerancia a los componentes de la leche
En general hace referencia a la aparición de síntomas tras el consumo de leche y, en algunas ocasiones, de otros derivados lácteos. Desde un punto de vista clínico, podemos distinguir entre la intolerancia a la lactosa y la alergia a las proteínas de la leche de vaca (propiamente las reacciones adversas a la leche)(15).
Intolerancia a la lactosa
Aunque mucha gente confunde la alergia a la leche con la intolerancia a la lactosa, no son lo mismo. La lactosa es el azúcar de la leche. La leche de vaca contiene alrededor de 53 g/L de lactosa, que es hidrolizada por la lactasa, un enzima del borde en cepillo del enterocito, en sus componentes: glucosa y galactosa.
Aunque existe una deficiencia primaria de debut neonatal, su incidencia es excepcional. La deficiencia primaria de lactasa del adulto es, por el contrario, muy frecuente. Ocurre por una regulación a la baja (downregulation) de la actividad enzimática de la lactasa que comienza en la edad infantil. Esta regulación de la actividad lactásica está determinada genéticamente y puede aparecer una vez terminado el destete (alrededor de los tres años). Esta actividad deficiente ocasiona síntomas de maldigestión de la lactosa tras el consumo de leche (flatulencia, dolor abdominal, vómitos y, en ocasiones, diarrea). En algunas poblaciones esta deficiencia ocurre en prácticamente la mayoría de la población, como es el caso de algunas regiones asiáticas o subsaharianas. De hecho, al igual que en el resto de mamíferos, lo propio de la especie sería la desaparición de la actividad lactásica tras el destete. Probablemente en el Neolítico, se produjo la mutación –presencia del alelo -13810*T- responsable de la persistencia de la actividad lactásica en algunas zonas de Oriente Próximo distribuyéndose, posteriormente, en función de las migraciones de esas poblaciones hasta los límites entonces conocidos y que explica la distribución de la tolerancia a la lactosa descrita(16).
La prevalencia de intolerancia a la lactosa en nuestro medio se ha estimado en un 13% en niños de 10 años y de cerca de un 40% en adultos.
Existe una gran variación interindividual en la tolerancia a la lactosa, lo que lleva a que sea el propio individuo quien autorregula la cantidad de lácteos que puede tolerar. Por lo tanto, incluso los individuos con hipolactasia congénita pueden tolerar una determinada cantidad de leche y una mayor cantidad de lácteos fermentados que contienen menos lactosa(17,18).
La hipótesis principal señala que la persistencia de la actividad lactásica es una ventaja adaptativa de la especie humana: permitiría el aprovechamiento de un alimento de elevado contenido proteico y calórico, en épocas en las que la provisión continua de alimentos no estaba garantizada. Será interesante seguir el curso de las investigaciones encaminadas a resolver el enigma de qué fue primero: la mutación que permitió el aprovechamiento de la leche como alimento o la cultura de cuidado de ganado. Ambos están íntimamente relacionados y su aparición en el tiempo data del Neolítico (alrededor de 7.500 a 8.500 años aC).
Una cuestión muy distinta es la deficiencia secundaria de lactasa asociada, generalmente, a enfermedades del intestino delgado en las que se produce un daño grave en la mucosa. Es el caso de la enfermedad celíaca, algunos casos de enfermedad de Crohn, tras infecciones intestinales graves o como consecuencia de algunos tratamientos (quimio o radioterapia). Cuando el epitelio se recupera, la actividad de lactasa vuelve.
Alergia a proteínas de la leche de vaca
La mayoría de las proteínas de la leche, incluso a concentraciones bajas, son alergenos potenciales. Una persona puede ser alérgica a la caseína, a alguna de las proteínas del suero o a ambas fracciones. Sin embargo, la alergia a la proteína de leche de vaca es un cuadro que ocurre en lactantes y niños pequeños, con una frecuencia estimada de alrededor del 2% de los lactantes. Los síntomas pueden empezar en las primeras semanas de vida y pueden manifestarse como síntomas cutáneos, respiratorios o gastrointestinales o, incluso, manifestarse en más de un órgano o sistema. La mayoría (entre un 60 y un 75%) de los lactantes afectos son tolerantes a los dos años y la cifra de tolerantes aumenta más lentamente a partir de esa edad. La alergia a la leche puede estar mediada por IgE o no mediada, siendo esta última más frecuente.
Mientras que el diagnóstico de la alergia a proteínas de leche de vaca mediada por IgE tiene unos criterios bien establecidos, no ocurre lo mismo con los cuadros de alergia no mediada por IgE, generalmente manifestados por síntomas digestivos inespecíficos (irritabilidad, rechazo de las tomas, vómitos o diarrea). Probablemente esta indefinición lleva a considerar como reacciones adversas a la leche a cuadros clínicos que no lo son. En todo caso, no parece constituir esta la causa del abandono del consumo de leche en niños en edad escolar o edades superiores.
Aunque recientemente algunas publicaciones relacionan el consumo de leche con la aparición de estreñimiento, probablemente engloben distintos mecanismos(19). Por una parte, en algunos lactantes el estreñimiento puede ser manifestación de una alergia a las proteínas de leche de vaca mientras que, en el estreñimiento en niños mayores con un consumo elevado de lácteos, las causas pueden ser múltiples (formación de sales cálcicas en las heces, disminución del consumo de frutas y verduras y, por tanto, de fibra, etc.).
Situaciones clínicas en los que existen algunos datos controvertidos sobre el papel causal de la leche de vaca
Riesgo aumentado de diabetes mellitus tipo 1
Hace aproximadamente 20 años se publicaron una serie de artículos en los que se ponía en relación la exposición temprana a las proteínas de la leche de vaca y el riesgo de desarrollar diabetes mellitus tipo 1 (DM1). La explicación entonces era que la exposición temprana a las proteínas de la leche de vaca favorecía la producción de anticuerpos frente a la insulina en algunos niños. Se responsabilizó a la albúmina sérica bovina de esta respuesta, al ocasionar una reacción cruzada con la proteína p69 de la superficie de la célula beta. Más recientemente se ha atribuido ese papel a una fracción de la ß-caseína A1, la caseomorfina ß-7. Se ha encontrado una relación directa entre el consumo diario per cápita de ß-caseína A1 y la incidencia anual de diabetes tipo 1 en la mayoría de países occidentales. La caseomorfina ß-7 es un péptido con actividad opioide con afinidad por los receptores opiáceos mu- y delta-. La betacaseína estimularía la respuesta inmune mediada por células T o una respuesta mediada por anticuerpos. En la primera de las situaciones la caseomorfina ß-7 contribuiría a la alteración del desarrollo de la tolerancia inmune intestinal en individuos de riesgo, mientras que en la segunda se produciría una autodestrucción de las células beta pancreáticas.
La revisión de los estudios publicados hasta 2005 no permitió establecer ninguna relación directa entre el consumo de leche y la aparición de DM1(20). La publicación de los resultados del estudio TRIGR en el que se administraba un hidrolizado de caseína a lactantes con riesgo de desarrollar diabetes –y que no pudieran recibir leche materna– en vez de la fórmula infantil habitual ha vuelto a reabrir el debate. En este estudio se encontraron niveles más elevados de autoanticuerpos frente a insulina o pancreáticos en el grupo que recibía una fórmula estándar, aunque la incidencia de nuevos casos de DM1 fue similar(21). La lactancia materna tiene un efecto protector(22). La Academia Americana de Pediatría recomienda encarecidamente la lactancia materna en familias con elevado riesgo de desarrollo de DM1 y evitar la introducción de leche de vaca o productos que los contengan en los primeros años de vida. No hay recomendaciones específicas sobre las fórmulas infantiles.
Trastornos del espectro autista (TEA)
Los trastornos del espectro autista constituyen un grupo heterogéneo de alteraciones del neurodesarrollo con un amplio grado de manifestaciones clínicas. En un número elevado de pacientes existen además síntomas digestivos. Una de las teorías etiopatogénicas sería un exceso de exomorfinas procedentes de la dieta. Se han encontrado niveles aumentados de péptidos en la orina y en el líquido cefalorraquídeo de personas con autismo. El gluten de los cereales y la caseína de la leche serían fuentes importantes de péptidos con actividad opioide(23).
La terapia conductual y algunos fármacos pueden ser de utilidad, al menos de forma parcial, en el tratamiento de estos trastornos. No existe, sin embargo, un tratamiento eficaz por lo que muchas familias recurren al uso de terapias complementarias y alternativas(24). Los aditivos alimentarios, los azúcares refinados, las alergias alimentarias o un metabolismo alterado de los ácidos grasos han sido objeto de particular atención. También el empleo de dietas restrictivas, fundamentalmente las que excluyen el gluten y la caseína. En el año 2004 se publicó una revisión Cochrane en el que sólo pudo encontrarse un único trabajo metodológicamente correcto y en que parecía encontrarse una disminución en los rasgos autistas y se animaba a la realización de nuevos trabajos de calidad(25). Una nueva revisión en 2008 sólo pudo recoger dos ensayos clínicos aleatorizados, concluyendo que los datos disponibles hasta ese momento eran escasos para poder establecer la eficacia del tratamiento. Un panel multidisciplinar dentro de la Academia Americana de Pediatría sólo pudo concluir que era necesario profundizar más en el conocimiento de los problemas gastrointestinales presentes en estos pacientes antes de definir las mejores estrategias de tratamiento dietético(26).
El resumen de los escasos estudios publicados parece apuntar a que quizá exista grupo de pacientes, en especial en aquellos con sintomatología digestiva, o con clínica de alergia alimentaria, que podrían beneficiarse de una dieta sin gluten y sin caseína, aunque no ha sido posible demostrar un efecto mantenido(27). No existe ningún dato que permita asociar el consumo de leche o lácteos con riesgo de desarrollar un trastorno del espectro autista.
Síndrome metabólico y enfermedad cardiovascular
Elegantes estudios publicados hace más de una década demostraron que había una relación lineal entre el consumo de leche y los niveles séricos de IGF-1 que justificaban el mensaje de que “la leche era buena para el crecimiento”. Por este motivo siempre se ha asociado el consumo de leche a un mejor estado nutricional en niños. Todavía en los programas de rehabilitación nutricional en países en pobreza, el empleo de leche constituye una de las herramientas primordiales.
Estudios más recientes en lactantes han confirmado que la ingesta de una cantidad mayor de proteínas en los primeros seis meses de vida se asociaba a un aumento en IGF-1 y en el cociente péptido C: creatinina en orina. La advertencia surge cuando se aprecia un aumento de la adiposidad infantil y un adelanto en la edad del rebote adiposo asociado a un mayor consumo proteico en los primeros años de vida. Este efecto no es exclusivo de las proteínas de la leche.
La leche tendría ese doble papel, promotor del crecimiento pero, al mismo tiempo, fuente importante de proteínas y con posibilidad de influir, por tanto, en la expresión de enfermedades no transmisibles, en función de la base genética.
La cuestión se complica cuando consideramos el efecto sobre la presión arterial. En una revisión sistemática reciente con metanálisis, que incluyó 45.000 individuos, el consumo de lácteos en población adulta y su relación con la hipertensión arterial mostró un riesgo relativo de 0,87 para aquellos individuos que consumían habitualmente leche y derivados (Intervalo de confianza 95% 0,81-0,94), todavía más significativo cuando se trataba de lácteos semidesnatados (RR de 0,84 IC 95% 0,74-0,95)(28).
Es más, cada vez es mayor la tendencia a considerar el posible papel de algunos péptidos bioactivos presentes en la leche en la prevención y el tratamiento del síndrome metabólico y sus complicaciones. Las investigaciones más recientes apuntan a que la exposición a la leche en edades tempranas tenga unos efectos a corto plazo (aumento de IGF-1) distintos a los que ocurren en al edad adulta, vía programación del control hipofisario en respuesta a niveles elevados de IGF-1, con implicaciones muy interesantes en el riesgo de desarrollar cáncer o sufrir enfermedad coronaria en la edad adulta(29,30).
Leche y cáncer
La leche y los derivados lácteos contienen micronutrientes y constituyentes bioactivos que pueden influir en el riesgo y en la progresión del cáncer. En los últimos daños se han publicado numerosos estudios epidemiológicos en las que se compara el consumo de lácteos o de calcio y el riesgo de padecer determinados tipos de cáncer o, por el contrario, mostrando un efecto protector. Los análisis sistemáticos y meta-análisis han concluido que el consumo de tres raciones diarias de leche y derivados no aumenta el riesgo de cáncer, aunque se apunta a que son preferibles los productos de menor contenido graso o fermentados.
El Word Cancer Research Fund y el American Institute for Cancer Research concluyeron en 2007 que existía una asociación entre la ingesta de leche y un riesgo disminuido de cáncer colorrectal, una probable asociación entre dietas ricas en calcio y mayor riesgo de cáncer de próstata y una evidencia limitada de asociación entre ingesta de lácteos y menor riesgo de cáncer de vejiga(31). Con posterioridad se han publicado nuevas revisiones que confirman esa asociación para el cáncer colorrectal: el consumo de 400 g/día de productos lácteos tiene un RR de 0,83 (IC 95 0,78-0,88) y de 0,91 (IC 95% 0,85-0,94) si el consumo es de 200 g/día. Datos similares se han obtenido para el caso del cáncer de mama, con la salvedad de que los hallazgos positivos se encontraron para el grupo de derivados lácteos, pero no para la leche.
En general las recomendaciones dietéticas para la prevención del cáncer animan a conseguir una cantidad de calcio suficiente, preferiblemente a través del consumo de productos lácteos, especialmente de menor contenido en grasa.
Acné
El acné es el problema dermatológico más frecuente en los países occidentales, especialmente entre los adolescentes. Tradicionalmente se había relacionado su aparición, entre otros factores, al consumo de determinados alimentos (chocolate y comidas grasas), aunque se disponía de pocos datos científicos que lo avalasen. Es cierto que existen condicionantes genéticos que favorecen su aparición, pero estudios más recientes vuelven a señalar el papel de la dieta en su aparición. En concreto, tres estudios amplios muestran la asociación entre el consumo de lácteos y la aparición de acné, con independencia de que se tratara de lácteos descremados o no(32).
Condiciones clínicas donde no existen datos claros sobre el papel patogénico de la leche
Aumento en la producción de mucosidad
De todas las consideraciones que más han calado en el gran público probablemente sea ésta la más extendida. Pero, ¿cuál es el origen de esta idea? En la Medicina clásica Maimónides desaconsejaba el consumo de leche en aquellas personas con asma. Esa misma recomendación recoge la medicina tradicional china. Son, sin embargo, algunos libros de divulgación (por ejemplo, el clásico Dr. Spock’s baby and Child Care), o páginas web las que más han contribuido a la difusión de esta idea. En una encuesta realizada entre los padres que acudían a una consulta de Neumología Pediátrica en Estados Unidos, de 330 participantes, 193 (58%) creían que la leche causaba mayor producción de mocos. Dicha información la obtenían de otros miembros de la familia (30%), de pediatras (10%) y de otros médicos (19%)(33).
Arney y Pinnock realizaron un elegante experimento en el que se sometió a un grupo de sujetos “creyentes en que la leche produce moco” y a un grupo control a la ingesta de 300 ml de leche o de una bebida de soja que actuaba como placebo, encontrando una mayor proporción de síntomas en el grupo de los “creyentes”, independientemente de la bebida a la que fueran expuestos(34). Se especula sobre el papel de la beta-caseomorfina 7 en la aparición de moco(35). No existen datos científicos que relacionen directamente el consumo de leche y la aparición de mucosidad o de asma(36,37).
Curiosamente, sin embargo, existen estudios experimentales que demuestran que la alfa-lactoalbúmina bovina estimula la producción de moco en la mucosa gástrica, lo que explicaría su efecto gastroprotector. Lo mismo ocurre con la betacaseomorfina sobre las células del colon (glándulas MUC5AC). Sería necesario demostrar paso de esta fracción de la leche al torrente circulatorio para que llegara al tejido donde están presentes las glándulas mucosas y producir su inflamación.
Leche de vaca y asma
Existen muy pocos datos que correlacionen el consumo de la leche y la aparición o agravamiento del asma(38,39). En los últimos años se han realizado varios estudios clínicos controlados analizando diversos parámetros de función respiratoria tras el consumo de determinada cantidad de leche, no pudiendo demostrar, en la mayoría de ellos, ninguna relación entre el consumo de leche y la exacerbación de síntomas de asma, ni tampoco en un aumento en su prevalencia. En un estudio no controlado realizado en un grupo de 13 niños en Malasia, el seguimiento de una dieta de exclusión de leche y huevo durante 8 semanas se tradujo en un Pico Expiratorio Forzado (PEF) mejor(40).
Beneficios para la salud del consumo de leche y derivados
Existen suficientes datos en la literatura que muestran que el consumo de una cantidad suficiente de productos lácteos reduce el riesgo de osteoporosis al aumentar la adquisición de masa ósea durante el crecimiento, disminuyendo la pérdida ósea con la edad y reduciendo las fracturas osteoporósicas. Además, un consumo adecuado de lácteos parece tener un efecto protector frente al desarrollo de hipertensión arterial.
En algunos países hay larga tradición de modificaciones en la composición de la leche de vaca en busca de beneficios para la salud. Más allá de la disminución o eliminación de la grasa de la leche, esas modificaciones se realizan sobre todo en el cuerpo graso (aumento del aporte de omega-3, aumento en la proporción de ácido oleico en detrimento del palmítico, enriquecimiento con 9c, 11t- ácido linoleico conjugado, disminución de ácido vaccénico) o en aporte de oligoelementos y vitaminas (aumentar el contenido en yodo o en selenio); o incluso adicionando otros nutrientes (fibra, probióticos). Además, se especula sobre los efectos de determinados péptidos presentes en la proteína de suero lácteo que pudieran actuar mejorando la función barrera intestinal(41), y posiblemente con un efecto anti-inflamatorio, aunque faltan estudios que corroboren este último aspecto(42).
Recomendaciones de consumo de leche en niño
El consumo de 0,4-0,5 litros de leche al día proporciona una cantidad importante de los nutrientes requeridos diariamente. Es fuente de aminoácidos esenciales y contiene algunas proteínas y péptidos con propiedades bioactivas. Sin duda, es una fuente excelente de calcio.
El Comité de Nutrición de ESPGHAN y el Comité de Nutrición de la AEP recomiendan que se consuma leche entera por debajo de los 2 ó 3 años de edad. Recomendaciones similares apunta el Grupo de trabajo AEPap/PAPPS semFYC en la guía PrevInfad (2-4 porciones de lácteos al día, de bajo contenido en grasa si se asocian factores de riesgo cardiovascular u obesidad) o en las de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica de 2010 (500-1.000 ml/día).
Conclusiones
Es cierto que existe una preocupación general en relación con las enfermedades crónicas y su relación con los hábitos de vida actuales, fundamentalmente la alimentación y la actividad física. La obesidad, la enfermedad cardiovascular, la osteoporosis… ocupan los primeros lugares en los índices de preocupación de la población. En las últimas décadas, aunque hemos conocido el papel que la dieta ejerce en su aparición, también sabemos que influyen otros factores ambientales junto con una susceptibilidad genética.
La leche de vaca ha formado parte de la alimentación en gran parte de Europa en los últimos 10.000 años y, en su momento, la tolerancia a la leche constituyó una ventaja adaptativa. En los últimos 20 años y con carácter creciente han surgido algunas voces discrepantes, también dentro de la comunidad científica. Sin embargo, la repercusión de estas discrepancias es muy superior a lo que podía esperarse de la mera discusión científica. La población debe recibir mensajes claros respecto a los hábitos saludables y a las recomendaciones dietéticas. A la luz de los datos científicos disponibles debemos continuar recomendando que nuestros niños y jóvenes consuman leche y derivados lácteos diariamente en cantidades adecuadas. Hay líneas de trabajo muy interesantes sobre el papel de algunos componentes de la leche, en especial los péptidos bioactivos, y sus repercusiones sobre la salud(43). También en las formas y métodos de procesamiento de los derivados lácteos para el consumo humano.
Bibliografía
1. Weinberg LG, Berner LA, Groves JE. Nutrient contributions of dairy foods in the United States. Continuing Survey of food intakes by individuals, 1994-1996, 1998. J Am Diet Assoc. 2004; 104: 895-902.
2. Rizzoli R. Nutrition: its role in bone health. Best Pract Res Clin Endocrinol Metab. 2008; 22: 813-29.
3. Weinsier RL, Krumdieck CL. Dairy foods and bone health: examination of the evidence. Am J Clin Nutr. 2000; 72: 681-9.
4. Lloyd T, Chinchilli VM, Johnson-Rollings N, Kieselhorst K, Eggli DF, Marcus R. Adult female hip bone density reflects teenage sports. Exercise patterns but not teenage calcium intake. Pediatrics. 2000; 106: 40-4.
5. Rodríguez Rodríguez E, Navia Lombán B, López Sobaler AM, Ortega Anta RM. Review and future perspectives on recommneded calicum intake. Nutr Hosp. 2010; 25: 366-74.
6. Perrine CG, Sullivan KM, Flores R, Caldwell KL, Grummer-Strawn LM. Intakes of dairy products and dietary supplements are positively associated with iodine status among US children. J Nutr. 2013 (en prensa).
7. Martínez Suárez V, Moreno Villares JM, Dalmau Serra J, Comité de Nutrición de la Asociación Española de Pediatría. Recomendaciones de ingesta de calcio y vitamina D: posicionamiento del Comité de Nutrición de la Asociación Española de Pediatría. An Pediatr (Barc). 2012; 77: 57.e1-e8.
8. Nicklas TA, O’Neill CE, Fulgoni VL. The role of Dairy in meeting the recommendations for shortdfall nutrients in the American Diet. J Am Coll Nutr. 2009; 28: 73S-81S.
9. Agostoni C, Turck D. Is cow’s milk harmful to a child’s health? J Pediatr Gastroenterol Nutr. 2011; 53: 594-600.
10. Agostoni C, Braegger C, Desci T, et al. ESPGHAN Committee on Nutrition. Breast-feeding a commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2009; 49: 112-25.
11. Ziegler EE. Consumption of cow’s milk as a cause of iron deficiency in infants and toddlers. Nutr Rev. 2011; 69(suppl 1): S37-42.
12. Kazal L. Prvention of iron deficiency in infants and toddlers. Am Fam Physician. 2002; 66: 1217-27.
13. Agostoni C, Desci T, Fewtressl M, et al. Complementary feeding: a commnetary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2008; 46: 99-110.
14. Bondi SA, Lieuw K. Excessive cow’s milk consumption and iron deficiency in toddlers. Two unsual presentations and review. ICAN. 2009; 1: 133-9.
15. Kvenshagen B, Halvorsen R, Jacobsen M. Adverse reactions to milk in infants. Acta Paediatr. 2008; 97: 196-200.
16. Ingram CJE, Mulcare CA, Thomas MG, Swallow DM. Lactose digestion and evolutionary genetics of lactose persistence. Hum Genet. 2009; 124: 579-91.
17. Wilt TJ, Shaukat A, Shamliyan T, Taylor BC, MacDonald R, Tacklind J, Rutks I, et al. Lactose intolerance and health. Evid Rep Technol Assess (Full Rep). 2010; (192): 1-410.
18. Lomer MC, Parkes GC, Sanderson JD. Review article: lactose intolerance in clinical practice–myths and realities. Aliment Pharmacol Ther. 2008; 27(2): 93-103.
19. Irastorza I, Ibañez B, Delgado-Sanzonetti L, Maruri N, Vitoria JC. Cow’s-milk-free diet as a therapeutic option in childhood chronic constipation. J Pediatr Gastroenterol Nutr. 2010; 51: 171-6.
20. Clemens RA. Milk A1 and A2 peptides and diabetes. Nestle Nutr Workshop Ser Pediatr Program. 2011; 67:187-95.
21. TRIGR Study Group, Akerblom HK, Krischer J, Virtanen SM, Berseth C, Becker D, Dupré J, et al. The Trial to Reduce IDDM in the Genetically at Risk (TRIGR) study: recruitment, intervention and follow-up. Diabetologia. 2011; 54(3): 627-33. doi: 10.1007/s00125-010-1964-9. Epub 2010 Dec 12.
22. Patelarou E. Current evidence on the associations of breastfeeding, infant formula, and cow’s milk introduction with type 1 diabetes mellitus: a systematic review. Nutr Rev. 2012; 70(9): 509-19.
23. Reichelt KL, Hole K, Hamberger A, et al. Biologically active peptide-containing fractions in schizophrenia and childhood autism. Adv Biochem Psychopharmacol. 1981; 28: 627-43.
24. Tchaconas A, Adesman A. Autism spectrum disorders: a pediatric overview and update.Curr Opin Pediatr. 2013; 25(1): 130-44.
25. Millward C, Ferriter M, Calver S, Connell-Jones G. Gluten- and casein-free diets for autistic spectrum disorder. Cochrane Database Syst Re.v 2004; 2: CD003498.
26. Buie T, Campbell DB, Fuchs GJ, et al. Evaluation, diagnosis, and treatment of gastrointestinal disorders in individuals with ASDs: a consensus report. Pediatrics. 2010; 125(sup 1): 1-18.
27. Rennesi CM, Klein LC. Effectivenesss of the gluten-free, casein-free diet for children diagnosed with autism spectrum disorder based on parental report. Nutr Neurosci. 2012; 13: 85-91.
28. Ralston RA, Lee JH, Truby H, Palermo CE, Walker KZ. A systematic review and meta-analysis of elevated blood pressure and consumption of dairy foods. J Hum Hypertens. 2012; 26(1): 3-13.
29. Phelan M, Kerins D. The potential role of milk-derived peptides in cardiovascular disease. Food Funct. 2011; 2(3-4): 153-67.
30. Rice BH, Quann EE, Miller GD. Meeting and exceeding dairy recommendations: effects of dairy consumption on nutrient intakes and risk of chronic disease. Nutr Rev. 2013; 71: 209-23.
31. Chagas CE, Rogero MM, Martini LA. Evaluating the links between intake of milk/diary products and cancer. Nutr Rev. 2012; 70: 294-300.
32. Spencer EH, Ferdowsian HR, Barnard ND. Diet and acne: a review of the evidence. Int J Dermatol. 2009; 48: 339-47.
33. Lee C, Dozor J. Do you believe milk makes mucus? Arch Pediatr Adolesc Med. 2004; 158: 601-3.
34. Arney WK, Pinnock CB. The milk mucus belief: sensory analysis comparing cow’s milk and a soy placebo. Appetite. 1993; 20: 61-70.
35. Bartley J, McGlashan SR. Does milk increase mucus production? Med Hypotheses. 2010; 74: 732-4.
36. Thiara G, Goldman RD. Milk consumption and mucus production in children with asthma. Can Fam Phys. 2012; 58: 165-6.
37. Pinnock CB, Graham NM, Mylvaganam A, Douglas RM. Relationship between mil intake and mucus production in adult volunteers challenged with rhinovirus-2. Am Rev Respir Dis. 1990; 141: 352-6.
38. Wüthrich B, Schmid A, Walther B, Sieber R. Milk consumption does not lead to mucus production or occurrence of asthma. J Am Coll Nutr. 2005; 24: 547S-55S.
39. Orozco López P. ¿Los lácteos aumentan los mocos? AMF. 2010; 6: 42-3.
40. Yusoff NA, Hampton SM, Dickerson JW, Morgan JB. The effects of exclusion of dietary egg and milk in the management of asthmatic children: a pilot study. J R Soc Promot Health. 2004; 124: 74-80.
41. Kotler BM, Kerstetter JE, Insogna KL. Claudins, dietary milk proteins, and intestinal barrier regulation. Nutr Rev. 2013; 71: 60-5.
42. Labonté ME, Coutute P, Richard C, Desroches S, Lamarche B. Impact of dairy products on biomarkers of inflammation: a systematic review of randomized controlled nutritional intervention studies in overweight and obese adults. Am J Clin Nutr. 2013; 97: 706-17.
43. Huth PJ, DiRienzo DB, Millar GD. Major scientific advances with dairy foods in nutrition and health. J Dairy Sci. 2006; 89: 1207-21.
 |
| Crítica de libros |
Carlos Marina
Pediatra y Médico Puericultor del Estado

M. Cruz – Manual de Pediatría
J. Brines, A. Carrascosa, M. Crespo, R. Jiménez, J.A. Molina
3ª edición. Madrid: Ergon; 2013
En momentos de plena crisis económica mundial, con importante repercusión en el medio editorial, tiene lugar la aparición de un libro importante: “M. Cruz. Manual de Pediatría”, extraordinariamente bien presentado por la editorial Ergon, bajo la dirección de un Maestro de la Pediatría –el Prof. Manuel Cruz–, con la inestimable colaboración de cinco Catedráticos de Pediatría –como editores–, casi 300 expertos autores colaboradores y un contenido del máximo interés para todos los implicados en el cuidado de la salud del ser humano durante la edad pediátrica.
Se pone a disposición del Pediatra la 3ª edición de este “M. Cruz. Manual de Pediatría” (2013), versión compacta de la 10ª edición del Tratado de Pediatría (2011) del Prof. M. Cruz. En formato reducido en tamaño y en número de páginas, se resume, de forma clara y concisa, el impresionante texto de los dos tomos –más de 2.500 páginas– integrantes de esta última edición del Tratado. Los casi 300 autores colaboradores, bajo la dirección del propio Prof. Cruz y los cinco editores, Catedráticos de Pediatría, extractan hábilmente el texto elaborado para el Tratado, dando lugar a un volumen concentrado, fácilmente manejable, con contenido riguroso y didáctico, magistralmente expuesto, para agilizar y abreviar el trabajo intelectual del estudioso de la edad pediátrica.
¿Cuál va a ser el futuro del “M. Cruz. Manual de Pediatría”? Ocurre que desde la próxima edición del Tratado –la 11ª– la responsabilidad editorial, por gentil decisión del Prof. Cruz, ha pasado a manos de la Junta Directiva de la Asociación Española de Pediatría (AEP). Muy alto deja el listón el Prof. Cruz. A partir de ahora, la designación de editores, autores y elaboración del nuevo contenido, queda bajo la decisión de la AEP. Desde estas líneas deseamos toda clase de aciertos a los nuevos responsables.
Es muy posible, pues, que la hasta ahora íntima subordinación del Manual de Pediatría al Tratado de Pediatría no vuelva a ocurrir. Animamos a los directores y autores del “M. Cruz. Manual de Pediatría” a no cejar en su empeño, en esta nueva situación, de continuar ofreciendo a los pediatras el mejor extracto compacto de la más actual Pediatría, ya como publicación autónoma.
Los autores-colaboradores, así como los miles de lectores de estos textos, fruto del permanente magisterio de D. Manuel Cruz, a la cabeza de las publicaciones pediátricas formativas en lengua española, con inigualable prestigio a ambos lados del Atlántico, desean manifestar su orgullo, satisfacción y agradecimiento por haber podido disfrutar durante tantos años de la inestimable labor docente –que no consideramos conclusa– del Prof. Cruz, a través de su incansable y siempre brillante tarea como Director y “alma” de tan prestigiosos libros y publicaciones.
 |
| El Rincón del Residente |
I.M. Cabrera López, J. Gaitero Tristán, V. Sanz Santiago, A. López Neyra
Hospital Universitario Niño Jesús. Madrid
El Rincón del Residente es una apuesta arriesgada de Pediatría Integral. No hemos querido hacer una sección por residentes para residentes. Yendo más allá, hemos querido hacer una sección por residentes para todo aquel que pueda estar interesado. Tiene la intención de ser un espacio para publicaciones hechas por residentes sobre casos clínicos, imágenes y revisión bibliográfica. ¡Envíanos tu caso! Normas de publicación en www.sepeap.org Se presenta el caso de una niña de 15 años con episodios de dificultad respiratoria de comienzo brusco durante el esfuerzo. Se plantean al lector una serie de preguntas para el diagnóstico y manejo del caso. |
Pediatr Integral 2013; XVII(5): 368-370
Historia actual
Mujer de 15 años y 9 meses de edad que es valorada en la consulta de Neumología por presentar episodios de comienzo brusco de dificultad respiratoria intensa durante el esfuerzo, fundamentalmente con carrera libre. Nota que “se le cierra la garganta” y tiene dificultad en la inspiración, cediendo en unos minutos tras parar el ejercicio. Estos episodios no se acompañan de tos pero sí de un ruido inspiratorio. Tras estos episodios de disnea, mantiene una voz un poco disfónica durante una hora aproximadamente.
Estos episodios no le ocurren en todas las ocasiones que practica ejercicio.
Es una niña deportista y muy perfeccionista. Actualmente refiere tener problemas familiares.
Antecedentes personales: embarazo gemelar de curso normal. Parto eutócico a las 36 semanas de edad gestacional. Peso al nacimiento de 2.200 gramos. Periodo neonatal normal. Vacunas según el calendario vigente. Antecedentes de catarros de repetición durante los primeros 5 años. No antecedentes de atopia.
No refieren antecedentes familiares de interés.
Exploración física
Peso: 51,8 kg (p44). Talla: 164 cm (p77). IMC: 20 kg/m2. Saturación de O2 basal: 98%. FC: 87 lpm.
Buen estado general. Coloración normal de piel y mucosas. No lesiones en piel. Auscultación cardiopulmonar normal. Abdomen blando y depresible, no doloroso a la palpación. No masas ni megalias. ORL normal. Neurológico normal.
Figura 1. Espirometría basal (curva 1) normal. Tras prueba de esfuerzo sobre tapiz rodante (curvas 2 y 3), marcado aplanamiento de asas inspiratoria y espiratoria. Normalización posterior (curva 4).

Figura 2. Fibrolaringoscopia: imagen en inspiración con estridor audible tras realización de ejercicio.
 |
| Temas de FC |
J.M. Ademà Alcover, E. Esteller Moré, E. Matiñó Soler, R. López Diu, G. Pedemonte Sarrias, J.C. Villatoro Sologaistoa
Servicio de Otorrinolaringología. Hospital General de Catalunya. Sant Cugat de Vallés, Barcelona
| Resumen
Sin duda nos encontramos frente a uno de los síntomas más frecuentes de la infancia. Debida a sus múltiples causas, morfológicas o funcionales, propias de la vía aérea o expresión local de diferentes enfermedades, su diagnóstico es a veces sencillo y, a veces, muy complejo. |
| Abstract
Without a doubt we are faced with one of the most frequent infantile syndromes to date. Due to its multiple morphological or functional causes that come from the upper airways or local expression from different diseases, its diagnosis is not always easy. |
Palabras clave: Obstrucción; Hipertrofia adenoamigdalar; Apnea nocturna; Tumores.
Key words: Obstruction; Tonsillar hypertrofya; Sleep apnea; Tumors.
Pediatr Integral 2013; XVII(5): 319-329
Introducción
Se hará referencia primero al primer y tercer tramos (fosas nasales y laringe), dejando el segundo (rinofaringe y orofaringe) para el final del artículo, debido a que, en la práctica diaria, es en el que se concentran el mayor porcentaje de las obstrucciones crónicas. También, se justifica por el hecho de que la hipertrofia amigdalar sea la responsable de la apnea obstructiva del sueño a la que, por su incidencia en el momento actual, se dedica una atención especial.
Fosas nasales
El primer tramo de la vía aérea superior lo comprenden las fosas nasales.
Su obstrucción, no por su frecuencia, deja de ser importante, ya que no tan sólo se encarga de hacer llegar el aire a los pulmones en unas condiciones óptimas de temperatura, humedad y pureza, sino que su alteración en épocas de tan intenso crecimiento puede modificar el desarrollo del macizo facial anterior.
Salvo en pocas ocasiones, los síntomas que acompañan a la obstrucción no nos ayudan al diagnóstico etiológico. La clave del diagnóstico diferencial la tiene la historia clínica. Deberemos tener en cuenta la edad del paciente, el tiempo de evolución del proceso, su posible estacionalidad, si es uni o bilateral, si existen antecedentes traumáticos o quirúrgicos, la exposición a irritantes o tóxicos ambientales, la acción de medicamentos y, en lactantes, el tratamiento al que pueda estar sometida la madre. Se considera actualmente que un niño de cinco años es capaz de describir perfectamente sus síntomas. Sus explicaciones, junto a las observaciones de padres, maestros y cuidadores, y una exploración adecuada, conseguirán un elevado porcentaje de diagnósticos correctos.
Etiología
Las causas de obstrucción crónica de las fosas nasales son numerosas. Fundamentalmente, se pueden dividir en cuatro grupos: congénitas, inflamatorias, traumáticas y tumorales.
Congénitas
1. Atresia de coanas. Es la anomalía congénita nasal más frecuente. Consiste en la impermeabilidad posterior de una o de las dos fosas nasales. La bilateral puede ser causa de urgencia vital neonatal; sin embargo, algunas unilaterales pueden pasar desapercibidas hasta la adolescencia. El hecho de no poder pasar una sonda más de 35 mm por las fosas nasales, debe hacernos sospechar su existencia. Se clasifican en óseas (29%) y osteomembranosas (71%). La TC es la exploración radiológica obligada para establecer el diagnóstico, valorar las características de la atresia y elegir la técnica quirúrgica más adecuada. Dependiendo de si es uni o bilateral, ósea u osteocartilaginosa, el tratamiento será urgente o diferido y más o menos agresivo. Desde abordajes transnasales y transantrales a abordajes transpalatinos(1,2).
2. Paladar hendido, asociado o no a fisura palatina y a labio leporino. Provoca diferentes grados de obstrucción y de dificultad de alimentación. Las podemos dividir en completas o incompletas y unilaterales o bilaterales. Las secuelas tendrán una magnitud variable, la que menos tiene es la hendidura incompleta. El tratamiento es siempre quirúrgico y laborioso(1,2).
3. Meningoceles y meningoencefaloceles. Son herniaciones extracraneales de meninges y de tejido cerebral. Dependiendo de su localización y tamaño, producen diferentes grados de obstrucción; debido a esto, algunos no son diagnosticados más que por la casualidad en edad adulta. Se hallan cubiertos por mucosa nasal, son elásticos y pulsátiles y suelen aumentar con las maniobras de Valsalva. Si bien la TC nos puede mostrar significativos defectos en la base del cráneo, la prueba diagnóstica de elección es la RM. Jamás debemos practicar una biopsia sin haber realizado antes esta prueba, ya que, hasta que no se demuestre lo contrario, una masa endonasal en la primera infancia es un meningocele. El tratamiento es quirúrgico, bien desde la nariz mediante cirugía endoscópica nasosinusal, o bien mediante complejos abordajes neuroquirúrgicos(1-3).
4. Gliomas. Son masas de tejido glial en una localización heterotópica extradural. No se trata de un tumor, simplemente se trata de tejido cerebral aislado al cerrarse el foramen caecum. Su localización intranasal (30%) produce obstrucción respiratoria, tanto si su localización es anterior como posterior. Un 50% conservan una comunicación con la duramadre. Se puede confundir con un pólipo y su diagnóstico diferencial se establece con los meningoencefaloceles. A diferencia de estos, es fijo, no es pulsátil y no se modifica con las maniobras de Valsalva. Su tratamiento es quirúrgico y exige, en ocasiones, abordajes intracraneales(1,2).
5. Quistes del dorso nasal. Son de especial importancia, ya que, por su localización, interfieren en el desarrollo de huesos y cartílagos nasales. Son, en general, visibles desde el nacimiento y se abren al exterior en la unión osteocartilaginosa del dorso. Son fácilmente diagnosticables si aparece supuración o pelos. Su exéresis completa es el único tratamiento curativo(1-3).
Inflamatorias
1. Alergia: es una causa frecuente de obstrucción nasal en el niño. Sus síntomas facilitan el diagnóstico etiológico de la obstrucción, sobre todo si es estacional. Aproximadamente, un 20% de los niños de 2 a 3 años pueden tener síntomas de rinitis alérgica, hasta un 40% a los 6 años y un 30% pueden verse afectados durante la adolescencia. Su aumento de incidencia se atribuye a diferentes causas: mayor número de animales en las casas, aditivos y colorantes alimentarios, polución ambiental, tabaco y alcohol durante el embarazo, contacto en guarderías con diferentes virus respiratorios, etc. La clínica característica de rinitis alérgica no se manifiesta plenamente hasta los cuatro o cinco años y se va incrementando hasta la adolescencia. El diagnóstico se basa en test in vivo, como son las pruebas cutáneas (PRICK) y el test de provocación nasal, y test in vitro, como la detección de IgE específica (RAST). El tratamiento tendrá tres vertientes: sintomatológico (antihistamínicos, corticoides tópicos, etc.), de evitación del alergeno y etiopatogénico, mediante la inmunoterapia(2,4).
2. Rinosinusitis: la cavidad nasal y los senos paranasales constituyen en el niño una cavidad anatómica en evolución, con una estrecha dependencia, tanto en el plano fisiológico como patológico. Se acepta como rinosinusitis crónica, aquella infección sinusal de síntomas leves cuya evolución se prolonga más de cuatro semanas. A pesar de que se ha considerado durante años que el origen era infeccioso, es muy probable que el origen sea un edema de la mucosa nasal y sinusal que provoque una alteración de la ventilación, del movimiento ciliar y un enlentecimiento del transporte del moco, circunstancias que favorecerán la colonización de los senos por las cepas más frecuentes del aparato respiratorio (Streptococcus pneumoniae, Haemophilus influenzae y Moxarella catharralis, entre otras) (Fig. 1). Cualquier proceso que provoque una alteración del complejo osteomeatal (infecciones virales, alergia, irritantes, etc.) provoca una alteración de la ventilación y del drenaje de los senos que, a su vez, provoca una disminución de la presión parcial de oxígeno, una disminución de la presión dentro del seno y, como consecuencia, un enlentecimiento del transporte mucociliar y una alteración del pH, circunstancias que favorecen la proliferación de la flora. Una de las causas que pueden provocar este proceso es el reflujo gastroesofágico. De difícil diagnóstico en el niño, debe descartarse cuando nos encontremos frente a una rinosinusitis crónica o recurrente, rebelde al tratamiento(2,4-6).

Figura 1. Imagen endoscópica de una rinosinusitis purulenta.
Todas las enfermedades sistémicas que alteran la viscosidad del moco o la movilidad ciliar provocando un estasis del moco, pueden ser causa de afecciones sinusales recurrentes.
3. Poliposis nasosinusal: los pólipos son la tumoración benigna más frecuente de las fosas nasales (Fig. 2). Son neoformaciones de carácter inflamatorio que, en general, se originan en el etmoides. Pueden ser unilaterales o bilaterales. El pólipo unilateral más frecuente es el antrocoanal de Killian (Fig. 3).

Figura 2. Imagen endoscópica de una poliposis nasal (pólipo que ocupa el meato medio).

Figura 3. Imagen endoscópica de un pólipo antrocoanal de Killian a su salida del seno maxilar.
Pueden presentarse de forma aislada o asociados a asma bronquial, teniendo algunas de estas asociaciones connotaciones características, como la enfermedad de Widal o tríada ASA, en la que, además, hay una intolerancia a la aspirina.
Producen diferentes grados de obstrucción dependiendo de su tamaño y, en algunos casos, tienen tanta fuerza que, en edades tempranas, pueden deformar la pirámide nasal en su crecimiento. Es el caso de la poliposis nasosinusal infantil deformante o enfermedad de Woakes.
Las poliposis que afectan a las fosas nasales de forma bilateral pueden ser de causa alérgica o no (la mayoría), y pueden ser la expresión local de enfermedades sistémicas más graves, como la fibrosis quística(2,4).
Traumáticas
1. Los traumatismos nasales son la principal causa de desviaciones septales, sin embargo, en un gran número se deben a partos laboriosos. En la mayoría de los casos, se afecta el septum cartilaginoso, pero también se pueden fracturar los huesos propios de la nariz. Deben ser valorados con precisión y actuar en consecuencia; ya que, independientemente de la obstrucción que provoquen, pueden, en su crecimiento, alterar la morfología de la pirámide nasal.
La exploración nos ha de permitir valorar con exactitud el tipo de lesiones; ya que, de ello dependerá el tipo de tratamiento, que puede ir, desde mantener una actitud expectante, hasta realizar una cirugía de mayor o menor complejidad. Si bien, hoy en día, la cirugía septal o septopiramidal se acepta como un acto que se debe realizar para prevenir futuras complicaciones, debe ser extremadamente limitada para no alterar los centros de crecimiento(1).
2. Cuerpos extraños. A pesar de que una obstrucción nasal unilateral, sobre todo si se acompaña de rinorrea mucopurulenta y más aún si es maloliente, debe hacernos pensar inmediatamente en un cuerpo extraño, algunos de ellos son diagnosticados meses después de la obstrucción y múltiples tratamientos médicos(2).
Tumorales
1. Tumores benignos: en la infancia, la mayoría son de origen vascular.
– Hemangiomas cavernosos de septum o cornetes. Por su localización pueden provocar obstrucción; por ello, deben ser extirpados quirúrgicamente.
2. Tumores malignos: son tumores raros y, al no pensar en ellos debido a la poca especificidad de su sintomatología en estados iniciales, pueden pasar desapercibidos perdiéndose posibilidades de curación.
– El sarcoma más frecuente en la infancia es el rabdomiosarcoma.
Su tratamiento varía dependiendo de su tamaño y delimitación. Si son pequeños y bien delimitados, los extirparemos completamente con márgenes de seguridad e irradiaremos. En los grandes tumores, la única actuación quirúrgica será para hacer una biopsia. Se tratarán con quimioterapia y radioterapia asociada(2,7).
– Neuroblastoma olfatorio. Son tumores que se originan en la membrana olfatoria. Forman una lesión localmente agresiva y metastatizan en el 30% de los casos en ganglios regionales, pulmón y huesos. La supervivencia es elevada y su pronóstico depende de si sólo afecta a las fosas nasales, se extiende a los senos o de si lo hace más allá de la cavidad nasosinusal.
El tratamiento de elección es la cirugía radical seguida de radioterapia.
Laringe
El tercer tramo de este estudio lo forma la laringe.
La laringe del niño no es simplemente una miniatura de la del adulto, sino que, en cuanto a sus funciones y conformación, existen importantes diferencias. Los cartílagos y el resto de las estructuras laríngeas son mucho más flexibles y maleables y, por lo tanto, son más susceptibles al colapso y menos resistentes al edema(6).
La obstrucción laríngea puede ser congénita o adquirida (Tabla I).
Obstrucción post-traqueotomía
La traqueotomía en los niños tiene una morbi-mortalidad mayor que en los adultos. Una técnica quirúrgica incorrecta es la causa de muchas complicaciones y secuelas, en concreto de estenosis. Por ello, es recomendable que se realice siempre por manos expertas y con una técnica quirúrgica minuciosa(8).
Obstrucción post-intubación prolongada
La intubación prolongada puede producir la aparición de: granulomas, localizados preferentemente en el tercio posterior de las cuerdas vocales, quistes subglóticos o estenosis laringotraqueales, que aparecen en el 1-8% de los casos. La endoscopia es, sin duda, la prueba diagnóstica de elección para esta patología. El tratamiento de los granulomas consiste en prevenir su formación, retirando el tubo lo antes posible o administrando ciclos de corticoides previamente a la extubación. Los quistes subglóticos deben ser escindidos mediante láser CO2 o disección; mientras que, el tratamiento quirúrgico de la estenosis será siempre individualizado y la elección de la técnica quirúrgica dependerá de la localización, grado de obstrucción, extensión y estado de la función laríngea.
Obstrucción laríngea por reflujo gastroesofágico
El reflujo gastro-esofágico-laríngeo (RGEL) se define como la presencia de ácido procedente del estómago en la porción más proximal del complejo laringofaríngeo. Se le considera como uno de los agentes etiológicos más destacado en casos de disfonía crónica, estenosis laringotraqueal, granulomas y laringitis posterior. Aunque la laringoscopia indirecta y la endoscopia son indicativas, la pH-metría de 24 horas, con doble o triple canal, se considera la prueba de elección para determinar el verdadero factor etiológico. En la práctica clínica, valorar la respuesta al tratamiento médico también constituye una prueba diagnóstica de gran utilidad. Debe tratarse el RGEL y valorar la evolución, antes de realizar cualquier procedimiento invasivo en estos niños(5,6).
Papilomatosis laríngea infantil
La papilomatosis laríngea es una enfermedad de origen viral, causada por el virus del papiloma humano y, principalmente, por los serotipos 6 y 11. Constituye la tumoración laríngea benigna más frecuente en los niños y es la segunda causa de estridor en la infancia.
Su incidencia varía en función de los autores, oscilando entre 3,6 y 4,3 casos por cada 100.000 niños. Puede presentarse a cualquier edad, aunque la incidencia es mayor entre los 2 y los 4 años.
La disfonía progresiva o la presencia de un lloro anómalo suelen ser signos tempranos de esta enfermedad. En las formas muy proliferativas, el paciente puede presentar disnea, observándose un estridor de inicio gradual y progresivo durante semanas o meses. La disfunción respiratoria aguda es rara.
El curso de la enfermedad es imprevisible; de manera que, puede responder al tratamiento, recurrir de forma crónica o retroceder espontáneamente al cabo de algunos años. A pesar de ello, la recidiva es la norma general. El riesgo de malignización en niños es extremadamente bajo.
La papilomatosis laríngea constituye una entidad clínica de difícil tratamiento, debido a las recurrencias y complicaciones asociadas. Actualmente, el tratamiento de elección es la vaporización con láser CO2. La media de intervenciones en la papilomatosis infantil es de 4 intervenciones por año, con una eliminación total de las lesiones superior al 50%. También pueden utilizarse terapias coadyuvantes, como el interferón alfa, enzimas proteolíticas o inhibidores del crecimiento tumoral (cidofovir), que se han demostrado útiles para reducir el tamaño tumoral y alargar el tiempo entre las recidivas(8).
Tuberculosis laríngea
Suele cursar con una clínica de faringitis asociada a lesiones membranosas y ulceraciones mucosas. No suele asociarse con afectación pulmonar. El diagnóstico se realiza mediante endoscopia y es necesario realizar biopsias para identificar el Mycobacterium tuberculosis mediante cultivo o identificación genética. Se utilizan las pautas de tratamiento clásico(2).
Laringomalacia
La laringomalacia se define como el colapso intraluminal de las estructuras supraglóticas durante la inspiración. Constituye la causa más frecuente de estridor en la infancia (65-75%), siendo, además, la anomalía congénita más habitual de la laringe. El mecanismo etiopatogénico es desconocido, pero se han descrito diferentes factores anatómicos, histológicos y neurológicos, que pueden influir en el desarrollo de esta patología.
El estridor, inspiratorio e intermitente, es la manifestación clínica típica de la laringomalacia. El pronóstico es favorable y, en la mayoría de casos (70%), se produce una mejoría espontánea y gradual antes de los 12-24 meses de vida. Sin embargo, en el 10% de los casos, la obstrucción es severa y puede producir: cianosis, apnea, insuficiencia cardiaca e hipertensión pulmonar, siendo necesaria la cirugía para su tratamiento. La laringomalacia puede presentarse de forma aislada o asociada a otras anomalías de la vía respiratoria (19%) u otros órganos sistémicos.
Para el diagnóstico, es muy importante la historia clínica, valorar la existencia de estridor, sus características y la presencia o no de síntomas asociados. El diagnóstico definitivo se establece mediante endoscopia. La laringe debe visualizarse con respiración espontánea para valorar de forma dinámica su función y morfología.
El tratamiento inicial es expectante; ya que, está demostrado que, en la mayoría de casos, los síntomas desaparecen espontáneamente antes de los dos años de vida. El tratamiento quirúrgico (epiglotoplastia/traqueotomía) se reserva para aquellos casos con síntomas severos y repercusión orgánica grave(9).
Parálisis congénita de cuerdas vocales
Constituye el 10% de las anomalías congénitas. La parálisis unilateral se asocia a causas periféricas, siendo la más frecuente el estiramiento del cuello durante el parto. El pronóstico es bueno y suele curar de forma espontánea.
Las parálisis bilaterales casi siempre se relacionan con problemas del sistema nervioso central. Tienen peor pronóstico; se recomienda traqueotomía y esperar evolución.
Estenosis subglótica congénita
Es la tercera anomalía congénita por orden de frecuencia. Se admiten como estenosis todas aquellas en las que se objetiva, mediante endoscopia, un diámetro subglótico inferior al correspondiente para la edad y el peso. Este tipo de estenosis suele mejorar espontáneamente con el crecimiento. La traqueotomía y/o laringoplastia sólo se precisan en casos muy graves(2).
Hemangioma subglótico
Coincide con hemangiomas cutáneos en el 50% de los casos. Predominancia femenina. Generalmente, el tratamiento es conservador, ya que suelen regresar de forma espontánea antes de los dos años. El tratamiento quirúrgico es excepcional.
Rinofaringe y orofaringe
El segundo tramo de las vías aéreas superiores lo comprenden la rinofaringe y la orofaringe.
Fundamentalmente, la obstrucción de estas dos áreas tiene dos causas fundamentales: infamatorias y tumorales.
Inflamatorias
La obstrucción más frecuente de esta zona la provoca la hipertrofia del tejido linfoide situado a este nivel, las vegetaciones adenoideas en la rinofaringe y las amígdalas palatinas en la orofaringe (ambas estructuras forman parte del anillo de Waldeyer, que se complementa con los rodetes tubáricos y la amígdala lingual).
Las vegetaciones adenoideas son pliegues de mucosa respiratoria ubicados en la rinofaringe. Las amígdalas palatinas son auténticos ganglios linfáticos con un importante centro germinal. A diferencia de las primeras, en vez de pliegues, en su superficie tienen criptas.
Estas estructuras se ven con frecuencia afectadas de forma recurrente por cuadros virales o bacterianos, ambientes polucionados e irritativos e, incluso, por alergias alimentarias. La patología adenoamigdalar representa uno de los motivos más frecuentes de consulta médica (más de 4 millones de consultas al año en España). Las infecciones adenoamigdalares no sólo son importantes por sí solas, sino por la repercusión que tienen en las estructuras vecinas: nariz, senos paranasales, oído medio y vía aérea superior, cuya obstrucción nos ocupa y puede tener consecuencias sistémicas. La infección y la obstrucción coexisten con frecuencia.
Cierto grado de hipertrofia adenoidea se considera fisiológico hasta los cinco años. El diagnóstico de la hipertrofia adenoidea es clínico; ya que la radiografía lateral de cavum para el diagnóstico está en desuso. En pacientes colaboradores, el diagnóstico es más preciso con visión endoscópica directa(10).
Clínicamente, la hipertrofia adenoidea se manifiesta por obstrucción nasal crónica y ronquido (raramente se asocia a apneas nocturnas en ausencia de hipertrofia amigdalar acompañante). La inflamación crónica o aguda recurrente determina la aparición de otitis media. En casos de larga evolución, se han descrito alteraciones del crecimiento facial. La hipertrofia amigdalar es la principal causa de obstrucción durante el sueño.
El fenómeno obstructivo más llamativo de este área se produce, pues, principalmente durante el sueño y su importancia es de tal magnitud que merece una atención especial:
Los Trastornos Respiratorios del Sueño (TRS) en la infancia deben considerarse como una entidad diferenciada del cuadro clínico del adulto, al margen de que existen aspectos que comparten. Las diferencias se observan en todos los capítulos de la enfermedad. Las alteraciones anatómicas en los TRS infantil tienen mayor preponderancia y existen también diferencias en sus manifestaciones clínicas. No existen muchos datos epidemiológicos sobre la enfermedad en niños. Los estudios bien conformados en adultos ya son escasos y complicados de realizar y en niños estas dificultades se incrementan al intentar aplicar los criterios diagnósticos del adulto. Aproximadamente, el 10-12% de los niños roncan y muchos de ellos tienen el mal llamado ronquido simple, que es el ronquido que ocurre sin asociarse a apnea o a alteraciones del intercambio gaseoso(11). Su frecuencia declina a partir de los 9 años. La prevalencia de apnea del sueño en niños se estima entre el 0,7% y el 3%, con un pico entre los 2 y 5 años, y la del ronquido se sitúa entre un 7 y un 9%. En los TRS tienen influencia factores ambientales, factores del desarrollo del niño, así como múltiples genes. Los genes específicos que influyen en el desarrollo de esta patología no han sido determinados, aunque se tiene cada vez más evidencia de la existencia de una base genética en su expresión. Muchos estudios han demostrado ya la presencia de una agregación familiar. Las características fenotípicas del individuo, así como determinados genes relacionados con los principales factores de riesgo y mediadores biológicos relacionados con la expresión clínica influyen en los mecanismos celulares y moleculares implicados en su etiopatogenia(12).
Fisiopatología
Los estudios actuales sobre la fisiopatología van más dirigidos a alteraciones de función (alteración muscular o de control neural) que no a alteraciones anatómicas que comporten obstrucción. Sin embargo, en la población infantil, el factor anatómico es muy evidente. Además, existen factores inherentes a su anatomía que facilitan el colapso: vías aéreas altas más estrechas, posición más alta de la laringe, mayor laxitud de los tejidos y mayor flexibilidad cartilaginosa de las estructuras de soporte. Los casos más frecuentes de TRS infantil son los derivados de las hipertrofias adenoamigdalares. Suponen tres cuartas partes de casos en la mayoría de series (Fig. 4). Además, los procesos infecciosos de vías altas repetidos pueden agravar TRS leves o desencadenar su desarrollo en niños. Además de esta causa, se puede observar TRS en alteraciones craneofaciales, como las de los síndromes de Apert, Crouzon o Treacher-Collins (hipoplasia maxilar y descenso del diámetro anteroposterior de faringe), en el síndrome de Pierre-Robin (micrognatia, glosoptosis, hendidura palatina e hipotonía muscular), en el síndrome de Down o acondroplasia (alteraciones faciales y macroglosia) o en las mucopolisacaridosis (hipertrofia del tejido linfoide faríngeo). Se ha sugerido una base familiar del TRS, probablemente por disfunciones del control ventilatorio o de la morfología cráneo-facial, que pueden heredarse(12). El modo respiratorio y la morfología craneofacial están estrechamente conectados. La hipertrofia adenoidea o amigdalar pueden influir en el desarrollo de la hemicara inferior y mandibular, al provocar respiración oral. La respiración oral en el niño es un hecho muy común en la infancia, afecta al 25% de los menores de 10 años. Todo ello conlleva una modificación en el patrón de crecimiento, con planos faciales divergentes y arcos dentales estrechos. La persistencia de este cuadro, junto con sus factores desencadenantes, perpetúa el proceso de respiración oral, generando un círculo vicioso que influye negativamente en el desarrollo esquelético facial y de estructuras internas, como la vía aérea superior.
Figura 4. Hipertofia amigdalar obstructiva.
Clínica y consecuencias negativas
Durante el sueño, los síntomas más relevantes son el ronquido o la respiración ruidosa. También pueden constatarse: pausas respiratorias, sueño intranquilo con posturas anómalas, enuresis, sudoración abundante o la existencia de pesadillas o terrores nocturnos. También, es frecuente la presencia de bruxismo o, incluso, sonambulismo. En vigilia, al contrario que en el adulto, la somnolencia no es frecuente, pero sí los trastornos del comportamiento: hiperactividad, déficit de atención, escaso rendimiento escolar, inhibición social, mal carácter o agresividad. Puede existir cefalea matutina, sed excesiva al levantarse o síntomas derivados de la hipertrofia adenoamigdalar, como respiración oral o disfagia(13). Una consecuencia negativa importante de los TRS son las alteraciones del comportamiento y del desarrollo neurocognitivo. En estos niños se multiplica por tres la frecuencia de alteraciones de conducta y problemas de atención. Estos parámetros son importantes, ya que la capacidad de atención juega un papel importante en el aprendizaje y, por tanto, en desarrollo social y académico. Las diferentes alteraciones publicadas en niños con apnea del sueño en relación al campo del conocimiento van desde alteraciones en inteligencia general y memoria, hasta inteligencia verbal y alteraciones cognitivas ejecutivas. Es importante el rápido reconocimiento y tratamiento de las alteraciones del sueño, dado que suceden en un momento de la vida (primera década) de rápido desarrollo neurocongnitivo. Los TRS pueden asociarse con retraso en el desarrollo pondoestatural. Entre el 4 y el 13% de los niños con trastornos respiratorios del sueño tienen problemas de crecimiento. Este retraso en el desarrollo se ha atribuido, sobre todo, a un excesivo consumo energético nocturno por parte de la musculatura respiratoria y a que la alteración de la arquitectura del sueño interfiere en la liberación de la hormona del crecimiento que se produce, sobre todo, en la fase de ondas lentas. Otras posibles causas son la anorexia o disfagia debidas a la hipertrofia adenoamigdalar y a la hipoxemia y acidosis respiratoria, nocturnas. Los niveles de IGF-I e IGFBP-3, parámetros que dependen de la hormona de crecimiento, experimentan un incremento significativo tras el tratamiento de la enfermedad, con una normalización de la secreción de GH. Otra posible consecuencia negativa son las alteraciones cardiovasculares. Existe evidencia de hipertrofia ventricular derecha en un 55% de los niños con SAOS. La apnea del sueño expone a la población infantil a hipoxemia intermitente nocturna y estrés oxidativo. Estos factores amplifican el efecto de la adiposidad sobre el estado inflamatorio sistémico y favorecen el desarrollo de alteraciones metabólicas que derivan en diabetes y enfermedades vasculares. La obstrucción de la vía aérea superior comporta apnea e hipoxia durante el sueño y puede progresar hacia un incremento de la presión arterial pulmonar y, en algunos casos, a cor pulmonale. A este efecto de presión debe añadirse la posibilidad de que el incremento de resistencias esté favorecido por la hiperviscosidad. La presencia de HTA es muy frecuente en el caso del adulto, pero en el niño, aparentemente, no tanto y lo mismo sucede con las alteraciones del ritmo. Sin embargo, se ha demostrado que los niños con un IAH (índice de apnea-hipoapnea) mayor de 10 exhiben presiones diastólicas y sistólicas mayores que los casos con IAH inferiores a 10.
Diagnóstico
La historia clínica y la exploración física no son capaces, por sí solas, de diferenciar el roncador primario del niño con apneas nocturnas. La polisomnografía nocturna sigue siendo el mejor método, aunque los problemas derivados de su alto coste y de la necesidad, sobre todo en niños, de personal adiestrado, siguen provocando el intento de ofertar métodos alternativos. Los episodios de apnea obstructiva completa suelen faltar en los niños con TRS. Los criterios de adulto basados en el IAH fallan a la hora de identificar a niños con TRS y son más importantes los criterios gasométricos y los basados en los esfuerzos respiratorios paradójicos, para evaluar la gravedad del TRS en los niños. El diagnóstico anatómico o de localización de la causa obstructiva es más importante en la población infantil, dado que, en el niño, estos factores tienen más protagonismo. Se pueden apreciar con facilidad las alteraciones anatómicas que condicionan en tantos casos el TRS: hipertrofia adenoamigdalar, alteraciones craneofaciales y trastornos neuromusculares(12). En la exploración física, no es frecuente hallar la obesidad tan típica en los casos de adulto. La prevalencia de la obesidad infantil en España está en aumento. Aproximadamente, un tercio de los niños con sobrepeso tienen TRS. La obesidad en niños con apnea del sueño oscila entre el 13 y el 36%. Se ha demostrado que, en los obesos, predominan claramente, y de forma significativa, las alteraciones respiratorias nocturnas en frecuencia y severidad. Por otro lado, los principales problemas de la adenoamigdalectomía, la persistencia del cuadro y las complicaciones postoperatorias, son más prevalentes en obesos. Por ello, es importante conocerlo para reducir peso previamente o bien prever estas eventualidades post-quirúrgicas en este grupo de niños. Radiológicamente, la placa simple lateral de partes blandas de cuello puede mostrar, con relativa fiabilidad, el tamaño de las vegetaciones adenoideas, aunque difícilmente predice el grado de obstrucción real y menos durante el sueño. Más importante es el estudio cefalométrico en los niños con alteraciones craneomandibulares (Fig. 5). Otras técnicas de imagen, como: fluoroscopia, resonancia nuclear magnética, tomografía axial computarizada ultrarrápida o cine-TC pueden ser útiles para casos concretos e investigación, pero no suelen aplicarse en la práctica diaria. La fibroendoscopia de la vía aérea superior forma parte del diagnóstico de localización de la obstrucción, a pesar de que, como todas estas técnicas no reproduce, en realidad, lo que sucede durante el sueño. Con ella, pueden evaluarse con precisión los tres niveles de la exploración endoscópica de la vía aérea: rinofaringe, orofaringe e hipofaringe.

Figura 5. Micrognatia
Tratamiento
La adenoamigdalectomía es el tratamiento más extendido y eficaz en casi tres cuartas partes de los casos. Consigue la normalización del cuadro respiratorio nocturno, de la sintomatología diurna y la reversión, en muchos casos, de las complicaciones cardiovasculares y del retraso en el crecimiento. En el momento actual, a la mayoría de niños a los que se indica la amigdalectomía, es debido a la existencia de una obstrucción de la vía aérea. El síndrome de apneas obstructivas del sueño es, pues, la indicación más frecuente de amigdalectomía. Habitualmente, debe asociarse a adenoidectomía en el mismo acto quirúrgico(12,14).
Amigdalectomía. Técnicas quirúrgicas
Se han descrito multitud de técnicas de amigdalectomía. Los procedimientos con el paciente despierto (guillotina de Sluder) son inaceptables hoy día debido al alto riesgo de complicaciones. La disección bajo anestesia general e intubación orotraqueal es el procedimiento más habitual. Se han descrito múltiples modificaciones de la técnica de disección (disección fría, bipolar, láser, criocirugía, radiofrecuencia, etc.), que no han disminuido significativamente la morbilidad de la intervención, ni la tasa de complicaciones.
• Técnica de amigdalectomía por disección fría. El procedimiento universalmente admitido es la técnica de disección. Esta técnica se realiza en un quirófano correctamente equipado y bajo anestesia general con intubación oro-traqueal. Con el paciente en decúbito supino, el cirujano se coloca detrás de la cabeza y, con la ayuda de un abrebocas que deprime la lengua, se procede a la disección extracapsular de las amígdalas.
• Amigdalectomía por electrodisección. El electrobisturí y el electrocauterio se utilizan en cirugía para muchas intervenciones. Se consigue la hemostasia del campo quirúrgico más fácilmente que con otras técnicas y se acorta el tiempo operatorio. Se puede realizar con bisturí monopolar o bipolar ayudada o no con microscopio. Con bisturí monopolar el dolor es superior a la disección “fría”.
• Radiofrecuencia. Consiste en la generación de calor por medio de radiación electromagnética. La radiofrecuencia se puede utilizar como instrumento de disección para realizar la amigdalectomía total extracapsular (similar a la disección fría y a la electrodisección), como bisturí para realizar amigdalotomía (o amigdalectomía parcial) o como reductor del volumen amigdalar por medio de una sonda de radiofrecuencia en el interior de la amígdala. Con la radiofrecuencia, se consiguen temperaturas tisulares más bajas que con el láser o electrocauterio, con un menor daño térmico tisular, lo que ocasiona menos dolor postoperatorio que la electrodisección.
• Láser CO2. El láser CO2 puede utilizarse como instrumento para la disección extracapsular (amigdalectomía total) o como bisturí para amigdalotomía (amigdalectomía parcial):
– Amigdalectomía total (disección extracapsular): no posee ventajas comprobadas y sí un alto costo. Es una técnica lenta, por lo que está reservada sólo para aquellos pacientes con patologías tales como hemofilia u otros trastornos importantes de la coagulación(16-19).
Debido a las altas temperaturas tisulares, se produce más dolor que con técnicas tradicionales y no reduce la hemorragia postoperatoria comparada con otras técnicas.
– Amigdalectomía parcial (amigdalotomía): es una alternativa razonable para la hipertrofia amigdalar obstructiva. Junto a la amigdalotomía con radiofrecuencia, es la técnica con menor morbilidad (mínimo sangrado intra y postoperatorio y escaso dolor postoperatorio), debido a la ausencia de desgarro de la cápsula amigdalina(2,15).
Existen, sin embargo, otras propuestas terapéuticas. La postura y la dieta pueden ser elementos importantes en la estrategia terapéutica. La reducción ponderal en niños, por sí sola, no suele ser suficiente para solucionar el problema. Un metaanálisis reciente señala que la gravedad del TRS se relaciona con el grado de obesidad y que los niños con apnea del sueño y obesos tienen proporcionalmente más HTA. Sabemos que el tratamiento estrella de esta patología es la cirugía adenoamigadalar; se ha señalado que los de los principales problemas de esta cirugía, la persistencia del cuadro y las complicaciones postoperatorias son más prevalentes en obesos. La posición en decúbito supino es altamente conocido que tiene una influencia negativa en el caso del adulto. En niños no está tan claro, sin embargo y pensando en la relación con el síndrome de muerte súbita, parece ser aceptado, que la posición en decúbito prono es más peligrosa. Existen evidencias de que, en los niños, la colapsabilidad de la vía aérea superior aumenta en decúbito prono. El tratamiento médico de los TRS en los niños no es el tratamiento de elección. Existen tratamientos publicados, casi de forma anecdótica, como la insuflación faríngea con oxígeno durante el sueño o el tratamiento antiinflamatorio con antileucotrienos (Montelukast) que parecen reducir el volumen de las estructuras linfoides hipertrofiadas. Sí tienen mayor relevancia los tratamientos que mejoran la permeabilidad nasal. La obstrucción nasal o nasofaríngea colabora en el colapso faríngeo durante el sueño y su resolución, al igual que sucede en el adulto, podría ser un tratamiento, al menos, coadyuvante. Los tratamientos ortopédicos maxilares(2,14), además de conseguir una mejoría estética y oclusal, inducen variaciones esqueléticas que llevan a un cambio significativo en las estructuras internas de soporte de la vía aérea superior (VAS). La ortopedia del maxilar superior es capaz de producir una disminución de las resistencias nasales, mejorar la postura natural de la cabeza y aumentar la VAS. Además, induce un cambio en la dirección de crecimiento mandibular que conduce a una mejora en las proporciones esqueléticas faciales y un cambio en los lugares de inserción muscular encargados de garantizar la permeabilidad de la VAS. Debemos entender estas formas de corrección ortopédica como un mecanismo de profilaxis frente a una futura patología obstructiva de la VAS en el adulto. La cirugía sobre el macizo maxilar y las distracciones mandibulares pueden aumentar los espacios naso y orofaríngeos, mejorando las resistencias en el paso aéreo en los pacientes con TRS. Las estrategias terapéuticas, sobre todo en los casos de malformaciones, deben ser individualizadas a cada caso(14). En los casos de cirugía mayor maxilofacial para estas malformaciones, a pesar de corregirlas correctamente, no siempre consiguen solucionar el problema. La glosopexia, utilizada, sobre todo, en casos de Pierre-Robin, los avances maxilares y correcciones de anomalías congénitas en niños con síndrome de Crouzon o Apert, siempre con una correcta selección de los casos y con la experiencia necesaria pueden ser útiles. Las series publicadas no son amplias y muchas describen técnicas de expansión mandibular, ya sea mediante aparatos intraorales que la provocan de forma progresiva mediante un tornillo en el eje necesario (Rapid Maxillary Expansion) o bien mediante maniobras de distracción mandibular con osteogenésis secundaria. En los últimos años, el tratamiento con presión nasal positiva continua (CPAP) se ha convertido en la segunda línea de tratamiento cuando la apnea obstructiva persiste a pesar de la intervención quirúrgica(12). Otras indicaciones estarían destinadas al periodo prequirúrgico para estabilizar a niños con riesgo de compromiso posquirúrgico o en el tiempo necesario de crecimiento craneofacial hasta la cirugía definitiva. Existen diversos problemas al respecto que se revisarán en este capítulo. El cálculo del nivel de presión necesaria varía con el crecimiento y, por tanto, se hacen necesarias revisiones periódicas con polisomnografía. Existe una mayor tasa de intolerancia e incumplimiento a estas edades. Se requiere personal de soporte, como enfermeras entrenadas y la colaboración de los padres para conseguir la máxima aceptación por parte del niño. Finalmente, la estandarización de mascarillas especiales, sobre todo en niños con alteraciones craneofaciales que requieren diseños individuales, puede suponer otro problema. Además de la obstrucción de la vía respiratoria, la amigdalectomía tiene otras indicaciones:
• Amigdalitis agudas recurrentes.
• Disfagia mecánica, por hipertrofia amigdalar obstructiva de la orofaringe.
• Absceso periamigdalino. En su primer episodio o en el segundo, según los autores.
• Amigdalitis crónica resistente al tratamiento, en la que se producirían microabscesos en las criptas amigdalares que darían lugar a febrícula crónica y manifestaciones infecciosas generales(10).
Adenoidectomía
La adenoidectomía se debe realizar siempre en quirófano bajo anestesia general con intubación. Con el paciente en decúbito supino se coloca un abrebocas estático que sujeta la lengua. Con un instrumento de corte, diseñado para esta finalidad, se practica un legrado del cavum rinofaríngeo.
Las indicaciones de adenoidectomía son:
• Obstrucción nasal crónica diurna de más de 6 meses de evolución.
• Síndrome de apnea del sueño (asociada a amigdalectomía).
• Otitis media recurrente.
• Rinosinusitis aguda recurrente o crónica.
• Otitis serosa crónica.
Tumorales
Tumores benignos(2)
Angiofibroma de cavum. Es una tumoración que predomina en adolescentes varones. Su diagnóstico precoz es muy importante, pues de su extensión dependerá la agresividad y complejidad del tratamiento. No es lo mismo la extirpación de un tumor que afecte solamente a nasofaringe y senos, a que se extienda hacia la fosa ptérigo-maxilar, al suelo de la órbita o a la fosa infratemporal y que termine con una extensión intracraneal. El diagnóstico por excelencia se realiza mediante la RM y es imperativo no practicar una biopsia de una tumoración de cavum, sin haberla hecho antes, pues corremos el riesgo de provocar una hemorragia cataclísmica.
Su tratamiento es siempre quirúrgico. Es recomendable embolizarlo previamente y preparar sangre para una autotransfusión.
Tumores malignos(2,7)
• El carcinoma de nasofaringe es el más frecuente en la adolescencia. En el 60% de los casos, su primera manifestación es una adenopatía cervical y es la endoscopia nasal la que nos muestra una masa localizada en la pared posterior o externa de la rinofaringe.
Después del consecuente estudio por imagen, se diagnostica mediante biopsia. Ésta se debe realizar en quirófano, ya que muchas veces existe en la superficie tejido inflamatorio de aspecto polipoide o tejido necrótico que enmascaran el tumor. En los niños, predomina el carcinoma no queratinizante indiferenciado (linfoepitelioma), que tiene tendencia a metastatizar. Es un tumor en el que existe la participación del virus de Epstein-Barr.
Se trata con radioterapia, pudiéndose complementar con quimioterapia en caso de que haya metástasis. Responde bien a la radioterapia con una supervivencia del 60% a los 5 años. Sin embargo, entre el 20 y el 60%, pueden metastatizar (principalmente en pulmón, hígado y huesos).
• En nasofaringe y amígdalas podemos también encontrar linfomas MALT (tejido linfoide asociado a mucosas). Están compuestos por células linfocitarias B, de la zona marginal del folículo linfoide. También podemos encontrar localizado en la rinofaringe el linfoma no Burkitt.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** González A. Malformaciones congénitas y deformaciones de la nariz, fosa y senos paranasales. En: Tratado de Otorrinolaringología y Cirugía de Cabeza y Cuello. Tomo I. Ciencias básicas y materias afines. Rinología. Madrid: Editorial Proyectos Médicos; 1999. p. 457-74.
2.*** Tomás M, Bernal M. Tratado de Otorrinolaringología Pediátrica. Girona: Gráficas Alzamora; 2000 (Ponencia oficial de la SEORL 2000).
3.* Fernández Pérez AJ, Burgos Sánchez AJ, Gras Albert JR. Lesiones congénitas de la línea media nasofrontal. Acta Otorrinolarig Esp. 2001; 52: 404-8.
4.** Massegur Solench H, Ademà Alcover JM. Rinitis y sinusitis en el niño. En: Formación continuada de la Sociedad Española de Otorrinolaringología y Patología Cérvico-Facial. Vol II. Infección en ORL: Barcelona: Editorial Masson; 2005. p. 1-10.
5.** Rosbe KW, Kenna MA, Auerbach AD, Extraesophageal reflux in Pediatric Patients With Upper Respiratory Symptoms. Arch Otol Head Neck Surg. 2003; 129: 1213-20.
6.*** Yellon RF, Goldber H. Update on Gastroesophageal Reflux Disease in Pediatric Airway disorders. Am J Med. 2001; 111(suppl 8A): 78S-84S.
7.*** Muñoz Borge F, González Alonso J, Galera Ruiz H, Delgado Moreno F, Galera Davidson H. Avances en los tumores Otorrinoloringológicos. An Pediatr. 2003; 58(5) 456-63.
8.** Derkay Craig S. Recurrent Respiratory Papillomatosis. Laryngoscope. 2001; 111; 57-69.
9.** Olney DR, Greinwald JH Jr, Smith RJ, Bauman NM. Laryngomalacia and its Treatment. Laryngoscope. 2001; 109: 1770-5.
10.* Benito Jiménez J, Villafruela Sanz MA. Vegetaciones adenoideas. Fisiopatología. Indicaciones de tratamiento. Otitis media con efusión. An Pediatr Monogr. 2003; 1(1): 72-80.
11.** Owen G, Canter R, Maw R. Screening for obstructive sleep apnoea in children Int J Pediatr Otorhinolaryngol. 1995; 32(Suppl): s67-9.
12.*** Guilleminault C, Pelayo R. Sleep-disordered breathing in children. Ann Med. 1998; 4: 350-6.
13.** Gaultier C. Obstructive sleep apnea syndrome in infants and children: established facts and unsettled issues. Thorax. 1995; 50: 1204-10.
14.** Esteller E, Estivill E. El Ronquido y el Síndrome de la apnea obstructiva en los niños. Vigilia-Sueño. 2000; 12(1) (Supl): s29-s35.
15.*** Pinder D, Hilton M. Disección versus diatermia para la amigdalectomía (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus. 2005; Número 1.
16.* Llorente Pendas JL, Suárez C. Indicaciones de la adenoamigdalectomía. Boletín de la Sociedad de Pediatría de Asturias, Cantabria, Castilla y León. 1999; 39: 72-5.
17.** Melchor Díaz MA. Amigdalitis aguda. Criterios de amigdalectomía. An Pediatr Monogr. 2003; 1(1): 62-8.
18.** Nazar J. Amigdalectomía: nueva tecnología confrontada con la cirugía tradicional. Rev Otorrinolaringol Cir Cabeza Cuello. 2004; 64: 252-61.
19.*** Friedman M, Wilson M, Lin HC, Chang HW Updated systematic review of tonsillectomy and adenoidectomy for treatment of pediatric obstructive sleep apnea/hypopnea syndrome. Otolaryngol Head Neck Surg. 2009; 140(6): 800-8.
Bibliografía recomendada
– Guilleminault C, Pelayo R. Sleep-disordered breathing in children. Ann Med. 1998; 4: 350-6.
Importante revisión del SAOS infantil de un grupo de reconocido prestigio en el tema. Destacan los aspectos de predisposición familiar y los signos clínicos de la enfermedad en esta población. También, hacen referencia a los aspectos diferenciales con el cuadro clínico en adultos. Es importante que estos niños sean tratados mediante CPAP o cirugía para evitar complicaciones serias a largo plazo.
– Pinder D, Hilton M. Disección versus diatermia para la amigdalectomía (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus. 2005; Número 1.
Interesante artículo de revisión de ensayos aleatorios en niños y adultos sometidos a cirugía amigdalar en el que compara la morbilidad de la amigdalectomía realizada con dos técnicas diferentes, la disección fría y la electrodisección. Concluye que todavía no se ha demostrado claramente la superioridad de una técnica sobre otra.
– Yellon RF, Goldber H. Update on Gastroesophageal Reflux Disease in Pediatric Airway disorders. Am J Med. 2001; 111(suppl 8A): 78S-84S.
El reflujo gastroesofágico (RGE) se ha relacionado con la aparición de tos, apnea, estenosis laringotraqueal, laringitis posterior y laringomalacia. Muchos de estos síntomas mejoran con tratamiento para el RGE. El diagnóstico definitivo se establece mediante La pH-metría de 24 horas.
– Schechter MS; Section on Pediatric Pulmonology, Subcommittee on Obstructive Sleep Apnea Syndrome. Technical report: diagnosis and management of childhood obstructive sleep apnea syndrome. Pediatrics. 2002; 109(4): e69.
Documento de la Academia Americana de Neumología Pediátrica donde se revisan todos los aspectos actuales sobre el abordaje terapéutico y diagnóstico del síndrome de la apnea del dueño en los niños. Se trata de un documento de referencia mundial sobre las recomendaciones a seguir en diferentes aspectos de tratamiento y diagnóstico.
– Friedman M, Wilson M, Lin HC, Chang HW. Updated systematic review of tonsillectomy and adenoidectomy for treatment of pediatric obstructive sleep apnea/hypopnea syndrome. Otolaryngol Head Neck Surg. 2009; 140(6): 800-8.
Una revisión exhaustiva y sistemática sobre el tratamiento más extendido y eficaz de la apnea obstructiva en la infancia: la adenoamigdalectomía. Se revisan las técnicas, indicaciones y resultados de dicho tratamiento.
| Caso clínico | |
|
Paciente de 3 años de edad que acude a la consulta del ORL por que los padres observan dificultad respiratoria nasal e intensos ronquidos nocturnos. El interrogatorio del ORL pone de manifiesto la presencia de apneas nocturnas prolongadas que asustan a la familia, enuresis nocturna y un sueño muy intranquilo. Profundizando más en la anamnesis, los padres refieren que el niño durante el día está muy irritable pero no excesivamente somnoliento. En la exploración, se aprecia una hipertrofia amigdalar significativa y una cara larga con respiración oral continuada. En la exploración dental, se evidencia un paladar estrecho y una mordida abierta anterior. El registro polisomnográfico del niño muestra un índice de apnea-hipoapnea de 10,7 sin claras desaturaciones de O2. Se aconseja a los padres la realización de una reducción amigdalar con radiofrecuencia y adenoidectomía asociada bajo anestesia general y se realiza un estudio previo del riesgo quirúrgico con la colaboración de los Servicios de Anestesia y Pediatría. Se practica dicha intervención sin ningún tipo de incidencia peroperatoria ni postoperatoria y, a los diez días, el cuadro clínico del niño se resuelve por completo. El paciente es citado al cabo de un año para nuevo control clínico y polisomnográfico. |
|